全酶解法提取杜仲叶中绿原酸及其含量测定
张雪梅,谢金芮,陈玉甫,张学俊*
(1.贵州大学贵州省发酵工程及生物制药重点实验室,贵州贵阳550025;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.贵州大学药学院,贵州贵阳550025)
全酶解法提取杜仲叶中绿原酸及其含量测定
张雪梅1,2,谢金芮3,陈玉甫1,2,张学俊1,2*
(1.贵州大学贵州省发酵工程及生物制药重点实验室,贵州贵阳550025;2.贵州大学酿酒与食品工程学院,贵州贵阳550025;3.贵州大学药学院,贵州贵阳550025)
采用酸性蛋白酶、果胶酶和纤维素酶分步酶解提取杜仲叶中的绿原酸,并经高效液相色谱(HPLC)法测定其中的绿原酸含量。杜仲叶经过酸性蛋白酶、果胶酶、纤维素酶的分步连续酶解后,测得杜仲粉样品中的绿原酸总含量可达到61.8 μg/g,其中酸性蛋白酶、果胶酶和纤维素酶提取杜仲粉中绿原酸含量分别为26.4 μg/g、20.5 μg/g、14.9 μg/g,明显高于水提法(12.2 μg/g)。
杜仲叶;绿原酸;酶解;高效液相色谱法
杜仲(Eucommia ulmoidesOlive)也被称为“丝棉树”、“丝棉皮”[1],是200多万年以前冰川活动残留下来的一种多年生落叶乔木的古生物树种[2],起源于我国,已被列入《中国植物红皮书稀有濒危植物》中的二级珍稀物种[3]。杜仲具有降压[4]、调血脂、降血糖、增强免疫力、抗氧化、抗衰老、抗肿瘤、抗菌、抗病毒、保肝、利胆、利尿等作用[5]。绿原酸(chlorogenic acid)是杜仲具有降压调节作用的重要药效成分之一[6],其主要药效有双向调整血压、抗肿瘤、补肾[7]、改善机体免疫力、抗氧化、延缓衰老、抗菌、抗病毒等[8]。2005版中国药典将绿原酸定为评估杜仲品质好坏的重要技术参数[9]。
杜仲天然药物成分的提取研究一直广受重视,引起大批学者的关注,采用的方法很多,如有机溶剂提取、乙醇系列浓度提取法、溶剂固相萃取法、超声提取法[10]、微波提取法以及酶解法等,分离提纯的方法有大孔树脂分离法[11]、硅胶柱色谱分离法、高速逆流色谱技术[12]等。兰小艳等[13]采用正交试验确定了乙醇法提取杜仲叶中绿原酸的最佳工艺条件。冉琴琴等[14]采用角质酶破坏寄主植物中起保护作用的角质层,再通过蛋白酶、果胶酶和纤维素酶处理,可以更好提取杜仲叶中的绿原酸。
杜仲叶与杜仲树皮相比简便、大量、易得,而且绿原酸等含量高于杜仲皮且多分布于云、贵、川地区[15]。实验采取多种生物酶,对杜仲叶进行全酶解,首先用酸性蛋白酶去除蛋白质组分,再用果胶酶与纤维素酶降解表层与黏连角质层的果胶质和粘连植物细胞壁的果胶质,降解分散植物细胞壁。采用酸性蛋白酶、果胶酶和纤维素酶联合酶促降解提取杜仲叶中的化学成分,并经高效液相色谱(high performance liquid chromatography,HPLC)法测定其中的绿原酸含量,从而达到对杜仲叶的全酶降解,实现有效成分的提取。深入探索杜仲资源的开发,以期增强我国中草药在国际舞台上的竞争力,加速中草药的国际化进程。
1 材料与方法
1.1材料与试剂
杜仲叶:贵州省遵义市遵义县新舟镇金仲村;酸性蛋白酶(5万U/g)、果胶酶(5万U/g)、纤维素酶(5万U/g):张家港市金源生物化工有限公司;β-环糊精(生化试剂)、异丙醇(色谱纯):天津市科密欧化学试剂有限公司;柠檬酸(纯度为99%)、柠檬酸钠(纯度为99%):潍坊英轩实业有限公司;无水乙醇、磷酸(均为分析纯):天津市富宇精细化工有限公司;乙腈(色谱纯):美国Tedia公司;绿原酸标准品(纯度为98%):阿拉丁试剂(上海)试剂有限公司;超纯水为实验室自制。
1.2仪器与设备
Agilent1260高效液相色谱仪:美国安捷伦公司;FA2004B电子天平:沈阳龙腾电子科技有限公司;UV-2550紫外可见分光光度计:日本岛津公司;SHA-CA数显水浴恒温振荡器:常州普天仪器制造有限公司;EYELA旋转蒸发仪:上海爱朗仪器有限公司;XW-80A漩涡混合仪:海门市其林贝尔仪器制造有限公司;0.45μm微孔滤膜:上海兴亚净化材料厂;B01145AA贝克曼离心机:贝克曼库尔特商贸(中国)有限公司;SZ-96A自动纯水蒸馏器:上海亚荣生化仪器厂。
1.3方法
1.3.1酶制剂的制作
(1)酸性蛋白酶制剂:酸性蛋白酶最适pH值为3.4,准确称量33.62 g柠檬酸与11.77 g柠檬酸钠,蒸馏水溶解并定容至2 000 mL。分4次与10 g酸性蛋白酶混合,合并收集4次洗脱液制成酸性蛋白酶液。
(2)果胶酶制剂:果胶酶最适pH为3.6,准确称量31.30 g柠檬酸与15.00 g柠檬酸钠,蒸馏水溶解并定容至2 000 mL。分4次与10 g果胶酶混合,合并收集4次洗脱液制成果胶酶液。
(3)纤维素酶制剂:纤维素酶最适pH为5,准确称量17.23 g柠檬酸与34.71 g柠檬酸钠,蒸馏水溶解并定容至2 000 mL。分4次与10 g纤维素酶混合,合并收集4次洗脱液制成纤维素酶液。
1.3.2样品处理方法
杜仲叶酶解工艺流程:
水提取:在编号为1号、2号、3号和4号的4个1 000 mL三角瓶中分别加入50.0 g经小心揉碎成团(杜仲叶中含杜仲胶,揉碎后自动成团)且无损失的杜仲叶,加入500 mL蒸馏水,摇匀后置于50℃水浴床,180 r/min振荡8.0 h后取出,合并收集并抽滤,将滤液置于旋转蒸发仪上浓缩至100mL,加入无水乙醇400 mL至整个酶解液体系中的乙醇体积分数为80%,混合充分后静置沉淀过夜。将经乙醇沉淀处理的水解液上清液与β-环糊精以8∶1(mL∶g)的比例充分混合均匀,将混合溶液置于旋转蒸发仪(45℃、60 r/min)蒸干呈块状后粉碎,即为水提杜仲粉。
酸性蛋白酶提取:取编号为1号、2号、3号和4号的4个1 000 mL三角瓶,分别加入50.0 g经小心揉碎,加入500 mL酸性蛋白酶制剂,置于55℃水浴摇床,180 r/min振荡8.0 h后取出,合并收集滤液并抽滤,将滤液置于旋转蒸发仪上浓缩至100 mL,加入无水乙醇400 mL至整个酶解液体系中乙醇体积分数为80%,剧烈振荡混合充分后静置沉淀过夜,称取50 gβ-环糊精,将经乙醇沉淀的蛋白酶酶解液上清液与β-环糊精以8∶1(mL∶g)的比例充分混合均匀后,将混合溶液置于(45℃、60r/min)旋转蒸发仪蒸干呈块状后,粉碎,即为酸性蛋白酶提取杜仲粉。
果胶酶提取:收集蛋白酶酶解后各个三角瓶中所有杜仲叶残余固体继续进行果胶酶酶解。加入果胶酶制剂后后续处理,过程同蛋白酶酶解,即可得果胶酶提取杜仲粉。
纤维素酶提取:收集果胶酶酶解后各个三角瓶中所有杜仲叶残余固体继续进行纤维素酶酶解。加入纤维素酶制剂后后续处理过程同酸性蛋白酶酶解一致,即可得纤维素酶提取杜仲粉。
精密称取水提杜仲粉、酸性蛋白酶提取杜仲粉、果胶酶提取杜仲粉以及纤维素酶提取杜仲粉各0.1 g于1.5 mL离心管中,分别加入1.5 mL体积分数95%乙腈溶液溶解,于漩涡混合仪上充分混匀,经4℃,10 000 r/min离心20 min,取上清液经0.45 μm滤膜过滤并转移至样品瓶中待测。
1.3.3绿原酸检测方法
采用高效液相色谱法检测样品中绿原酸的含量。色谱柱为TOSOHTSKgelODS-100Z(5 μm×4.6 mm×250 nm),流动相A(0.4%磷酸水溶液)∶B(乙腈)=9∶91(V/V),检测波长324 nm,流速0.6 mL/min,进样量10 μL,柱温40℃。
绿原酸标准曲线的绘制:精密称取绿原酸标准品10.0mg,用体积分数为95%的乙腈溶液溶解,定容至100 mL,得质量浓度为0.1mg/mL标准储备液,分别量取1.25mL、2.50mL、3.75 mL、5.00 mL、6.25 mL的0.4 mg/mL标准储备液,并定容至10 mL,配制成质量浓度分别为0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.20 mg/mL、0.25 mg/mL的标准溶液,所得溶液用0.45 μm滤膜过滤。分别吸取10 μL配制好的绿原酸标准溶液注入高效液相色谱仪中,按照上述色谱条件测定峰面积,并以绿原酸标准溶液的质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制绿原酸标准曲线。
2 结果与分析
2.1绿原酸检测波长的选择
准确称取绿原酸标准品10.0 mg,用体积分数为95%的乙腈溶液溶解并定容至100 mL棕色容量瓶中,充分混匀,以超纯水作对比,在波长为200~500 nm范围内扫描,结果如图1所示。
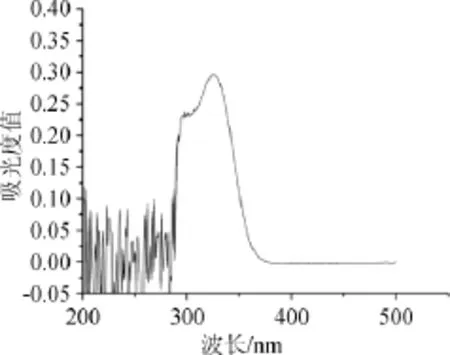
图1 绿原酸标准品紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of chlorogenic acid standard substance
由图1可知,绿原酸标准品在波长324 nm处有最大吸收峰,故选择324 nm为检测绿原酸的最佳波长。
2.2绿原酸标准品及样品高效液相色谱分析
绿原酸标准品高效液相色谱图如图2所示,杜仲叶水解液和3种酶解液高效液相色谱图如图3所示。
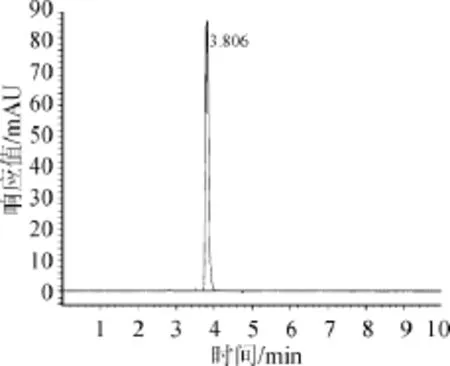
图2 绿原酸标准品HPLC色谱图Fig.2 HPLC chromatograms of chlorogenic acid standard substance
由图2可知,绿原酸标准品保留时间为3.806 min,峰形较尖锐,较窄,吸收相对较好。由图3可知,水提杜仲粉、蛋白酶杜仲粉、果胶酶杜仲粉、纤维素酶杜仲粉在设定的色谱条件下均在3.8~4.0 min左右出现最大吸收峰,保留时间和绿原酸标准品的保留时间十分相近,可以判定其中均含有绿原酸。绿原酸在每步酶解时所占的比例并不是都很高,均不同程度的有其他杂峰出现,由此推断还有其他组分存在,也同时说明经酸性蛋白酶、果胶酶、纤维素酶连续分步酶解后可以使有效成分一并溶出。
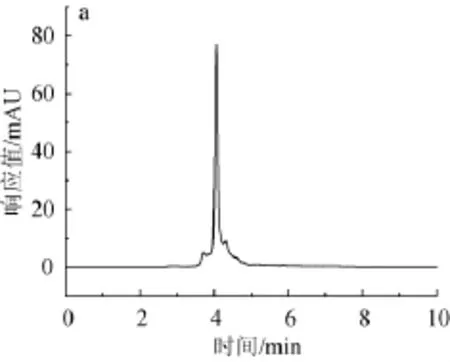
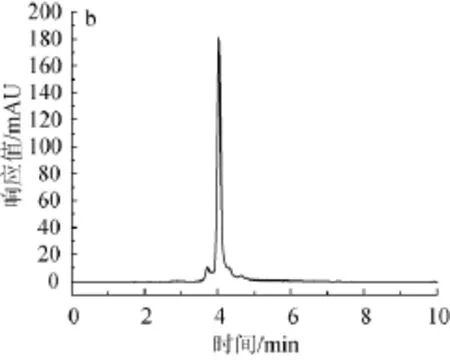
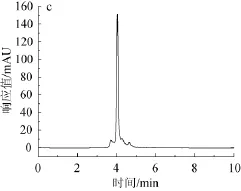
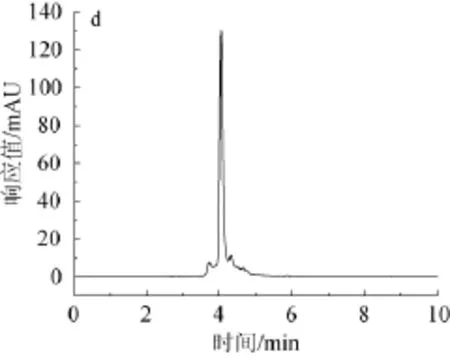
图3 杜仲叶水解液(a)、酸性蛋白酶酶解液(b)、果胶酶酶解解液(c)和纤维素酶解液(d)HPLC色谱图Fig.3 HPLC chromatograms of hydrolysate(a),acid protease enzymolysis liquid(b),pectinase enzymolysis liquid(c) and cellulose enzymolysis liquid(d)of folium cortex eucommiae
2.3绿原酸标准曲线的绘制
以绿原酸标准溶液的质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制绿原酸标准曲线。结果见图4。
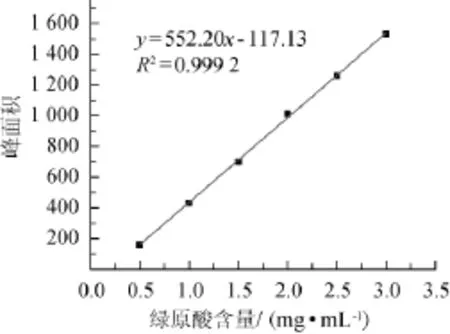
图4 绿原酸标准曲线Fig.4 Standard curve of chlorogenic acid
由图4可知,由绿原酸标准曲线求得标准线性回归方程为:y=552.20x-117.13,相关系数R2=0.999 2,表明两者线性关系良好,可根据标准线性回归方程计算各杜仲粉样品中绿原酸含量。
2.4杜仲叶中绿原酸含量的检测
根据1.3.3中的方法及2.3中的标准曲线测得的水、蛋白酶、果胶酶和纤维素酶提取杜仲粉中的绿原酸含量如表1所示。

表1 杜仲粉中绿原酸的含量Table 1 Chlorogenic acid contents in folium cortex eucommiae powder
由表1可知,经酸性蛋白酶、果胶酶、纤维素酶分别提取后,各步酶解的杜仲粉绿原酸含量分别为26.4 μg/g、20.5μg/g、14.9μg/g,三步酶解的绿原酸总量可达61.8μg/g,水提杜仲粉中绿原酸含量仅为12.1 μg/g,酶提法提取的绿原酸约为水提法提取的5倍多。随着酶的加入,提取出绿原酸逐渐减少。酸性蛋白酶处理后提取的绿原酸最多,纤维素酶处理后提取的绿原酸最少,仅有14.9 μg/g,但仍比水提法多2.8 μg/g。说明多种酶连续分步酶解可使杜仲叶中的绿原酸大量溶出。
3 结论
本研究采用酸性蛋白酶、果胶酶和纤维素酶对杜仲叶进行分步酶解,并采用高效液相色谱法对其绿原酸的含量进行测定。结果表明,随着酶的不断加入能提取出的物质逐渐变少,多种酶分步连续酶解后对于提取绿原酸十分有效,能达到充分提取的效果,经纯水、酸性蛋白酶、果胶酶和纤维素酶提取杜仲粉中绿原酸含量分别为12.1 μg/g、26.4 μg/g、20.5 μg/g、14.9 μg/g,酸性蛋白酶提取最多,果胶酶次之,纤维素酶最少,但仍然比水提取的绿原酸多2.8μg/g。相较于水提法来看,酶解法优势明显。
传统中多采用水提法提取中药草中的药效成分,长时间煎煮不但耗能费时,还会破坏许多热敏性的药效成分。水提法不能将叶中的绿原酸尽可能多的提出,因杜仲叶中的活性物质大多存在于细胞壁包被的叶细胞内,通过生物酶水解破坏杜仲的叶片结构和细胞壁使药效成分加快释放,充分提取,因此,酶解法提取杜仲中的绿原酸发展前景十分广阔。
[1]杜王康才,刘丽.杜仲黄柏高效种植[M].郑州:中原农民出版社,2003:3-7.
[2]王亚琴,张康健.杜仲次生代谢物的研究进展[J].中草药,2004,35(7):836.
[3]潘亚磊,翟远坤,武祥龙,等.杜仲活性成分的提取及分离纯化方法研究进展[J].化学与生物工程,2012,29(2):1-5.
[4]栾庆祥.杜仲化学成分和药理作用研究进展[J].安徽农业科学,2016,44(9):153-156.
[5]彭红梅,李小姝.杜仲的药理研究现状及应用展望[J].中医学报,2013,28(1):72-73.
[6]KWAN C Y,CHEN C X,DEYAMA T,et al.Endothelium-dependent vasorelaxant effects of the aqueous extracts of theEucommia ulmoides Oliv.leaf and bark:implications on their antihypertensive action[J]. Vascular Pharmacol,2004,40(5):229-35.
[7]魏明,杨晓梅,刘佳红,等.绿原酸的药理作用研究进展[J].陕西中医,2016,37(4):511-512.
[8]刘颖,郭明晔,白根本.绿原酸的研究进展[J].中药材,2012,35(7):1180-1185.
[9]国家药典委员.中国药典2005年版.二部[M].北京:中国医药出版社,2005.
[10]陈海莉.杜仲叶提取物制备工艺及质量标准研究[D].开封:河南大学,2014.
[11]兰小艳,张学俊,龚桂珍.杜仲叶中绿原酸的研究进展[J].中国农学通报,2009,25(21):86-89.
[12]冯薇薇.杜仲中化学成分的提取、分离、纯化与测定[D].长沙:中南大学,2013.
[13]兰小艳,黄敏,张学俊.杜仲叶中绿原酸醇提法的工艺研究[J].中国农学通报,2009,25(18):84-88.
[14]冉琴琴,张效宁,张文坤,等.产角质酶酵母菌的发现与鉴定及产酶条件的优化[J].生物技术通报,2014(5):148-154.
[15]张学俊,张萌萌,苏晓兰.原生态杜仲胶的生物提取意义[J].中国橡胶,2015,31(5):41-46.
Extraction of chlorogenic acid from folium cortex eucommiae by enzymatic hydrolysis method and determination of its content
ZHANG Xuemei1,2,XIE Jinrui3,CHEN Yufu1,2,ZHANG Xuejun1,2*
(1.Guizhou Province Key Laboratory of Fermentation Engineering&Biological Pharmacy,Guizhou University,Guiyang 550025,China; 2.School of Liquor&Food Engineering,Guizhou University,Guiyang 550025,China; 3.School of Pharmaceutical Sciences,Guiyang 550025,China)
The chlorogenic acid from folium cortex eucommiae was extracted by acid protease,pectinase and cellulase,and the content was determined by high performance liquid chromatography(HPLC).After continuous hydrolysis by acid protease,pectinase and cellulase in sequence, the total content of chlorogenic acid from folium cortex eucommiae was up to 61.8 μg/g,and the content of chlorogenic acid extracted by acid protease,pectinase and cellulase were 26.4 μg/g,20.5 μg/g and 14.9 μg/g,respectively,which was significantly higher than that of water extraction (12.2 μg/g).
folium cortex eucommiae;chlorogenic acid;hydrolysis;HPLC
Q55
0254-5071(2016)10-0149-04
10.11882/j.issn.0254-5071.2016.10.033
2016-05-19
校正合作项目(筑科合同[2011102]109)
张雪梅(1990-),女,硕士研究生,研究方向为微生物学、天然产物化学。
张学俊(1952-),男,教授,博士,研究方向为化学生物学,酶化学和天然产物化学。

