中慢生型天山根瘤菌MsiR组成型蛋白突变株的筛选
赵亚琪,马腾,蔡韬*
(1.天津科技大学生物工程学院,天津300222;2.中国科学院天津工业生物技术研究所,天津300308)
中慢生型天山根瘤菌MsiR组成型蛋白突变株的筛选
赵亚琪1,2,马腾1,2,蔡韬2*
(1.天津科技大学生物工程学院,天津300222;2.中国科学院天津工业生物技术研究所,天津300308)
MsiR蛋白来源于中慢生型天山根瘤菌(Mesorhizobium tianshanense),是LysR转录调控蛋白家族中的一员,它可以响应宿主植物释放的抗代谢物-刀豆氨酸,激活外运蛋白msiA编码基因的转录表达。通过构建MsiR突变文库,筛选得到了7个MsiR组成型突变蛋白,L166P、A147V、P83L、A278T组成型突变蛋白丧失了对刀豆氨酸的响应,在没有刀豆氨酸时的荧光值为800左右;A147T、E59G组成型突变蛋白仍然可以响应刀豆氨酸的诱导信号,添加刀豆氨酸时荧光值是未添加时的1.7倍。通过蛋白同源建模分析了组成型突变的氨基酸残基在MsiR蛋白上的空间分布及其对MsiR蛋白调控功能可能的影响。组成型突变蛋白的研究对进一步揭示LysR家族蛋白转录调控的机理有重要意义。
LysR家族转录调控蛋白;MsiR蛋白;组成型突变;mCherry报告基因
中慢生型天山根瘤菌(Mesorhizobium tianshanense CCBAU3306)是1995年定义命名的新菌种,分离于新疆土壤,可在刺果甘草(Glycyrrlazeuralensis)的根部形成共生根瘤并进行固氮[1];刀豆氨酸最早在1929年由日本科学家发现,是精氨酸的结构类似物,因此会被生物体误掺入正在合成的多肽链中,形成没有活性的蛋白质,最终导致生物体死亡。某些豆科植物会利用刀豆氨酸抵御昆虫和食草性动物。L-刀豆氨酸(L-canavanine)因其毒性、抗代谢性被认为是一种潜在的杀虫剂,另外,L-刀豆氨酸的抗肿瘤性是研究的热点[2]。甘草种子萌发时会向周围根际环境中释放刀豆氨酸,刀豆氨酸作为抗代谢物可以清除土壤中的潜在致病微生物,然而天山根瘤菌却可以在其根部大量繁殖并结瘤固氮,这主要是依赖于其体内的msiA/msiR调控系统。
msiA基因编码一种氨基酸外运蛋白,负责转运胞内刀豆氨酸;msiR基因编码的MsiR蛋白是msiA基因表达所必需的,MsiR蛋白可以特异的识别胞内的刀豆氨酸,并结合到msiA的启动子区,激活msiA基因的转录,MsiA蛋白将刀豆氨酸运出胞外[3-4],降低胞内刀豆氨酸的浓度,去除刀豆氨酸对根瘤菌的毒性,使天山根瘤菌可以在甘草根际繁殖并形成根瘤固氮。
MsiR蛋白是一种转录调控蛋白,属于LysR型转录调控蛋白家族中的一员,LysR家族转录调控蛋白是目前已知的最大的一类原核生物转录调控蛋白[5]。该家族蛋白可以识别小分子配体并调控多种基因的转录[6],涉及细胞生长代谢、发育分裂[7]、固氮结瘤[8]、毒素产生[9-10]、氧压感应、信号交流、群体感应[11]等多个过程。LysR家族蛋白通过突变文库筛选以及定点突变的方法筛选得到了多种组成型表达的突变蛋白,如NodD1突变蛋白(K205N、D284N)[12],CbbR突变蛋白(G96S、R136S、R155H)[13],CysB突变蛋白(A227D、Y164N、Y197S)[14]等;这些位点的突变导致转录调控蛋白在没有诱导物的情况下也可以激活目标基因的表达,推测这些位点可能影响调控蛋白对诱导物的结合、响应或者影响蛋白本身的聚集状态和构象。LOCHOWSKA A等[14]在CysB组成型蛋白的研究中指出CysBcA227D突变可能改变了蛋白的聚集状态,CysBcY164A突变可能改变了CysB蛋白的构象,使突变蛋白在不含诱导物的情况下始终保持激活诱导的状态;KULLIK I等[15]在对OxyR研究中也发现OxyR(A233V)组成型突变使蛋白由野生型的四聚体状态变成二聚体。组成型蛋白突变株的研究对我们进一步揭示LysR家族蛋白转录调控机理的奥秘有重要意义。
本研究以MsiR蛋白为研究对象,通过XL1-Red致突变菌株构建了MsiR蛋白的基因突变文库,在含mCherry报告基因[16]及卡那霉素抗性双筛选系统的筛选菌株中进行筛选并得到了7个组成型表达的蛋白;文章旨在建立了一种能够简单直观并且可以实现高通量筛选突变蛋白的方法,为LysR家族转录调控蛋白的机理研究提供新的思路。
1 材料与方法
1.1材料与试剂
1.1.1菌种与质粒
致突变菌株大肠杆菌(E.coli)XL1-Red感受态细胞以及E.coliXL1-Blue感受态细胞:美国安捷伦科技有限公司;E.coliBW20767用作结合转移供体菌、中慢生型天山根瘤菌(Mesorhizobium tianshanense)的msiR基因敲除菌株TC4:本实验室保存;质粒pTCV151,含有Ptac-msiR基因片段,用于在天山根瘤菌中表达msiR基因;质粒pTM5(含有PmsiA-mCherry基因片段),mCherry基因的表达受msiA启动子的控制,用于检测msiR及其突变株的转录活性。
1.1.2试剂
链霉素(质量浓度为100 mg/L)、壮观霉素(质量浓度为100 mg/L)、庆大霉素(质量浓度为20 mg/L)、卡那霉素(质量浓度为50 mg/L):北京索莱宝科技有限公司;刀豆氨酸:西格玛中国有限公司;PCR纯化试剂盒胶回收试剂盒、高纯度质粒小提试剂盒:美国Axygen公司。
1.1.3培养基
大肠杆菌采用LB培养基,37℃培养;LB培养基的成分:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,固体培养基琼脂添加量为1.5%。
天山根瘤菌采用TY培养基,28℃培养;TY培养基的成分:胰蛋白胨5 g/L,酵母提取物3 g/L,CaCl20.67 g/L,固体培养基琼脂添加量为1.5%。
1.2仪器与设备
SW-CJ-IFD超净工作台:苏州苏净集团有限公司;Master cycle pro梯度PCR仪:德国Eppendorf公司;SpectraMax M5连续波长多功能酶标仪:美国MD公司;THZ-052小型恒温摇床:上海博彩生物科技有限公司;SHP-150生化培养箱:上海森信试验仪器有限公司;Microtron21961高通量振荡培养系统:伊孚森生物技术(中国)有限公司。
1.3方法
1.3.1筛选菌株TC27(pTM5)的构建
本研究中构建了一个含双筛选系统的筛选菌株:以TC4(中慢生型天山根瘤菌的msiR基因敲除菌株)为出发菌株,利用同源双交换[17]法将没有启动子的卡那霉素抗性基因插入到msiA结构基因上,同时构建质粒pTM5,pTM5是将mCherry基因克隆到MsiR蛋白所调控的启动子PmsiA下游,用于定量的检测不同MsiR突变蛋白对PmsiA转录调控的影响,msiA启动子的表达情况用mCherry荧光值与OD600nm的比值来表示;将pTM5电转化至上述菌株中,构建成筛选菌株TC27(pTM5)。
1.3.2MsiR蛋白基因突变文库的构建
采用XL1-Red致突变菌株构建MsiR突变文库,致突变菌株的突变机制大都类似,这类菌株的DNA修复过程中的三个酶基因(错配修复基因[18]、DNA聚合酶III 3′→5′核酸外切酶基因[19]和8-oxo-dGTP水解酶基因[20])缺失,导致DNA复制过程的忠实性和准确性降低,致使基因发生突变。
(1)将XL1-Red化转感受态在冰上解冻,取100 μL感受态于1.5 mL的EP管中,在冰上冰浴10 min,每2 min轻轻搅动一次。
(2)向感受态中加入50 ng左右的质粒pTCV151,轻轻混匀,冰浴30 min后42℃热击42 s,冰浴2 min,加入1 mL的LB液体培养基(于42℃预热),37℃、220 r/min孵育1 h,取200 μL涂布于含庆大霉素的固体LB培养基中,37℃培养24 h。
(3)待菌落长出后,挑取200个左右的单克隆接种至20mL含有庆大霉素的液体LB培养基中,37℃、220r/min培养24 h。
(4)取5μL菌液转接至10mL的含有庆大霉素的液体LB培养基中,37℃、220 r/min培养24 h,重复转接3次。
(5)抽提质粒,电转化至电转感受态XL1-Blue中,37℃、220 r/min孵育1 h,涂布至含庆大霉素的固体LB培养基中,37℃培养过夜。
(6)收集菌体,加入50%甘油,-80℃保存,此为构建好的突变文库。
1.3.3MsiR蛋白突变文库筛选
取适量的含MsiR突变文库(用MsiR*来表示MsiR突变蛋白)的筛选菌株TC27(pTM5,Ptac-msiR*)涂布于含有链霉素、壮观霉素、庆大霉素、卡那霉素的固体TY培养基,28℃条件下培养4 d,挑取红色菌落并接种至液体培养基中进行活化,然后分别转接至含诱导物刀豆氨酸以及不含刀豆氨酸的液体培养基中,28℃培养4d,吸取200μL的新鲜菌液加入到96孔黑色荧光板中,使用连续波长酶标仪检测mCherry荧光值,激发光波长为587 nm,吸收光波长为610 nm,同时检测OD600nm值,收集数据进行分析。
2 结果与分析
2.1构建符合筛选需求的筛选菌株
本研究中构建了含双筛选系统的筛选菌株,实现了抗性和荧光双筛选,可以有效地去除单一筛选带来的假阳性。菌株TC27构建的示意图见图1。由图1可知,Ptac-msiR*表达MsiR突变蛋白(MsiR*),MsiR*突变蛋白可以结合在PmsiA上,刀豆氨酸为诱导物;当MsiR突变为组成型蛋白时,不需要刀豆氨酸诱导即可启动PmsiA下游基因(卡那抗性基因和mCherry荧光基因)的表达,在含卡那霉素的平板上形成肉眼可见的红色菌落。
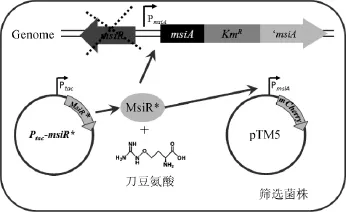
图1 筛选菌株TC27(pTM5,Ptac-msiR*)示意图Fig.1 Schematic diagram of screened strain TC27(pTM5,Ptac-msiR*)
为了验证筛选菌株的可行性,将含野生型msiR基因的表达载体pTCV151以及空载体pYC12通过结合转移分别转入筛选菌株中。将含有pTCV151以及空载体pYC12的筛选菌株分别在TY含链霉素、壮观霉素、庆大霉素、卡那霉素以及TY含链霉素、壮观霉素、庆大霉素、卡那霉素、终质量浓度为10 mg/L的刀豆氨酸的液体条件下培养4 d后检测菌体的OD600nm值,结果见图2。由图2a所示,含有质粒pTCV151的筛选菌株在有刀豆氨酸时的OD600nm为0.8,在没有刀豆氨酸诱导时,菌体的OD600nm只有0.1,含有空载体pYC12的筛选菌株无论是在有或者没有刀豆氨酸的条件下,菌体的OD600nm都只有0.1左右,这说明筛选菌株在野生MsiR蛋白以及刀豆氨酸同时存在时,才可以启动卡那抗性基因的表达,菌体在有卡那抗性的培养基中才可以生长。
同样,将含有pTCV151以及空载体pYC12的筛选菌株分别在TY含链霉素、壮观霉素、庆大霉素以及TY含链霉素、壮观霉素、庆大霉素、终质量浓度为10 mg/L的刀豆氨酸的液体培养基条件下培养4 d,检测菌体的荧光值;由图2b所示,含有质粒pTCV151的筛选菌株在有刀豆氨酸时的mCherry荧光值为520左右,在没有刀豆氨酸诱导时的荧光值仅为120左右,含有空载体pYC12的筛选菌株无论在有或是没有刀豆氨酸诱导的情况下菌体的荧光值都只有120左右,处于本底表达水平,这说明筛选菌株在有MsiR蛋白以及刀豆氨酸诱导时,mCherry基因才可以表达并产生红色荧光。综上所述,筛选菌株只有在转录调控蛋白—MsiR蛋白以及诱导物—刀豆氨酸同时存在时才可以启动卡那抗性基因以及mCherry基因的表达,菌体才可以生长并可以产生红色荧光。

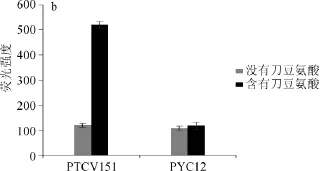
图2 验证筛选菌株的OD600nm值(a)以及mCherry荧光值(b)Fig.2 OD600nmvalue(a)andmCherryfluorescence intensity value(b)of screened strain
2.2分离鉴定MsiR组成型突变蛋白
将含有MsiR突变文库的筛选菌株在TY(链霉素、壮观霉素、庆大霉素、卡那霉素)的平板上涂布进行初筛,挑取红色菌落在含刀豆氨酸以及不含刀豆氨酸的液体培养基中培养并检测突变株的荧光强度,挑选了22株组成型表达的突变株,提取质粒并测序,经分析得到7个不同的MsiR组成型表达的突变蛋白。突变位点对应的氨基酸变化情况,出现的频率、突变位置以及可能影响的功能见表1,不同组成型突变蛋白的荧光强度见图3。
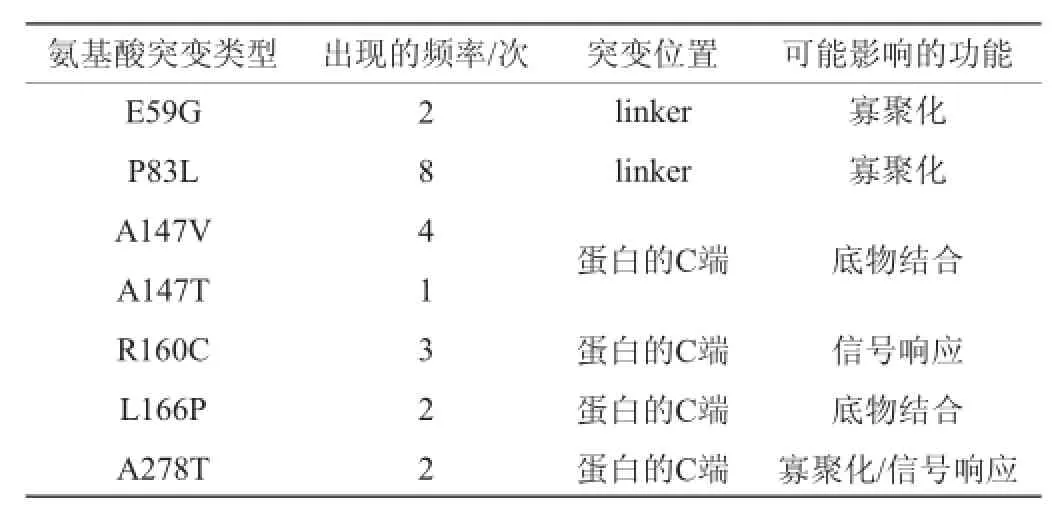
表1 组成型突变蛋白中氨基酸突变位置及频率统计Table 1 Mutation location of amino acids and frequency in constitutive mutant protein

图3 不同突变蛋白的荧光强度Fig.3 Fluorescence intensity of different mutant proteins
L166P、A147V、P83L、A278T突变蛋白在没有刀豆氨酸时,其荧光强度约是野生型的6倍,在有小分子——刀豆氨酸时,并没有表现出进一步的诱导作用,但荧光强度却是野生型在相同诱导条件下的1.5倍;A147T、E59G、R160C突变在不含刀豆氨酸时,其荧光强度与野生型蛋白在有刀豆氨酸诱导时的荧光强度相近,刀豆氨酸对R160C突变蛋白同样没有影响,但是对A174T、E59G这两个突变蛋白有明显的诱导作用,其荧光强度是原来的1.7倍;这说明这两种类型的组成型突变蛋白并没有完全失去响应诱导物的能力。
2.3MsiR组成型突变位点主要位于MsiR蛋白的C端以及linker区
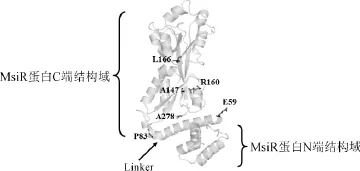
图4 MsiR蛋白结构模型Fig.4 Structure model of MsiR protein
通过蛋白同源建模得到MsiR蛋白的结构模型,将这些组成型表达的突变位点标注在模型上,由图4可以发现,突变位点大多位于C端以及linker上。E59、P83氨基酸残基位于linker上,linker区是LysR家族蛋白形成四聚体的寡聚化区之一。各突变位点具体分布以及其可能影响的功能情况见表1。因此,E59G以及P83L组成型突变蛋白可能影响了蛋白的寡聚化状态;A147、L166P氨基酸残基位于MsiR蛋白C端结构域,该结构域主要负责与小分子的结合,因此,A147V、A147T以及L166P组成型突变蛋白可能影响了蛋白与小分子的结合,使蛋白不需要小分子便可以形成具有活性的构象激活转录;R160氨基酸残基虽然也位于MsiR蛋白C端结构域,但是该氨基酸的侧链是伸向于结合口袋的外侧,并不直接参与和小分子的互作,因此推断R160C突变蛋白可能是影响了蛋白与小分子作用信号的传递;A278氨基酸残基位于MsiR蛋白C端结构域的loop上,可能会与蛋白linker或C端结构域的某些氨基酸发生作用,影响蛋白的寡聚化状态或者信号响应。
3 结论
一直以来,对于LysR家族蛋白的研究都侧重挖掘出转录调控蛋白与目的DNA之间的作用机理以及小分子在DNA与蛋白的互作过程中起到的关键性的作用;组成型突变蛋白在不存在小分子的情况下便可以激活转录,这可能是由于蛋白发生组成型突变时,改变了蛋白的构象或者改变了蛋白的寡聚化状态,使蛋白保持激活诱导的;也有报道指出,组成型突变蛋白与DNA结合后改变了DNA的弯折角度,使其处于持续转录的状态。
本研究通过构建MsiR突变文库以及含双筛选系统的筛选菌株,利用mCherry报告基因方便,快捷,光稳定性强的特点实现了高通量筛选;通过筛选得到了7株组成型突变株,通过测序确定这7个突变株的突变位点,通过蛋白同源建模分析了这些突变位点的位置以及可能影响的功能,丰富了对MsiR转录调控蛋白与DNA以及小分子——刀豆氨酸作用机理的理解,为LysR家族蛋白的调控机理研究提供了新思路。
[1]CHEN W,WANG E,WANG S,et al.Characteristics ofRhizobium tianshanensesp.nov.,a moderately and slowly growing root nodule bacterium isolated from an arid saline environment in Xinjiang,People's Republic of China[J].Int J Syst Bacteriol,1995,45(1):153-159.
[2]高艳,张小林,胡延雷,等.L-刀豆氨酸的研究进展[J].化工中间体,2006(3):5-7,27.
[3]CAI T,CAI W,ZHANG J,et al.Host legume-exuded antimetabolites optimize the symbiotic rhizosphere[J].Mol Microbiol,2009,73(3):507-517.
[4]马腾,赵亚琪,路福平,等.MsiR高可溶性蛋白突变株的筛选[J].中国酿造,2015,34(5):43-47.
[5]MADDOCKS S E,OYSTON P C.Structure and function of the LysR-type transcriptional regulator(LTTR)family proteins[J].Microbiology, 2008,154(12):3609-3623.
[6]HENIKOFF S,HAUGHN G W,CALVO J M,et al.A large family of bacterial activator proteins[J].P Natl Acad Sci USA,1988,85(18): 6602-6606.
[7]LU Z,TAKEUCHI M,SATO T.The LysR-type transcriptional regulator YofA controls cell division through the regulation of expression offtsW inBacillus subtilis[J].J Bacteriol,2007,189(15):5642-5651.
[8]KAMBOJ D V,BHATIA R,PATHAK D V,et al.Role of nodD gene product and flavonoid interactions in induction of nodulation genes in Mesorhizobium ciceri[J].Physiol Mol Biol Plant,2010,16(1):69-77.
[9]CAO H,KRISHNAN G,GOUMNEROV B,et al.A quorum sensing-associated virulence gene ofPseudomonas aeruginosaencodes a LysR-like transcription regulator with a unique self-regulatory mechanism[J].P Natl Acad Sci USA,2001,98(25):14613-8.
[10]RUSSELL D A,BYRNE G A,O'CONNELL E P,et al.The LysR-type transcriptional regulator VirR is required for expression of the virulence gene vapA ofRhodococcus equiATCC 33701[J].J Bacteriol,2004, 186(17):5576-84.
[11]KIM J,KIM JG,KANG Y,et al.Quorum sensing and the LysR-type transcriptional activator ToxR regulate toxoflavin biosynthesis and transport inBurkholderia glumae[J].Mol Microbiol,2004,54(4):921-934.
[12]PECK M C,FISHER R F,BLISS R,et al.Isolation and characterization of mutantSinorhizobium melilotiNodD1 proteins with altered responses to luteolin[J].J Bacteriol,2013,195(16):3714-23.
[13]DANGEL A W,GIBSON J L,JANSSEN A P,et al.Residues that influencein vivoandin vitroCbbR function in Rhodobacter sphaeroides and identification of a specific region critical for co-inducer recognition[J]. Mol Microbiol,2005,57(5):1397-1414.
[14]LOCHOWSKA A,IWANICKA-NOWICKA R,PLOCHOCKA D,et al. Functional dissection of the LysR-type CysB transcriptional regulator-Regions important for DNA binding,inducer response,oligomerization, and positive control[J].J Biol Chem,2001,276(3):2098-107.
[15]KULLIK I,STEVENS J,TOLEDANO M B,et al.Mutational analysis of the redox-sensitive transcriptional regulator OxyR:regions important for DNA binding and multimerization[J].J Bacteriol,1995,177(5): 1285-91.
[16]DUELLMAN T,BURNETT J,YANG J.Quantitation of secreted proteins usingmCherryfusion constructs and a fluorescent microplate reader[J].Anal Biochem,2015,473:34-40.
[17]于慧敏,马玉超.工业微生物代谢途径调控的基因敲除策略[J].生物工程学报.2010,26(9):1199-1208.
[18]LEE J B,CHO W K,PARK J,et al.Single-molecule views of MutS on mismatched DNA[J].DNA Repair,2014,20:82-93.
[19]HOSS M,ROBINS P,NAVEN T J,et al.A human DNA editing enzyme homologous to theEscherichia coliDnaQ/MutD protein[J].EMBO J, 1999,18(13):3868-3875.
[20]GORDON A J,SATORY D,WANG M,et al.Removal of 8-oxo-GTP by MutT hydrolase is not a major contributor to transcriptional fidelity [J].Nucleic Acid Res,2014,42(19):12015-12026.
Screening of MsiR constitutive mutants fromMesorhizobium tianshanense
ZHAO Yaqi1,2,MA Teng1,2,CAI Tao2*
(1.Tianjin University of Science&Technology,Tianjin 300222,China;2.Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences,Tianjin 300308,China)
MsiR protein,derived fromMesorhizobium tianshanense,is one of LysR-type transcriptional regulators(LTTRs),which can activate transcription of themsiAgene in response to anti-metabolite canavanine released by host plant licorice.By building MsiR mutant library,seven MsiR mutants were screened,the mutant protein of L166P,A147V,P83L,A278T lost response to canavanine,and the fluorescence intersity were about 800 without canavanine.While constitutive mutants A147T and E59G can still be induced by canavanine,the fluorescence intonsity of the mutants with canavanine were 1.7 times of the ones without canavanine.Through the distribution of the mutated amino acid residues in MsiR protein and their possible functions through protein homology modeling,the research for MsiR consititutive mutants may provide inspiration to uncovering regulatory mechanism of LTTRs.
LysR-type transcriptional regulator;MsiR protein;constitutive mutant;mCherryreporter gene
Q819
0254-5071(2016)10-0130-05
10.11882/j.issn.0254-5071.2016.10.029
2016-05-04
赵亚琪(1991-),女,硕士研究生,主要从事转录调控蛋白相关方面的研究工作。
蔡韬(1982-),男,副研究员,博士,主要从事转录调控蛋白相关方面的研究工作。

