海藻酸钠-阿拉伯胶固定化酸性蛋白酶及其性质的研究
焦玉双,王冕,王如福*
(山西农业大学食品科学与工程学院,山西太谷030801)
海藻酸钠-阿拉伯胶固定化酸性蛋白酶及其性质的研究
焦玉双,王冕,王如福*
(山西农业大学食品科学与工程学院,山西太谷030801)
以海藻酸钠(SA)与阿拉伯胶(GA)为载体固定化酸性蛋白酶,以酶活回收率为评价指标,在单因素试验基础上,通过正交试验优化固定化条件。得到以SA-AG复合凝胶为载体制备固定化酸性蛋白酶的最佳工艺条件为:复合凝胶质量浓度3.5 g/100 mL,SA与AG质量比2∶1,氯化钙质量浓度7.0 g/100 mL,固定化时间1.0 h,给酶量1 540 U/g,吸附时间2.0 h,酶液pH值为3.0。此最佳条件下,固定化酸性蛋白酶酶活回收率为67.34%,酶活力为1 380 U/g。固定化酶酶学性质的研究结果表明,固定化酸性蛋白酶的最适作用温度(45℃)和最适反应pH值(pH=3)均与游离酶相同,但其热稳定性优于游离酶,且随着温度的升高这种优势越明显。
酸性蛋白酶;固定化酶;海藻酸钠;阿拉伯胶
酸性蛋白酶是指具有较低的最适pH值的蛋白酶,一般pH值在2.0~5.0,酸性蛋白酶在食品工业中最主要的应用是在酒类、酱油和食醋的酿造等方面[1-4]。游离蛋白酶直接应用于生产,不利于再次回收利用,同时也可能会对产品造成一定的污染。固定化技术是20世纪50年代发展起来的一项新技术,固定化酶技术就是用载体将游离酶束缚在一定空间里,但不影响其特有的催化作用的一项技术,相较游离酶具有易于控制、易于分离、可重复使用的优点[5]。目前传统的酶固定化的方法主要有吸附法、共价结合法、包埋法及交联法四大类[6],其中吸附法制备固定化酶因其操作简单、载体选择范围较广、固定化操作过程简单、制备条件温和、不易破坏酶分子的高级结构以及活性中心的构象且酶活回收率较高、载体可回收重复利用[7]等优点而被广泛应用。
海藻酸钠(sodium alginate,SA)是从海带中提取的天然多糖碳水化合物,易溶于水且易与一些二价阳离子相结合形成凝胶[8]。阿拉伯胶(Arabic gum,AG)是应用最广泛的一种树胶,有很好的酸稳定性[9]。二者均为食品级天然胶体,安全无毒、廉价易得,在营养学、医学、食品工业等方面具有广泛的应用[10-12]。
目前,有较多关于使用海藻酸钠制备固定化载体材料的研究。李晓卉等[13]以海藻酸钠和明胶为载体,对L-阿拉伯糖异构酶进行固定,得到性能较稳定的固定化酶;张富新等[14]研究了中性蛋白酶在海藻酸钠中的固定化技术,并确定了最佳固定化工艺条件;崔松松等[15]以海藻酸钠为载体、戊二醛为交联剂,制备固定化生姜蛋白酶,制得与游离酶相比对温度和酸碱适应范围更加宽泛的固定化生姜蛋白酶。而将SA-AG作为固定化载体材料的研究较少。王冕等[16]以SA与AG为载体固定化糖化酶,研究出最佳制备工艺条件,并得到热稳定性及操作稳定性均较强的固定化酶。
本试验以海藻酸钠和阿拉伯胶复合制备酶的固定化载体,采用吸附法制得固定化酸性蛋白酶。研究了复合凝胶浓度、SA与AG质量比、氯化钙浓度、固化时间、给酶量、吸附时间等因素对固定化效果的影响,并对所制得的酸性蛋白酶的酶学性质进行研究,为固定化酸性蛋白酶的实际应用提供理论参考。
1 材料与方法
1.1材料与试剂
酸性蛋白酶(50 000 U/g):苏柯汉生物工程有限公司;海藻酸钠:青岛迈潮海洋科技发展有限公司;阿拉伯胶:艾纳提化工科技有限公司;其他试剂均为国产分析纯。
1.2仪器与设备
TGL-20MG高速台式冷冻离心机:湘仪离心机仪器有限公司;PHSJ-3F型pH计:上海精密科学仪器有限公司;BS210S万分之一电子天平:北京赛多利斯仪器系统有限公司;HH-4型数显恒温水浴锅:常州国华电器有限公司;85-2型恒温磁力搅拌器:上海思乐仪器有限公司。
1.3方法
1.3.1固定化酸性蛋白酶的制备方法[17]
(1)以载体溶液总体积30 mL计,设定复合凝胶质量浓度2.0 g/100 mL,SA与AG质量比1∶1,称取胶体于50~60℃蒸馏水中溶解,混合均匀,超声波快速消泡至复合凝胶中无气泡。
(2)使用10 mL医用注射器以约1滴/s的速度,将复合凝胶滴到浓度为5.0 g/100 mL的氯化钙溶液中,在4℃冰箱中固化1.0 h,用纱布滤出载体颗粒,并用pH值为3.0的乳酸-乳酸钠缓冲液冲洗3~5次除去表面的氯化钙。
(3)用滤纸吸干表面水分,放入pH值3.0、给酶量1 760 U/g的酶液中吸附1.0 h后用纱布滤出固定化颗粒,用缓冲液清洗,并用滤纸吸干表面的水分,制成球状颗粒,即得固定化酶,0~4℃条件下保存备用。
1.3.2酸性蛋白酶固定化条件优化单因素试验
设定复合凝胶质量浓度分别为2.0 g/100 mL、2.5 g/100 mL、3.0 g/100 mL、3.5 g/100 mL、4.0 g/100 mL、4.5 g/100 mL,SA与GA质量比分别为1∶1、2∶1、3∶1、4∶1,氯化钙质量浓度分别为5.0g/100mL、6.0g/100mL、7.0g/100mL、8.0g/100mL、9.0 g/100mL,固定化时间分别为0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h,给酶量分别为1 100 U/g、1 320 U/g、1 540 U/g、1760U/g、1980U/g、2200U/g,吸附时间分别为1.0h、1.5h、2.0 h、2.5 h、3.0 h,酶液pH值分别为2.5、3.0、3.5、4.0、4.5,考察复合凝胶质量浓度、SA与AG质量比、氯化钙质量浓度、固定化时间、给酶量、吸附时间、酶液pH值对酶活回收率的影响。
1.3.4酸性蛋白酶固定化条件优化正交试验
在单因素试验的基础上,选择对固定化过程影响较大的3个因素,每个因素设定3个水平,以酶活回收率为评价指标,采用L9(33)正交设计对固定化条件进行优化,正交试验因素与水平见表1。

表1 酸性蛋白酶固定化条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for conditions optimization of acid protease immobilization
1.3.3固定化酸性蛋白酶酶学性质的研究
(1)最适反应pH值
在不同pH的缓冲液中,以1%酪蛋白为底物,放入一定量的固定化酶及游离酶,30℃保温振荡反应10 min,测定固定化酶和游离酶的酶活。
(2)最适作用温度
取一定量的固定化酶及游离酶,以1%酪蛋白为底物,不同温度条件下,在上一步得到的酶最适反应pH缓冲液中保温振荡反应10 min,测定其酶活。
(3)热稳定性
取一定量的固定化酶于pH 3.0的缓冲液中,在不同温度条件下加热处理30 min后,迅速冷却。在固定化酶最适作用温度条件下,测定其酶活。
1.3.4游离酸性蛋白酶活力的测定
酶活力测定采用国标GB/T 23527—2009《蛋白酶制剂》中的福林-酚法。
酸性蛋白酶活力定义:单位质量的酸性蛋白酶在温度为40℃,pH 3.0条件下,1 min水解酪蛋白产生1 μg酪氨酸为1个酶活力单位(U)。样品的酸性蛋白酶活力按下式计算:
式中:X为样品的酶活力,U/g;A为由酪氨酸标准曲线得到的样品最终稀释液的酶活力,U/mL;V为溶解样品所使用的容量瓶的体积,mL;N为样品稀释倍数;4为反应试剂总体积,mL;为酶液分解酪蛋白的反应时间1为10 min,以1 min计。
L-酪氨酸标准曲线的制备:分别配制L-酪氨酸标准溶液的质量浓度为0、10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL,以波长680 nm处吸光度值(y)作纵坐标,酪氨酸的质量浓度(x)作横坐标,绘制L-酪氨酸标准曲线并计算其回归方程。按照标准曲线回归方程计算样品中酸性蛋白酶活力
1.3.5酶活回收率及相对酶活的计算
固定化酶所显示的活力占加入酶液中酶的总活力的
百分数为固定化酶的活力回收率。其计算公式如下:
相对酶活是指以同组最高酶活为参照,计算出的比值为相对酶活,设定同组酶活力最高的相对酶活为100%。其计算公式如下:
2 结果与分析
2.1酪氨酸标准曲线的制作
以吸光度值(y)作纵坐标,酪氨酸的质量浓度(x)作横坐标,绘制L-酪氨酸标准曲线,结果见图1。由图1可知,L-酪氨酸标准曲线回归方程为y=0.010 4x+0.008 4,相关系数为R2=0.999 2,表明二者线性关系良好。
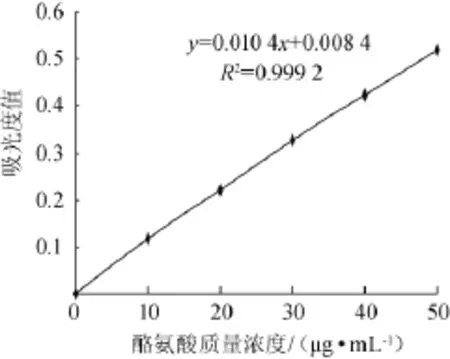
图1 酪氨酸标准曲线Fig.1 Standard curve of tyrosine
2.2载体选择及固定化条件对固定化酸性蛋白酶活力的影响
2.2.1复合凝胶浓度对酸性蛋白酶固定化效果的影响
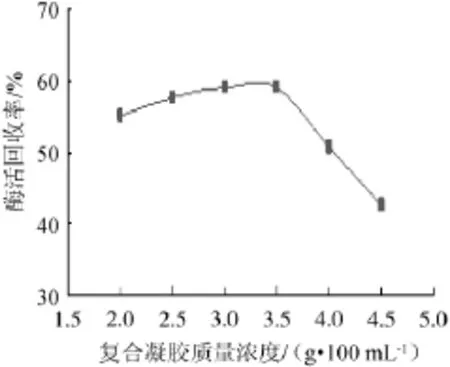
图2 复合凝胶质量浓度对固定化酶活回收率的影响Fig.2 Effect of composite gel content on the recovery rate of immobilized enzymes activity
由图2可知,在较低凝胶质量浓度时,随着复合凝胶质量浓度的增加固定化酶酶活回收率增加;当复合凝胶质量浓度达到3.5 g/100 mL时酶活回收率达到最大,之后随着凝胶质量浓度的增加酶活回收率开始降低,这是由于当凝胶质量浓度过大时其表面空隙过于紧密,不利于酶的吸附。因此,最佳复合凝胶质量浓度为3.5 g/100 mL
2.2.2SA-AG比例对酸性蛋白酶固定化效果的影响
由图3可知,随着SA-AG凝胶比例的增加酶活回收率呈现先增大后减小的趋势,在凝胶质量比为3∶1时酶活回收率达到最大。因此,最佳SA-AG凝胶质量比为3∶1。
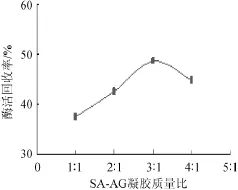
图3 SA-AG凝胶质量比对固定化酶活回收率的影响Fig.3 Effect of SA-AG mass ratios on the recovery rate of immobilized enzymes activity
2.2.3氯化钙质量浓度对酸性蛋白酶固定化效果的影响
由图4可知,随着氯化钙质量浓度的增大,固定化酶酶活回收率呈现先升高后下降的趋势,并在氯化钙质量浓度为7.0 g/100 mL时达到最大,这是因为SA与氯化钙作用是由于离子强度所决定,同时离子浓度会影响AG的分子结构,从而影响其效果[18-19]。因此,随着离子强度的增强,作用越明显;而当离子强度过大时,酶会受到影响而发生失活,表现为酶活回收率的降低。因此,最佳氯化钙质量浓度为7.0 g/100 mL。
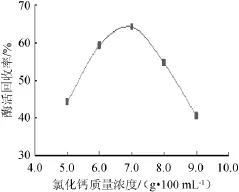
图4 氯化钙质量浓度对固定化酶活回收率的影响Fig.4 Effect of calcium chloride content on the recovery rate of immobilized enzymes activity
2.2.4固定化时间对酸性蛋白酶固定化效果的影响
由图5可知,随着固定化时间的延长,固定化酶酶活回收率呈现先增大后减小的趋势,且在固定化时间为1.0 h时达到最大。这是由于随着固定化时间的延长,载体的结构受到影响,对酶的吸附作用增强,酶活回收率增大;而当时间过长时固定化颗粒浸泡在氯化钙溶液中的时间较长,受Ca2+和Cl-影响的时间较长,导致酶活力下降。因此,最佳固定化时间为1.0 h。
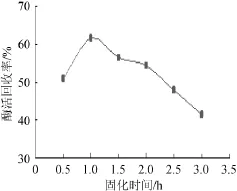
图5 固定化时间对固定化酶活回收率的影响Fig.5 Effect of immobilized time on the recovery rate of immobilized enzymes activity
2.2.5给酶量对酸性蛋白酶固定化效果的影响
由图6可知,随着给酶量的增加,给酶量为1 540~2 200 U/g时,酶活回收率呈下降趋势,相对酶活呈先增加后减小的趋势,相对酶活呈先增加后减小的趋势,并在给酶量为1 760 U/g时达到最高,在给酶量为1 540 U/g时,酶活回收率和相对酶活均处于较高水平,分别为87.2%和86%。这是由于给酶量的增加不利于酶被载体充分吸附,导致酶活回收率的降低;而一定质量的载体可吸附的酶量有限,当载体的吸附酶量达到饱和后继续增加给酶量反而会影响酶的继续吸附效果,所以相对酶活呈先增加后减小的趋势。因此,综合考虑酶活回收率和固定化酶相对酶活两个指标,确定最佳给酶量为1 540 U/g载体。
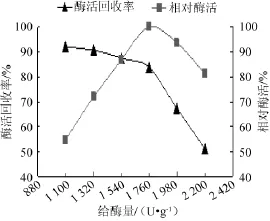
图6 给酶量对固定化酶活回收率的影响Fig.6 Effect of the enzyme addition on the recovery rate of immobilized enzymes activity
2.2.6吸附时间对酸性蛋白酶固定化效果的影响
由图7可知,吸附时间在1.0~3.0 h,固定化酶酶活回收率呈先增大后减小的趋势;在吸附时间为2.0 h时,固定化酶酶活回收率达到最大值;吸附时间>2.0 h时,固定化酶酶活回收率有所下降。因此,最佳吸附时间为2.0 h。
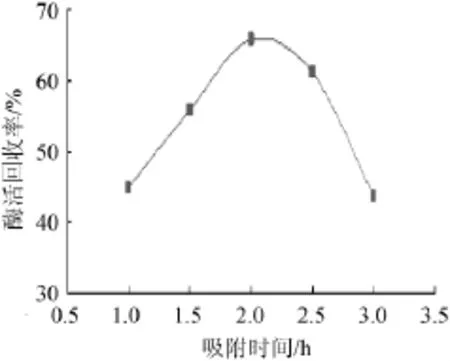
图7 吸附时间对固定化酶活回收率的影响Fig.7 Effect of absorption time on the activity recovery rate of immobilized enzymes
2.2.7酶液pH值对酸性蛋白酶固定化效果的影响
由图8可知,pH值在2.5~4.5,固定化酶酶活回收率呈先增大后减小的趋势;在pH值为3.0时固定化酸性蛋白酶活力最大;pH值>3.0,固定化酶酶活回收率有所下降。因此,最佳pH值为3.0。
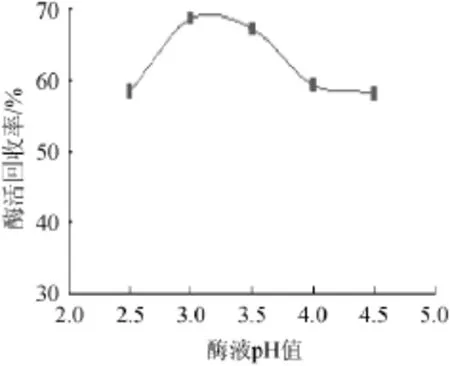
图8 酶液pH值对固定化酶活回收率的影响Fig.8 Effects of pH of the enzyme solution on the activity recovery rate of immobilized enzymes
2.3正交试验优化固定化工艺条件
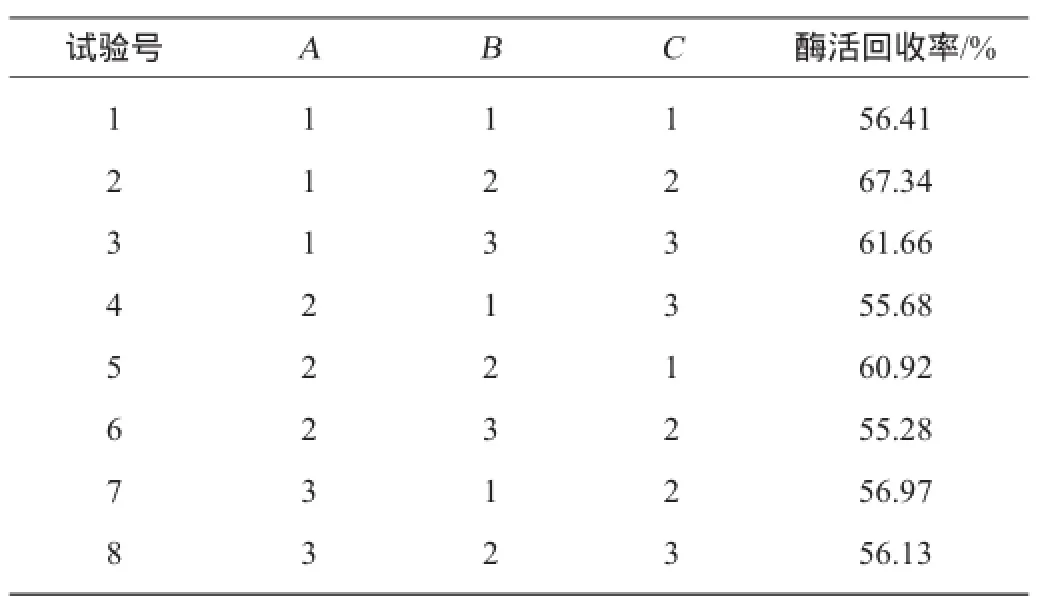
表2 酸性蛋白酶固定化条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for conditions optimization of immobilized acid protease

续表
由表2可知,影响因素的主次顺序为B>A>C,即氯化钙质量浓度>SA-AG质量比>固定化时间。固定化酶的理论最优水平为A1B2C2,即当SA-AG质量比为2∶1,氯化钙质量浓度为7.0 g/100 mL,固定化时间为1.0 h时,固定化酶的酶活回收率达到最高,为67.34%。
2.4固定化酶酶学性质的研究
2.4.1固定化酸性蛋白酶的最适作用温度
由图9可知,固定化酶和游离酶在不同的作用温度下相对酶活有一定的差异,当作用温度为45℃时,两种酶的酶活均达到最大。因此,固定化酶的最适温度为45℃。
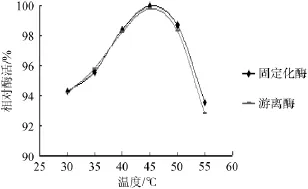
图9 游离酶和固定化酶的最适作用温度Fig.9 Optimum temperature of free enzyme and immobilized enzymes
2.4.2固定化酸性蛋白酶的最适反应pH值
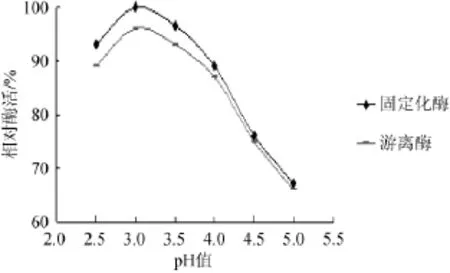
图10 游离酶和固定化酶的最适pH值Fig.10 Optimum pH of free enzyme and immobilized enzymes
由图10可知,固定化酶和游离酶的最适反应pH值均为3.0,且在相同pH值的情况下固定化酶的相对酶活均高于游离酶,证明经过固定化的酸性蛋白酶的pH稳定性有所提高。因此,固定化酶的最适pH值为3.0。
2.4.3固定化酸性蛋白酶的热稳定性
由图11可知,随着温度的升高,固定化酶和游离酶的酶活力均有所下降,且随着温度的升高固定化酶相对酶活高于游离酶的趋势越明显,证明固定化酶的热稳定性要高于游离酶。
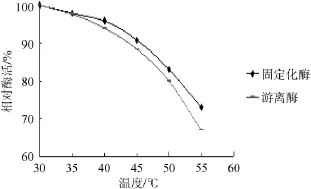
图11 游离酶和固定化酶的热稳定性Fig.11 Thermostability of free enzyme and immobilized enzymes
3 结论
SA-AG复合凝胶为载体制备固定化酸性蛋白酶的最佳工艺条件为:复合凝胶质量浓度3.5 g/100 mL,SA-AG质量比为2∶1,氯化钙质量浓度为7.0 g/100 mL,固定化时间为1.0 h,给酶量为1 540 U/g,吸附时间为2.0 h,酶液pH值为3.0。
通过对固定化酸性蛋白酶与游离酶酶学性质的研究得出:固定化酶和游离酶的最适pH均为3.0,最适作用温度为45℃,而且固定化酶的热稳定性则明显优于游离酶。
[1]张志刚,吴生文,陈飞.大曲酶系在白酒生产中的研究现状及发展方向[J].中国酿造,2011,30(1):13-16.
[2]赖樱花,成坚,李勇波,等.酸性蛋白酶对黄酒常规质量指标的影响[J].食品科技,2012,37(3):135-138.
[3]徐德峰.高活力酸性蛋白酶曲霉融合子的选育及其在酱油发酵中的初步应用[D].广州:华南理工大学,2010.
[4]刘鑫,李佳,刘克武.黑曲霉酸性蛋白酶在食醋酿造中的催化效应[J].化学研究与应用,2004,16(4):482-484.
[5]李晓静,侯俊财,江连洲,等.海藻酸钠-壳聚糖固定化胃蛋白酶的研究[J].生物工程,2014,35(1):168-174.
[6]韩志萍,叶剑芝,罗荣琼.固定化酶的方法及其在食品中的应用研究进展[J].保鲜与加工,2012,12(5):48-53.
[7]游金坤,余旭亚,赵鹏.吸附法固定化酶的研究进展[J].化学工程,2012,40(4):1-5.
[8]李芝,葛旭升,王志.啶虫脒/羧甲基壳聚糖-阿拉伯胶-海藻酸钠缓释微球的制备及性能研究[J].保定学院学报,2011,24(3):58-62.
[9]姚日生,董岸杰,刘永琼.药用高分子材料[M].北京:化学工业出版社,2003:131-132.
[10]杨雷,仇丹,周逸奎,等.阿拉伯胶的结构特征和乳化性能研究进展[J].食品工业科技,2013,34(12):353-356.
[11]冯辉霞,别倩雯,陈娜丽,等.海藻酸钠及其改性物对硅藻土的絮凝性能研究[J].食品工业科技,2014,35(5):62-65.
[12]王卫平.阿拉伯胶的种类及性质与功能的研究[J].中国食品添加剂,2002(2):22-28.
[13]李晓卉,程丽芳,沐万孟,等.交联海藻酸钠-明胶固定化L-阿拉伯糖异构酶的研究[J].食品工业科技,2011,30(8):198-201.
[14]张富新,张媛媛,党亚丽,等.海藻酸钠固定化中性蛋白酶的研究[J].西北农林科技大学学报:自然科学版,2005,33(11):89-93.
[15]崔松松,张琛,何孔泉,等.固定化生姜蛋白酶的制备及其性质研究[J].中国饲料,2011(18):31-33.
[16]王冕,王如福,焦玉双.海藻酸钠-阿拉伯胶固定化糖化酶及其性质的研究[J].中国酿造,2015,34(3):24-29.
[17]NAGANAGOUDA K.Gelatin bends with alginate:Gel fibers for galactosidase and its application in reduction of non-digestible oligosaccharides[J].Process Bioehem,2006,41(8):1903-1907.
[18]DICKINSON E,ELVERSON D J,MURRAY B S.On the film-forming and emulsion-stabilizing properties of gum Arabic:dilution and flocculation aspects[J].Food Hydrocolloid,1989,3(2):101-114.
[19]WANG B,WANG L J,LI D,et al.Effect of gum Arabic on stability of oil-in-water emulsion stabilized by flaxseed and soybean protein[J]. Carbohyd Polym,2011,86(1):343-351.正式批本刊自京大学国期刊新为一,对推动博士研
Immobilization of acid protease with sodium alginate-Arabic gum and study of protease properties
JIAO Yushuang,WANG Mian,WANG Rufu*
(College of Food Science and Engineering,Shanxi Agricultural University,Taigu 030801,China)
Using the sodium alginate(SA)and Arabic gum(AG)as carrier to immobilize acid protease,and using enzyme activity recovery rate as the evaluation index,the immobilization conditions were optimized by orthogonal experiments on the basis of single factor experiments.The result s showed that the optimum technological conditions of acid protease immobilization with SA-AG composite gel as the carrier were composite gel content 3.5 g/100 ml,SA-AG mass ratio 2∶1,calcium chloride content 7.0 g/100 ml,immobilization time 1.0 h,enzyme addition 1 540 U/g,adsorption time 2.0 h,pH of enzyme liquid 3.0.Under the conditions,the recovery rate of immobilized acid protease activity was 67.34%,and enzyme activity 1 380 U/g.The research results of immobilized enzyme properties showed that the optimal temperature(45℃)and the optimal pH(3.0)of immobilized acid protease were the same as the free enzyme.The thermal stability of immobilized acid protease was better than that of the free enzyme,and this advantage was more and more obvious with the increase of temperature.
acid protease;immobilized enzyme;sodium alginate;Arabic gum
Q814
0254-5071(2016)10-0062-06
10.11882/j.issn.0254-5071.2016.10.014
2016-06-21
山西省科技重点研发项目(2015-TN-10)
焦玉双(1989-),女,硕士研究生,研究方向为发酵食品工艺、果蔬采后生理及贮运技术。
王如福(1960-),男,教授,博士,研究方向为发酵食品工艺、果蔬采后生理及贮运技术。

