伊维菌素对雄性吉富罗非鱼生理生化指标的影响
李世凯,江敏,吴昊,彭晓叶,张健龙,谢芹,刘利平
1. 上海海洋大学 水产与生命学院,上海 201306 2. 贵州省水产研究所,贵阳 550025
伊维菌素对雄性吉富罗非鱼生理生化指标的影响
李世凯1,2,江敏1,,吴昊1,彭晓叶1,张健龙1,谢芹1,刘利平1
1. 上海海洋大学 水产与生命学院,上海 201306 2. 贵州省水产研究所,贵阳 550025
为探讨抗寄生虫药物伊维菌素(IVM)对鱼类的毒性效应,以雄性吉富罗非鱼(Oreochromis niloticus)为实验对象,设定了A(空白对照)、B(乙醇对照)、C(0.1 mg·kg-1)、D(0.5 mg·kg-1)、E(1 mg·kg-1)5个实验组,研究IVM对吉富罗非鱼肝脏和血液生理生化的影响。研究发现:正常生理状态下吉富罗非鱼肝脏中的丙二醛(MDA)含量较低,IVM作用后除最高剂量E组中MDA含量在4 h、16 h和24 h时极显著高于对照组外,其余各组均未受到显著影响。较低注射剂量C组中超氧化物歧化酶(SOD)活性均得到了诱导,且均显著高于对照组,较高注射剂量组中除E组在第4 h、16 h和24 h SOD活性显著高于对照组外,其余均未发现有显著变化。肝脏中谷草转氨酶(AST)和谷丙转氨酶(ALT)在IVM作用下均发生了一定的变化,尤其是E组均显著低于对照组。与肝脏中的相反,血液中的AST则随剂量的升高而呈现增加的趋势,在某些时间点与对照组相比显著升高,而血液中ALT除C、D组个别时间点外其余的均未有显著变化。B、C、D、E 4组肝脏中的碱性磷酸酶(ALP)相对A组均发生了显著下降,但C、D、E组与B组除个别时间点外均未有显著差异,因此肝脏中的ALP变化可能是无水乙醇作用的结果,而非IVM。血液中ALP则均未有显著变化。研究表明高剂量的IVM对吉富罗非鱼的肝脏造成了一定影响,因此在实际使用过程中应选择合适的给药方式以及合理的给药剂量。
伊维菌素;吉富罗非鱼;酶活性;丙二醛
伊维菌素(ivermectin,IVM)是一种广谱的抗寄生虫药物,属土壤微生物阿维链霉菌(Streptomyces avermitilis)发酵产物阿维菌素类药物的一种[1]。自IVM作为渔药在大西洋鲑鱼(Salmo salar )的海虱病防治上取得成功后,其在水产养殖上得到了广泛应用[2]。
随着IVM在水产养殖上的广泛使用,其对水生生物本身及水生生态系统的影响也逐渐受到关注。IVM主要作用于谷氨酸钠离子通道和抑制性神经递质γ-氨基丁酸(GABA)通道引起GABA的释放增加,从而使神经传导受到抑制[3]。因其在环境中具有生物累积性,且在沉积物中的降解非常缓慢,从而会对生活在水体底层的水生生物或底栖生物造成较大影响[4]。对于使用IVM后其对鱼本身产生的副作用,Palmer等[5]指出IVM对鱼类有效的治疗浓度与可能导致死亡的浓度的安全边界比较狭窄。在对大西洋鲑鱼、虹鳟(Oncorhynchus mykiss)进行治疗时也发现了不同程度的死亡[6-7]。吴昊等[8]通过急性毒性试验发现IVM对斑马鱼(Brachydanio rerio)、食蚊鱼(Gambusia affinis)和鲫鱼(Carassius carassius)鱼苗的影响均属极高毒。除了IVM对鱼类的急性毒性外,研究者也从IVM对鱼类血液、肝脏等影响研究了IVM的毒性效应,Katharios等[9]对金头鲷(Sparus aurata)注射不同剂量的IVM后发现最高剂量组(0.8 mg·kg-1)中金头鲷的血液红细胞压积值显著降低,此外还导致了鱼的神经中毒如活力下降、食欲不振、体色变深等。Varo等[10]采用荧光差异凝胶电泳技术研究了金头鲷幼鱼(35 g)在口灌剂量为0.2 mg·kg-1的IVM后其肝脏中的蛋白质表达谱,试图通过这一技术了解IVM可能造成的肝中毒现象,结果发现,与对照组相比,IVM处理组的36个蛋白质表达均发生了显著变化,其中6个蛋白质的丰度增加而另外的30个减少。Hφy等[11]及Katharios等[12]均发现IVM可以穿透鱼的血脑屏障,在脑部有较高浓度的蓄积,从而对鱼的中央神经系统产生一定影响。Toovey等[13]发现IVM 中毒后的虹鳟鳃部呼吸受到影响。Ucán-Marín等[14]从行为学指标、生理学指标如生长、肝体比(liver somatic index,LSI)、脑部乙酰胆碱酯酶(AChE)及卵黄蛋白原(vitellogenin,Vg)研究了IVM对大西洋鲑鱼幼鱼生理生化的影响,结果发现在给药30 d后,鱼的活力下降,完成摄食需要的时间更长,低剂量组(0.05 mg·kg-1)和高剂量组(0.25 mg·kg-1)的累计死亡率分别为5%和70%,高剂量组的鱼体重显著降低,低剂量组的雌鱼在经30 d的恢复后LSI和Vg显著降低,给药后雄鱼的AChE活力显著升高。韩冰等[15]发现高剂量的IVM会导致多器官损伤,其不仅会使鱼类肠绒毛出现坏死、脱落现象,也会导致肝细胞萎缩,肝血窦变大,肾小管上皮细胞变性、坏死以及心肌纤维萎缩、变性,从而造成鱼的死亡;王荻等[16]发现正常治疗剂量伊维菌素对生产期雄性鲫未产生明显生殖毒性效应,但高剂量给药可对鲫造成严重的潜在生殖毒性。李世凯等[17]也研究了IVM对斑马鱼(Danio rerio)生理生化特性的影响。
罗非鱼具有生长繁殖快、产量高、食性杂、抗性强、肉质好等特点,是我国主要养殖鱼类之一[18]。2014年,全国养殖产量达170万t[19]。在罗非鱼养殖过程中,IVM作为主要的抗寄生虫类药物在防治罗非鱼寄生虫病方面得到广泛应用[20]。关于IVM对罗非鱼的研究较少,Badar等[21]研究了氚标IVM(3H-ivermectin)在奥尼罗非鱼(Oreochromis niloticus♀×O. aureus♂)肌肉组织中的残留和消除规律,但关于IVM对罗非鱼生理生化影响方面的研究尚未多见。为研究IVM对罗非鱼机体生理生化的影响,本实验以吉富罗非鱼为实验对象,探究在不同给药剂量下IVM对吉富罗非鱼肝脏、血液生理生化指标的影响,以期评估IVM对吉富罗非鱼的毒性效应。
1 材料与方法 (Materials and methods)
1.1 实验用鱼
吉富罗非鱼购自上海蓝海水产发展有限公司,均为雄性,健康无伤病,平均体重(250±25) g。实验前在规格为(220 cm×150 cm×60 cm)的PVC材质移动鱼池中暂养15 d,实验用水为曝气充氧除氯超过48 h的自来水,水温控制在(26±1) ℃,增氧机充氧,投喂配合饲料(通威集团),暂养期间自然死亡率低于3%。
1.2 仪器与试剂
BS-200全自动生化分析仪,深圳迈瑞公司;UV-4802紫外可见分光光度计,上海Unico仪器有限公司;低温超高速离心机,Eppendorf公司;FSH-2匀浆器;DK-S24恒温水浴锅,上海精宏实验设备有限公司。
伊维菌素标准品购自美国Sigma公司,无水乙醇(AR)购自国药化学试剂有限公司,SOD、MDA试剂盒购自南京建成生物工程研究所,ALP、AST、ALT试剂盒购自深圳迈瑞公司。
1.3 给药及染毒组织获取
称取IVM标准品0.1000 g,用无水乙醇将IVM标准品配制成1 g·L-1的使用液。实验用鱼随机分成A、B、C、D、E 5组,每组42尾。C、D、E 3组肌注给药,给药剂量分别为0.1、0.5、1.0 mg·kg-1;B组肌注无水乙醇量为0.2 mL;A组不做任何处理为空白对照组。给药前8 h禁食,给药后8 h投饵。分别在给药后1、2、4、8、16、24、48、86、192、384 h进行取样,每个时间点均取3尾鱼。
从尾静脉抽取血液,将抽取到的罗非鱼血液置于含少量1%肝素钠的离心管中在低温超速离心机中以8 000 r·min-1离心8 min后分离出血清,于-70 ℃超低温冰箱中冷冻保存,用于测定血清中的酶活性。取罗非鱼肝脏组织样品在0.86%的冰镇生理盐水中漂洗,除去血液,用滤纸拭干。按照比例加入0.86%生理盐水(组织质量(g)∶生理盐水体积(mL)=1∶9),进行冰上匀浆,将制成的10%肝脏组织匀浆液,在4 000 r·min-1下离心10 min,分离出的上清液于-70 ℃超低温冰箱中冷冻保存待测。
1.4 酶活性及MDA含量测定
测定前将在-70 ℃保存的上清液在4 ℃条件下融化,用ALP、AST、ALT试剂盒在生化分析仪上进行其活性及含量测定;SOD活性及MDA含量的测定严格按照南京建成生物工程研究所提供的说明书的步骤进行操作。
1.5 数据处理
试验数据用Excel 2010进行整理,试验结果用平均值±标准差(Mean±SD)表示;用SPSS 19.0软件对数据进行单因素方差分析(one-way ANOVA),最小极差法(LSD)进行多重比较,P<0.05表示与对照组有显著差异,P<0.01表示与对照组有极显著差异。
2 结果(Results)
2.1 IVM对吉富罗非鱼肝脏SOD活性的影响
作为鱼类机体抵抗外界异源物质的非特异性相关酶之一,SOD的主要作用在于有效清除和降解异源物质。不同IVM注射剂量对吉富罗非鱼肝脏SOD的影响数据如图1所示。从图中可以看出,空白对照A组肝脏中的SOD平均值在(37.43±10.01) U·mg-1prot,其在整个试验期间均无较大波动。乙醇对照组B组中的SOD活性在试验期间均高于A组,但经单因素方差分析发现除了在第2 h和第384 h 2个时间点与A组有显著差异外(P<0.05),其他均无显著差异(P>0.05)。较低注射剂量组C组中的SOD活性在各个时间点均高于空白对照组,与A组相比除第16 h时无显著差异外,其中在第2 h、8 h时均呈现显著差异(P<0.05),其余时间点中SOD活性与A组差异极显著(P<0.01)。D组中SOD活性与对照组相比均无显著差异。E组中SOD除在4 h、16 h和24 h时显著高于对照组外,其余各时间点均无显著差异。总体看出低剂量的IVM对肝脏SOD活性产生了诱导,而较高剂量组除个别时间点外均未产生明显的影响。
2.2 IVM对吉富罗非鱼肝脏MDA含量的影响
MDA是脂蛋白中多元未饱和脂肪酸发生脂质过氧化作用的主要产物,它与多肽类的巯基和氨基、酶类以及核酸具有很强的亲和性,对细胞具有极强的毒性,另外它也能够破坏脂质膜的结构性质,从而严重影响细胞功能。从图2可见,正常生理状况下吉富罗非鱼肝脏中MDA含量较低;B组、C组及D组中除极个别时间点MDA含量显著高于对照组外,其余均未有显著性差异。在最高剂量组E组中,MDA含量在第4 h、16 h、24 h均显著高于对照组,这可能是由于高剂量IVM导致吉富罗非鱼肝脏发生了脂质过氧化有关。同时,由于MDA含量的增高,激发了机体中强大的自由基清除能力,因此E组中的SOD在这些时间点也异常升高。

图2 不同IVM注射剂量对吉富罗非鱼肝脏MDA的影响Fig. 2 Effects of ivermectin on MDA content of liver in tilapia by different dose
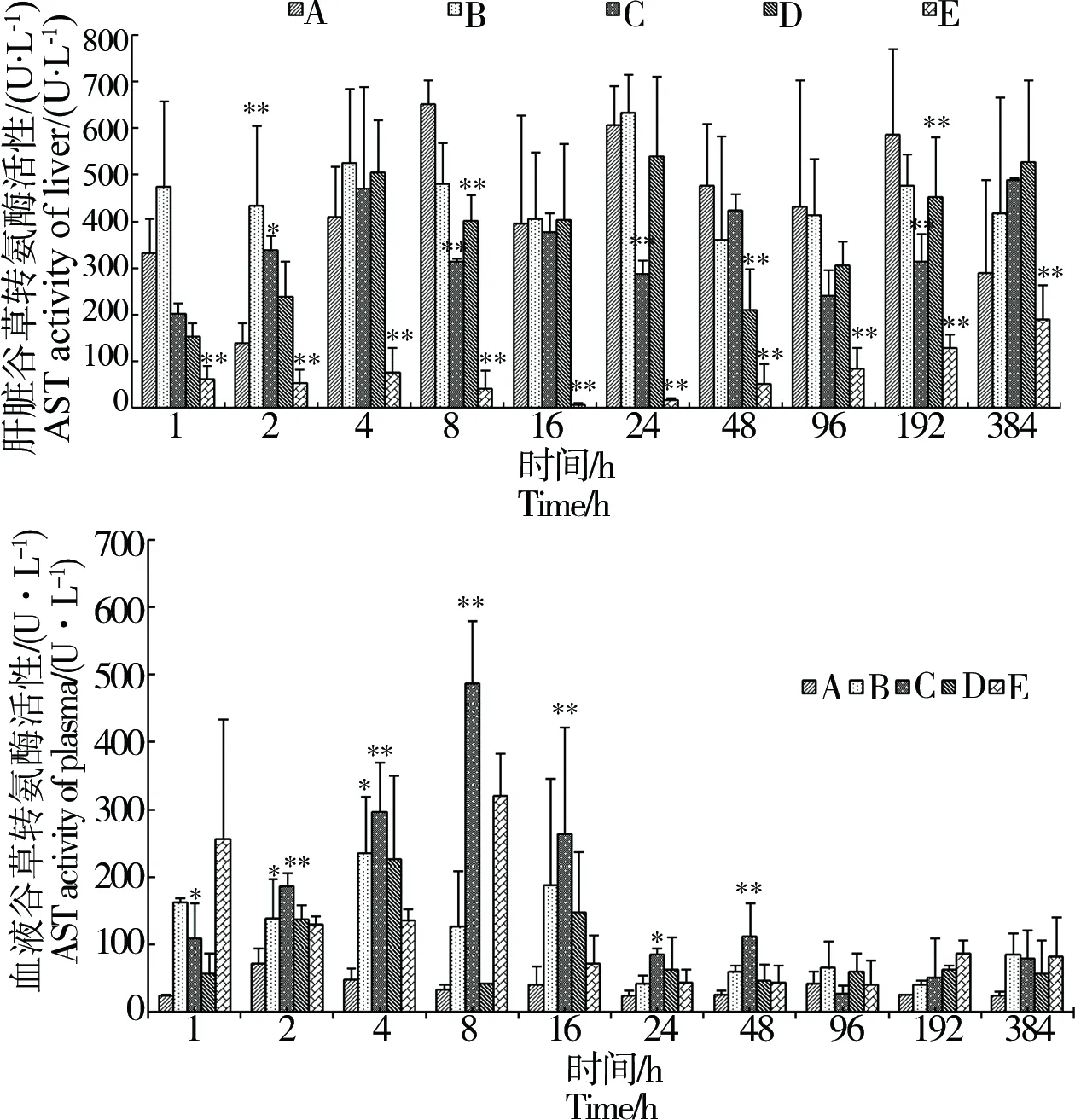
图3 不同IVM注射剂量对吉富罗非鱼肝脏和血液AST的影响Fig. 3 Effects of ivermectin on AST activity of liver and plasma in tilapia by different dose
2.3 IVM对吉富罗非鱼肝脏和血液AST的影响
AST和ALT是2种存在于动物体内的转氨酶,主要参与蛋白质代谢,其活性高低可以反应机体氨基酸代谢情况。图3显示,肝脏中的AST活性在注射无水乙醇后虽发生一些不规律的变化,但除个别时间点外,总体上与空白对照组无显著差异。在0.1 mg·kg-1组和0.5 mg·kg-1组中,肝脏中的AST活性相对对照组而言有所下降。在1 mg·kg-1组中,肝脏中的AST均极显著低于对照组。由此可以看出,高剂量IVM对吉富罗非鱼肝脏产生了一定的影响,AST活性随IVM剂量的提高而逐渐降低。
正常的生理状况条件下吉富罗非鱼血液中的AST活性较低,大约为肝脏中AST活性的1/10。在注射IVM后,与肝脏中的现象相对应的是血液中的AST活性基本随IVM注射剂量的升高而逐渐升高,虽然这种升高趋势在部分时间点未表现出显著性差异,但仍稍高于空白对照组,因血液中的AST主要来源于肝脏组织,因此血液中AST的变化情况,也可以很好地解释肝脏中AST减少的原因。
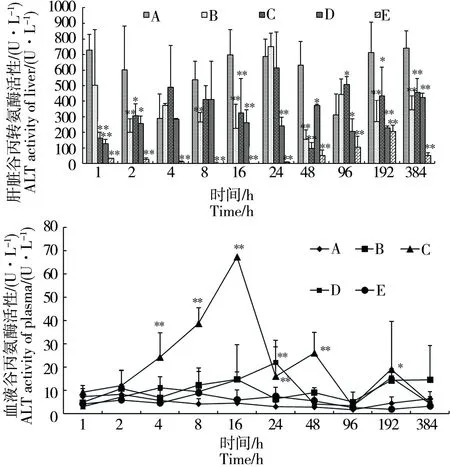
图4 不同IVM注射剂量对吉富罗非鱼肝脏和血液ALT的影响Fig. 4 Effects of ivermectin on ALT activity of liver and plasma in tilapia by different dose
2.4 IVM对吉富罗非鱼肝脏和血液ALT的影响
与AST相似,在受到IVM影响后,吉富罗非鱼肝脏中的ALT也逐渐降低(图4)。注射IVM的吉富罗非鱼肝脏中的ALT均受到了影响,也基本呈现随IVM剂量的升高而逐渐降低这一规律。同时也可注意到,注射无水乙醇也对肝脏ALT产生了一定影响。另外从图4也可看出IVM对吉富罗非鱼血液中的ALT的影响仅出现在C组、D组2组的个别时间点,其余均未产生明显影响。
2.5 IVM对吉富罗非鱼肝脏和血液ALP的影响
作为调控鱼类赖以生存及生长的重要酶类之一,ALP在调节机体内钙磷的吸收,维持适宜的钙磷比例方面起到重要作用。由图5可知IVM对血液ALP活性的影响除极个别时间点外均未有显著影响。与A组相比,其余各组罗非鱼肝脏中ALP均显著下降,但这种下降并未随IVM注射剂量的提高而呈现出明显的剂量效应;与乙醇对照组相比,C、D、E组除在某些时间点产生了显著差异外其余均未有显著影响,且种影响也并未呈现出明显的变化规律。

图5 不同IVM注射剂量对吉富罗非鱼肝脏和血液ALP的影响Fig. 5 Effects of ivermectin on ALP activity of liver and plasma in tilapia by different dose
3 讨论(Discussion)
外源物质尤其是农药等有毒物质通常可导致机体活性氧(reactive oxygen species,ROS)的增加、脂质过氧化作用的增强和加速蛋白质的氧化,从而使鱼类或者其他水生生物由于受到氧化性损伤而受到伤害。抗氧化酶在应对来自于机体自身新陈代谢或者外源物质导致的氧化应激方面起着重要作用[22-23]。在鱼体内,肝脏作为最重要的解毒器官,在对外源物质的解毒和对有毒物质的排泄方面起到关键作用。目前众多研究发现,虽然肝脏在清除由血液运输过来的所有外源物质起到了十分重要的作用,但是仍有部分外源物质在进入肝组织后对肝脏造成了一定的结构性损伤[24]。肝脏中抗氧化酶的变化情况通常被用来判断肝脏在受到外源物质胁迫后是否仍旧能发挥正常的生理作用,或是已经受到损害或者发生病变。MDA是脂蛋白中多元未饱和脂肪酸发生脂质过氧化的主要产物,它能够破坏脂质膜的结构与性质,从而对肝脏细胞功能造成严重的损伤[25]。在正常的生理状态下,鱼类肝脏内的MDA含量较少,当肝细胞受到自由基攻击较为严重时,肝脏中MDA含量会有较为明显的升高。SOD作为机体中最主要的抗氧化酶之一,具有较强的清除自由基能力。SOD活性改变有受到抑制或产生诱导2种状态。诱导效应的产生通常被认为是机体的一种适应性改变,而抑制的产生则表明机体组织可能受到了一定的损伤。本研究发现,吉富罗非鱼在注射不同剂量的IVM后,肝脏中MDA仅在最高注射剂量组16 h和24 h出现了极显著升高,Qureshi[26]通过腹腔注射IVM对大鼠的研究中也发现血液MDA在较高注射剂量组时显著高于空白对照组。结合IVM在吉富罗非鱼体内的药物代谢动力学研究发现,肌肉注射1 mg·kg-1剂量的IVM后,药物在肝脏中浓度的最大值就出现在这个时间段,因此可以推断:在这2个时间点由于高浓度的IVM存在,吉富罗非鱼肝脏脂质过氧化较为严重;而SOD活性也在同时间异常升高,这主要是由于大量自由基的产生激发了机体强大的清除自由基能力,从而使肝脏SOD代偿性得到极大的增强。另外,研究还发现在较低注射剂量下肝脏SOD活性均受到了诱导,陈家长等[27]发现在较低浓度的阿维菌素作用初期,鲤鱼肝脏中的SOD活性代偿性得到增强。而另外2组在较高注射剂量下除个别时间点外SOD活性基本未发生显著变化。李世凯等[17]在对斑马鱼的研究中也发现IVM对斑马鱼肌肉SOD活性的影响也基本呈现出低质量浓度抑制,高质量浓度先诱导后抑制的现象。
酶活性被视作敏感的生化指标而在评价水生生物的健康方面得到广泛的应用[28]。在鱼体内,肝脏作为药物主要的吸收、累积、转化和排泄器官,其酶活性也最容易受到药物影响而发生改变,其中转氨酶AST和ALT目前已经被广泛用来检测由毒物造成的组织损伤。另外通过血清中的一些可溶性酶也可以作为反映肝功能紊乱和损伤的重要指示指标[29]。AST在转运天冬氨酸的氨基到α-酮戊二酸生成草酰乙酸和谷氨酸的过程中起到催化作用;ALT则是在转运天冬氨酸的氨基到α-酮戊二酸生成丙酮酸和谷氨酸过程中起到催化作用。这些酶不仅是碳水化合物和蛋白质之间代谢的重要链接,其在机体由于氧化和糖原异生而对氨基酸的利用上也扮演着重要角色。此外,AST、ALT除了可以被用作检测鱼类肝脏是否因毒物影响而造成损伤外,也可以反映鱼类所生存的水环境污染状况[30]。目前,关于IVM对肝脏中的AST、ALT影响的相关报道较少,吴斌[31]对小鼠采用一次口灌IVM后发现,不同剂量的IVM对小鼠肝脏造成了不同程度的损伤,血清中的AST、ALT显著高于对照组。彭章晓等[32]对鲫鱼的研究发现血清中的ALT仅在高剂量的IVM给药后16 h时显著高于对照组,其余均未受到较明显的影响。而本研究发现,吉富罗非鱼在注射IVM后,肝脏中的AST、ALT均发生了变化,肝脏中AST随给药剂量的提高而逐渐下降,尤其是最高剂量组时AST活性极显著低于对照组;肝脏中的ALT也表现出与AST类似的现象,但ALT比AST更为敏感,其不仅受到IVM的影响,注射无水乙醇后ALT也发生了较大变化。与肝脏不同,血清中的AST总体上随给药剂量的提高而不断升高,这主要是由于IVM对肝脏造成了一定损伤,导致肝脏中的AST释放到血液中,而血液中的ALT变化的原因可能是由于鱼本身的身体差异状况造成的,而非IVM或无水乙醇影响的结果。
作为鱼类生长和生存重要的调控酶之一,ALP在机体中主要起到防御、离子分泌、免疫调节等作用[33],本研究发现肝脏中的ALP受到较大的影响,而血液中的ALP则几乎未产生大的变化,这也说明吉富罗非鱼肝脏中的ALP比血液中的ALP对外源物质影响更为敏感。同时也发现,虽然在注射IVM后肝脏中的ALP发生了较大变化,但注射无水乙醇的B组中的ALP也显著低于空白对照组,而将药物注射组与乙醇对照组对比后发现它们之间除在个别时间点有差异外,其余并未产生显著的差异,因此可以推断造成肝脏中ALP下降的原因可能是由于无水乙醇对肝脏产生了一定的影响,加上IVM对肝脏毒副作用以及鱼本身的身体状况差异,其共同作用的结果导致较为敏感的ALP活性下降。
本研究中高剂量的IVM对吉富罗非鱼肝脏生理生化指标造成了一定的影响,虽然在整个试验过程中并未发现有鱼的死亡,但也发现部分鱼类产生游动迟缓、摄食减少等现象,如果鱼长期在这种胁迫下生存,可能会对其生长产生更大危害。因此,在实际的养殖过程中,在预防和治疗吉富罗非鱼的寄生虫病时需要根据鱼的实际情况选择合适的给药方式以及合理的给药剂量,以免影响吉富罗非鱼的生长。
[1] Prichard R, Ménez C, Lespine A. Moxidectin and the avermectins: Consanguinity but not identity[J]. International Journal for Parasitology Drugs and Drug Resistance, 2012, 2(12): 134-153
[2] 江敏, 彭章晓, 吴昊, 等. 伊维菌素在水产养殖中的应用及其水生态风险[J]. 渔业现代化, 2008, 35(4): 47-50
Jiang M, Peng Z X,Wu H, et al. Application of ivermectin in aquaculture and corresponding aqua-ecosystem risk [J]. Fishery Modernization, 2008, 35(4): 47-50 (in Chinese)
[3] Campbell W C, Benz G W. Ivermectin: A review of efficacy and safety [J]. Journal of Veterinary Pharmacology and Therapeutics, 1984, 7(1): 1-16
[4] Sanderson H, Laird B, Pope L, et al. Assessment of the environmental fate and effects of ivermectin in aquatic mesocosms [J]. Aquatic Toxicology, 2007, 85(4): 229-240
[5] Palmer R, Rodger H, Drinan E, et al. Preliminary trials on the efficacy of ivermectin against parasitic copepods of Atlantic salmon [J]. Bulletin of the European Association of Fish Pathologists, 1987, 7(2): 47-54
[6] Davies I M, Rodger G K. A review of the use of ivermectin as a treatment for sea lice [Lepeophtheirus salmonis (Kroyer) and Caligus elongatus Nordmann] infestation in farmed Atlantic salmon (Salmo salar L.) [J]. Aquaculture Research, 2000, 31(11): 869-883
[7] Johnson S C, Margolis L. Efficacy of ivermectin for control of the salmon louse Lepeophtheirus salmonis on Atlantic salmon [J]. Diseases of aquatic organisms, 1993, 17(2): 101-105
[8] 吴昊, 江敏, 彭章晓, 等. 伊维菌素在环境中的降解及其对七种水生生物的急性毒性研究[J]. 水生生物学报, 2012, 36(5): 965-970
Wu H, Jiang M, Peng Z X, et al. Research on the degradation of ivermectin and its acute toxicity to seven aquatic organisms [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 965-970 (in Chinese)
[9] Katharios P, Iliopoulou-Georgudaki J, Kapata-Zoumbos K, et al. Toxicity of intraperitoneally injected ivermectin in sea bream, Sparus aurata [J]. Fish Physiology and Biochemistry, 2001, 25(2): 99-108
[10] Varo I, Rigos G, Navarro J C, et al. Effect of ivermectin on the liver of gilthead sea bream (Sparus aurata): A proteomic approach [J]. Chemosphere, 2010, 80(5): 570-577
[11] Høy T, Horsberg T E, Nafstad I. The disposition of ivermectin in Atlantic salmon (Salmo salar) [J]. Pharmacology & Toxicology, 1990, 67(4): 307-312
[12] Katharios P, Pavlidis M, Iliopoulou-Georgudaki J. Accumulation of ivermectin in the brain of sea bream, Sparus aurata after intraperitoneal administration [J]. Environmental Toxicology and Pharmacology, 2004, 17(1): 9-12
[13] Toovey J P G, Lyndon A R, Duffus J H. Ivermectin inhibits respiration in isolated rainbow trout (Oncorhynchus mykiss Walbaum) gill tissue [J]. Bulletin- European Association of Fish Pathologists, 1999, 19(4): 149-152
[14] Ucán-Marín F, Ernst W, O'Dor R K, et al. Effects of food borne ivermectin on juvenile Atlantic salmon (Salmo salar L.): Survival, growth, behavior, and physiology [J]. Aquaculture, 2012, 334: 169-175
[15] 韩冰, 王荻, 卢彤岩. 伊维菌素对松浦镜鲤的急性毒性与组织损伤[J]. 中国水产科学, 2015, 22(4): 687-697
Han B, Wang D, Lu T Y. Acute toxicity and tissue injury studies of ivermectin for Songpu mirrorcarp (Cyprinus specularis Songpu) [J]. Journal of Fishery Sciences of China, 2015, 22(4): 687-697 (in Chinese)
[16] 王荻, 李绍戊, 耿龙武, 等. 伊维菌素对雄性鲫的生殖毒性评价[J]. 应用生态学报, 2015, 26(10): 3174-3180
Wang D, Li S W, Geng L W, et al. Evaluation of ivermectins reproductive toxicity to male Carassius auratus [J].Chinese Journal of Applied Ecology, 2015, 26(10): 3174-3180 (in Chinese)
[17] 李世凯, 张健龙, 江敏, 等. 伊维菌素对斑马鱼(Danio rerio)生理生化特性的影响[J]. 安全与环境学报, 2014, 14(1): 300-305
Li S K, Zhang J L, Jiang M, et al. Effects of ivermectin on the physiological and biochemical characteristic features of Danio rerio [J]. Journal of Safety and Environment, 2014, 14(1): 300-305 (in Chinese)
[18] 王文龙, 崔欣, 李成成, 等. 饲料中铜暴露对吉富罗非鱼幼鱼血红细胞微核和组织中铜蓄积的影响[J]. 生态毒理学报, 2014, 9(4): 757-764 (in Chinese)
Wang W L, Cui X, Li C C, et al. Effects of dietary copper exposure on micronucleus of erythrocyte and accumulation in different tissues of juvenile GIFT tilapia (Oreochromis niloticus) [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 757-764
[19] 农业部渔业渔政管理局. 《2015中国渔业统计年鉴》[M]. 北京: 中国农业出版社, 2015: 23-44
[20] Rico A, Phu T M, Satapornvanit K, et al. Use of veterinary medicijnes, feed additives and probiotics in four major internationally traded aquaculture species farmed in Asia [J]. Aquaculture, 2013, 412-1413(6): 231-243
[21] Shaikh B, Rummel N, Gieseker C, et al. Residue depletion of tritium-labeled ivermectin in the muscle tissues of aquacultured Atlantic salmon, tilapia, and catfish following oral treatment [J]. North American Journal of Aquaculture, 2012, 74(1): 27-33
[22] Kanak E G, Dogan Z, Eroglu A, et al. Effects of fish size on the response of antioxidant systems of Oreochromis niloticus following metal exposures [J]. Fish Physiology and Biochemistry, 2014, 40(4): 1083-1091
[23] 于庆云, 王悠, 徐彦, 等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报, 2013, 8(4): 504-512
Yu Q Y, Wang Y, Xu Y, et al. Effects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes in Ruditapes philippinarum [J]. Asian Journal of Ecotoxicology, 2013, 8(4): 504-512 (in Chinese)
[24] Pathan T S, Shinde S E, Thete P B, et al. Histopathology of liver and kidney of Rasbora daniconius exposed to paper mill effluent [J]. Research Journal of Biological Sciences, 2010, 5(5): 389-394
[25] 龙奕, 刘珊珊, 王萌, 等. 纳米Al2O3和Cd联合暴露对铜锈环棱螺体内Cd的生物积累和抗氧化酶活性的影响[J]. 生态毒理学报, 2015, 10(2): 216-223
Long Y, Liu S S, Wang M, et al. Effects of Cd and Al2O3-NPs co-exposure on bioaccumulation of Cd and antioxidase enzyme activities in Bellamya aeruginosa [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 216-223 (in Chinese)
[26] Qureshi S. Biochemical toxicity of ivermectin in wistar albino rats [J]. American-Eurasian Journal of Toxicological Sciences, 2013, 5(1): 15-19
[27] 陈家长, 杨光, 马晓燕, 等. 低浓度阿维菌素对鲤鱼超氧化物歧化酶(SOD)的影响[J]. 生态毒理学报, 2009, 4(6): 823-828
Chen J C, Yang G, Ma X Y, et al. Effect of low concentration of avermectins on superoxide dismutase (SOD) activities in common carp [J]. Asian Journal of Ecotoxicology, 2009, 4(6): 823-828 (in Chinese)
[29] Kavitha C, Malarvizhi A, Senthil Kumaran S, et al. Toxicological effects of arsenate exposure on hematological, biochemical and liver transaminases activity in an Indian major carp (Catla catla) [J]. Food and Chemical Toxicology, 2010, 48(10): 2848-2854
[30] Nemcsok J, Benedeczky I. Effect of sublethal concentrations of phenol on some enzyme activities and blood sugar level of carp (Cyprinus carpio L.) [J]. Environmental Monitoring and Assessment, 1990, 14(2-3): 377-383
[31] 吴斌. 小鼠伊维菌素急性与蓄积性毒性试验研究[D]. 成都: 四川农业大学, 2010: 1-48
Wu B. A Study on acute toxicity and accumulative toxicity of ivermectin in mice [D]. Chengdu: Sichuan Agricultural University, 2010: 1-48 (in Chinese)
[32] 彭章晓, 江敏, 吴昊, 等. 伊维菌素对鲫血液成分影响的初步研究[J]. 淡水渔业, 2012, 42(1): 93-96
Peng Z X, Jiang M, Wu H, et al. Preliminary study on the influence of ivermectin on blood component of Carassius auratus [J]. Freshwater Fisheries, 2012, 42(1): 93-96 (in Chinese)
[33] 祁明亮, 朱敏, 赵晓祥. DEP、DOP暴露对鲤鱼的酸碱性磷酸酶的影响[J]. 安全与环境学报, 2012, 12(2): 10-13
Qi M L, Zhu M, Zhao X X. Effects of DEP and DOP exposure on the acid phosphatase and alkaline phosphatase in the crap [J]. Journal of Safety and Environment, 2012, 12(2): 10-13 (in Chinese)
Effects of Ivermectin on Physiological and Biochemical Characteristic Indexes of Male GIFT Tilapia (Oreochromis niloticus)
Li Shikai1,2, Jiang Min1,*, Wu Hao1, Peng Xiaoye1, Zhang Jianlong1, Xie Qin1, Liu Liping1
1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China 2. Guizhou Institute of Aquaculture Sciense, Guiyang 550025, China
Received 25 December 2015 accepted 11 March 2016
To study the toxic effects of antiparasitc agent ivermectin on fish, the physiological and biochemical characteristic indexes of liver and plasma in male GIFT tilapia (Oreochromis niloticus) were studied after a single intramuscular administration according to following group-dose: group C-0.1 mg·kg-1, group D-0.5 mg·kg-1, group E- 1.0 mg·kg-1, groups A as blank control and group B administrated with absolute ethanol. The results showed that in group E with a dose of 1.0 mg·kg-1, the malonaldehyde (MDA) content and superoxide dismutase (SOD) activity significantly increased after 4 h, 16 h and 24 h IVM treatment. The SOD activity also increased in group C with the low dose of 0.1 mg·kg-1. Alanine transaminase (AST) and aspartate aminotransferase (ALT) activity of liver were significantly lower in group E than in control group. AST activity in plasma increased with increasing IVM concentration while the ALT activity in plasma was not affected. Since alkaline phosphatase (ALP) activity in liver significantly decreased in all the administrated group B, C, D and E, the changes of ALP in liver might be affected by absolute ethanol. The research indicated that high dose of ivermectin is harmful to the liver of tilapia.
ivermectin; GIFT tilapia (Oreochromis niloticus); enzyme activity; malonaldehyde
欧盟科研架构计划(EU-FP7-SEAT222889);上海市教委重点学科建设项目(J50701);上海市高校知识服务平台项目(ZF1206)
李世凯(1988—),男,助理研究员,研究方向为环境毒理学,Email: lishikai_shou@hotmail.com;
*通讯作者(Corresponding author), E-mail: mjiang@shou.edu.cn
10.7524/AJE.1673-5897.20151225001
2015-12-25 录用日期:2016-03-11
1673-5897(2016)4-245-08
X171.5
A
简介:江敏(1972—),女,博士,教授,硕士生导师,研究方向为环境毒理学。
李世凯, 江敏, 吴昊, 等. 伊维菌素对雄性吉富罗非鱼生理生化指标的影响[J]. 生态毒理学报,2016, 11(4): 245-252
Li S K, Jiang M, Wu H, et al. Effects of ivermectin on physiological and biochemical characteristic indexes of male GIFT tilapia (Oreochromis niloticus) [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 245-252 (in Chinese)

