浓度效应对卡马西平在生物炭上的吸附动力学影响
陈建,张凰,王朋,文方园,张迪
1. 昆明理工大学 环境科学与工程学院,昆明 650500 2. 昆明理工大学 云南省食品安全研究院,昆明 650500
浓度效应对卡马西平在生物炭上的吸附动力学影响
陈建1,张凰2,*,王朋1,文方园1,张迪1
1. 昆明理工大学 环境科学与工程学院,昆明 650500 2. 昆明理工大学 云南省食品安全研究院,昆明 650500
为了解人工合成药物在生物炭上的吸附动力学特征及其浓度效应的影响,选择卡马西平(CBZ)为目标污染物。探讨不同初始质量浓度(2、4、25、50 mg·L-1)在不同裂解温度(200、300、500 ℃)下制备的生物炭上的吸附动力学特征。结果表明,双室一级动力学模型可以精确地描述CBZ在生物炭上的吸附动力学特征。CBZ的快室吸附对总体吸附的贡献随初始浓度的增大而减小,而慢室吸附贡献则增大。π-π作用可能对CBZ的吸附贡献较大。孔隙填充可以描述慢室吸附过程,可能是吸附速率的控制环节。
卡马西平;生物炭;双室一级动力学模型;孔隙填充;浓度效应
Received 30 March 2016 accepted 5 May 2016
生物炭作为一种新型炭材料,由于其特殊的环境功能价值受到广泛的关注[1]。生物炭是良好的土壤改良剂,可以提高土壤pH、总氮和总磷的含量,促进植物根系的生长,提高土壤水分的储蓄能力[2]。此外,生物炭在碳封存和有机污染物的吸附等方面也有良好的应用前景[3]。近年来,以卡马西平(CBZ)为代表的人工合成药物的环境行为和风险吸引了大量的研究关注。CBZ使用过程中近50%的剩余物和代谢物(例如10,11-环氧化卡马西平和10,11-二羟卡马西平)会进入环境[4],成为在水生环境中最为频繁检测到的药物残留物之一[5]。因此,利用生物炭吸附性能控制人工合成药物的环境风险成为国际研究热点[3, 6-7]。以往研究普遍关注吸附系数随有机污染物液相浓度的升高而降低的现象,即非线性吸附。Huang和Weber[8]认为土壤或沉积物中的有机质结构上的异质性可能是主要吸附机制以及影响吸附等温线的线性因素。Pignatello和Xing等[9-10]在一系列的实验结果的基础上建立了双模式吸附模型,他们认为有机物在土壤或沉积物上的吸附机制主要包括孔隙填充和分配作用。这些研究都肯定了吸附剂上吸附点位的异质性是非线性吸附的主要原因[8-11]。然而,有机污染物液相浓度对其吸附动力学特征的影响尚不清楚,对动力学过程中快、慢室吸附的影响更是鲜有报道。
因此,本研究选取不同裂解温度下制备的花生壳生物质碳为吸附剂,CBZ代表人工合成药物,探究CBZ不同初始浓度对其在生物炭上的吸附动力学特征的影响。借助双室一级动力学模型(多域吸附模型)[12],定量描述快、慢室吸附在吸附过程中对表观总体吸附的贡献,进而探究浓度效应对快、慢室吸附动力学的影响。
1 材料与方法 (Materials and methods)
1.1 试验材料
卡马西平(CBZ)标准品购于日本东京化学工业有限公司,化学纯,具体性质见表1;甲醇为分析纯,购于上海西格玛奥德里贸易有限公司;CBZ储存液由Milli-Q超纯水制备。
收集的花生壳生物质冷冻干燥,经研磨过筛后转棕色瓶待用。制备花生壳生物炭采用限氧裂解法[13]。具体方法:取20 g过筛后的生物质于坩埚,压实并盖上盖子后置于微波炉中以10 ℃·min-1的升温速率升至200、300、500 ℃,保持4 h,期间一直通入氮气以确保无氧的环境。冷却至室温后取出并用蒸馏水洗至中性,置于70 ℃烘箱干燥24 h,研磨粉碎过60目筛得到的样品分别标记为BC200、BC300、BC500。
生物炭样品的C、H、O、N、S元素含量通过元素分析仪(MicroCube,Elementar,Germany)测定。样品的比表面积在氮气吸附模式下通过比表面积分析仪(Autosorb-1C, Quantachrome,USA)测定。生物炭样品的理化性质分析结果具体见表1。
1.2 吸附动力学实验
制备50 mg·L-1的CBZ储备液,具体步骤如下,准确称取一定量的CBZ粉末,溶解于少量的甲醇,然后用含有0.02 mol·L-1的NaCl(提供背景离子强度)和200 mg·L-1的NaN3(抑制微生物生长)背景液进行稀释至50 mg·L-1即为CBZ储备液。储备液中甲醇的体积分数控制在2×10-3以下,以防止共溶剂效应的影响。吸附动力学实验在40 mL带聚四氟乙烯垫螺口塞的玻璃瓶中进行。根据预实验结果,固液比(mg:mL)选取5:1 (BC200)、5:2 (BC300)和5:4 (BC500),CBZ的初始浓度为2、4、25、50 mg·L-1。在室温避光条件下,将所有样品置于恒温振荡器中,以120 r·min-1转速振荡并开始计时。根据预实验的结果,吸附表观平衡在168 h后达到,因此,样品分别在开始后1、2、4、8、12、48、72、96、168 h取下样品瓶,以2 500 r·min-1的转速离心15 min,取出0.4 mL上清液于2 mL液相瓶中,置于4 ℃冰箱中,避光保存,待测。待所有时间点的样品取完后,用高效液相色谱仪(Agilent 1260)定量液相中游离的CBZ浓度。
CBZ的液相色谱分析条件:C18反相柱( 5 μm,4.6 mm × 250 mm),紫外检测器检测波长280 nm、流动相(V:V )超纯水:甲醇=40:60,流动相流速1 mL·min-1。
1.3 数据处理
为了定量描述生物炭对CBZ的吸附动力学特征,本研究采用双室一级动力学和颗粒内扩散模型对吸附动力学曲线进行拟合,动力学方程如下:
颗粒内扩散方程: qt=kp·t1/2+C
(2)
式中:qe、qt(mg·kg-1)分别为吸附平衡量和t时刻的吸附量;kp(mg·kg-1·h-1/2)为颗粒内扩散速率常数,C (mg·kg-1)为与边界层厚度的常数;k1、k2(h-1)分别为快、慢室吸附的速率常数,ffast、fslow分别为快、慢室吸附所占总吸附率的分率,且ffast+ fslow= 1。
2 结果与讨论(Results and discussion)
2.1 生物炭的理化性质
由表1可知,花生壳生物质在3种不同裂解温度(200、300和500 ℃)下制得的生物炭的理化性质存在较大的差别。具体表现为:生物炭的C含量随炭化温度的升高而增大,O和H含量则降低,多数文献也报道了类似的结果[14-16]。这说明随裂解温度的升高,在热解过程中会发生脱羧、脱水和脱羰作用[16]。有文献指出(N+O) /C和H/C可分别表征生物炭的极性和芳香性[17]。表1显示生物炭的(N+O)/C和H/C随热解温度的升高而降低,表明憎水性和芳香性均增加,生物炭是从“软质碳”向“硬质碳”过渡的过程[18]。Chen和Chen[19]研究萘和1-萘酚在橘子皮生物质碳上的吸附时也得到类似的结果。此外,随炭化温度的升高,生物炭的比表面积增加,这是由于无定型碳向结晶碳转化过程中形成了大量的孔隙[6],其中,BC500的比表面积急剧增加可能归因于纤维素在300 ℃时开始分解[6]。以上结果表明生物炭的结构特征和元素组成受裂解温度的显著影响。
2.2 不同初始浓度的CBZ在生物炭上的吸附动力学比较
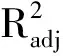
双室吸附过程在数学上可分为快吸附单元和慢吸附单元,快、慢吸附的速率常数分别为k1和k2[20]。从表2可以看出k1和k2与浓度并没有显著的依赖关系,即CBZ快、慢室吸附的速率并不受初始浓度的控制。吸附量qt与t1/2之间的关系是确定吸附速率控制环节的重要依据。在固液吸附体系中,吸附动力学过程主要包括外扩散、吸附剂颗粒内扩散和吸附剂内的吸附反应[21]。颗粒内扩散模型显示若吸附过程仅受颗粒内扩散控制,则qt-t1/2的图形呈线性,否则吸附过程受多个步骤控制[22]。由图2可知,CBZ吸附过程明显包括2个阶段,初始阶段qt-t1/2呈现很高的线性,随后逐渐趋于平缓,且趋势线均不经过原点。Suriyanon等[21]研究双氯芬酸和CBZ在功能硅基多孔材料上的吸附机制时也得到类似的结果。以上结果表明生物炭对CBZ的吸附初始阶段可能存在颗粒内扩散现象,但不是速率控制环节[21]。

表1 生物炭和卡马西平(CBZ)的理化性质
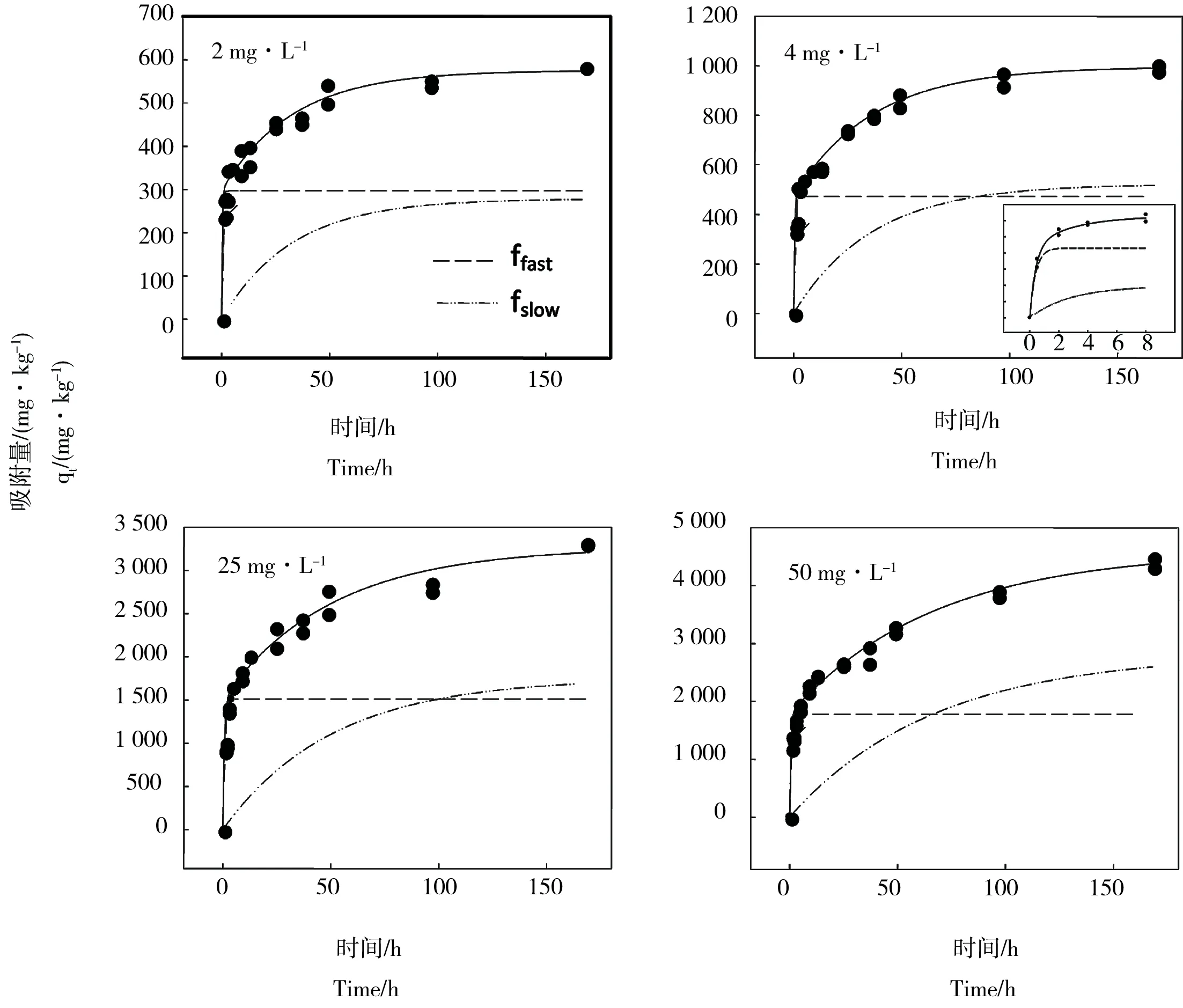
图1 不同初始浓度CBZ的快、慢室吸附对总体吸附的贡献Fig. 1 The contribution of fast and slow adsorption of CBZ on BC300 at different initial concentration to the apparent adsorption

表2 CBZ吸附动力学拟合结果
注:kp的单位为mg·kg-1·h-1/2。
Note: The unit of kpis mg·kg-1·h-1/2.

图2 不同初始浓度CBZ在生物炭上吸附的qt-t1/2曲线Fig. 2 Plots qt versus time t1/2 for adsorption of CBZ at different initial concentrations on biochar
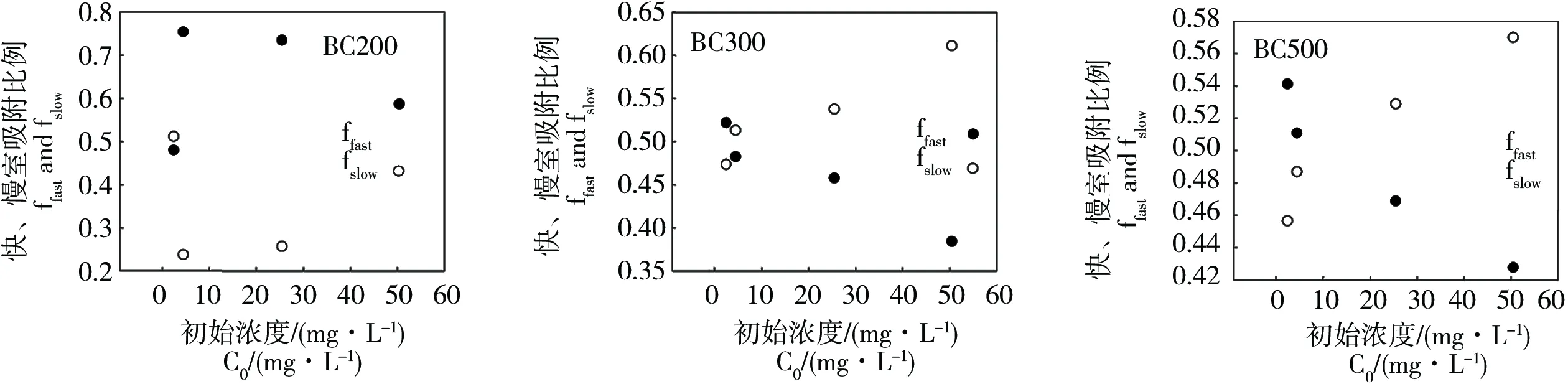
图3 不同初始浓度的CBZ双室吸附动力学比例Fig. 3 The fractions of the two sorption-compartments at different CBZ initial concentrations
2.3 不同初始浓度下快、慢室吸附对CBZ总体吸附的贡献
CBZ吸附动力学表现出明显的两阶段特征,即初始的快吸附阶段(用ffast表示)和后续的慢吸附阶段(用fslow表示)。由图1可知,快室吸附在2 h左右时趋于平衡,慢室吸附平衡时间需要100 h以上,慢室吸附决定了表观吸附吸附动力学的非线性吸附特征。研究指出有机污染物在土壤或沉积物等多域吸附剂上吸附时,不同的吸附区域呈现出不同的吸附特性,具体表现为,快室吸附归因于线性模型描述的分配作用,慢室吸附归因于非线性方程描述的孔隙填充机制[9-10, 23]。因此,CBZ在生物炭上的慢室吸附可以借助孔隙填充过程进行描述。孔隙填充可能是CBZ在生物炭上吸附速率的控制性因素。图1(以BC300为例)中ffast和fslow曲线与横坐标围成的面积分别表示快、慢室的吸附量。显然,快室吸附对总体吸附的贡献随CBZ初始浓度的增大而减小,慢室吸附的贡献则逐渐增大,这与图3中快室吸附比例(ffast)随CBZ初始浓度的增大而减小(BC200,2 mg·L-1除外),慢室吸附比例(fslow)则增大的结果一致。这些结果表明CBZ的快吸附可能发生在具有高能量点位的生物炭表面上的羧基和烃基,随着表层吸附的不断进行,部分CBZ分子穿过生物炭表层到达内部的孔,从而增加了慢室吸附的贡献[20]。Pignatello和Xing等[9]研究有机化合物在天然颗粒物上的慢室吸附机制时也得到类似结果,发现随污染物初始质量浓度的增加,慢室吸附比例增加,快室吸附比例下降。这与一些疏水性有机物的吸附结果并不一致,有文献报道,慢室吸附在低浓度时起主导作用,随有机物浓度的增加,快室吸附逐渐占据主导作用[24],说明CBZ与疏水性有机物的吸附机制可能差别较大。由于CBZ是离子型有机物,含有丰富的官能团,疏水作用可能不是CBZ吸附的主要作用机制,而氢键作用和π-π作用等可能对CBZ的吸附贡献较大。由表1中CBZ的结构可知,由于其含有氨基官能团和含氮杂环,CBZ分子是强π-受体[25]。高温裂解的生物炭(BC500)含有大量的石墨碳,是典型的强π-供体[7],低温裂解的生物炭(BC200和BC300)无定型碳含量较高,其供电子能力较弱[26]。因此,高温裂解生物炭与CBZ的π-π作用强于低温裂解生物炭与CBZ的作用[25],这与表2中双室一级动力学拟合参数qe的结果一致。
[1] Lee J W, Kidder M, Evans B R, et al. Characterization of biochars produced from cornstovers for soil amendment [J]. Environmental Science & Technology, 2010, 44(20): 7970-7974
[2] Tenenbaum D. Biochar: Carbon mitigation from the ground up [J]. Environmental Health Perspectives, 2009, 117(2): A70-A73
[3] Zhang P, Sun H, Yu L, et al. Adsorption and catalytic hydrolysis of carbaryl and atrazine on pig manure-derived biochars: Impact of structural properties of biochars [J]. Journal of Hazardous Materials, 2013, 244: 217-224
[4] Lienert J, Güdel K, Escher B I. Screening method for ecotoxicological hazard assessment of 42 pharmaceuticals considering human metabolism and excretory routes [J]. Environmental Science & Technology, 2007, 41(12): 4471-4478
[5] Zhang Y, Geißen S U,Gal C. Carbamazepine and diclofenac: Removal in wastewater treatment plants and occurrence in water bodies [J]. Chemosphere, 2008, 73(8): 1151-1161
[6] Zheng H, Wang Z, Zhao J, et al. Sorption of antibiotic sulfamethoxazole varies with biochars produced at different temperatures [J]. Environmental Pollution, 2013, 181: 60-67
[7] Ji L, Wan Y, Zheng S, et al. Adsorption of tetracycline and sulfamethoxazole on crop residue-derived ashes: Implication for the relative importance of black carbon to soil sorption [J]. Environmental Science & Technology, 2011, 45(13): 5580-5586
[8] Huang W, Weber W J. Thermodynamic considerations in the sorption of organic contaminants by soils and sediments. 1. The isosteric heat approach and its application to model inorganic sorbents [J]. Environmental Science & Technology, 1997, 31(11): 3238-3243
[9] Pignatello J J, Xing B. Mechanisms of slow sorption of organic chemicals to natural particles [J]. Environmental Science & Technology, 1995, 30(1): 1-11
[10] Xing B, Pignatello J J. Dual-mode sorption of low-polarity compounds in glassy poly (vinyl chloride) and soil organic matter [J]. Environmental Science & Technology, 1997, 31(3): 792-799
[11] O'Connor D J, Connolly J P. The effect of concentration of adsorbing solids on the partition coefficient [J]. Water Research, 1980, 14(10): 1517-1523
[12] Schmidt M W, Noack A G. Black carbon in soils and sediments: Analysis, distribution, implications, and current challenges [J]. Global Biogeochemical Cycles, 2000, 14(3): 777-793
[13] Chun Y, Sheng G, Chiou C T, et al. Compositions and sorptive properties of crop residue-derived chars [J]. Environmental Science & Technology, 2004, 38(17): 4649-4655
[14] Sun K, Kang M, Zhang Z, et al. Impact of deashing treatment on biochar structural properties and potential sorption mechanisms of phenanthrene [J]. Environmental Science & Technology, 2013, 47(20): 11473-11481
[15] Gao B, Wang P, Zhou H, et al. Sorption of phthalic acid esters in two kinds of landfill leachates by the carbonaceous sorbents [J]. Bioresource Technology, 2013, 136: 295-301
[16] Keiluweit M, Nico P S, Johnson M G, et al. Dynamic molecular structure of plant biomass-derived black carbon (biochar) [J]. Environmental Science & Technology, 2010, 44(4): 1247-1253
[17] Chen B, Johnson E J, Chefetz B, et al. Sorption of polar and nonpolar aromatic organic contaminants by plant cuticular materials: Role of polarity and accessibility [J]. Environmental Science & Technology, 2005, 39(16): 6138-6146
[18] 陈静文, 张迪, 吴敏, 等. 两类生物炭的元素组分分析及其热稳定性[J]. 环境化学, 2014, 33(3): 417
Chen J W, Zhang D, Wu M, et al. Elemental composition and thermal stability of two different biochars [J]. Environmental Chemistry, 2014, 33(3): 417 (in Chinese)
[19] Chen B, Chen Z. Sorption of naphthalene and 1-naphthol by biochars of orange peels with different pyrolytic temperatures [J]. Chemosphere, 2009, 76(1): 127-133
[20] Pan B, Wang P, Wu M, et al. Sorption kinetics of ofloxacin in soils and mineral particles [J]. Environmental Pollution, 2012, 171: 185-190
[21] Suriyanon N, Punyapalakul P, Ngamcharussrivichai C. Mechanistic study of diclofenac and carbamazepine adsorption on functionalized silica-based porous materials [J]. Chemical Engineering Journal, 2013, 214: 208-218
[22] Abbas M, Nadeem R, Zafar M N, et al. Biosorption of chromium (III) and chromium (VI) by untreated and pretreated Cassia fistula biomass from aqueous solutions [J]. Water, Air, and Soil Pollution, 2008, 191(1-4): 139-148
[23] Pan B, Xing B, Liu W, et al. Two-compartment sorption of phenanthrene on eight soils with various organic carbon contents [J]. Journal of Environmental Science and Health, 2006, 41(8): 1333-1347
[24] Huang W, Weber W J. A distributed reactivity model for sorption by soils and sediments. 10. Relationships between desorption, hysteresis, and the chemical characteristics of organic domains [J]. Environmental Science & Technology, 1997, 31(9): 2562-2569
[25] Zhu D, Hyun S, Pignatello J J, et al. Evidence for π-π electron donor-acceptor interactions between π-donor aromatic compounds and π-acceptor sites in soil organic matter through pH effects on sorption [J]. Environmental Science & Technology, 2004, 38(16): 4361-4368
[26] Zhang D, Pan B, Zhang H, et al. Contribution of different sulfamethoxazole species to their overall adsorption on functionalized carbon nanotubes [J]. Environmental Science & Technology, 2010, 44(10): 3806-3811
Adsorption Kinetics of Carbamazepine on Biochars at Different Initial Concentrations
Chen Jian1, Zhang Huang2,*, Wang Peng1, Wen Fangyuan1, Zhang Di1
1. Faculty of Environmental Science and Engineering, Kunming University of Science & Technology, Kunming 650500, China 2. Yunnan Institute of Food Safety, Kunming University of Science & Technology, Kunming 650500, China
Sorption kinetics of synthetic drugs on biochars and the effect of drug concentration were investigated. Carbamazepine (CBZ) was used as the target pollutant. The sorption kinetics of CBZ at different initial concentrations (2, 4, 25, 50 mg·L-1) on biochars produced at different temperatures (200, 300, 500 ℃) were studied. The results showed that the two-compartment first order model could well fit the sorption kinetics of CBZ. The contribution of fast sorption decreased but the contribution of slow sorption increased to the total sorption with increasing CBZ initial concentrations. The π-π EDA interaction might be an important mechanism for CBZ sorption. The slow sorption was controlled by pore-filling mechanism which was likely to be the rate-limiting step of CBZ sorption kinetics.
carbamazepine; biochar; two-compartment first order model; pore-filling; concentration effect
国家自然科学基金(41303093);云南省自然科学基金(2014FB121);昆明理工大学人才启动经费(14118762);云南省大学生创新创业训练计划项目基金(201610674035)
陈建(1994-),男,本科生,研究方向为碳基材料对有机物的吸附,E-mail: chenjiankmust@qq.com
*通讯作者(Corresponding author), E-mail: zhanghuang2002113@163.com
10.7524/AJE.1673-5897.20160330012
2016-03-30 录用日期:2016-05-05
1673-5897(2016)4-161-07
X171.5
A
简介:张凰(1983-),女,博士,讲师,主要研究方向为环境化学。
陈建, 张凰, 王朋, 等. 浓度效应对卡马西平在生物炭上的吸附动力学影响[J]. 生态毒理学报,2016, 11(4): 161-167
Chen J, Zhang H, Wang P, et al. Adsorption kinetics of carbamazepine on biochars at different initial concentrations [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 161-167 (in Chinese)

