Tenax萃取技术用于养殖底泥中有机氯农药的生物有效性研究
陈美娜,胡谦,肖强,刘银歌,李娟英
上海海洋大学水产动物遗传育种中心协同创新中心,上海 201306
Tenax萃取技术用于养殖底泥中有机氯农药的生物有效性研究
陈美娜,胡谦,肖强,刘银歌,李娟英*
上海海洋大学水产动物遗传育种中心协同创新中心,上海 201306
本研究以经济底栖生物菲律宾蛤仔和河蚬为受试生物,分别对不同浓度梯度的海洋和淡水底泥中9种代表性有机氯农药(OCPs)进行累积实验;同时采用Tenax连续萃取法研究2类底泥中OCPs的脱附动力学,提供简单、快速评价养殖底泥中OCPs生物有效性的方法,并将Tenax萃取结果与2种底栖生物的累积结果进行比较。结果表明,菲律宾蛤仔和河蚬对OCPs的生物-底泥富集因子(BSAF)分别为0.31~1.89和0.12~2.12,且底泥中有机碳标化的OCPs浓度与生物体内脂肪标化的OCPs浓度之间的相关性较差。Tenax脱附动力学的结果表明,2类底泥中OCPs的快速脱附比例(Frap)均在50%左右,其快速、慢速和极慢速脱附速率常数数量级分别为10-1、10-2和10-4。Tenax快速脱附组分与2种底栖生物累积结果之间具有良好的相关性(r2=0.75,P<0.0001),表明Tenax萃取技术可以预测OCPs在底栖生物体内的累积量,并且该方法克服了大型底栖生物累积实验结果重复性较差等缺点。另外通过与基于热力学平衡的方法对比发现,Tenax萃取技术更适用于滤食性或可消化底泥的底栖生物对底泥污染物的富集;同时Tenax 6 h和24 h单点萃取技术可以作为简单快速评价底泥疏水性有机污染物(HOCs)生物有效性的替代方法,进一步为养殖领域的底泥污染状况以及相关水产品的质量安全和食用风险提供生物有效性评价依据。
有机氯农药;底泥;经济底栖生物;Tenax萃取;生物有效性
有机氯农药(organochlorine pesticides, OCPs)是20世纪70、80年代主要使用的杀虫剂[1],属于疏水性有机污染物(hydrophobic organic contaminants, HOCs),具有较大的辛醇-水分配系数(Kow),主要储存于底泥(沉积物)有机质中[2]。因为OCPs难以降解,在自然环境中存在可以长达数十年甚至上百年,因此尽管大部分OCPs在我国已经停止生产和使用,但是至今在我国部分地区的水体、底泥和食品中仍维持一定量的残留水平[1];例如2006年太湖、海河和大沽排污河的表层底泥中OCPs的总浓度分别高达4.22~460.99、8.95~239.92和27.36~250.46 μg·kg-1(干重)[3-4]。近年来有研究表明,养殖区域的底泥中OCPs存在一定的检出率,如吕赢等[5]的研究结果显示吕泗渔场海域受到OCPs一定程度上的污染,其中含量最高的为六六六和滴滴涕。由于OCPs具有生物累积性和高毒性,残留于底泥中的该类污染物可能被栖息于底泥或水体中的生物富集并造成毒性影响,从而影响水产品如鱼、虾和蚌等的生长和食品质量,进一步经食物链生物放大作用而危害人类健康[1]。因此,底泥中OCPs生态风险受到广泛关注,研究底泥中OCPs的残留风险具有重要意义。
传统评估底泥质量的化学分析方法通常采用污染物的总量进行评价,但是由于污染物总量没有考虑到生物有效性或污染物的形态,得到的结果可能会高估其环境风险[6],进而无法准确反映污染物对生物可能造成的不利影响及相关的生态风险,因而生物有效性的研究很有必要。目前,针对生物有效性的研究方法有生物暴露法,即通过底栖生物的暴露实验确定从底泥进入到生物体内污染物的量,进而表征该类污染物的生物有效性,但该方法通常存在受试生物饲养过程繁琐,试验周期较长,生物个体差异大,耗时费力和实验重复性较差等缺点[6]。因此,具有快捷简易、价格相对低廉和重现性好等特点,用于评价底泥中HOCs生物有效性的化学萃取技术成为研究热点[7]。化学萃取技术大体上可归纳为2类,包括基于热力学平衡(如SPME固相微萃取技术)和基于脱附动力学过程(如Tenax萃取技术)的评价方法[8];另外通过2种化学技术得到的底泥中HOCs的萃取浓度与生物累积结果之间的相关性也被广泛报道[9-12]。
本研究以底栖滤食生活的海洋和淡水经济双壳类生物菲律宾蛤仔和河蚬为受试生物,利用生物累积实验测试2种双壳类底栖生物对养殖底泥中OCPs的生物富集程度。同时利用基于脱附动力学的Tenax萃取技术评价底泥中OCPs的生物有效性,并对Tenax萃取结果与生物累积结果进行相关性分析,进而验证Tenax萃取技术应用于评价生物有效性和预测生物累积的可靠性和准确性,以期在评价和预测养殖底泥中OCPs的生物有效性和生物累积性时提供更为简单、可行的方法,同时也为相关水产品质量安全和食用风险提供有力参考依据。
1 材料与方法 (Materials and methods)
1.1 药品与试剂
甲醇、丙酮、正己烷和二氯甲烷等有机溶剂均为色谱纯,购自美国Sigma公司;无水硫酸钠、Florisil硅土(100~200目)、层析硅胶(80~100目)、氧化铝和铜粉均为分析纯,购自国药集团。无水硫酸钠、Florisil硅土、层析硅胶和氧化铝分别置于马弗炉中在450 ℃、650 ℃、650 ℃和400 ℃下灼烧6 h,冷却后转移到干燥器备用;铜粉在使用前,用5 mol·L-1盐酸活化5 h后再用丙酮超声清洗2次备用。Tenax-TA(60~80目)购自美国Supelco公司,使用前分别用丙酮和正己烷超声清洗3次,75 ℃条件下烘干备用。9种有机氯农药标准品α-六六六、β-六六六、γ-六六六、δ-六六六、p,p'-DDD、p,p'-DDE、六氯苯、环氧七氯和狄氏剂购自德国Dr.Ehrenstorfer公司。
1.2 实验设计与方法1.2.1 底泥的采集、分析及加标老化
本实验中所用底泥分别采自上海洋山港潮间带表层底泥(海水底泥)和上海芦潮港引河表层底泥(淡水底泥),2种底泥的有机碳(OC)和黑碳(BC)含量采用元素分析仪测定,测定结果分别为:w(OC)= 0.53%±0.008%,w(BC)= 0.10%±0.001%和w(OC)= 0.75%±0.043%,w(BC)= 0.14%±0.011%。本研究选择底泥环境检出率较高并具有不同梯度Kow值的9种OCPs作为研究对象,并以实际环境底泥中OCPs残留数据为基础选择2个加标浓度梯度,分别为生态效应低值(美国EPA底泥质量基准,lowest effect level,LEL)的2倍和4倍。将以丙酮为载体的9种有机氯农药混合液加入2种底泥中,搅拌均匀后于4 ℃冰箱内避光条件下老化28 d。
1.2.2 生物累积实验
分别选取壳长(32±2) mm、壳高(12±2) mm的健壮成年菲律宾蛤仔和壳长(22±2) mm、壳高(20±2) mm的健壮成年河蚬在实验室条件下驯养3周以上。驯养过程中采用半静水式方法,水温控制为(20±1) ℃,连续曝气,日换水量1/2,每天定时定量投加实验纯培养微藻饵料;其中菲律宾蛤仔和河蚬的养殖用水分别为盐度25±2的人工海水和在实验室内曝气2 d以上的自来水。生物样品中脂肪的测定采用索氏抽提法,具体操作步骤参考GB/T5009.6—2003《食品中脂肪的测定》;菲律宾蛤仔和河蚬的脂肪含量分别为0.51%±0.157%和1.52%±0.155%。
累积实验参照EPA方法(EPA 600/R-99/064),称取2 kg(湿重)左右的老化底泥,放入8 L玻璃缸中,表面覆盖6 L左右的养殖用水。静置1 d后,向盛装底泥的玻璃缸中放入驯养后活力强、个体大小相近的菲律宾蛤仔和河蚬25~30只,采用半静水式方法(日换水量1/2)进行累积实验,条件同驯养,暴露期间不喂食。2种生物的累积实验分别设置1个空白,每个浓度梯度设置3个平行,持续28 d。实验结束后,将生物和底泥取出,冷冻干燥磨碎后备用。
1.2.3 Tenax脱附动力学实验
取4 g(湿重)老化底泥置于40 mL棕色样品瓶中,加入0.3 g Tenax和35 mL去离子水,再加入约3 mg的HgCl2(相当于底泥干重的0.15%),摇匀后置于滚轴混合器上连续振荡。在合适的时间点(1、3、6、12、24、48、96、168、312、480和672 h)分离Tenax,重新加入0.3 g新鲜Tenax,继续振荡。将上述步骤中每次分离出的Tenax用10 mL丙酮/正己烷(V/V=1:1)混合液超声萃取2次,每次10 min,将2次萃取液合并,按3 000 r·min-1离心5 min,轻柔氮气吹干,用正己烷定容至1 mL,待气相色谱-质谱联用仪(GC-MS)测定,试验设置3个平行。
1.3 样品处理及测定
1.3.1 样品的萃取和净化
底泥样品的萃取和净化:称取冷冻干燥后的底泥样品3 g,加入1 g清洗后的铜粉,用滤纸包好后放入抽提器中,加入100 mL丙酮/正己烷(V/V=1:1)混合液,进行索氏提取,提取温度65 ℃,连续萃取24 h,萃取结束后,浓缩萃取液至1 mL左右进行净化。净化柱从下至上依次填充1 cm无水硫酸钠、3~5 g Florisil硅土和1 cm无水硫酸钠,净化之前需用10 mL正己烷预淋洗净化柱,然后将浓缩后的萃取液移入净化柱中,用30 mL正己烷/二氯甲烷(V/V=1:1)混合液淋洗,收集淋洗液,轻柔氮气吹干,用正己烷定容至1 mL,GC-MS待测。
生物样品的萃取和净化:称取冷冻干燥后的生物样品1 g,用滤纸包好后放入抽提器中,加入100 mL丙酮/正己烷(V/V=1:1)混合液,进行索氏提取,65 ℃下连续萃取24 h,萃取结束后,萃取液用轻柔氮气吹至近干,将溶剂置换为4 mL乙腈,再加入4 mL乙腈饱和的石油醚,漩涡振荡1 min,使其充分混合。于3 000 r·min-1离心5 min,弃去上层石油醚,将乙腈层氮气吹干。(乙腈饱和的石油醚的配制:参考GB/T5009.132—2003,向100 mL石油醚中加入20 mL乙腈,振荡1 min,待静置分层后,上层即为乙腈饱和的石油醚,取其保存备用[13]。)将上述氮气吹干的生物样品用1 mL正己烷/二氯甲烷(V/V=1:1)混合液溶解残留物移入已经预淋洗好的净化柱中,净化柱从下至上依次为1 cm无水硫酸钠、5 g氧化铝、5 g中性硅胶和1 cm无水硫酸钠,用30 mL正己烷/二氯甲烷(V/V=1:1)混合液淋洗,收集淋洗液,轻柔氮气吹干,用正己烷定容至1 mL,GC-MS待测。
1.3.2 色谱分析
采用GC-MS (Agilent7890A/5975C)和DB-5MS(30 m×0.25 mm×0.25 μm)色谱柱进行分离分析。选用EI离子源,选择离子监测模式,以脉冲不分流方式进样,进样量为2 μL,载气流量为1.2 mLmin-1。气相条件:进样口温度280 ℃;色谱柱初始温度50 ℃,保持3 min;以35 ℃min-1上升到220 ℃,保持1 min;15 ℃min-1上升到300 ℃,保持2 min。质谱条件:离子源温度为230 ℃,四级杆温度为150 ℃,传输线温度为300 ℃。
1.4 质量保证与质量控制
通过测定2种受试生物体内有机氯农药的背景值发现,其背景值均低于检测限;同时对用于喂食的纯培养微藻饵料进行测定,同样没有检测到有机氯农药的残留。生物累积试验期间生物的死亡率控制在15%以内,均无急性毒性,满足生物累积试验的要求。底泥和生物样品提取前,进行加标3个浓度梯度OCPs的样品回收率实验,其回收率在70%~120%之间,相对标准偏差为0.2%~15%,方法检出限为0.10~1.5 μg·kg-1。暴露实验中设置过程空白、方法空白及3个平行,对底泥和生物样品的萃取和净化做全流程空白实验及3个样品平行样。
2 结果与讨论(Results and discussions)
2.1 2种双壳类底栖生物对养殖底泥中OCPs的生物富集作用
一般认为底泥环境中HOCs的生物富集是HOCs在生物体脂类与底泥之间的分配过程,HOCs在水生生物中的累积主要是通过鳃与表皮的直接吸收和摄食悬浮颗粒物以及其他生物等途径,通常用生物-底泥富集因子(biota-sediment accumulation factor,BSAF)表示水生生物对底泥HOCs的富集程度,即平衡时生物体内化学物质浓度与底泥中浓度的比值,其大小取决于HOCs在生物脂肪与底泥有机碳之间的相对亲和力[14]。为了更好地比较HOCs的生物富集作用,本研究通过计算得到菲律宾蛤仔和河蚬对OCPs的BSAF值(表1)。
由表1可知,菲律宾蛤仔和河蚬对底泥中9种OCPs的生物-底泥富集因子BSAF在0.31~1.89和0.12~2.12之间,这与李天云[15]的研究中河蚬对OCPs的BSAF(1.79±0.22)值接近。有研究认为,当HOCs在底泥、水和生物体内达到分配平衡时,BSAF值一般处于1~4之间[16],因此本研究中大部分OCPs的BSAF值属于正常范围。其中菲律宾蛤仔对六氯苯和p,p’-DDE及河蚬对六氯苯的BSAF值较其他有机氯农药相对偏低,这可能是由于底泥理化性质和农药的自身性质等导致了六氯苯和p,p’-DDE类有机氯农药在生物体内的富集程度偏低。另外国内也有研究报道鱼类、虾、蟹以及乌贼对DDTs的BSAF值分别为0.55、0.26、0.56和0.06,发现本研究中2种底栖生物对p,p’-DDE和六氯苯的BSAF值与之比较接近,这与BSAF值受多种因子如底泥OC含量、粒径分布和生物相的脂肪含量等的影响有关[15]。

表1 2种浓度梯度下菲律宾蛤仔和河蚬对有机氯农药(OCPs)的生物-底泥富集因子(BSAF)
另外,实验中发现,底泥中有机碳标化的OCPs浓度(Cs,oc)与生物体内脂肪标化的OCPs浓度(Cb,lip)之间相关性不显著关(图1,r2=0.13和0.12;P>0.05),这主要是由于底栖生物体内污染物的主要来源是底泥中生物有效部分的污染物[17],而底泥粒径分布和OC含量与特性以及污染物本身的理化性质都会影响污染物在底泥和生物体内的分布浓度,从而导致Cs,oc与Cb,lip的相关性较差。
目前在养殖水域和水生生物体内均能检测到有机氯农药的残留[5],长期以来,研究工作者使用全底泥监测的方法忽视了环境介质中污染物的总浓度与污染物的生物吸收程度的相关性,导致污染物的总浓度往往过高地估计了污染物的生态风险[18]。因此,具有快捷、价格相对低廉和重现性好等特点的基于脱附动力学的Tenax萃取技术,用于评价底泥中HOCs生物有效性成为研究热点,并且通过Tenax(6 h和24 h)单点萃取技术得到的底泥中HOCs的萃取浓度与生物累积结果之间的相关性也被广泛报道[10]。
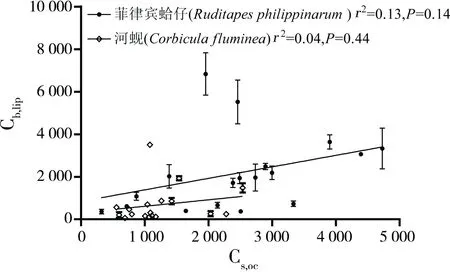
图1 生物体内OCPs浓度(Cb,lip)和底泥中OCPs浓度(Cs,oc)的关系注:Cb,lip为生物体内脂肪标化的OCPs浓度(μg·kg-1),Cs,oc为底泥中有机碳标化的OCPs浓度(μg·kg-1)。Fig. 1 The correlation between the concentrations of OCPs in organisms (Cb,lip) and sediments (Cs,oc)Note: Cb,lip, lipid-normalized concentrations in organisms (μg·kg-1); Cs,oc, organic carbon normalized OCPs concentrations in sediments (μg·kg-1).
2.2 Tenax萃取技术评价底泥中OCPs的生物有效性
Tenax(商品名)是一种多孔的高分子聚合物,化学名为聚2,6-二苯基对苯醚(poly(2,6)-diphenyl-p-phenylene oxide),具有孔隙多、比表面积大和吸收容量大等性质,对HOCs具有良好的吸附和脱附能力,可以源源不断地萃取孔隙水中的HOCs,从而促进底泥有机质中的HOCs向孔隙水中转移,最终达到完全提取的目的[6]。Cornelissen等[19]较早使用Tenax连续萃取结果拟合三相脱附方程(下述式1和2)来研究底泥中HOCs的脱附动力学,根据HOCs与底泥的结合能力不同,分为快速、慢速和极慢速脱附部分,并用快速脱附组分所占比例(Frap)来表征底泥中HOCs的生物有效性,其中快速脱附部分容易脱附下来进入到水相中,因而易于被生物吸收富集。
(1)
Frap+Fslow+Fvs= 1
(2)
其中:S0、St分别表示初始点和t (h)时间点测得的底泥中HOCs的含量(ng);Frap,Fslow和Fvs分别表示快速、慢速和极慢速脱附组分的量占总量的比例(%);krap、kslow和kvs分别表示快速、慢速和极慢速脱附组分的脱附速率常数(h-1)。
2.2.1 有机氯农药的脱附动力学
本文通过Tenax连续萃取实验研究底泥中OCPs的脱附动力学,得出各脱附动力学参数(表2),以期为养殖底泥中OCPs的生物有效性提供简单快捷、有效的评价方法。
由表2可知,海水和淡水2种底泥中OCPs的快速脱附组分所占比例(Frap)最大,均在50%左右,范围处于40%~70%之间,慢速脱附比例(Fslow)约在10%~40%之间,极慢速脱附比例(Fvs)约在10%~30%之间。说明底泥中接近一半的OCPs属于快速脱附组分,较容易脱附下来被生物所利用,而慢速和极慢速脱附组分之和约占总量一半。其他研究对底泥中OCPs的脱附动力学也作出了报道,如Agustina等[27]的研究显示,底泥中DDTs的Frap在30%~45%之间,Yang等[28]的研究中DDTs的Frap在25%~45%之间,本研究中DDTs的Frap(40%~50%)与两者相比均较高,这可能是由于不同理化性质的底泥对DDTs的生物有效性有所差异。You等[29]的研究证明了底泥有机碳(OC)含量的不同会影响HOCs的生物有效性,该研究通过模拟OC含量分别为1.31%和7.85%的2种底泥中DDE的脱附动力学,得出OC含量较低的底泥中DDE的Frap(40%~60%)明显高于OC含量较高的底泥中的值(20%~30%),这是由于OC含量较高的底泥表面具有更多的吸附位点,污染物更难脱附下来,因而表现出较低的生物有效性。Yang等[28]的研究中底泥的OC含量为2.2%,本研究中海水底泥和淡水底泥的OC含量(0.53%和0.75%)均比其较低,因此本研究底泥中OCPs较容易脱附下来被生物利用,表现出了更高的生物有效性。所以OC含量较低的底泥中HOCs具有较高的生物有效性,导致了其较高的环境风险,尤其在养殖底泥中容易被经济底栖生物所富集进而危害到人类健康。
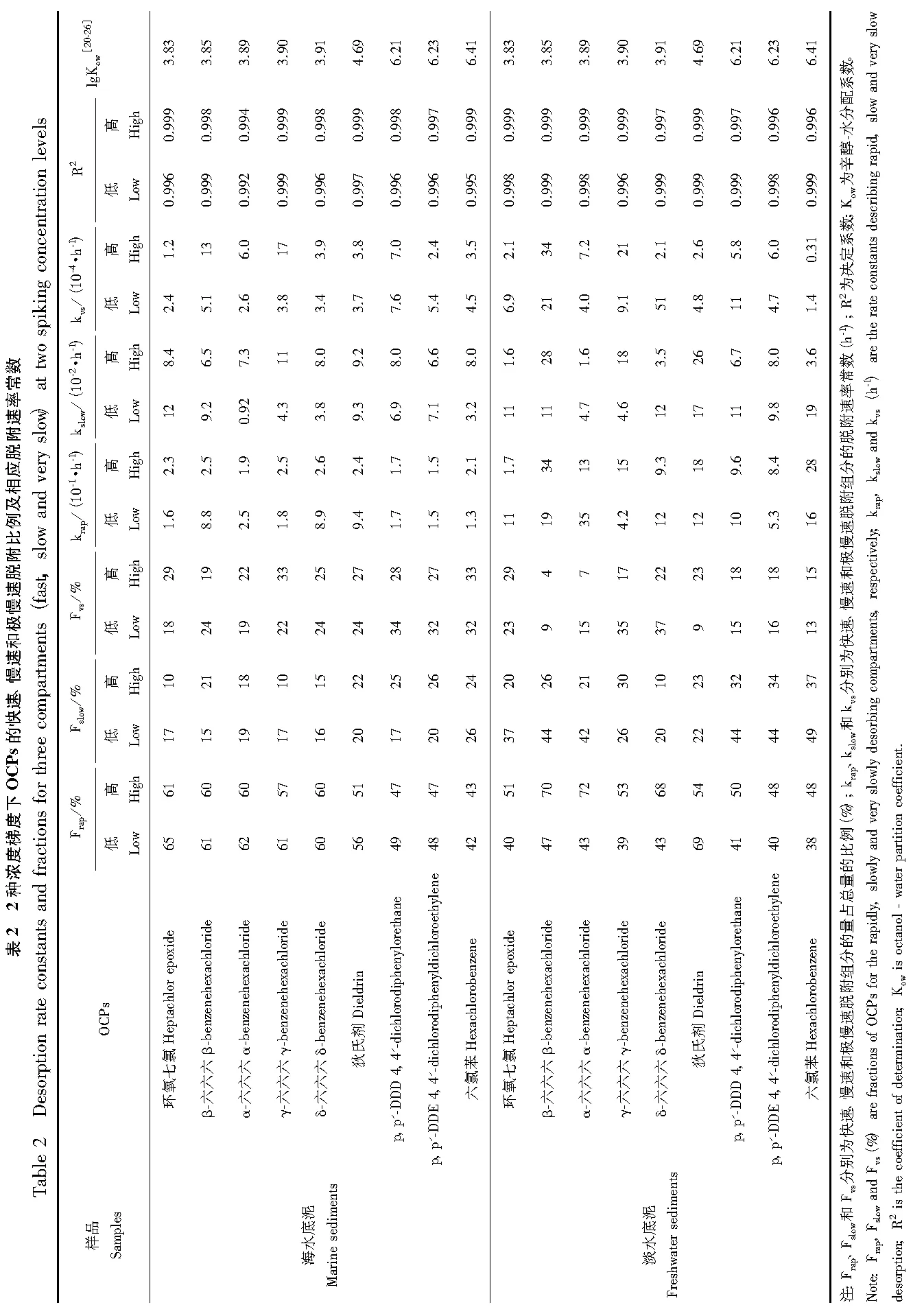
由表2可知,对于大部分的OCPs,其快速、慢速和极慢速脱附速率常数大小顺序描述为10-1>10-2>10-4(h-1),这与Yang等[28]的研究结果一致。Liu等[30]的研究显示,PBDEs的快速和慢速脱附速率常数与本研究中的OCPs比较接近分别为10-1和10-2~10-3(h-1),而PBDEs的极慢速脱附速率常数(10-5h-1)比OCPs小一个数量级;这是由于具有更强疏水性的PBDEs (lgKow值的范围5.9~10.33)的极慢速脱附组分更难从底泥中脱附下来,进而更难以被生物所利用。因此通过Tenax萃取技术模拟脱附动力学,可以得到底泥中HOCs各组分的脱附比例和相应脱附速率常数,进而使用快速脱附比例(Frap)评价底泥中HOCs的生物有效性,尤其对养殖底泥更具有实践意义。
2.2.2 Tenax萃取结果与生物累积结果的相关性分析
Tenax萃取技术被广泛应用于评价底泥中HOCs的生物有效性,同时发现Tenax萃取部分与底栖生物累积量之间存在良好的相关性,并且污染物浓度经有机碳标化后其相关性更为显著。本研究分析了快速脱附组分经有机碳标化后OCPs浓度Cs,rap(μg·kg-1)与双壳类经济底栖生物菲律宾蛤仔和河蚬体内经脂肪标化后OCPs浓度Cb,lip(μg·kg-1)之间的关系。结果表明,lgCs,rap与lgCb,lip之间的相关性达到极显著水平(图2,P<0.0001),表明Tenax萃取技术可以预测OCPs在双壳类经济底栖生物菲律宾蛤仔和河蚬体内的累积量。这与其他研究结果类似,如Tricia等[9]研究了基于Tenax萃取的lgCs,rap与通过底栖无脊椎动物Lumbriculus variegates富集PCBs得到的lgCb,lip之间的线性关系,即lgCb,lip=0.94 lgCs,rap+ 0.83,r2=0.91。本研究与其他研究中Tenax萃取结果与生物累积结果之间均具有良好的相关性,因此使用Tenax萃取技术可以准确、有效地评价底泥中HOCs的生物有效性,进而为养殖底泥中HOCs的环境质量和相关水产品的质量评估提供科学依据。
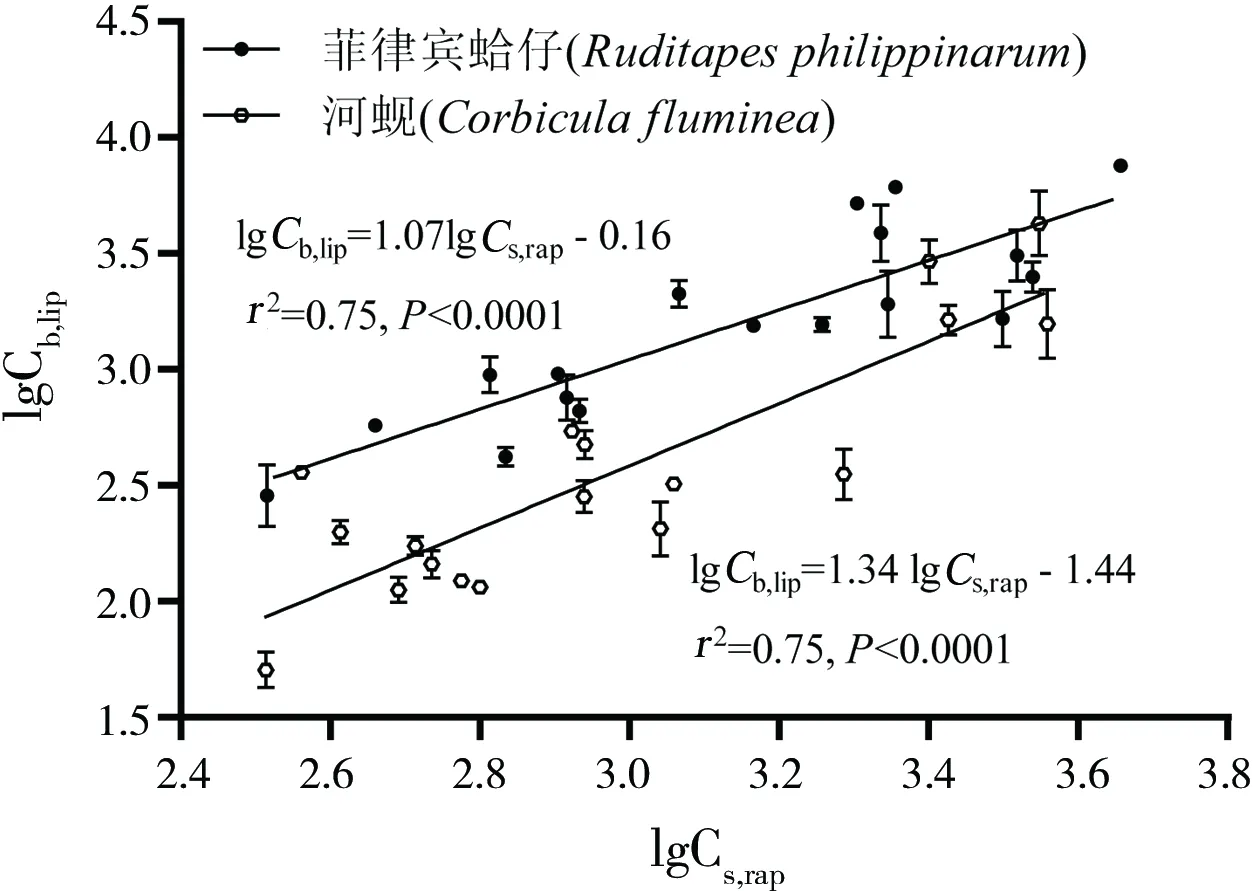
图2 生物体内OCPs浓度(Cb,lip)和Tenax萃取快速脱附浓度(Cs,rap)的关系Fig. 2 The relationship between concentrations of OCPs in Ruditapes philippinarum and Corbicula fluminea (Cb,lip) and concentrations in sediments in the rapidly desorbing fraction (Cb,lip) measured by Tenax extraction

图3 Frap与F6、F24的相关性注:F6,F24表示Tenax单点萃取6 h或24 h获得组分所占比例。Frap 为快速脱附比例。Fig. 3 The relationship between Frap and F6/F24Note: F6, F24 stand for the desorbing fraction after 6 h or 24 h Tenax extraction; Frap stands for rapidly-desorbing fraction.
2.3 Tenax单点萃取技术评价底泥中OCPs的生物有效性
由上述脱附动力学可知,快速脱附比例(Frap)是基于完整的脱附动力学拟合而来,要获得底泥中的快速脱附组分一般需要1~100 h,实验耗费时间长,故有研究认为采用Tenax单点萃取(如6 h和24 h)获得的组分所占比例(如F6和F24)可以代替Frap来评价底泥中HOCs的生物有效性[8]。本研究通过对Frap与F6和F24进行相关性分析发现,Frap与F6、F24相关性极显著(图3,P<0.0001),其中F6、F24与Frap的比值分别为0.59和1.15。与其他研究类似,如Liu等[30]的研究中,F6/Frap的值为0.60±0.024,F24/Frap的值为1.01±0.015,Yang等[28]的研究发现F6/Frap的范围在0.47~0.54之间。另外通过Tenax(6 h和24 h)单点萃取技术得到的底泥中HOCs的萃取浓度与生物累积结果之间的相关性也被广泛报道,Mehler等[10]研究了基于Tenax萃取6 h的结果lgCs,6h与底栖无脊椎动物Lumbriculus variegates富集PCBs、DDTs和PBDEs 3种HOCs得到的lgCb,lip之间的线性关系,结果为lgCb,lip=1.06 lgCs,6h+ 0.74, r2=0.89;Landrum等[31]研究了基于Tenax萃取24 h的结果lgCs,24h与通过2种生物Diporeia spp.和Oligochaetes富集PAHs和PCBs的实验结果lgCb,lip之间的线性关系,分别为lgCb,lip=0.032 lgCs,24h+ 1.06,r2=0.63和lgCb,lip=0.626 lgCs,24h+ 0.71,r2=0.63。因此Tenax 6 h和24 h的单点萃取技术可以作为简单快速测定底泥HOCs生物有效性的方法,进而使用F6和F24实现了在评价上更加简单快速而有效(lgCb,lip=1.28 lgCs,6h- 1.01,r2=0.54,P<0.0001;lgCb,lip=1.41 lgCs,24h- 1.60,r2=0.57,P<0.0001);同时还可以快速预测栖息于海洋和淡水2类底泥中的双壳类经济底栖生物对HOCs的累积程度,为养殖领域的底泥环境质量和污染状况以及相关水产品的质量安全和食品风险评价提供更为快捷、有效的参考依据。
2.4 Tenax萃取技术与基于热力学平衡方法的比较
由于底泥中HOCs的生物有效性是一个复杂的问题,因此正确理解其环境影响有赖于生物有效性评价方法的不断发展。基于热力学平衡的方法是利用平衡被动采样技术测定HOCs的化学活性或底泥孔隙水中HOCs的自由溶解态浓度(freely dissolved concentration,Cfree)来评价生物有效性(指“即手可得”部分,是环境中现成的,在一定时间内可穿过膜进入生物体的那部分污染物);而另一种方法则是使用不完全萃取技术估计底泥中HOCs的潜在生物有效性(指“即手可得”与“潜在可给”部分之和,“潜在可给”部分是指暂时难以被生物所利用,但是在一定条件下可以从底泥中释放出来而被生物所吸收的那部分污染物)[8]。基于2种方法得到的“现成”和“潜在”的生物有效性,可以在理论上从2个不同的方面很好地进行描述[12,18,32]。本研究已通过以上结果验证了基于脱附动力学的Tenax萃取技术在评价底泥中HOCs生物有效性的准确性。为了更好地比较该技术与固相微萃取技术在量化生物有效性的区别及相应的适用范围,本研究通过固相微萃取实验得到的基于热力学平衡状态下的生物有效性与基于Tenax脱附动力学方法得到的结果进行比较(图4)。FAEP(本课题同期未发表实验数据,即底泥中HOCs在平衡分配过程中有效态浓度占总浓度的比例(the fraction available for equilibrium partitioning,FAEP)[8])与基于Tenax萃取技术中得到的快速脱附比例(Frap)的相关性分析,有助于对2类化学技术在评价生物有效性方面进行较为直观的比较。

图4 FAEP与Frap的相关性分析Fig. 4 The relationship between the fraction available for equilibrium partitioning (FAEP) measured by matrix solid-phase microextraction and the rapidly desorbing fraction (Frap) measured by Tenax extraction
由图4可知,FAEP与Frap相关性非常显著(FAEP=0.50Frap+0.02,r2=0.78,P<0.0001),这与You等[8]的研究结果一致(FAEP=0.47Frap+0.02,r2=0.77),斜率接近且均小于1,说明基于Tenax萃取技术得到的Frap总体上高于基于固相微萃取技术得到的FAEP值,并且两者之间存在良好的相关性,2种技术都能很好地评价底泥中HOCs的生物有效性。由此可知,在评价生物有效性上,基于热力学平衡的固相微萃取技术测定的底泥孔隙水中自由溶解态浓度反映了相对较低的环境风险,有研究证明该技术可模拟生物吸收污染物的过程,适用于原位的测定,可作为一种评价现场底泥污染物生物有效性的原位被动采样技术[8]。但是由于底泥中污染物的平衡时间通常较长,且随着污染物疏水性增强,平衡时间可达到数月,甚至更长,因此该方法在应用上相对比较耗时、费力。另外,由于部分底栖生物通过摄取底泥结合态污染物而进行累积,并通过各种途径将有毒物质传递到食物链的上一级,进而影响到相关水产品质量安全和人类健康[15];因此使用Tenax萃取技术得到的生物有效性污染物组分在底泥的环境风险评价上更加保守,尤其对滤食性或可以消化底泥的底栖生物所栖息的养殖底泥的环境质量和污染状况分析及相关水产品质量评估等方面更具有意义。而Tenax 6 h和24 h单点萃取技术使其在生物有效性评价的应用中大大缩短了实验时间,同时该方法的样品、溶剂等使用量耗费较少使其在实验操作上更加简单、快捷;因此使用Tenax单点萃取技术不仅能快速、准确评价和预测养殖底泥中HOCs生物有效性和生物累积性,为养殖领域底泥污染管理和科学修复提供有力科学依据;同时也能克服大型底栖生物累积实验结果重复性和准确性较差的缺点,并及时反映养殖底泥中HOCs污染状况,为相关水产品的质量安全和食用风险提供早期预警。
综上可知:
(1)通过2种双壳类底栖生物的累积实验得到,菲律宾蛤仔和河蚬对9种OCPs的生物-底泥富集因子(BSAF)为0.31~1.89和0.12~2.12;且发现底泥中OC标化的OCPs浓度与生物体内脂肪标化的OCPs浓度之间相关性不显著,说明用全底泥监测的方法忽视了底泥中污染物的生物有效性与生物吸收的影响。
(2)Tenax脱附动力学的结果表明,海水和淡水底泥中OCPs的快速脱附比例(Frap)均在50%左右,说明底泥中约有一半的OCPs具有生物有效性,其快速、慢速和极慢速脱附速率常数数量级分别为10-1、10-2和10-4;Tenax快速脱附组分与2种底栖生物累积结果之间具有显著的相关性,表明Tenax萃取技术可以预测OCPs在底栖生物体内的累积量,并且该方法克服了大型底栖生物累积实验结果重复性和准确性较差的缺点,使得其在评价生物有效性时更加准确、有效。
(3)Tenax 6 h和24 h的单点萃取技术可以代替完整的脱附动力学评价生物有效性,F6和F24使得在评价上更加简单快速而有效。
(4)与基于热力学平衡的评价生物有效性的方法对比发现,Tenax萃取技术更适用于滤食性或可以消化底泥的底栖生物所栖息的养殖底泥的环境质量和污染状况分析,并为养殖领域的底泥污染状况以及相关水产品的质量安全和食用风险提供早期预警。
[1] 吴雪. 海河干流沉积物中有机氯农药的释放行为[D]. 天津: 天津大学, 2009: 1-2
Wu X. Release of organochlorine pesticides from sediments in Haihe River mainstream [D]. Tianjin: Tianjin University, 2009: 1-2 (in Chinese)
[2] 王伟. 疏水性有机污染物在水-土/沉积物体系中的环境行为与归趋[D]. 杭州: 浙江大学, 2011: 1-8
Wang W. Environmental fate and behavior of hydrophobic organic compounds (HOCs) in water-sediment / soil system [D]. Hangzhou: Zhejiang University, 2011: 1-8 (in Chinese)
[3] 赵中华, 张路, 于鑫, 等. 太湖表层沉积物中有机氯农药残留及遗传毒性初步研究[J]. 湖泊科学, 2008, 20(5): 579-584
Zhao Z H, Zhang L, Yu X, et al. Distribution of organochlorine pesticide residues and potential genotoxicity in surface sediments from Lake Taihu [J]. Journal of Lake Sciences, 2008, 20(5): 579-584 (in Chinese)
[4] 高波. 有机氯农药生物降解及污染底泥修复技术研究[D]. 大连: 大连理工大学, 2011: 1-5
Gao B. Biodegradation of organochlorine pesticides and remediation of contaminated sediments [D]. Dalian: Dalian University of Technology, 2011: 1-5 (in Chinese)
[5] 吕赢, 袁广旺, 花卫华, 等. 吕泗渔场有机氯农药污染状况调查[J]. 江苏科技信息, 2015(15): 20-23
Lv Y, Yuan G W, Hua W H, et al. Survey on pollution status of OCPs in Lvsi Fishing Ground [J]. Jiangsu Science and Technology Information, 2015(15): 20-23 (in Chinese)
[6] 张吉营, 孟祥周, 段艳平, 等. Tenax提取法表征有机污染物生物有效性的研究进展[J]. 安徽农业科学, 2012, 40(20): 10573-10576
Zhang J Y, Meng X Z, Duan Y P, et al. Advance in the bioavailability of organic contaminants using Tenax extraction [J]. Journal of Anhui Agriculture, 2012, 40(20): 10573-10576 (in Chinese)
[7] Cui X Y, Mayer P, Gan J. Methods to assess bioavailability of hydrophobic organic contaminants: Principles, operations, and limitations [J]. Environmental Pollution, 2012, 172: 223-234
[8] You J, Harwood A D, Li H Z, et al. Chemical techniques for assessing bioavailability of sediment-associated contaminants: SPME versus Tenax extraction [J]. Journal of Environmental Monitoring, 2011, 13: 792-800
[9] Trimble T A, You J, Lydy M J. Bioavailability of PCBs from field-collected sediments: Application of Tenax extraction and matrix-SPME techniques [J]. Chemosphere, 2008, 71(2): 337-344
[10] Mehler W T, Li H, Pang J, et al. Bioavailability of hydrophobic organic contaminants in sediment with different particle-size distributions [J]. Archives of Environmental Contamination and Toxicology Letters, 2011, 61(1): 74-82
[11] 李娟英, 李振华, 崔昱, 等. 固相微萃取在评价沉积物中菊酯类农药生物有效性及生物累积中的仿生研究[J]. 生态毒理学报, 2015, 10(3): 144-152
Li J Y, Li Z H, Cui Y, et al. Biomimetic research on bioavailability and bioaccumulation of sediment-associated pyrethroids using solid-phase microextraction [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 144-152 (in Chinese)
[12] 李娟英, 陈美娜, 李振华, 等. 基于Tenax脱附动力学的沉积物中菊酯类农药生物有效性研究[J]. 生态与农村环境学报, 2015, 31(3): 406-413
Li J Y, Chen M N, Li Z H, et al. Research on bioavailability of pyrethroids in sediments based on Tenax desorption kinetics [J]. Journal of Ecology and Rural Environment, 2015, 31(3): 406-413 (in Chinese)
[13] 母玉敏, 叶玫, 吴成业, 等. 气相色谱法测定南美白对虾中10种拟除虫菊酯残留方法的研究[J]. 上海海洋大学学报, 2011, 20(3): 399-404
Mu Y M, Ye M, Wu C Y, et al. Determination of 10 pyrethroids residues in Penaeus vannanmei by gas chromatography [J]. Journal of Shanghai Ocean University, 2011, 20(3): 399-404 (in Chinese)
[14] 李天云, 黄圣彪, 孙凡, 等. 河蚬对太湖梅梁湾沉积物中HCHs和DDTs的生物富集[J]. 环境工程学报, 2008, 2(8): 1009-1016
Li T Y, Huang S B, Sun F, et al. Bioaccumulation of HCHs and DDTs in Asiatic clam (Corbicula fluminea) exposed to sediments from Meiliang Bay, Taihu Lake [J]. Chinese Journal of Environmental Engineering, 2008, 2(8): 1009-1016 (in Chinese)
[15] 李天云. 利用河蚬研究沉积物中有机氯农药和多环芳烃在生物体内的累积效应[D]. 重庆: 西南大学, 2008: 47-49
Li T Y. Bioaccumulation of organochlorine pesticides (OCPs) and polycyclic aromatic hydrocarbons (PAHs) for Corbicula flumina from sediment in sewer channel of Tianjin [D]. Chongqing: Southwest University, 2008: 47-49 (in Chinese)
[16] You J, Brennan A, Lydy M J. Bioavailability and biotransformation of sediment-association pyrethroidinsecticides in Lumbriculus variegates [J]. Chemosphere, 2009, 75: 1477- 1482
[17] Escher B I, Hermens J L. Modes of action in ecotoxicology: Their role in body burdens, species sensitivity, QSARs, and mixture effect [J]. Environmental Scienceand Technology, 2002, 36(20): 4201-4217
[18] 胡霞林, 刘景富, 卢士燕, 等. 环境污染物的自由溶解态浓度与生物有效性[J]. 化学进展, 2009, 21(2): 514-523
Hu X L, Liu J F, Lu S Y, et al. Freely dissolved concentration and bioavailability of environmental pollutants [J]. Progress in Chemistry, 2009, 21(2): 514- 523 (in Chinese)
[19] Cornelissen G, Rigterink H, Ten Hulscher D E M, et al. A simple Tenax®extraction method to determine the availability of sediment-sorbed organic compounds [J]. Environmental Toxicology and Chemistry, 2001, 20(4): 706-711
[20] 李超灿. 巢湖沉积物中有机氯农药的污染特征研究[D]. 沈阳: 沈阳航空航天大学, 2012: 6
Li C C. Research of organochlorine pesticide pollution characteristics in sediment of Lake Chaohu [D]. Shenyang: Shenyang Aerospace University, 2012: 6 (in Chinese)
[21] 龚香宜. 有机氯农药在湖泊水体和沉积物中的污染特征及动力学研究-以洪湖为例[D]. 武汉: 中国地质大学, 2007: 6
Gong X Y. Contamination and kinetics of organochlorine pesticides in water and sediments in a lake: A case study in Honghu Lake [D]. Wuhan: China University of Geosciences, 2007: 6 (in Chinese)
[22] 杨丹. 福建晋江流域对泉州湾有机氯农药的传输通量研究[D]. 武汉: 中国地质大学, 2012: 34
Yang D. Transport fluxes of organochlorine pesticides from Jinjiang River watershed to Quanzhou Bay, Fujian, China [D]. Wuhan: China University of Geosciences, 2012: 34 (in Chinese)
[23] 车明秀. 渤海湾沉积物-水界面有机氯农药的环境污染化学研究[D]. 成都: 成都理工大学, 2011: 2
Che M X. Environmental pollution chemistry on organochlorine pesticide residues at sediment-water interface of Bohai Bay [D]. Chengdu: Chengdu University of Technology, 2011: 2 (in Chinese)
[24] 钟恢明. 鄱阳湖有机氯农药污染研究及环境风险评估[D]. 南昌: 南昌大学, 2009: 5
Zhong H M. Study on organnochlorinated pesticides pollutants and its environmental risk evaluation in Poyang Lake [D]. Nanchang: Nanchang University, 2009: 5 (in Chinese)
[25] Hale S E, Martin T J, Goss K U, et al. Partitioning of organochlorine pesticides from water to polyethylene passive samplers [J]. Environmental Pollution, 2010, 158: 2511-2517
[26] Heltsley R M. Novel methods for monitoring chlorinated contaminants in aquatic environments [D]. USA: North Carolina State University, 2004
[27] de la Cal A, Eljarrat E, Grotenhuis T, et al. Tenax®extraction as a tool evaluate the availability of polybrominated diphenyl ethers, DDT, and DDT metabolites in sediments [J]. Environmental Toxicology and Chemistry, 2008, 27(6): 1250-1256
[28] Yang X L, Wang F, Gu C G, et al. Tenax TA extraction to assess the bioavailability of DDTs in cotton field soils [J]. Journal of Hazardous Materials, 2010, 179(1-3): 676-683
[29] You J, Pehkonen S, Landrum P F. Desorption of hydrophobic compounds from laboratory-spiked sediments measured by Tenax absorbent and matrix solid-phase microextraction [J]. Environmental Science & Technology, 2007, 41: 5672-5678
[30] Liu M, Tian S, Chen P, et al. Predicting the bioavailability of sediment-associated polybrominated diphenylethers using a 45-d sequential Tenax extraction [J]. Chemosphere, 2011, 85(3): 424-431
[31] Landrum P F, Robinson S D, Gossiaux D C, et al. Predicting bioavailability of sediment-associated organic contaminants for Diporia spp. and Oligochaetes [J]. Environmental Science & Technology, 2007, 41(18): 6442-6447
[32] 李娟英, 胡谦, 陈美娜, 等. 固相微萃取模拟生物法用于养殖底泥多环芳烃污染监测的研究[J]. 环境科学学报, 2016, 36(3): 753-759
Li J Y, Hu Q, Chen M N, et al. Application of solid-phase microextraction-based biomimetic sampling on monitoring of polycyclic aromatic hydrocarbons in sediment of mariculturezone [J]. Acta Scientiae Circumstantiae, 2016, 36(3): 753-759 (in Chinese)
Research on Bioavailability of Sediment-associated Organochlorine Pesticides of Aquaculture Zone Based on Their Desorption Kinetics with Tenax Extraction
Chen Meina, Hu Qian, Xiao Qiang, Liu Yinge, Li Juanying*
Shanghai Collaborative Innovation Center for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China
Received 8 September 2015 accepted 10 October 2015
In the present study, we used two economic benthic organisms Ruditapes philippinarum and Corbicula fluminea to study the bioaccumulation of nine organochlorine pesticides (OCPs) from marine or freshwater sediment with different concentration gradients. In parallel, we applied Tenax-based sequential extraction to assess the desorption kinetics of these OCPs from the tested sediment samples in comparison with their bioaccumulation characteristics in the two model organisms. This approach provided a simple, rapid way to evaluate the bioavailability of these aquaculture sediment-associated chemicals. The results showed that the biota-sediment accumulation factor (BSAF) for Ruditapes philippinarum and Corbicula fluminea were within the range of 0.31-1.89 and 0.12-2.12, respectively. A poor correlation was observed between organic carbon normalized concentrations of OCPs in the sediment studied and the lipid-normalized concentrations of OCPs in organisms. The Tenax desorption kinetics study showed that the rapidly-desorbing fraction (Frap) of OCPs was approximately 50% for both marine and freshwater sediments, and the rate constants for the rapidly-, slowly- and very slowly-desorbing fractions were of the order of magnitude of 10-1, 10-2and 10-4, respectively. The lipid-normalized concentrations of OCPs in the test organisms were significantly correlated with their concentrations of the rapidly-desorbing fraction in Tenax extraction (r2=0.75, P<0.0001), suggesting the predictive power of Tenax-based extraction for the bioaccumulation of OCPs in benthic organisms. This method overcomes the poor reproducibility of conventional bioaccumulation studies using benthic organisms. Compared with themodynamic equilibrium-based predictions, Tenax extraction is more suited to predict the bioaccumulation of sediment-associated chemicals in filter feeders that can ingest sediment particles. 6-h and 24-h Tenax extractions can therefore serve as a simple, rapid altemative to evaluate the bioavailability of hydrophobic organic contaminants in sediment, providing a sound basis for assessing aquatic product safety and human health risks associated with its consumption.
organochlorine pesticides; sediment; economic benthic animal; Tenax extraction; bioavailability
上海海洋大学科技发展专项资助(A2-0209-14-200055);农业部淡水水产种质资源重点实验室(B1-4901-13-000151)
陈美娜(1990—),女,硕士,研究方向为底泥中有机污染物的生物有效性,Email: 915024130@qq.com
*通讯作者(Corresponding author), E-mail: jyli@shou.edu.cn
10.7524/AJE.1673-5897.20150908001
2015-09-08 录用日期:2015-10-10
1673-5897(2016)4-079-11
X171.5
A
简介:李娟英(1978—),女,博士,副教授,主要从事底泥中有机污染物生物有效性研究。
陈美娜, 胡谦, 肖强, 等. Tenax萃取技术用于养殖底泥中有机氯农药的生物有效性研究[J]. 生态毒理学报,2016, 11(4): 79-89
Chen M N, Hu Q, Xiao Q, et al. Research on bioavailability of sediment-associated organochlorine pesticides of aquaculture zone based on their desorption kinetics with Tenax extraction [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 79-89 (in Chinese)

