基于体外模拟消化的黑脉羊肚菌多酚细胞抗氧化及抗增殖活性
郑少杰,廖 霞,卢可可,刘 冬,吴素蕊,明 建,*
(1.西南大学食品科学学院,重庆 400715;2.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055;3.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223)
基于体外模拟消化的黑脉羊肚菌多酚细胞抗氧化及抗增殖活性
郑少杰1,廖 霞1,卢可可1,刘 冬2,吴素蕊3,明 建1,*
(1.西南大学食品科学学院,重庆 400715;2.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055;3.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223)
以黑脉羊肚菌多酚提取物为研究对象,通过体外模拟消化实验,研究消化过程中消化液多酚含量及氧自由基吸收能力的变化;研究体外模拟胃、肠消化对人肝癌细胞(HepG2细胞)和人结肠癌细胞(Caco-2细胞)的毒性及抗增殖活性的影响;并以HepG2细胞为模型对细胞抗氧化活性(cellular antioxidant activity,CAA)进行评价。结果表明:体外模拟消化后,黑脉羊肚菌多酚释放及氧自由基吸收能力均有提高,模拟胃、肠消化过程中多酚释放分别在1 h和0.5 h达到最高并保持稳定。细胞实验表明,在不产生细胞毒性的范围内,胃0 h、胃液1 h、肠液0.5 h对HepG2的抑制率分别为41%、45%、91%;对Caco-2细胞的抑制率分别为73%、96%、90%。CAA结果显示,胃消化处理的样品表现出促氧化的作用,肠消化处理的样品表现出抗氧化的作用,肠液0.5 h的CAA值为(70.506±0.011)μmol QE/100 g(以干质量计)。由此可见,体外模拟消化处理黑脉羊肚菌具有一定的抗氧化及抗增殖活性,为羊肚菌功能活性的开发提供了理论依据。
黑脉羊肚菌;模拟消化;多酚;氧自由基吸收能力;细胞抗氧化活性
黑脉羊肚菌(Morchella angusticepes Peck)是我国常见羊肚菌品种之一,主要分布于四川、云南、甘肃等地。羊肚菌中蛋白质含量丰富、种类齐全、氨基酸组成优于大豆蛋白[1],并且含有微量元素、抗氧化物质等活性成分,具有较高的营养价值和保健功能,有研究报道,黑脉羊肚菌多酚含量丰富,对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基(ABTS+·)有清除作用,具有一定的抗氧化、抗增殖作用[2-5]。
然而这些研究主要针对有机溶剂提取羊肚菌多酚的化学研究,并没有考虑到羊肚菌在消化系统中酶对其抗氧化成分的影响,因此本研究以中国云南产的黑脉羊肚菌为原料,对其进行体外模拟消化,分析消化过程中多酚及氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)的变化情况,以人肝癌细胞(HepG2细胞)和人结肠癌细胞(Caco-2细胞)为模型,对黑脉羊肚菌经体外模拟消化处理后的细胞毒性及抗增殖活性进行评价。采用Wolfe等[6]建立的细胞抗氧化活性(cellular antioxidant activity,CAA)方法,以HepG2细胞为模型,从细胞水平上对黑脉羊肚菌经体外模拟消化处理后的CAA进行评价,为羊肚菌功能活性及营养保健价值研究提供参考。
1 材料与方法
1.1 材料与试剂
黑脉羊肚菌(Morchella angusticepes Peck)产自云南,由中华全国供销总社昆明食用菌研究所提供。人肝癌细胞HepG2、人结肠癌细胞Caco-2 美国菌种保藏中心。
没食子酸、槲皮素、Folin-Ciocalteu、2,2’-偶氮二异丁基脒盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride,ABAP)、荧光素钠盐、胃蛋白酶、胰酶、胆汁提取物、WME培养基等 美国Sigma公司;胰酶、胎牛血清(fetal bovine serum,FBS)、平衡盐溶液(hanks balanced salt solutions,HBSS)、DMEM培养基美国赛默飞世尔公司;2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorofuorescin diacetate,DCFH-DA) 美国Sigma公司。
1.2 仪器与设备
FW177型中草药粉碎机 天津泰斯特仪器有限公司;DK-8B型电热恒温水浴锅 上海精密实验设备有限公司;5810R台式高速冷冻离心机 德国Eppendorf公司;SpectraMaxM2型连续光谱密度荧光检测仪 美国Molecular公司;HERA cell 240型CO2细胞培养箱 美国Thermo公司;BHC-BOOⅡA2型生物安全柜 苏净安泰空气技术有限公司。
1.3 方法
1.3.1 材料预处理
羊肚菌用前至50 ℃烘箱中烘干,中草药粉碎机粉碎,过80 目筛后密封避光保存。
1.3.2 体外模拟消化
参考赵旭[7]的方法。体外模拟消化包括体外模拟胃、肠消化两部分。体外模拟肠消化是在胃消化多酚最佳释放时间点的基础上进行的。
1.3.2.1 体外模拟胃消化
称取20 g干样品,加入200 g生理盐水,沸水浴糊化15 min(中心温度达到80 ℃);冷却至室温,去离子水恒质量至220 g;1 mol/L HCl调pH值至2.0,加入2.5 mL胃蛋白酶溶液(0.2 g胃蛋白酶溶于5 mL 0.01 mol/L HCl溶液)。空白对照组用等体积的生理盐水替代盐酸和胃蛋白酶,胃酸对照组用等体积0.01 mol/L HCl代替胃蛋白酶。避光,充分充入氮气后在-37 ℃的恒温水浴摇床消化4 h。
分别在消化0、0.5、1、2、3、4 h时取出一定质量的悬浊液;4 ℃,12 000 r/min,离心15 min,取上清液,-80 ℃保存备用。
1.3.2.2 体外模拟肠消化
向达到最佳胃消化时间的消化液中加入1 mol/L NaHCO3调pH值至7.0;加入5 mL胰酶-胆汁提取物(4 g胰酶、25 g胆汁提取液溶于1 L 0.1 mol/L NaHCO3缓冲溶液),混匀。空白组用等体积NaHCO3缓冲溶液代替胰酶-胆汁提取物。避光,充分充入氮气,37 ℃恒温水浴摇床消化5 h 。
分别在消化0、0.5、1、2、3、4、5 h 时取出一定质量的悬浊液;4 ℃,12 000 r/min,离心15 min,取上清液,-80 ℃保存备用。
1.3.3 多酚含量测定
采用Folin-Ciocalteu法[8-9],样品解冻,离心后取上清液,进行多酚含量测定。结果以每100 g干物质相当于没食子酸(galic acid,GA)的含量表示(mg GAE/100 g),以干质量计。
1.3.4 ORAC值测定
参照Wolfe[10]、Kremer[11]等的方法,结果以每100 g干物质相当于水溶性VE(Trolox)的含量(μmol TE/100 g表示,以干质量计。其工作原理是:荧光素钠盐作为荧光指示剂在485 nm光波激发下可发射538 nm的荧光。在有自由基或氧化剂时,荧光素钠盐的荧光逐渐减弱;当有抗氧化剂存在时,荧光素钠盐的荧光减弱被抑制。然后计算荧光衰退曲线下面积(area under the curve,AUC),有抗氧化剂的荧光衰退AUC与无抗氧化剂时荧光衰退AUC之差为抗氧化剂的保护面积,通过抗氧化剂的保护面积与标准抗氧化物质的保护面积相比得出抗氧化剂的ORAC值。
1.3.5 细胞培养
人肝癌细胞HepG2用含有体积分数为5%胎牛血清的培养液,人结肠癌细胞Caco-2用含有体积分数为10%胎牛血清的培养液,于37 ℃、体积分数5%的CO2条件下培养传代,用于实验的细胞为第12~35代。
1.3.6 细胞毒性测定
细胞毒性测定参照Malta[8]、Huang Haizhi[12]等的方法,即取对数生长期的HepG2细胞或Caco-2细胞接种于96 孔白板中,控制每孔细胞数约为4×104个,于37 ℃、体积分数5%的CO2条件下培养24 h,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗一次,样品孔加入100 μL含样品的培养基,控制孔加入100 μL的培养基,每个浓度梯度做3 个平行,于37 ℃、体积分数5%的CO2条件下培养24 h后测定。测定方法:移去培养基,用PBS清洗一次,每孔加入50 μL亚甲基蓝染色溶液,于37 ℃、体积分数5%的CO2条件下孵育1 h,然后移去染液,在去离子水中洗板3 次或洗至去离子水无色,吸取多余的水分并放置2~3 min,每孔加入100 μL洗脱液,然后振荡20 min,在波长570 nm下读板。与控制孔相比,处理孔减小的吸光度与控制孔吸光度的比值即可代表此样品细胞毒性大小,吸光度减少大于等于10%时,即认为样品具有细胞毒性。
1.3.7 细胞抗增殖活性测定
细胞抗增殖活性测定参照Boaventura等[13]的方法,即取对数生长期的HepG2细胞或Caco-2细胞接种于96 孔白板中,控制孔细胞数约为2.5×104个,于37 ℃、体积分数为5%的CO2条件下培养,使90%的细胞贴壁后,移去培养基,样品孔加入100 μL含不同浓度样品(根据加入的样品体积换算出样品的浓度)的培养基,控制孔加入100 μL的培养基,每个浓度梯度做3 个平行,于37 ℃、体积分数5%的CO2条件下培养72 h后测定,测定方法同毒性测定方法。按下式计算细胞抑制率。

处理孔OD值达到控制孔OD值50%时的样品浓度为抗增殖活性的半有效抑制浓度(EC50),EC50值越低表示抗增殖活性越高。
1.3.8 CAA测定
采用Wolfe[6]、Boaventura[13]等方法,即细胞用抗氧化剂和本身无荧光的荧光探针(DCFH-DA)预处理,抗氧化剂结合在细胞膜上并通过细胞膜进入细胞;DCFHDA穿过细胞膜进入细胞内被细胞酯酶水解形成极性更强的还原型二氯荧光素(dichlorofluoorescin,DCFH)。然后用ABAP处理细胞,ABAP在细胞内形成过氧化自由基ROO·,过氧化自由基攻击细胞膜产生更多自由基或活性氧(ROS·)。而细胞内的DCFH极易被氧自由基或活性氧氧化成荧光物氧化型二氯荧光素(dichlorofluorescein,DCF),荧光物质DCF可通过分光光度法测定。抗氧化剂可在细胞膜外部结合氧自由基而阻止其进入细胞,或者在细胞膜内部与ROS·和ROO·结合而阻断DCFH氧化成DCF的过程,从而减少DCF的形成。CAA方法测定抗氧化剂阻止人体HepG2癌细胞中ABAP产生的氧自由基导致DCF形成的能力,与对照组相比,细胞荧光物质的减少量能反映该化合物的抗氧化能力。
取对数生长期的HepG2细胞,接种至96 孔板中,每孔细胞数约为6×104个,37 ℃、体积分数5%的CO2条件下培养24 h,移去培养基,PBS清洗后,用含不同浓度样品的DCFH-DA工作液处理,37 ℃、体积分数5%的CO2条件下培养1 h,移去处理培养基,用PBS清洗,弃去PBS并将氧化剂处理培养基加入空白孔中,含ABAP的氧化剂处理培养基工作液加入其他孔中,将96 孔板置于酶标仪中读板(发射波长538 nm、激发波长485 nm),保持温度37 ℃恒定,测定60 min内荧光强度的变化。并根据标准品的荧光强度的变化,换算出抗氧化物质的CAA值。
1.4 数据处理
2 结果与分析
2.1 体外模拟消化对多酚释放的影响
由图1可知,与胃酸对照组、空白对照组相比,模拟胃液消化组在0~0.5 h释放显著增大,1 h后趋于平稳,胃酸对照组和空白对照组的多酚释放量几乎没有变化。这说明模拟胃液消化组中胃蛋白酶对多酚释放作用较胃酸和生理盐水对多酚释放作用大。模拟胃消化多酚释放最大量为(1 254.1±28.7) mg GAE/100 g,是胃0 h多酚释放量的1.21~1.26 倍。模拟肠液消化组的多酚释放量略高于空白对照组,这说明胰酶和胆汁混合物对多酚释放量有影响,但是影响很小。模拟肠消化多酚释放最大量为(1 347.48±54.5) mg GAE/100 g,是胃0 h多酚释放量的1.26~1.28 倍;肠0 h多酚释放量的1.04~1.06 倍。结果表明:体外模拟消化对食用真菌的影响与体外模拟消化谷物[7,14]、水果[15-18]之间存在一些差异,对于谷物而言,体外模拟胃酸和生理盐水处理几乎对多酚释放没有影响,而胃消化处理可以明显提高多酚的释放,谷物经胃蛋白酶作用,多酚释放量是胃0 h的3 倍左右;这主要是因为黑脉羊肚菌中游离酚含量较结合酚高很多,而谷物的结合酚较游离酚高;结合酚一般以酯键、糖苷键的形式与其他物质以结合状态存在,在酶消化过程中,共价键被胃蛋白酶破坏而游离出来。而对于水果而言,胃酸处理对水果多酚的释放也有一定的加强作用,主要是因为多酚和黄酮在酸性环境下较稳定,并且在强酸性环境下,多酚氧化酶的活性被抑制[19-21],胃空白组中的多酚氧化酶活性较胃酸组强,部分多酚发生降解,使得胃空白组的多酚释放量低于胃酸组的多酚释放量。胃消化阶段和肠消化阶段主要是pH值发生了改变,从强酸性环境变成中性或弱碱性环境,pH值的改变可能对水果及蔬菜样品中的多酚含量及结构有一定的影响,特别是花青素、儿茶素、槲皮素、黄烷-3-醇[22-25]等对pH值较为敏感,在碱性环境中损失比较严重,而槲皮素3-葡萄糖苷、根皮素在肠液中比较稳定[17]。从研究结果看,胰蛋白酶对多酚释放有微弱的增强作用,这主要是由于碱性环境中部分多酚降解,使得多酚含量增加的趋势不那么明显。
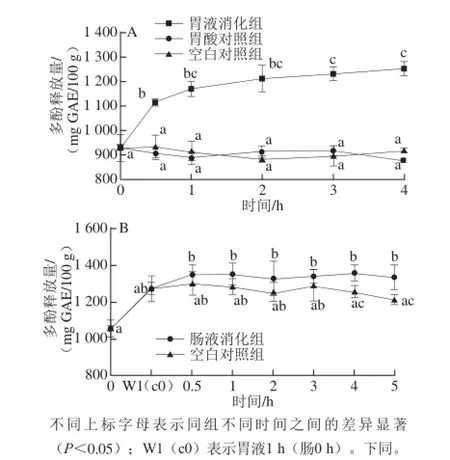
图1 黑脉羊肚菌体外模拟胃消化(A)和肠消化(B)过程中多酚释放量的变化Fig. 1 Changes in polyphenol content from Morchella angusticepes Peck during in vitro gastrointestinal digestion
2.2 体外模拟消化对ORAC值的影响
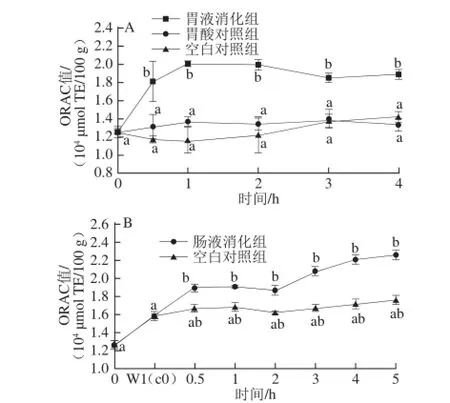
图2 黑脉羊肚菌体外模拟胃消化(A)和肠消化(B)过程中ORAC值的变化Fig. 2 Changes in ORAC of Morchella angusticepes Peck during in vitro gastrointestinal digestion
体外模拟胃、肠消化过程中ORAC值如图2所示,模拟消化过程中ORAC值的变化规律与多酚释放的变化规律相似。模拟胃消化过程中,ORAC最大值为(20 067.26±343.7) μmol TE/100 g,是胃0 h ORAC值的1.45~1.6 倍。模拟肠消化过程中ORAC最大值为(22 615.85±3 641.1) μmol TE/100 g,是胃0 h ORAC值的1.47~1.78 倍,肠0 h ORAC值的1.18~1.43 倍。
2.3 体外模拟消化阶段多酚释放量与ORAC值之间的相关性分析

表1 体外模拟消化过程中多酚释放量与ORAC值之间的Pearson系数Table 1 Pearson correlation between total polyphenol content and ORAC
体外模拟消化过程中多酚释放量与ORAC值之间的Pearson系数如表1所示。在胃消化过程胃液消化组、胃酸对照组、空白对照组的多酚释放量和ORAC值之间Pearson系数分别为0.902、-0.369、-0.137,说明胃液消化组抗氧化活性主要是由多酚类化合物引起的,胃酸对照组、空白对照组多酚释放量和ORAC值之间相关性较低,甚至呈负相关性。在肠消化过程中肠液消化组、空白对照组的多酚释放量和ORAC值之间Pearson系数分别为0.849、0.817。由此可见多酚含量与抗氧化能力呈一定的正相关关系,肠消化对黑脉羊肚菌多酚释放及ORAC值的影响并不明显,多酚化合物中某些单体的结构可能会相互影响,从而产生协同或拮抗作用[26-28]。
2.4 体外模拟胃肠消化对细胞抗增殖活性
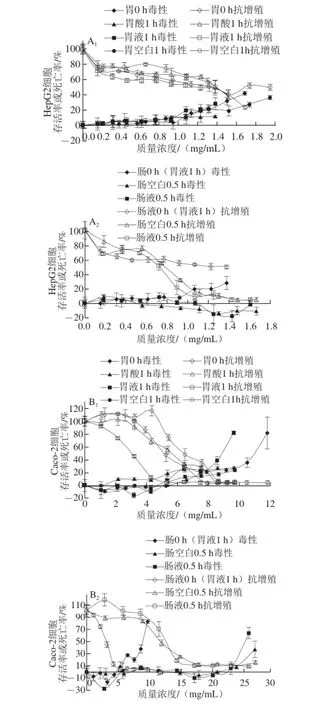
图3 黑脉羊肚菌模拟消化后对HepG2细胞(A)和Caco-2细胞(B)抗增殖及毒性的影响Fig. 3 Anti-proliferation activity and cytotoxicity of Morchella angusticepes Peck in HepG2 and Caco-2 cells during gastrointestinal digestion
体外模拟胃、肠消化对HepG2细胞增殖作用的影响如图3A所示。在不产生细胞毒性的范围内(细胞毒性质量浓度见表2),胃0 h、胃液1 h、胃酸1 h、空白1 h对HepG2的抑制率分别为41%、45%、33%、30%,抑制作用都比较弱,胃蛋白酶虽然对多酚释放有一定的增强作用,但是对HepG2细胞增殖的抑制作用并不明显。肠消化的毒性质量浓度分别为肠0 h(胃液1 h)、肠液0.5 h、肠空白0.5 h,对HepG2的抑制率分别为45%、91%、87%;除肠0 h(胃液1 h)对HepG2细胞增殖的抑制作用较弱外,肠液0.5 h、肠空白0.5 h都较强的抑制HepG2细胞增殖活性。
图3B为体外模拟胃、肠消化对Caco-2细胞增殖作用的影响,胃肠消化的毒性质量浓度分别为:胃0 h、胃液1 h、胃酸1 h、胃空白、肠0 h(胃液1 h)、肠液0.5 h、肠空白0.5 h,在毒性范围内(细胞毒性质量浓度见表2)对Caco-2细胞的抑制率分别为73%、96%、31%、26%、96%、90%、90%。胃0 h、胃液组、肠液组和肠空白组对Caco-2细胞的增殖有较强的抑制作用,胃空白组和胃酸组对Caco-2细胞的抑制作用较弱。研究结果与赵旭[7]、熊云霞[16]等对谷物和水果的研究存在差异,赵旭[7]报道,对谷物进行体外模拟消化处理几乎完全不能抑制Caco-2细胞的增殖;熊云霞[16]研究报道,体外模拟胃消化处理苹果全果,对Caco-2细胞增殖几乎不表现出抑制作用,而肠消化处理,对Caco-2细胞的增殖有一定的抑制作用,但是作用不强。而本研究表明,体外模拟胃、肠消化处理黑脉羊肚菌均能较强抑制Caco-2细胞的增殖作用。
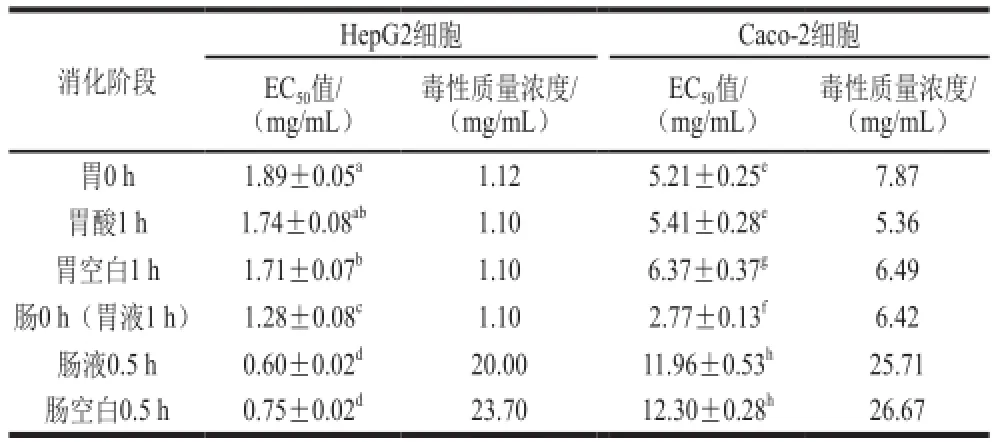
表2 黑脉羊肚菌模拟消化后对HepG2和Caco-2细胞的抗增殖活性(EC50)和毒性的影响Table 2 Anti-proliferation activity (EC50) and cytotoxicity of Morchella angusticepes Peck in HepG2 and Caco-2 cells during gastrointestinal digestion
表2为胃肠消化阶段抗氧化物质对HepG2细胞和Caco-2细胞的抗增殖活性(EC50)和细胞毒性的影响。胃0 h、胃液1 h、胃酸1 h、胃空白1 h对HepG2细胞的毒性质量浓度均小于EC50值,这可能是因为胃消化阶段胃0 h、胃液1 h、胃酸1 h、胃空白1 h均不能明显抑制HepG2细胞增殖导致的。肠消化阶段,除肠0 h(胃液1 h)毒性质量浓度小于EC50值外,肠液0.5 h、肠空白0.5 h的毒性质量浓度均大于EC50值,这说明肠消化阶段肠液0.5 h、肠空白0.5 h对HepG2细胞有较强的抑制作用。
体外模拟消化对Caco-2细胞和HepG2细胞的抑制作用有所不同,除胃酸1 h和胃空1 h对Caco-2细胞的毒性质量浓度小于EC50值外,胃0 h、肠0 h(胃液1 h)、肠液0.5 h、肠空白0.5 h对Caco-2细胞的毒性质量浓度大于EC50值,并且肠消化阶段的毒性及抗增殖作用明显低于胃消化阶段,这也进一步说明pH值的改变可能对多酚含量和结构的影响都比较大。
2.5 体外模拟消化对CAA的影响
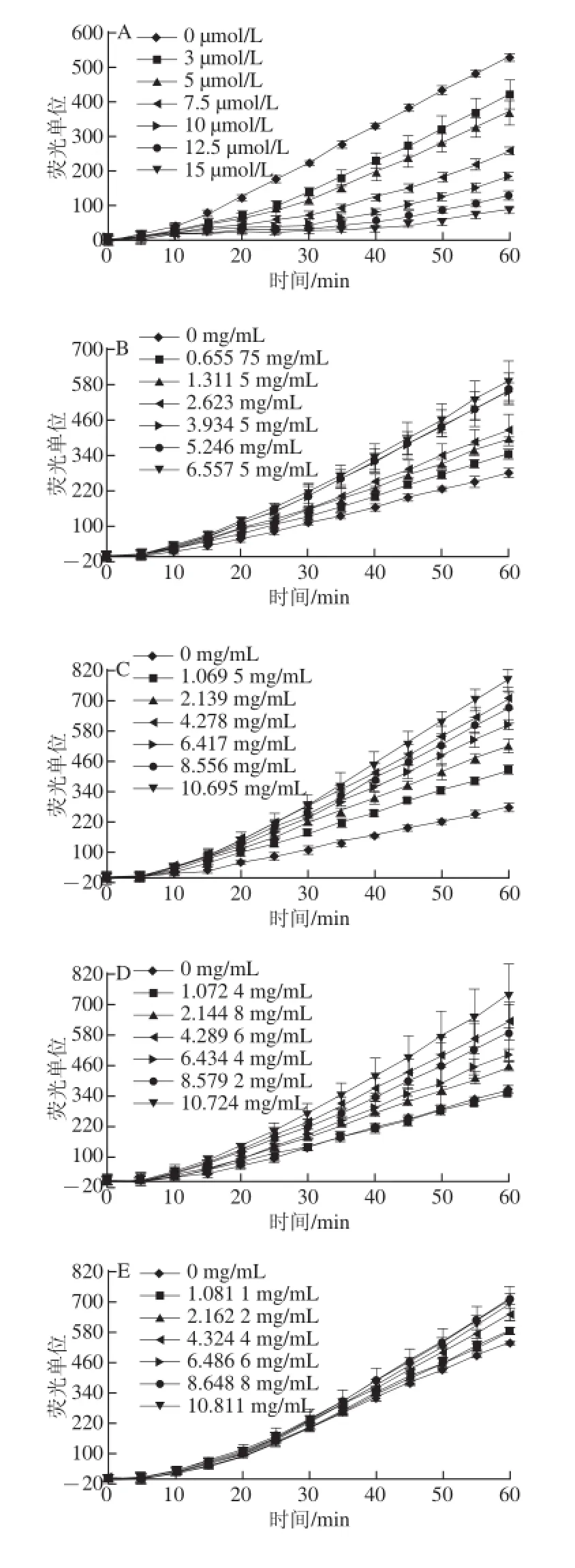
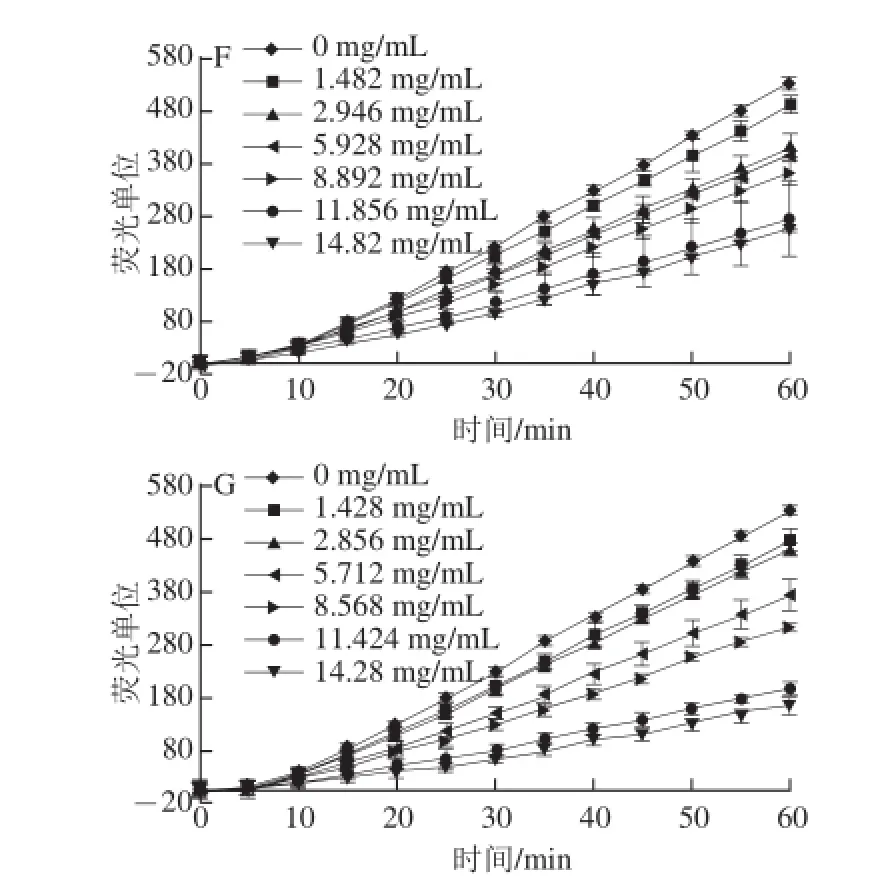
图4 HepG2细胞中ABAP产生的过氧自由基氧化探针DCFH生成荧光物质DCF的动力曲线Fig. 4 Kinetic curves of peroxyl radical-induced oxidation of DCFH to DCF in HepG2 cells
图4显示了HepG2细胞中ABAP产生的过氧自由基氧化探针DCFH生成荧光物质DCF的动力曲线。由于抗氧化剂能够猝灭过氧自由基,因此抗氧化剂处理的孔荧光强度低于未处理的孔,并且抗氧化剂浓度越高或抗氧化能力越强,荧光强度越低。
对比图4中A~E可发现槲皮素的荧光强度随着样品质量浓度的增大而减小,而胃0 h、胃液1 h、胃酸1 h、胃空1 h的荧光强度随着样品质量浓度的增加而增大,这说明槲皮素的细胞抗氧化能力随着质量浓度的增加而增大,而胃消化处理的样品表现出促氧化的作用。对比图4中A、C、F、G可发现,除肠0 h表现出促氧化的作用外,槲皮素、肠空0.5 h、肠液0.5 h表现出抗氧化的作用,并且抗氧化作用随着样品质量浓度的增加而增大。由此可见不同的处理方式对样品的抗氧化能力有所影响,酶处理及pH值的改变对抗氧化剂的成分及结构可能会产生一定的影响,进而导致细胞抗氧化能力的改变。

表3 黑脉羊肚菌体外模拟消化后CAA值及EC50值Table 3 CAA values and EC50values of Morchella angusticepesPeck during gastrointestinal digestion
胃、肠消化对样品的CAA值及EC50值如表3所示。肠空白0.5 h、肠液0.5 h的CAA值分别为(41.583±0.039)、(70.506±0.011)μmol QE/100 g;肠空白0.5 h、肠液0.5 h的EC50值分别为(13.810±2.352)、(8.872±0.811)mg/mL,肠液0.5 h的CAA值明显高于肠空白0.5 h的CAA值,而肠液0.5 h的EC50值显著低于肠空白0.5 h的EC50值(P<0.01)。由肠液0.5 h的CAA值高于肠空白0.5 h的CAA值,进一步说明肠消化阶段中,胰酶对抗氧化物质的释放有增强的作用。
3 结 论
通过对黑脉羊肚菌进行体外模拟消化,测定消化过程中多酚的释放及ORAC值的变化发现,胃蛋白酶、胰蛋白酶对多酚的释放及ORAC值有一定的影响,其中胃蛋白酶的作用较胰蛋白酶明显;抗增殖结果表明体外模拟胃、肠消化对HepG2细胞和Caco-2细胞的抗增殖活性存在明显的差异,其中体外模拟胃消化处理不能明显抑制HepG2细胞增殖,肠消化处理对HepG2细胞有较强的抑制作用;对Caco-2细胞而言,除胃酸组、胃空白组外,胃0 h、胃液组、肠液组和肠空白组对Caco-2细胞的增殖均有较强的抑制作用。CAA结果显示,体外模拟胃消化处理的样品表现出促氧化作用,体外模拟肠消化处理的样品表现出抗氧化作用,抗氧化作用随着样品质量浓度的增大而增大;并且肠液0.5 h的CAA值((70.506±0.011)μmol QE/100 g)高于肠空白0.5 h的CAA值((41.583±0.039)μmol QE/100 g)。比较体外模拟胃、肠消化阶段ORAC值及CAA值发现,两者之间并不严格一致,这主要是因为ORAC主要是对抗氧化物质体外抗氧化活性的研究,而CAA主要是从细胞水平上对抗氧化物质的吸收、代谢、分布等进行的研究。
[1] 刘蓓, 吴素蕊, 朱萍, 等. 滇西北地区四种羊肚菌营养成分分析比较[J]. 食品工业科技, 2012, 33(1): 363-365. DOI:10.13386/ j.issn1002-0306.2012.01.011.
[2] WANG Xuemei, ZHANG Ji, WU Lihua, et al. A mini-review of chemical composition and nutritional value of edible wild-grown mushroom from China[J]. Food Chemistry, 2014, 151(20): 279-285. DOI:10.1016/j.foodchem.2013.11.062.
[3] GURSOY N, SARIKURKCU C, CENGIZ M, et al. Antioxidant activities, metal contents, total phenolics and flavonoids of seven Morchella species[J]. Food and Chemical Toxicology, 2009, 47(9): 2381-2388. DOI:10.1016/j.fct.2009.06.032.
[4] 卢可可, 谭玉荣, 郑少杰, 等. 基于HepG2细胞模型的褐赭色羊肚菌多酚抗氧化及抗增殖活性研究[J]. 现代食品科技, 2015, 31(12): 6-13. DOI:10.13982/j.mfst.1673-9078.2015.12.002.
[5] 卢可可, 郑少杰, 吴素蕊, 等. 响应面试验优化黑脉羊肚菌多酚纯化工艺及其抗氧化活性[J]. 食品科学, 2015, 36(18): 13-20. DOI:10.7506/spkx1002-6630-201518003.
[6] WOLFE K L, LIU Ruihai. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8896-8907. DOI:10.1021/jf0715166.
[7] 赵旭. 体外模拟消化对小麦和大米抗氧化活性和抗细胞增殖作用影响的研究[D]. 广州: 华南理工大学, 2013: 13-14; 50-53.
[8] MALTA L G, TESSARO E P, EBERLIN M, et al. Assessment of antioxidant and antiproliferative activities and the identification of phenolic compounds of exotic Brazilian fruits[J]. Food Research International, 2013, 53(1): 417-425. DOI:10.1016/ j.foodres.2013.04.024.
[9] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteau reagent[M]. Salt Lake City: Academic Press, 1999: 152-178; 299. DOI:10.1016/S0076-6879(99)99017-1.
[10] WOLFE K L, KANG Xinmei, HE Xiangjiu, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8418-8426. DOI:10.1021/jf801381y.
[11] FALLER A L K, ELIANE F, LIU Ruihai. Cellular antioxidant activity of Feijoada whole meal coupled with an in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2012, 60(19): 4826-4832. DOI:10.1021/jf300602w.
[12] HUANG Haizhi, SUN Yujing, LOU Shuting, et al. In vitro digestion combined with cellular assay to determine the antioxidant activity in Chinese bayberry (Myrica rubra Sieb. et Zucc.) fruits: a comparison with traditional methods[J]. Food Chemistry, 2014, 146: 363-370. DOI:10.1016/j.foodchem.2013.09.071.
[13] BOAVENTURA B C B, AMBONI R D M C, SILVA E L. Effect of in vitro digestion of yerba mate (Ilex paraguariensis A. St. Hil.) extract on the cellular antioxidant activity, antiproliferative activity and cytotoxicity toward HepG2 cells[J]. Food Research International, 2015, 77: 257-263. DOI:10.1016/j.foodres.2015.05.004.
[14] 王慧清, 刘冬, 孙海燕, 等. 全麦粉模拟消化过程中的抗氧化活性研究[J]. 现代食品科技, 2015, 31(10): 122-128. DOI:10.13982/ j.mfst.1673-9078.2015.10.021.
[15] 彭梦雪, 从彦丽, 刘冬. 模拟胃肠消化评价苹果多酚、黄酮及抗氧化活性[J]. 现代食品科技, 2016, 32(1): 1-8. DOI:10.13982/ j.mfst.1673-9078.2016.1.020.
[16] 熊云霞. 体外模拟消化对苹果和梨的抗氧化活性及抗癌细胞增殖活性影响的研究[D]. 广州: 华南理工大学, 2013: 53-58.
[17] BOUAYED J, HOFFMANN L, BOHN T. Total phenolics, flavonoids, anthocyanins and antioxidant activity following simulated gastrointestinal digestion and dialysis of apple varieties: bioaccessibility and potential uptake[J]. Food Chemistry, 2011, 128(1): 14-21. DOI:10.1016/j.foodchem.2011.02.052.
[18] TAGLIAZUCCHI D, VERZELLONI E, BERTOLINI D, et al. In vitro bioaccessibility and antioxidant activity of grape polyphenols[J]. Food Chemistry, 2010, 120(120): 599-606. DOI:10.1016/ j.foodchem.2009.10.030.
[19] ARTURO H J, FLORENCE C R, PASCALE M G, et al. Inhibition studies on apple polyphenol oxidase[J]. Journal of Agricultural and Food Chemistry, 1990, 38(4): 926-931. DOI:10.1021/jf00094a002.
[20] 杨凤萍, 梁荣奇. 小麦多酚氧化酶研究进展[J]. 中国农学通报, 2007, 23(4): 209-213. DOI:10.3969/j.issn.1009-1041.2004.01.021.
[21] 王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究进展[J]. 植物学通报, 2005, 22(2): 215-222. DOI:10.3969/ j.issn.1674-3466.2005.02.013.
[22] BERMÚDEZ-SOTO M J, TOMÁS-BARBERÁN F A, GARCÍACONESA M T. Stability of polyphenols in chokeberry (aronia melanocarpa) subjected to in vitro gastric and pancreatic digestion[J]. Food Chemistry, 2007, 102(3): 865-874. DOI:10.1016/ j.foodchem.2006.06.025.
[23] LISA R, STUART L, PRESCOTT. Stability of the antioxidant capacity of twenty-five commercially available fruit juices subjected to an in vitro digestion[J]. International Journal of Food Science and Technology, 2010, 45(6): 1191-1197. DOI:10.1111/j.1365-2621.2010.02254.x.
[24] PETER C W, AISLING M, LISA R. Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and after in vitro digestion measured by FRAP, DPPH, ABTS and Folin-Ciocalteu methods[J]. Food Research International, 2011, 44(1): 217-224. DOI:10.1016/ j.foodres.2010.10.033.
[25] BOYER J, BROWN D, LIU Ruihai. In vitro digestion and lactase treatment influence the uptake of quercetin and quercetin glucoside by the Caco-2 cell monolayer[J]. Nutrition Journal, 2005, 4(1): 1-15. DOI:10.1186/1475-2891-4-1.
[26] 刘晓娟, 何凤林, 赵力超, 等. 番薯提取液与茶多酚、葛根黄酮对PC12细胞的协同抗氧化研究[J]. 现代食品科技, 2015, 31(12): 14-18. DOI:10.13982/j.mfst.1673-9078.2015.12.003.
[27] 盛雪飞. 柑橘黄酮抗氧化及协同作用研究[D]. 杭州: 浙江大学, 2010: 35-40.
[28] 沈维治, 邹宇晓, 刘凡, 等. 桑叶总多酚含量与体外抗氧化能力的相关性研究[J]. 蚕业科学, 2012, 50(6): 1073-1078. DOI:10.13441/ j.cnki.cykx.2015.02.021.
Antioxidant and Antiproliferative Activity in Human Cancer Cells of Polyphenols Extracted from Morchella angusticepes Peck Based on in Vitro Simulated Digestion
ZHENG Shaojie1, LIAO Xia1, LU Keke1, LIU Dong2, WU Surui3, MING Jian1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. School of Applied Chemistry and Biological Technology, Shenzhen Polytechnic, Shenzhen 518055, China; 3. Kunming Edible Fungi Institute of All China Federation of Supply and Marketing Cooporatives, Kunming 650223, China)
Morchella angusticepes Peck was subjected to in vitro simulated gastrointestinal digestion. Changes in polyphenol content and antioxidant activity in terms of oxygen radical absorption capacity (ORAC) were determined during the digestion process. The anti-proliferative activity and cytotoxicity of digests were measured in HepG2 cells and Caco-2 cells as a function of digestion time. Antioxidant activity was evaluated as well by cellular antioxidant activity (CAA) assay in HepG2 cells. The results showed that after the gastrointestinal digestion, polyphenol content and ORAC were increased significantly. Polyphenol release reached the maximum level and then remained stable after 1 h gastric digestion and 0.5 h intestinal digestion, respectively. The percentage inhibition of HepG2 cells by Morchella angusticepes Peck and its 1 h gastric and 0.5 h intestinal digests were 41%, 45% and 91%, respectively, and the percentage inhibition of Caco-2 cells were 73%, 96% and 90%, respectively. The gastric digests showed pro-oxidant effect, whereas the intestinal digests showed antioxidant capacity. The CAA value of the 0.5 h intestinal digest was (70.506 ± 0.011) μmol QE/100 g md. In conclusion, in vitro digestion of Morchella angusticepes Peck showed anti-proliferation and cellular antioxidant activity, which could provide a theoretical basis for further development and utilization of Morchella angusticepes Peck.
Morchella angusticepes Peck; simulated digestion; polyphenols; oxygen radical absorbance capacity; cellular antioxidant activity
10.7506/spkx1002-6630-201621040
R151.2
A
1002-6630(2016)21-0234-07
郑少杰, 廖霞, 卢可可, 等. 基于体外模拟消化的黑脉羊肚菌多酚细胞抗氧化及抗增殖活性[J]. 食品科学, 37(21): 234-240. DOI:10.7506/spkx1002-6630-201621040. http://www.spkx.net.cn
ZHENG Shaojie, LIAO Xia, LU Keke, et al. Antioxidant and antiproliferative activity in human cancer cells of polyphenols extracted from Morchella angusticepes Peck based on in vitro simulated digestion[J]. Food Science, 2016, 37(21): 234-240. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621040. http://www.spkx.net.cn
2016-04-14
中央高校基本科研业务费专项资金项目(XDJK2015D035;XDJK2016E113);国家自然科学基金面上项目(31471576);“十二五”国家科技支撑计划项目(2013BAD16B01)
郑少杰(1991—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:1654633013@qq.com
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com

