酸适应海德尔堡沙门氏菌对环境胁迫耐受性分析
刘佳玫,栗军杰,陆兆新,别小妹
(南京农业大学食品科技学院,江苏 南京 210095)
酸适应海德尔堡沙门氏菌对环境胁迫耐受性分析
刘佳玫,栗军杰,陆兆新,别小妹*
(南京农业大学食品科技学院,江苏 南京 210095)
目的:研究海德尔堡沙门氏菌(Salmonella heidelberg)低pH值酸适应性及酸适应对细胞其他胁迫环境耐受性的影响。方法:海德尔堡沙门氏菌在pH 5.5酸性培养基中生长2 h诱导酸适应性,以pH 3.0酸胁迫培养基及不同温度、NaCl、胆盐、消毒剂环境的存活率评价其耐受性。结果:pH 5.5酸适应2 h后,海德尔堡沙门氏菌在pH 3.0酸胁迫环境的存活率大幅提高。低pH值酸适应也使海德尔堡沙门氏菌在45、50 ℃高温条件下的存活率显著提高,对4 ℃冷藏环境的耐受性显著低于非酸处理菌株,但对-20 ℃冷冻环境的生存无影响。酸适应海德尔堡沙门氏菌对高渗、胆盐胁迫也表现良好的耐受性,5~10 g/100 mL NaCl溶液处理1 h,酸适应海德尔堡沙门氏菌的存活率大于60%,在1~10 g/100 mL胆盐溶液的存活率比对照组高3.8倍。海德尔堡沙门氏菌酸适应性也使其对消毒剂的敏感性发生变化,酸适应性海德尔堡沙门氏菌在10~25 mmol/L H2O2溶液的存活率显著高于对照菌株,最高达3.1 倍;但对NaClO、乙醇消毒剂的耐受性显著降低,高质量浓度下二者无显著差异。结论:海德尔堡沙门氏菌在低pH值酸性条件生长一段时间会诱导产生酸适应性,还会协同提高其对高温、高渗、胆盐、H2O2胁迫环境的交叉抗性;但对4、-20 ℃低温、NaClO、乙醇等杀菌、保藏措施敏感性提高。
海德尔堡沙门氏菌;酸适应性;环境胁迫
沙门氏菌是一种重要的食源性致病菌,我国约40%细菌性食物中毒是由沙门氏菌引起的,其感染人体后12~72 h内便会引起腹泻、腹部痉挛、发热等沙门氏菌病[1]。海德尔堡沙门氏菌是北美地区流行的一种重要的血清型,主要污染肉用仔鸡、火鸡[2]。随着全球化的深入,我国各地也相继从动物制品中检出海德尔堡沙门氏菌[3-5]。沙门氏菌的爆发不仅对食品制造业造成巨大的经济损失,对消费者的安全威胁也逐渐增加。
应用有机酸控制沙门氏菌等肠道致病菌传播的研究已有很多,并且取得了显著的效果。用柠檬酸、乙酸、乳酸等浸泡或喷雾处理,可以消除虾仁[6]、蔬果表面[7]的食源性致病菌。研究表明,将有机酸添加在动物饲料和饮用水中也可以降低肉制品中致病菌数量[8]。但有机酸杀菌剂在实际使用过程中,常常因工作浓度过低、被物品表面介质稀释等原因,造成致病菌亚致死酸浓度暴露。
据报道,沙门氏菌在亚致死pH值酸环境中生长一段时间会产生酸适应性(acid tolerance response,ATR)[9]。在西红柿汁和橙汁中培养24 h的沙门氏菌在pH 2.5模拟胃酸环境的存活率显著提高[10]。关于食源微生物对多种环境胁迫的反应研究已有很多,Leyer等[11]最早发现酸适应性鼠伤寒沙门氏菌在高温、高渗、表面活性剂、结晶紫、放线菌素B、抗菌肽处理条件下的存活率高于非酸适应性对照。黄小鸣等[12]发现压力适应性副溶血弧菌对高温、高渗、有机试剂的耐受性增强。
为了控制沙门氏菌的污染传播,本实验以检出率较高但目前研究较少的海德尔堡沙门氏菌为对象,研究了其酸适应性以及酸适应后对其他环境胁迫(高温、低温、高渗、胆盐、消毒剂)的交叉抗性反应,期望为控制酸适应性沙门氏菌提供思路,为食品加工业选择合适的食品加工保藏措施提供理论指导。
1 材料与方法
1.1 材料、培养基与试剂
海德尔堡沙门氏菌(Salmonella heidelberg)CICC21487购自中国工业微生物菌种保藏管理中心。
胰蛋白酶大豆蛋白胨培养基(trypticase soy broth,TSB) 北京陆桥技术有限公司;柠檬酸(分析纯,≥99%)、氯化钠、30% H2O2、乙醇 南京化学试剂有限公司;胆盐 北京索莱宝科学技术公司;NaClO(分析纯,有效氯≥5.5%) 成都市科龙化工试剂厂。
1.2 方法
1.2.1 海德尔堡沙门氏菌酸适应性诱导
酸适应性诱导:海德尔堡沙门氏菌经TSB液体培养基及固体平板活化后,挑取单菌落,接种于TSB,37 ℃摇瓶培养10 h。再按1%接种至50 mL新鲜TSB培养基中(pH 7.2),37 ℃、180 r/min振荡培养2 h后,加入已过滤除菌的柠檬酸调节溶液pH值。参考Leyer等[11]方法,每次以pH 5.5培养2 h的细胞作为酸处理样品,以pH 7.2 TSB培养基中相同培养条件的细胞作为非酸处理对照。
酸适应性抗性评价实验:将如上方法获得的酸适应性菌和非酸处理对照,1 000 r/min离心2 min,分别重悬于生理盐水和HCl调节的pH 3.0 TSB中。前者作为酸胁迫0 h菌体数;后者为酸胁迫处理,每隔20 min取样,并用灭菌生理盐水10 倍梯度稀释,取适宜稀释度菌液平板计数,其与0 h菌体数之比作为该时间点存活率,绘制存活率曲线,评价海德尔堡沙门氏菌酸适应性。
1.2.2 酸适应海德尔堡沙门氏菌环境胁迫抗性研究
取1.2.1节所述酸适应性和非酸适应性对照的菌悬液,1 000 r/min离心2 min、弃上清液。按以下方法进行海德尔堡沙门氏菌抗胁迫能力实验。高温处理:用2 mL灭菌生理盐水重悬菌体,混合均匀后制成细胞悬液,分别置于45、50、55、60 ℃水浴锅中处理30 min后,快速置于冰上冷却30 s;低温:用2 mL灭菌生理盐水重悬菌体后,分别置于4、-20℃冰箱冷藏、冷冻处理;高渗透压胁迫:将菌体分别重悬于高压蒸汽灭菌的5、10、15、20 g/100 mL NaCl溶液处理1 h;胆盐处理:将菌体分别重悬于0.22 μm滤膜除菌的1.0、2.5、5.0、10.0 g/100 mL的胆盐溶液中处理30 min;H2O2胁迫:将菌体分别重悬于用30% H2O2与无菌水配制的10、15、20、25 mmol/L H2O2溶液中处理30 min;NaClO溶液处理:将菌体重悬于无菌水与NaClO制成的12.5、25.0、50.0、100.0 mg/L NaClO溶液处理10 min,用过量的Na2S2O3终止反应;乙醇处理:将菌体重悬于无菌水与无水乙醇配制的10%、20%、30%、40%乙醇溶液中处理5 min。
菌体在压力环境下处理一定时间后,1 000 r/min离心2 min,弃上清液。沉淀用生理盐水重悬,振荡混匀后梯度稀释,取适宜稀释度细胞悬液涂布TSA平板计数。根据胁迫前后的菌体数计算存活率大小。
1.3 数据统计分析
每个实验重复3 次,实验数据经SAS(V8)软件进行单因素方差分析,结果用Origin 8.0软件绘图。
2 结果与分析
2.1 海德尔堡沙门氏菌酸适应性
海德尔堡沙门氏菌在pH 5.5 TSB中适应2 h后,在pH 3.0酸胁迫培养基中的存活率如图1A所示。随着酸处理时间延长,海德尔堡沙门氏菌存活率逐渐下降,但酸适应性菌的存活率显著高于非酸处理对照。pH 3.0酸处理60 min时,酸适应性菌的存活率降至70.00%,而非酸适应性菌仅有0.02%细胞存活,此时酸适应性菌与非适应性菌存活率的差最大。表明海德尔堡沙门氏菌经pH 5.5酸适应后,对极低pH值酸环境存活率显著提高,与Tosun等[13]报道的结果一样,温和的低pH值酸预处理使海德尔堡沙门氏菌抵抗酸胁迫的能力增强,即ATR。
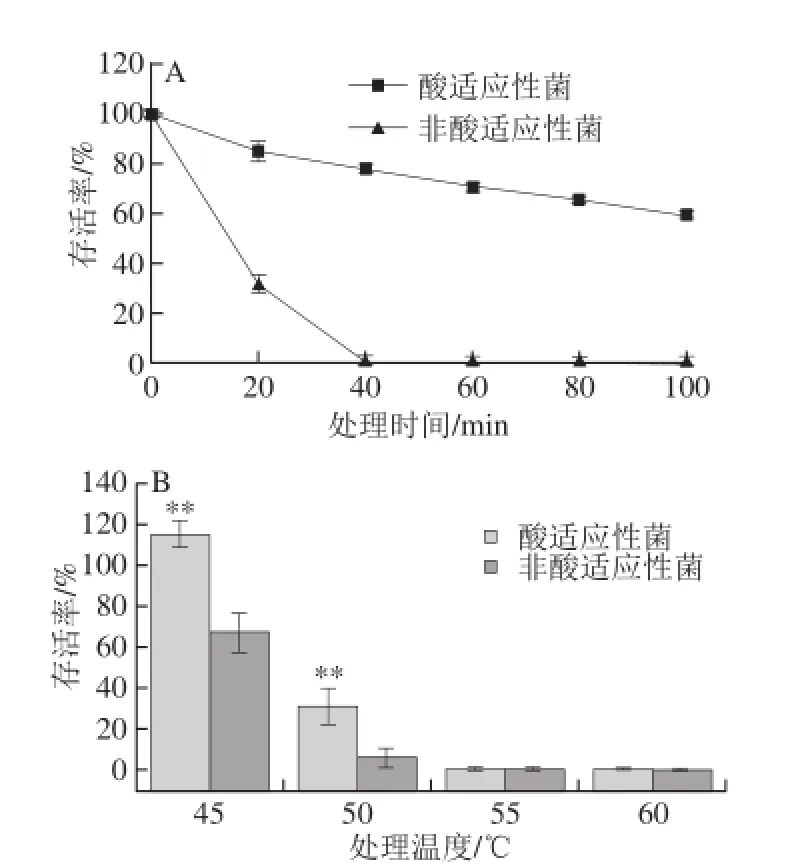
图1 海德尔堡沙门氏菌在pH 3.0酸胁迫(A)及高温环境(B)的存活率Fig. 1 Survival rates of acid adapted (A) and unadapted S. heidelberg in pH 3.0 acid challenge medium and thermal stress (B)
2.2 酸适应性海德尔堡沙门氏菌抗环境胁迫能力
2.2.1 酸适应性海德尔堡沙门氏菌高温抗性
分别以45、50、55、60 ℃热水浴处理酸适应性海德尔堡沙门氏菌与非酸适应性对照的菌悬液,结果如图1B所示。45 ℃水浴条件下酸适应性菌和非适应性菌都保持非常高的存活率,酸适应性菌在该温度下甚至可以增殖,存活率达115.00%,而对照组存活率仅有67.80%。随着处理温度提高,沙门氏菌存活率急剧下降,但50 ℃时酸适应性菌的存活率(31.20%)仍显著高于非酸处理对照(6.15%)(P<0.05);55、60 ℃处理30 min几乎检测不到活细胞,二者存活率无显著性差异。以上结果表明,海德尔堡沙门氏菌酸适应性使其高温抗性增强。有学者发现,酸适应性沙门氏菌产生的高温耐受性甚至使其在60 ℃胁迫条件仍保持很高的存活率[14]。彭珍等[15]发现1.5%乳酸、50 ℃冲淋15 s为肉鸡屠宰过程中最宜的表面微生物减菌措施。以上结果表明,有机酸协同高温杀菌时,应充分考虑酸诱导的细胞高温抗性,建立高效、彻底的杀菌条件,保证如上文提及的酸适应性菌完全灭活。
2.2.2 酸适应性海德尔堡沙门氏菌在4、-20 ℃低温条件的存活率
低温储藏是食品保鲜、延长货架期常用的方法。酸适应性和非适应性海德尔堡沙门氏菌在4 ℃冷藏条件下存活状况良好(图2A),菌体数下降缓慢,21 d内菌体数分别减少0.87、 0.46 (lg(CFU/mL));酸适应海德尔堡沙门氏菌在7~21 d的存活率显著高于非酸处理对照(P<0.05)。而-20 ℃冰箱冷冻保藏条件下,酸适应性菌和对照细菌大量死亡(图2B),4 d内菌体数无显著差异;冷冻处理后活菌数快速下降,还与计数前储藏液冻融引起的细胞损伤有关。以上结果表明酸适应性使沙门氏菌对低温环境更敏感,有机酸协同低温储藏可作为某些食品保鲜的方法。但也有学者发现[13,16],酸适应性不改变鼠伤寒沙门氏菌在低温条件下的存活情况,这些酸适应性菌对低温条件的不同反应,可能与微生物种类和酸处理条件不同有关。鼠伤寒沙门氏菌5 ℃冷激处理后的酸适应性也证实了沙门氏菌属中广泛存在的酸适应性与低温条件的交叉抗性[17]。
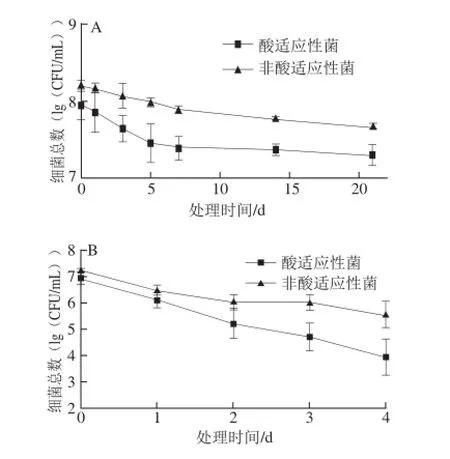
图2 酸适应性与非酸适应性海德尔堡沙门氏菌在低温条件下的存活率Fig. 2 Survival rates of acid adapted and unadapted S. heidelberg under low temperature stress
2.2.3 酸适应性海德尔堡沙门氏菌高渗条件抗性
沙门氏菌在自然条件及感染过程中都会遇到高渗环境,本实验以海德尔堡沙门氏菌在5~20 g/100 mL NaCl高渗条件处理1 h研究酸适应对其高渗环境抗性的影响。结果如图3A所示,随着NaCl溶液质量浓度逐渐增大,沙门氏菌存活率逐渐降低。5、10 g/100 mL NaCl条件下,酸适应性海德尔堡沙门氏菌的存活率分别为81.25%、52.35%,均显著高于非酸处理对照(62.55%、39.5%)(P<0.05)。NaCl溶液质量浓度再升高,二者存活率差异消失。酸适应性海德尔堡沙门氏菌高渗环境抗性,与Greenacre等[18]报道的鼠伤寒沙门氏菌结果一致。但有研究发现盐酸适应性鼠伤寒和山夫登堡沙门氏菌对2.5 mol/L NaCl溶液和H2O2压力环境更敏感[19],这可能与有机酸穿过细胞膜的能力及与细胞膜的作用有关。研究表明,酸适应性诱导的细胞渗透压抗性与甘氨酸、甜菜碱、脯氨酸等渗透压保护剂[16],以及与渗透压相关的外膜蛋白诱导表达量和种类有关[11]。
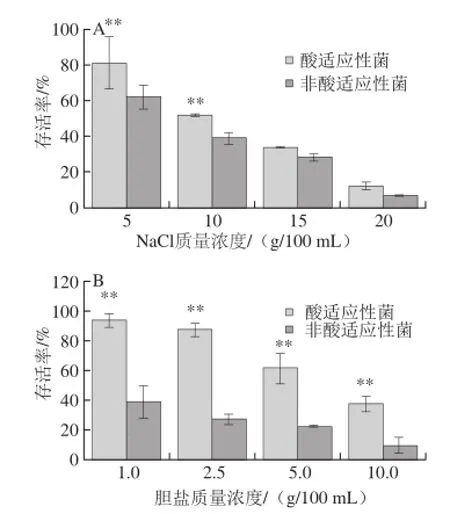
图3 酸适应性海德尔堡沙门氏菌在高渗(A)及胆盐环境(B)的存活率Fig. 3 Survival rates of acid adapted and unadapted S. heidelberg under high osmosis (A) and bile salt (B) stress
2.2.4 酸适应性海德尔堡沙门氏菌胆盐抗性
胆盐是肝脏分泌的胆汁的重要成分,主要参与脂类食物在小肠的分解和吸收,因此细菌通过胃部酸性屏障后,其依赖于胆盐抗性的肠道定殖、存活能力也是研究的一大热点。据报道沙门氏菌具有胆汁盐环境胁迫适应性[20],本实验用1~10 g/100 mL胆盐溶液模拟沙门氏菌可能面临的宿主胆盐环境。由图3B可知,随着胆盐处理质量浓度逐渐增大,海德尔堡沙门氏菌存活率逐渐降低;各质量浓度梯度下,酸适应性菌的存活率均显著高于非酸处理细胞(P<0.05)。特别的,在胆盐胁迫环境下对照组细菌存活率迅速下降,其在1 g/100 mL处理条件的存活率与酸适应性菌在10 g/100 mL质量浓度下的存活率相同(38.00%),而此时非酸适应对照组的存活率已降至10%。显著提高的胆盐耐受性,意味着酸适应性菌一旦进入肠道,其致病率也显著提高。RpoS转录调控子在酸适应性和胆盐适应性沙门氏菌中均表达上调[20-21],暗示其可能参与酸适应性诱导的沙门氏菌胆盐交叉抗性。
2.2.5 酸适应性海德尔堡沙门氏菌对氧化类消毒剂抗性
酸适应性海德尔堡沙门氏菌在食品及加工器械消毒剂——H2O2、NaClO溶液的存活率如图4所示。这两种消毒剂对海德尔堡沙门氏菌具有良好的杀菌效果,随着H2O2浓度、NaClO溶液质量浓度增大,细菌存活率均迅速降低。10~25 mmol/L H2O2处理30 min即可杀死90%以上的菌体(图4A),但酸适应性海德尔堡沙门氏菌存活率均高于非酸处理对照,最高可达到后者的3.1倍。以上结果表明海德尔堡沙门氏菌酸适应性使其对H2O2氧化条件产生交叉抗性。
但用NaClO溶液处理时,除100 mg/L NaClO溶液条件下二者存活率无显著差别外,12.5~50.0 mg/L NaClO溶液中酸适应性菌的存活率均显著低于非酸处理对照(P<0.05)。Leyer等[11]也发现酸适应性鼠伤寒沙门氏菌对NaClO更敏感,即酸适应性加剧了海德尔堡沙门氏菌在NaClO条件的死亡速率,表明NaClO是消除酸适应性沙门氏菌污染的有效消毒剂。
H2O2和NaClO都是氧化类消毒剂,但酸适应性海德尔堡沙门氏菌对二者的反应不同,一方面与处理时间不同有关,也反映出它们与细胞的作用方式不同。H2O2产生活性氧作用于细胞DNA、脂质和蛋白质[22],而NaClO强烈的杀菌效果与其破坏细胞膜渗透性、能量代谢有关。

图4 酸适应性海德尔堡沙门氏菌对消毒剂的敏感性Fig. 4 Survival rates of acid adapted and unadapted S. heidelberg in disinfectants
2.2.6 酸适应性海德尔堡沙门氏菌乙醇敏感性
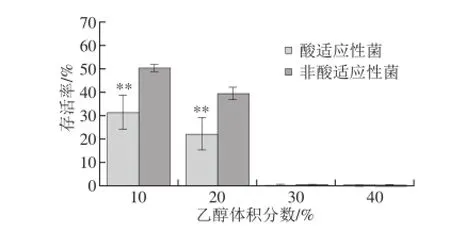
图5 酸适应性海德尔堡沙门氏菌在乙醇条件下的存活率Fig. 5 Survival rates of acid adapted and unadapted S. heidelberg in ethanol
如图5所示,与NaClO作用结果相似,当暴露于低体积分数乙醇溶液(≤20%)时,酸适应性海德尔堡沙门氏菌与原始菌株的存活率较高,且后者的存活率分别为酸适应性菌的1.62、1.78 倍(P<0.05)。但30%、40%高体积分数乙醇处理后海德尔堡沙门氏菌存活率急剧下降至0.1%。与Chiang等[16]报道的酸适应性副溶血弧菌在8%乙醇溶液中的存活率显著提高的结果不同,本研究发现酸适应性使海德尔堡沙门氏菌对乙醇溶液敏感性增强,也意味着乙醇消毒效果显著增强。这说明NaClO、乙醇可作为有效的消毒剂,与有机酸协同消除食品及加工环境沙门氏菌污染及传播。
3 结 论
如沙门氏菌中广泛存在的抗生素抗性一样[23],鼠伤寒和肠炎沙门氏菌低pH值酸环境适应性抗性的研究已有很多[9,11]。本研究发现海德尔堡沙门氏菌在低pH值条件诱导一段时间会产生酸适应性,酸适应性不仅使其在极酸环境存活率提高,还会诱导其高温、高渗、胆盐及过氧化氢胁迫环境的交叉抗性。当有机酸与这些措施协同杀菌时,会显著降低杀菌效果,产生的交叉保护也是食品安全一大隐患。同时,酸适应性却使海德尔堡沙门氏菌对某些压力环境的敏感性增强,如其在4、-20 ℃低温储藏条件、NaClO、乙醇消毒剂的生存能力显著降低。表明以上措施可以与有机酸联合作用,提高食品杀菌效果,保证可能产生的酸适应性菌快速灭活。
食品加工业还应加大开发新的有效杀菌措施,如有机酸与微波[24]、电解水[25]协同杀菌。并通过对沙门氏菌对环境胁迫的反应机制研究,建立有效的食品安全系统、阻止疾病的传播。
[1] 童哲, 程苏云, 梅玲玲. 浙江省272 份食品沙门氏菌检测结果[J]. 浙江预防医学, 2003, 15(4): 33-34. DOI:10.3969/j.issn.1007-0931.2003.04.023.
[2] ROUTH J A, PRINGLE J, MOHR M, et al. Nationwide outbreak of multidrug-resistant Salmonella heidelberg infections associated with ground turkey: United States, 2011[J]. Epidemiology & Infection, 2015, 143(15): 3227-3234. DOI:10.1017/S0950268815000497.
[3] 刘雯静. 我国部分地区沙门氏菌的分子分型及流行特征分析[D]. 北京: 中国人民解放军军事医学科学院, 2011: 15-28.
[4] WANG Huhu, YE Keping, WEI Xinru, et al. Occurrence, antimicrobial resistance and biofilm formation of Salmonella isolates from a chicken slaughter plant in China[J]. Food Control, 2013, 33(2): 378-384. DOI:10.1016/j.foodcont.2013.03.030.
[5] 王金玲, 王芳, 马恒敏, 等. 从美国进口鸡腿中分离出海德尔堡沙门氏菌[J]. 辽宁畜牧兽医, 2003(5): 35-36. DOI:10.3969/ j.issn.1672-9692.2003.05.028.
[6] 刘媛, 方春, 程昌勇, 等. 虾仁中副溶血弧菌灭活动力学模型的建立[J]. 微生物学报, 2013, 53(1): 31-37. DOI:10.13343/j.cnki. wsxb.2013.01.007.
[7] PARK S H, CHOI M R, PARK J W, et al. Use of organic acids to inactivate Escherichia coli O157:H7, Salmonella typhimurium, and Listeria monocytogenes on organic fresh apples and lettuce[J]. Journal of Food Science, 2011, 76(6): M293-M298. DOI:10.1111/ j.1750-3841.2011.02205.x.
[8] 李凯年. 在不同饲料中添加有机酸控制沙门氏菌[J]. 中国动物保健, 2013(6): 90.
[9] FOSTER J W. Salmonella acid shock proteins are required for the adaptive acid tolerance response[J]. Journal of Bacteriology, 1991, 173(21): 6896-6902.
[10] YUK H G, SCHNEIDER K R. Adaptation of Salmonella spp. in juice stored under refrigerated and room temperature enhances acid resistance to simulated gastric fluid[J]. Food Microbiology, 2006, 23(7): 694-700. DOI:10.1016/j.fm.2005.12.003.
[11] LEYER G J, JOHNSON E A. Acid adaptation induces cross-protection against environmental stresses in Salmonella typhimurium[J]. Applied & Environmental Microbiology, 1993, 59(6): 1842-1847.
[12] 黄小鸣, 童钰, 马君妍, 等. 耐超高压胁迫副溶血性弧菌的逆境耐受性[J]. 食品科学, 2014, 35(7): 164-169. DOI:10.7506/spkx1002-6630-201407033.
[13] TOSUN H, GÖNÜL Ş A. Acid adaptation protects Salmonella typhimurium from environmental stresses[J]. Turkish Journal of Biology, 2003, 27(1): 31-36.
[14] SINGH M, MULLINS H R, SIMPSON S M, et al. Effect of acid adaptation on thermal tolerance of Escherichia coli O157:H7 and Salmonella enterica in meat serum[J]. Journal of Food Safety, 2010, 30(1): 111-123. DOI:10.1111/j.1745-4565.2009.00193.x.
[15] 彭珍, 刘书亮, 朱冬梅, 等. 肉鸡屠宰加工过程中胴体微生物污染分析及不同冲淋条件对胴体减菌的影响[J]. 食品与发酵工业, 2014, 40(3): 216-221.
[16] CHIANG M L, CHEN H C, WU C, et al. Effect of acid adaptation on the environmental stress tolerance of three strains of Vibrio parahaemolyticus[J]. Foodborne Pathogens & Disease, 2014, 11(4): 287-294. DOI:10.1089/fpd.2013.1641.
[17] SHAH J, DESAI P T, CHEN D, et al. Preadaptation to cold stress in Salmonella enterica serovar typhimurium increases survival during subsequent acid stress exposure[J]. Applied & Environmental Microbiology, 2013, 79(23): 7281-7289. DOI:10.1128/AEM.02621-13.
[18] GREENACRE E J, BROCKLEHURST T F. The acetic acid tolerance response induces cross-protection to salt stress in Salmonella typhimurium[J]. International Journal of Food Microbiology, 2006, 112(1): 62-65. DOI:10.1016/j.ijfoodmicro.2006.05.012.
[19] ÁLVAREZ-ORDÓÑEZ A, FERNÁNDEZ A, LÓPEZ M, et al. Relationship between membrane fatty acid composition and heat resistance of acid and cold stressed Salmonella senftenberg CECT 4384[J]. Food Microbiology, 2009, 26(3): 347-353. DOI:10.1016/ j.fm.2008.11.002.
[20] HERNÁNDEZ S B, COTA I, DUCRET A, et al. Adaptation and preadaptation of Salmonella enterica to bile[J]. PLoS Genetics, 2012, 8(1): 71-76. DOI:10.1371/journal.pgen.1002459.
[21] JOERGER R D, SARTORI C, FRYE J G, et al. Gene expression analysis of Salmonella enterica enteritidis NalRand Salmonella enterica kentucky 3795 exposed to HCl and acetic acid in rich medium[J]. Foodborne Pathogens & Disease, 2012, 9(4): 331-337. DOI:10.1089/fpd.2011.0984.
[22] RODRIGUES D, CERCA N, TEIXEIRA P, et al. Listeria monocytogenes and Salmonella enterica enteritidis biofilms susceptibility to different disinfectants and stress-response and virulence gene expression of surviving cells[J]. Microbial Drug Resistance, 2011, 17(2): 181-189. DOI:10.1089/mdr.2010.0183.
[23] 朱冬梅, 彭珍, 刘书亮, 等. 肉鸡屠宰加工过程中沙门氏菌的污染情况及其耐药性分析[J]. 食品科学, 2014, 35(17): 214-219. DOI:10.7506/spkx1002-6630-201417041.
[24] 刘怀田, 丁兰英, 杨华明. 微波与柠檬酸协同杀菌作用的研究[J]. 中国消毒学杂志, 1995(4): 241-242.
[25] 谢军, 孙晓红, 潘迎捷, 等. 电解水和有机酸对虾的杀菌效果及感官品质影响[J]. 食品与发酵工业, 2010, 36(5): 57-63.
Tolerance of Acid-Adapted Salmonella heidelberg to Various Environmental Stresses
LIU Jiamei, LI Junjie, LU Zhaoxin, BIE Xiaomei*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Purpose: To investigate the low pH acid adaptability of Salmonella heidelberg and the effect of acid adaptation on its response to different environment stresses. Methods: S. heidelberg was exposed to TSB at pH 5.5 for 2 h for acid adaptation. Comparison of the responses of acid adapted and unadapted cells to different temperature, high osmosis, bile salt, and disinfectant stresses was conducted by calculating their survival rate. Results: pH 5.5 acid adaptation enabled S. heidelberg to survive better in pH 3.0 acid challenge medium. Acid adaptation also provided S. heidelberg with increased tolerance to thermal stress at 45 and 50 ℃, and made it more susceptable to 4 ℃ cold environment, but did not affect its survival at −20 ℃. pH 5.5 acid adaptation also increased high osmotic and bile salt tolerance, and 60% of S. heidelberg survived after 1 h treatment in 5-10 g/100 mL NaCl solution. It survival rate in 1-10 g/100 mL bile salt was 3.8 times higher than that of the control group. Acid adaptation also changed S. heidelberg response to disinfectants, showing a significant increase (3.1 times at most) in survival rate under H2O2stress in the concentration range of 10-25 mmol/L when compared to the control group. On the other hand, acid adapted Salmonella had enhanced sensitivity to NaClO and ethanol, with no significant difference noted between the two disinfectants at high concentrations. Conclusion: Salmonella heidelberg could develop acid tolerance response (ATR) after being inoculated in low pH medium. Low pH acid exposure induced crosstolerance of S. heidelberg cells to thermal, high osmotic, bile salt and H2O2stresses. However, the tolerance to 4 and −20 ℃low temperatures, and NaClO and ethanol disinfectants was reduced due to acid adaptation.
Salmonella heidelberg; acid adaptation; environmental stresses
10.7506/spkx1002-6630-201621035
R378.22
A
1002-6630(2016)21-0209-05
刘佳玫, 栗军杰, 陆兆新, 等. 酸适应海德尔堡沙门氏菌对环境胁迫耐受性分析[J]. 食品科学, 2016, 37(21): 209-213.
DOI:10.7506/spkx1002-6630-201621035. http://www.spkx.net.cn LIU Jiamei, LI Junjie, LU Zhaoxin, et al. Tolerance of acid-adapted Salmonella heidelberg to various environmental stresses[J]. Food Science, 2016, 37(21): 209-213. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621035. http://www.spkx.net.cn
2016-01-14
刘佳玫(1991—),女,硕士研究生,研究方向为食品微生物与生物技术。E-mail:2013108021@njau.edu.cn
*通信作者:别小妹(1964—),女,教授,博士,研究方向为食品微生物与生物技术。E-mail:bxm43@njau.edu.cn

