1 株产细菌素乳酸菌的鉴定及所产细菌素的诱导合成现象
王筱梦,江 芸,孙芝兰,刘 芳,王道营,诸永志,耿志明,徐为民,3
(1.南京师范大学金陵女子学院食品科学系,江苏 南京 210097;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
1 株产细菌素乳酸菌的鉴定及所产细菌素的诱导合成现象
王筱梦1,2,江 芸1,*,孙芝兰2,刘 芳2,王道营2,诸永志2,耿志明2,徐为民2,3
(1.南京师范大学金陵女子学院食品科学系,江苏 南京 210097;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
从发酵大蒜中筛选到一株具有抑菌作用的菌株Br26,通过用不同蛋白酶处理判断该菌株是否为细菌素产生菌。随后,通过分析自身发酵上清液与其他乳酸菌对细菌素合成的影响,探讨该细菌素的诱导合成现象。结果表明:菌株Br26的发酵上清液经胃蛋白酶和木瓜蛋白酶处理后抑菌活性降低,确定该菌为细菌素产生菌,经16S rDNA鉴定为Weissella sp. Br26。Weissella sp. Br26在42 ℃、1/4 MRS培养时,细菌素抑菌活性消失,而当添加不同生长时期的发酵上清液时,抑菌活性显著增加,表明该细菌素可进行自我诱导。另一方面,Weissella sp. Br26与卷曲乳杆菌、瑞士乳杆菌、副干酪乳杆菌和肠膜明串珠菌的活菌共同培养后,发酵液pH值未有明显变化,但细菌素抑菌活性显著增加,表明细菌素的合成亦可受其他乳酸菌的诱导。综上,Weissella sp. Br26细菌素的合成是受自身发酵液及其他菌诱导调控的。
魏斯氏菌Br26;细菌素;群体效应
细菌素(bacteriocin)是由某些细菌在代谢过程中通过核糖体合成机制产生的对特定的菌株有抑菌活性的蛋白质和多肽。它可被蛋白酶消化,所以在食品中添加与使用被认为是安全的[1]。产细菌素的细菌包括乳杆菌属[2,4]、芽孢杆菌属[5]、葡萄球菌属[6]和肠球菌[7-8]等。近年来,由魏斯氏菌产生的细菌素如魏斯菌素110[9]、魏斯菌素A[10]、魏斯菌素Y[11]、魏斯菌素L[12]也陆续见诸报道,但却鲜有真正投入应用,部分原因是细菌素合成量不足导致的。因此,新型细菌素的开发及细菌素合成量的增加尤为必要。
据报道,细菌素的合成受群体感应效应[13-14]的影响。群体感应效应[15]是指微生物细胞内通过相应的感应系统感应细胞外的小分子诱导剂的浓度,从而感知菌群密度的大小,当菌群密度达到一定的阈值时激活一系列目的基因的表达,并表现相应的群体行为。这种小分子诱导剂可由自身合成,也可由其他特定细菌合成。有研究显示,副干酪乳杆菌(Lactobacillus paracasei)和粪肠球菌(Enterococcus faecalis)自身合成的信号分子都可诱导其细菌素的合成[16-17]。而植物乳杆菌(Lactobacillus plantarum)与特定革兰氏阳性菌共培养可导致细菌素合成量的增加[18]。
本实验从发酵大蒜中筛选出具有抑菌活性的菌株Br26,在排除有机酸、H2O2对菌株抑菌活性的干扰后,通过酶处理实验确定其产生的抑菌物质为细菌素。通过16S rDNA鉴定结合序列同源性分析,将菌株命名为Weissella sp. Br26。为进一步提高细菌素的合成量,本实验探究自身群体感应现象及其他乳酸菌的诱导效应对Weissella sp. Br26细菌素合成的影响,为细菌素的生产应用提供参考。
1 材料与方法
1.1 菌株、培养基与试剂
119 株供试菌株分离自酱腌的大蒜头。指示菌:溶酪大球菌(Macrococcus caseolyticus P6.16);共培养菌株:肠膜明串珠菌(Leuoconostoc mesenteroied)、副干酪乳杆菌(Lactobacillus paracasei)、卷曲乳杆菌(Lactobacillus crispatus)、乳酸乳球菌(Lactococcus lactis)、瑞士乳杆菌(Lactobacillus helveticus)为江苏省农业科学院农产品加工所畜产组保存。
MRS(man rogosa sharpe)肉汤培养基、营养肉汤培养基(固体培养基添加1.5%的琼脂) 北京陆桥技术有限责任公司。
细菌基因组提取试剂盒 北京天根生物技术有限公司;Taq DNA polymerase、1 kb DNA ladder TakaRa公司;过氧化氢酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶K、乳酸、盐酸、冰乙酸 上海生工生物工程有限公司。所用试剂均为分析纯。
1.2 仪器与设备
台式冷冻离心机 德国Herolab公司;pHS-25B型数字酸度计 上海大普仪器有限公司;UV-6100型紫外-可见分光光度计 上海美谱达仪器有限公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 菌株的活化与培养
119 株供试菌株与共培养菌株于-80 ℃冰箱冷冻保存,使用前将冻存菌种接种于MRS液体培养基中,37 ℃静止培养12 h,活化传代2 次。溶酪大球菌P6.16活化2 代后,以体积分数l%接种量接种于营养肉汤液体培养基中,37 ℃摇床培养18 h备用。
1.3.2 抑菌活性的测定
供试菌株活化2 代后,以体积分数1%接种量接种到MRS液体培养基中,37 ℃静止培养36 h后,8 000 r/min离心3 min,收集发酵液,利用牛津杯琼脂扩散法测定供试菌株发酵液的抑菌活性[19]。
1.3.3 目标菌株的分子鉴定
利用基因组提取试剂盒提取目标菌株染色体DNA,并以此为模板,利用细菌16S rDNA通用引物8F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1541R(5’-AAGGAGGTGATCCAGCCGCA-3’)扩增目标菌株的16S rDNA序列[20]。聚合酶链式反应(polymerase chain reaction,PCR)扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,30 个循环;最后72 ℃延伸10 min。PCR产物经凝胶回收纯化后,送上海生工生物工程有限公司测序。利用BLAST软件在线比对(http://www.ncbi.nlm.nih.Gov/blast/Blast. cgi)进行测序结果序列同源性分析。随后利用软件MEGA3.1构建系统发育树,进行系统发育分析。
1.3.4 Weissella sp. Br26产细菌素的确定
乳酸菌在生长过程中常产生一些具有抑菌活性的物质,如乳酸、苯乳酸[21]等,因此,在确定细菌素产生的同时要排除这类物质的干扰。
酸排除实验:用乳酸、盐酸、乙酸调节MRS培养基pH值至与Weissella sp. Br26发酵上清液的相同,将其作为对照,分别检测Weissella sp. Br26发酵上清液与对照的抑菌活性[22]。
H2O2排除实验[23]:将Weissella sp. Br26发酵上清液pH值调到7,加入过氧化氢酶至终质量浓度为1 mg/mL,37 ℃放置2 h,后将pH值调回发酵液原pH值,测其抑菌活性。以未经过氧化氢酶处理的发酵上清液做对照。
对蛋白酶的敏感性:用1 mol/L的HCl或NaOH将Weissella sp. Br26发酵上清液pH值调至胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶K的最适pH值,分别为3.0、8.2、7.0、8.0,分别加入酶母液至终质量浓度为 1 g/L,37 ℃放置2 h后再将pH值调回到初始发酵上清液的pH值,检测其抑菌活性,以未经蛋白酶处理的发酵上清液作为对照,检测各种蛋白酶对乳酸菌发酵上清液抑菌活性的影响[24]。
1.3.5 Weissella sp. Br26生长及产细菌素动态变化过程的研究
将Weissella sp. Br26菌株活化2 代,按体积分数1%的接种量接种于MRS培养基中,37 ℃静置培养。每隔4 h取样测其OD600nm值、pH值和发酵上清液抑菌活性[25]。
1.3.6 不同时期的发酵上清液对细菌素生成的影响
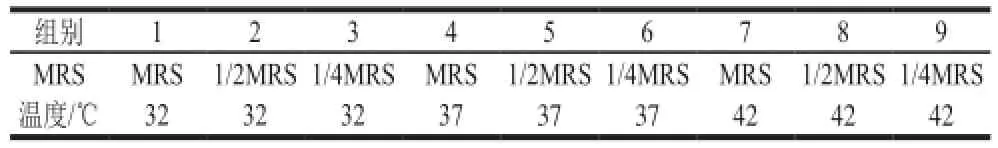
表1 不同培养条件Table 1 Culture conditions for obtaining different cell densities
细菌素产生的最低菌群密度实验:通过改变培养基的浓度和培养温度,设置9 种不同培养条件来改变细胞密度,按表1所述条件培养48 h,生长结束后测发酵上清液抑菌活性[17]。根据实验结果得出不产生细菌素的条件,以此为细菌素产生的低密度培养条件,即阈值。在阈值的基础上测定不同生长时期的发酵上清液对菌株抑菌活性的影响。
按体积分数2%的接种量将Weissella sp. Br26接种于40 mL MRS培养基中。因菌株在不同时间菌体密度不同,发酵上清液的质量浓度也不同,所以将菌株培养到106、107、108CFU/mL时的发酵上清液视为不同生长时期的发酵上清溶液。随后,在阈值条件下,按体积分数2%的接种量将Weissella sp. Br26接种于40 mL的低密度培养基中培养至对数期(6 h),分别在发酵液中加入不同生长时期的发酵上清液(10倍浓缩)1 mL,继续培养24 h,研究不同生长时期的发酵上清液对菌株抑菌活性的影响[15]。以低密度培养条件不加发酵上清液与加入未发酵的MRS培养基作为对照。
1.3.7 其他乳酸菌对细菌素合成的诱导作用
活化后的Weissella sp. Br26与16 株菌株按体积分数2%的接种量分别接种于相应的液体培养基中,37 ℃过夜培养,使活菌数分别达到109、108CFU/mL,后按体积分数2%和1%接种量转接至20 mL的锥形瓶中。在37 ℃共培养36 h,10 000 r/min离心5 min,制备共培养无细胞发酵上清液,测定其抑菌圈直径。同时设定对照:纯培养的Weissella sp. Br26无细胞发酵上清液、纯培养的共培养菌株的无细胞发酵上清液、按体积比1∶1配制的2 种上清液的混合液。如果共培养发酵液的抑菌圈大于设定的对照组的抑菌圈,则将其作为诱导菌株,否则为非诱导菌株。
1.3.7.1 培养液中活菌数的测定
采用平板计数法分别计数纯培养的Weissella sp. Br26、纯培养的共培菌及Br26与共培菌共培养后的活菌数。将菌液用无菌生理盐水稀释至适当菌体浓度后涂布于固体MRS平板。每个稀释度做3 个重复,平板上菌落总数在30~300 CFU间计数,菌落数乘稀释倍数即为菌落总数。
1.3.7.2 诱导菌的发酵上清液和死菌悬浮液对抑菌活性和活菌数的影响
制备诱导菌的发酵上清液(生长到稳定期的诱导菌,10 000 r/min离心10 min,上清液用0.22 µm滤膜过滤)和死菌悬浮液(上述离心菌体用同等体积的磷酸缓冲液清洗2 次后加同等体积磷酸缓冲液于121 ℃灭菌15 min)。Weissella sp. Br26和无细胞上清液或死菌悬浮液按2%和1%的接种量接种于20 mL的MRS培养液中,37 ℃培养36 h,测定其抑菌活性和活菌数。以纯培养的Weissella sp. Br26作为对照。
1.4 数据统计分析
应用SPSS软件进行数据统计学分析。
2 结果与分析
2.1 产细菌素菌株的鉴定与系统进化树的构建
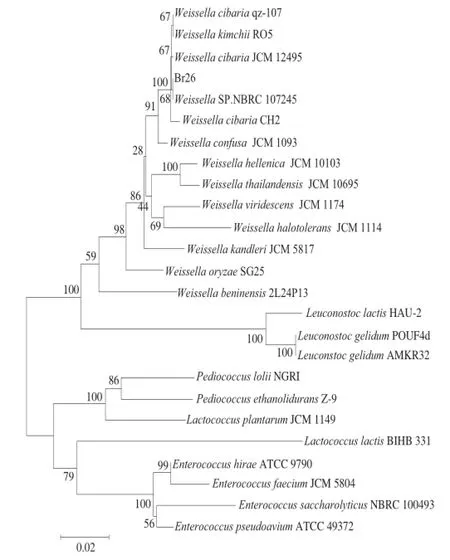
图1 菌株Br26基于16S rDNA基因序列构建的系统发育树Fig. 1 Phylogenetic tree of strain Br26 based on 16S rDNA gene sequences
从发酵大蒜中共筛选出119 株乳酸菌,以溶酪大球菌P6.16为指示菌,采用牛津杯琼脂扩散法筛选出一株具有明显抑菌作用的菌株Br26。利用细菌通用引物8F/1541R扩增该菌株的16S rDNA序列,并测序。利用MEGA 3.1软件构建系统发育树(图1)。由图1可知,菌株Br26与Weissella cibaria qz-107同源性高达99%,结合16S rDNA基因序列分析,该菌为魏斯氏菌,命名为Weissella sp. Br26。
2.2 细菌素的确定
排除酸和H2O2对乳酸菌抑菌活性的影响:分别用乳酸、盐酸、乙酸将MRS培养基pH值调至与Weissella sp. Br26发酵上清液相同,它们对溶酪大球菌P6.16均无抑制作用,说明发酵上清液的抑菌效果不是由所产酸引起的。用过氧化氢酶处理过的发酵上清液,对溶酪大球菌P6.16的抑菌效果也无明显影响,亦可排除H2O2的影响。

表2 不同蛋白酶对Weissella sp. Br26发酵上清液抑菌活性的影响Table 2 Influence of different protease treatments on the fermentation supernatant activity of Weissella sp. Br26
Weissella sp. Br26发酵上清液经胰蛋白酶、蛋白酶K处理后抑菌圈无变化,而经胃蛋白酶、木瓜蛋白酶作用2 h后,抑菌活性部分丧失(表2),说明发酵上清液中主要的抑菌物质是蛋白质或多肽。
2.3 菌体生长及细菌素合成的动态变化过程
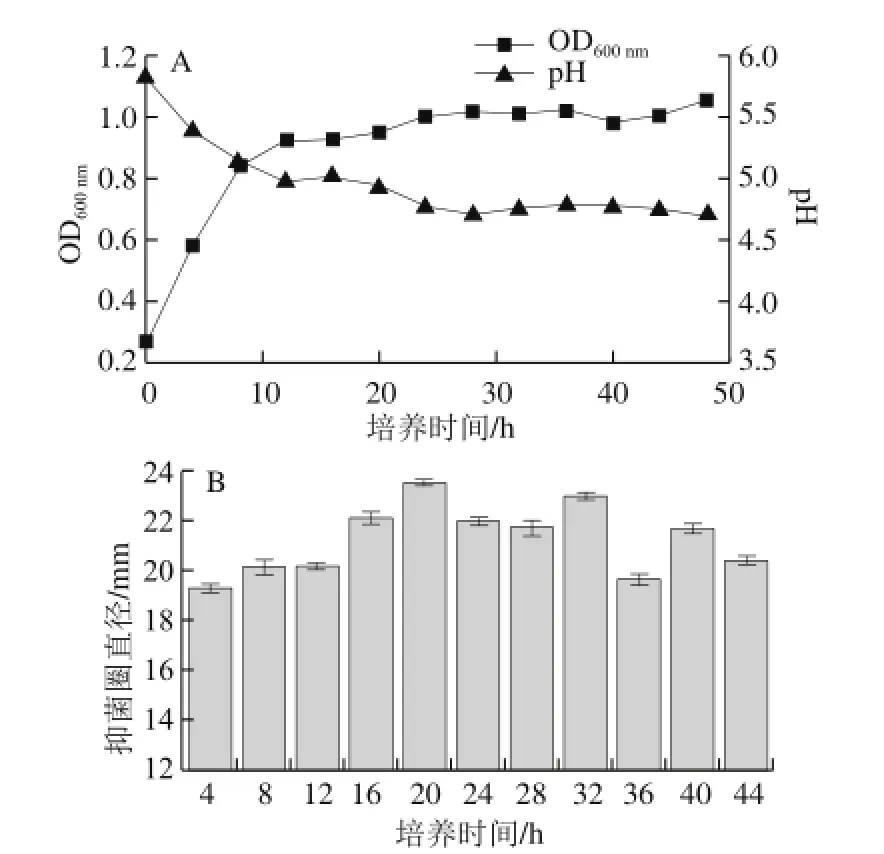
图 2Weissella sp. Br26在37 ℃连续培养OD600nm、pH值(A)和抑菌活性(B)的变化Fig. 2 Effect of incubation duration at 37 ℃ on the OD600nm, pH (A) and antibacterial activity (B) of Weissella sp. Br26
为了研究Weissella sp. Br26的生长和所产细菌素的合成过程,每隔4 h取无细胞发酵上清液测其pH值、OD600nm和抑菌圈直径。由图2可知,在发酵初期,随着菌体的生长,发酵液pH值开始下降,至8 h时,菌株进入对数后期,发酵液抑菌活性开始显现,细菌素开始大量合成。至12 h时,菌株进入稳定期,pH值也趋于稳定,发酵液抑菌活性继续增加,细菌素持续合成。24~36 h菌体密度和发酵液pH值趋于稳定,此时发酵液抑菌活性也最大。但36 h之后,发酵液的抑菌活性略微下降,因此,将24~36 h作为细菌素合成的高峰期。
2.4 不同生长时期的发酵上清液对Weissella sp. Br26产生细菌素抑菌活性的影响
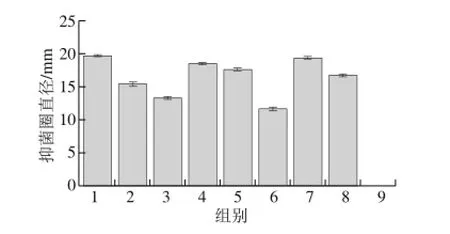
图3 不同培养条件下细菌素的抑菌活性Fig. 3 Antibacterial activity of bacteriocin under different culture conditions
由图3可知,抑菌圈直径随MRS质量浓度的降低减小,随温度的升高而降低。并且第9组(1/4 MRS 42 ℃)抑菌活性消失。所以将其定为细菌素产生的低密度培养条件,即阈值。

表3 添加不同生长时期发酵上清液对细菌素抑菌活性的影响Table 3 Effect of fermentation supernatants at different growth phases on the antibacterial activity of bacteriocin
将含有不同生长时期自身发酵上清液的溶液加到低密度培养条件下的菌株发酵液中,42 ℃发酵培养(表3)。添加MRS培养基时,发酵液抑菌圈直径为牛津杯直径,而添加培养Weissella sp.到106CFU/mL时的自身发酵上清液后,发酵液的抑菌活性明显增大。随着菌体浓度的增加,收集的发酵上清液浓度也随之增加,而添加到低密度培养条件下的菌株发酵液中时,抑菌圈直径也逐步增大,当添加菌体浓度为108CFU/mL时的发酵上清液时,抑菌圈直径最大为15.54 mm,说明不同生长时期的发酵上清液可以刺激菌株产生高浓度的细菌素。
2.5 其他乳酸菌对细菌素合成的诱导作用
2.5.1 共培养后Weissella sp. Br26活菌数与发酵液抑菌活性的变化
将Weissella sp. Br26与其他16 株乳酸菌共同培养,确定其细菌素合成的诱导菌株。Weissella sp. Br26与肠膜明串珠菌、副干酪乳杆菌、瑞氏乳杆菌、卷曲乳杆菌共培养后,发酵液pH值未有明显变化,但抑菌圈直径显著增大(P<0.01),所以推测这4 株菌株可能为Weissella sp. Br26细菌素合成的诱导菌。而与其他菌株共培养后,发酵液抑菌圈直径小于对照组,因此为非诱导菌(结果未显示)。Weissella sp. Br26与4 株诱导菌共培养后,活菌数(图4B)显著高于单独培养的Weissella sp. Br26和单独培养的诱导菌(P<0.01)。并且细菌素的抑菌活性在图4A中显示最大,说明细菌素的合成与自身菌体密度呈正相关。而这与表1得出的结论(细菌素的合成与Br26的菌体密度有密切关系)相似,符合群体感应效应。即Weissella sp. Br26受到诱导菌刺激后菌体数增多达到阈值条件,启动细菌素合成的基因表达,促进细菌素合成量的增加。
2.5.2 诱导菌的死菌悬浮液和上清液对Weissella sp. Br26细菌素合成和活菌数的影响
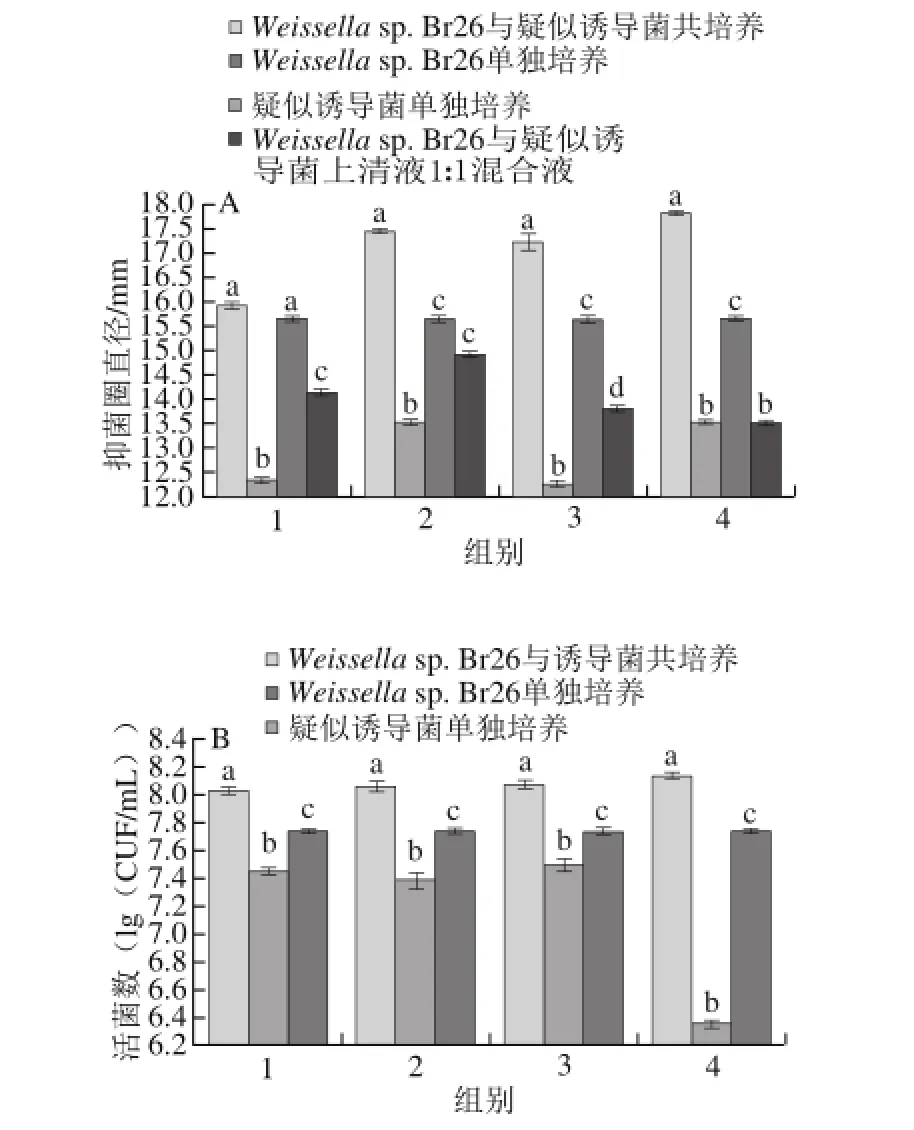
图4 Weissella sp. Br26与4株疑似诱导菌共培养后的抑菌圈直径(A)和活菌数(B)的变化Fig. 4 Bacteriocin production of Weissella sp. Br26 in co-culture with one of 4 inducing strains: diameter of inhibition zone (A) and cell number (B)
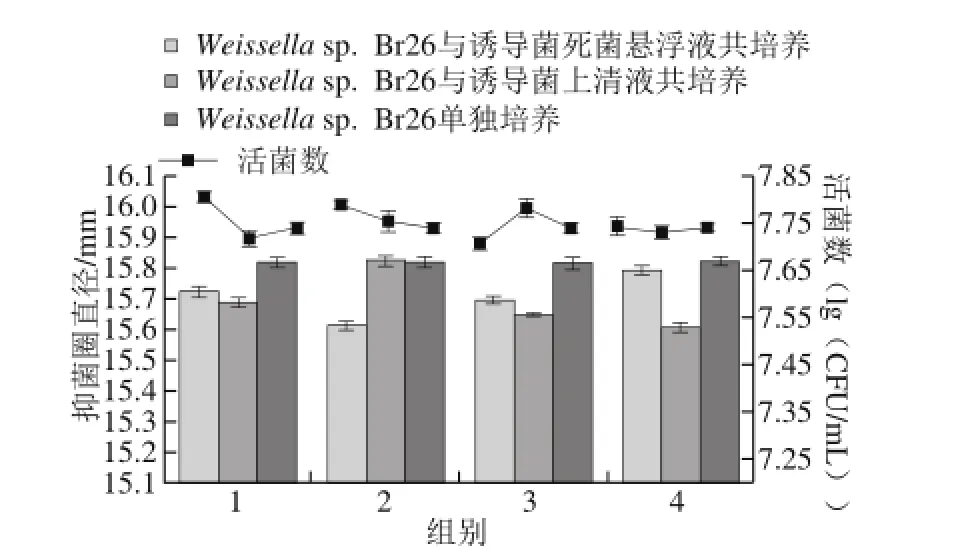
图5 Weissella sp. Br26与诱导菌的死菌悬浮液和上清液共培养后抑菌活性和活菌数的变化Fig. 5 Cell number of Weissella sp. Br26 and antimicrobial activity of bacteriocin produced during co-culture with cell-free supernatants and autoclaved cultures of inducing strains
由图5可知,Weissella sp. Br26与4 株诱导菌的上清液和死菌悬浮液共培养后,共培养的活菌数无显著变化,共培养后发酵液的抑菌活性也无显著变化。这与文献[17]报道一致。此结果说明诱导菌的死菌和代谢产物不能刺激细菌素的合成,原因可能是与诱导菌的死菌悬浮液和上清液共培养后,菌体密度并未达到细菌素合成时群体感应效应的条件,从而不能刺激菌体产生更多的细菌素。由此推断,诱导菌的活菌数是诱导细菌素合成的必要条件。
3 结 论
从发酵大蒜中筛选到一株对溶酪大球菌P6.16具有较强抑菌活性的菌株,经16S rDNA鉴定为魏斯氏菌属,命名为Weissella sp. Br26。在排除酸、H2O2的干扰后,该菌的发酵上清液仍有抑菌活性,同时用最适pH值的胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶K处理后抑菌活性部分消失,表明该菌株产生的抑菌活性物质为蛋白或多肽。通过改变培养基浓度与培养条件,初步证实Weissella sp. Br26细菌素的产生依赖于菌体密度。通过添加不同生长时期发酵上清液再发酵的方法,确定细菌素其本身可进行自我诱导。将Weissella sp. Br26与肠膜明串珠菌、副干酪乳杆菌、瑞士乳杆菌、卷曲乳杆菌分别共培养后,细菌素抑菌活性显著增加,推测这4 株菌可能为细菌素产生的诱导菌。诱导菌的死菌悬浮液、发酵上清液对Weissella sp. Br26细菌素的合成无影响,推断活的诱导菌是影响细菌素合成的主要因素。
[1] DEEGAN L H, COTTER P D, HILL C, et al. Bacteriocins: biological tools for bio-preservation and shelf-life extension[J]. International Dairy Journal, 2006, 16(9): 1058-1071. DOI:10.1016/ j.idairyj.2005.10.026.
[2] GAUTAM N, SHARMA N. A study on characterization of new bacteriocin produced from a novel strain of Lactobacillus spicheri G2 isolated from Gundruk-a fermented vegetable product of North East India[J]. Journal of Food Science and Technology, 2015, 52(9): 5808-5816. DOI:10.1007/s13197-015-1710-x.
[3] SABO S D S, VITOLO M, GONZÁLEZ J M D, et al. Overview of Lactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria[J]. Food Research International, 2014, 64: 527-536. DOI:10.1016/j.foodres.2014.07.041.
[4] RAO K P, CHENNAPPA G, SURAJ U, et al. Probiotic potential of Lactobacillus strains isolated from sorghum-based traditional fermented food[J]. Probiotics and Antimicrobial Proteins, 2015, 7(2): 1-11. DOI:10.1007/s12602-015-9186-6.
[5] GUO Yaoqi, YU Zhanqiao, XIE Jianhua, et al. Identification of a new Bacillus licheniformis strain producing a bacteriocin-like substance[J]. Journal of Microbiology, 2012, 50(3): 452-458. DOI:10.1007/s12275-012-2051-3.
[6] SALGADO-RUIZ T B, RODRÍGUEZ A, GUTIÉRREZ D, et al. Molecular characterization and antimicrobial susceptibility of Staphylococcus aureus from small-scale dairy systems in the highlands of central Mexico[J]. Dairy Science and Technology, 2015, 95(2): 181-196. DOI:10.1007/s13594-014-0195-0.
[7] SEO S H, JUNG M, WANG J K. Antilisterial and amylase-sensitive bacteriocin producing Enterococcus faecium SH01 from Mukeunji, a Korean over-ripened kimchi[J]. Food Science and Biotechnology, 2014, 23(4): 1177-1184. DOI:10.1007/s10068-014-0161-x.
[8] El-GHAISH S, EL-BAZ A, HWANHLEM N, et al. Bacteriocin production and safety evaluation of non-starter Enterococcus faecium IM1 and Enterococcus hirae IM1 strains isolated from homemade Egyptian dairy products[J]. European Food Research and Technology, 2015, 240(6): 1211-1223. DOI:10.1007/s00217-015-2424-z.
[9] SIRINAT S, FUJITOSHI Y, LI H L, et al. Weissellicin 110, a newly discovered bacteriocin from Weissella cibaria 110, isolated from plaa-som, a fermented fish product from Thailand[J]. Applied and Environmental Microbiology, 2007, 73(7): 2247-2250. DOI:10.1128/ AEM.02484-06.
[10] MARIA P, PAPAMICHAEL E M. Purification, amino acid sequence and characterization of the class Ⅱa bacteriocin weissellin A, produced by Weissella paramesenteroides DX[J]. Bioresource Technology, 2011, 102(12): 6730-6734. DOI:10.1016/j.biortech.2011.03.106.
[11] MASUDA Y, ZENDO T, SAWA N, et al. Characterization and identification of weissellicin Y and weissellicin M, novel bacteriocins produced by Weissella hellenica QU 13[J]. Journal of Applied Microbiology, 2012, 112(1): 99-108. DOI:10.1111/j.1365-2672.2011.05180.x.
[12] LEONG H K, CHEN Y S, L H Y, et al. Weissellicin L, a novel bacteriocin from sian-sianzih-isolated Weissella hellenica 4-7[J]. Journal of Applied Microbiology, 2013, 115(1): 70-76. DOI:10.1111/ jam.12218.
[13] NAKAYAMA J, CAO Y, HORII T, et al. Gelatinase biosynthesisactivating pheromone: a peptide lactone that mediates a quorum sensing in Enterococcus faecalis[J]. Molecular Microbiology, 2001, 41(1): 145-154. DOI:10.1046/j.1365-2958.2001.02486.x.
[14] CAGNO R D, ANGELIS M D, CALASSO M, et al. Quorum sensing in sourdough Lactobacillus plantarum DC400: induction of plantaricin A (PlnA) under co-cultivation with other lactic acid bacteria and effect of PlnA on bacterial and Caco-2 cells[J]. Proteomics, 2010, 10(11): 2175-2190. DOI:10.1002/pmic.200900565.
[15] 马晨晨, 李柏林, 欧杰. 食源性细菌的群体感应效应[J]. 食品科学, 2008, 29(9): 643-647. DOI:10.3321/j.issn:1002-6630.2008.09.156.
[16] 塔娜, 贺银凤. 粪肠球菌的群体感应现象[J]. 食品工业科技, 2013, 34(19): 119-121.
[17] 葛菁萍, 房保柱, 苑婷婷, 等. 副干酪乳杆菌HD1.7群体感应行为[J].微生物学报, 2011, 51(11): 1561-1567.
[18] MAN Lili, MENG Xiangchen, ZHAO Rihong. Induction of plantaricin MG under co-culture with certain lactic acid bacterial strains and identification of LuxS mediated quorum sensing system in Lactobacillus plantarum KLDS1.0391[J]. Food Control, 2012, 23(2): 462-469. DOI:10.1016/j.foodcont.2011.08.015.
[19] 张香美, 张宝, 李平兰. 戊糖乳杆菌群体感应信号肽AIP的纯化及鉴定[J]. 中国食品学报, 2015, 15(3): 201-206. DOI:10.16429/j.1009-7848.2015.03.027.
[20] 孙芝兰, 孔文涛, 孔健. Paenibacillus sp. K1乳糖酶基因bga在乳酸乳球菌中的表达[J]. 山东大学学报(理学版), 2008, 43(7): 74-77.
[21] 张旭, 赵斌, 张香美, 等. 产细菌素乳酸菌的筛选及细菌素相关基因的分析[J]. 中国农业大学学报, 2013, 18(4): 168-177. DOI:10.11841/ j.issn.1007-4333.2013.04.26.
[22] 吴惠芬, 毛胜勇, 姚文, 等. 猪源乳酸菌产乳酸及其抑菌特性研究[J]. 微生物学通报, 2005, 32(1): 79-84. DOI:10.3969/ j.issn.0253-2654.2005.01.016.
[23] 张小美, 楼秀玉, 顾青. 1 株产细菌素乳酸菌的鉴定和细菌素的分离纯化[J]. 中国食品学报, 2013, 13(12): 181-187.
[24] HONG J, QUAN L H, HEU S, et al. A new antimicrobial substance produced by Staphylococcus pasteuri isolated from vegetables[J]. Food Science & Biotechnology, 2014, 23(3): 983-990. DOI:10.1007/ s10068-014-0133-1.
[25] CHEN Cen, CHEN Xiaohong, JIANG Mei, et al. A newly discovered bacteriocin from Weissella hellenica D1501 associated with Chinese Dong fermented meat (Nanx Wudl)[J]. Food Control, 2014, 42(2): 116-124. DOI:10.1016/j.foodcont.2014.01.031.
Identification of Bacteriocin-Producing Lactic Acid Bacteria and Induction of Bacteriocin Synthesis
WANG Xiaomeng1,2, JIANG Yun1,*, SUN Zhilan2, LIU Fang2, WANG Daoying2, ZHU Yongzhi2, GENG Zhiming2, XU Weimin2,3
(1. Department of Food Science, Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 3. Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control, Nanjing 210095, China)
The strain Br26 with antibacterial activity was screened from fermented garlic. Different proteases were selected to determine whether the strain is bacteriocin-producing bacterium. Subsequently, the induction efficiency of bacteriocin synthesis by the fermentation supernatant of Br26 alone and co-cultures with other lactic acid bacteria was determined. The results showed the inhibitory activity of the fermentation supernatant of Br26 decreased after treatment with pepsin and papain, respectively, suggesting that the antimicrobial substance is bacteriocin. The strain was identified as Weissella sp. Br26 by 16S rDNA gene sequence homology analysis. The inhibitory activity disappeared when Br26 was cultured in 1/4 MRS at 42 ℃; however, it was significantly increased after adding fermentation supernatants at different growth phases, indicating that bacteriocin biosynthesis can be self-induced. On the other hand, although there were no significant changes in the pH values of fermentation supernatants, bacteriocin activity of Br26 was significantly increased after co-culturing with Lactobacillus crispatus, Lactobacillus helveticus, Lactobacillus paracasei and Leuconostoc mesenteroides, indicating that the synthesis of bacteriocin can also be induced by other lactic acid bacteria. In summary, bacteriocin synthesis of Weissella sp. Br26 can be induced by itself and other lactic acid bacteria.
Weissella sp. Br26; bacteriocin; quorum sensing
10.7506/spkx1002-6630-201621029
TS201.3
A
1002-6630(2016)21-0170-06
王筱梦, 江芸, 孙芝兰, 等. 1 株产细菌素乳酸菌的鉴定及所产细菌素的诱导合成现象[J]. 食品科学, 2016, 37(21): 170-175. DOI:10.7506/spkx1002-6630-201621029. http://www.spkx.net.cn
WANG Xiaomeng, JIANG Yun, SUN Zhilan, et al. Identification of bacteriocin-producing lactic acid bacteria and induction of bacteriocin synthesis[J]. Food Science, 2016, 37(21): 170-175. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621029. http://www.spkx.net.cn
2016-01-15
江苏省农业科技自主创新资金项目(CX(14)2117);国家自然科学基金面上项目(31371802)
王筱梦(1992—),女,硕士研究生,研究方向为肉品安全与质量控制。E-mail:625196221@qq.com
*通信作者:江芸(1971—),女,教授,博士,研究方向为肉品安全与质量控制。E-mail:jiangyun@njnu.edu.cn

