微波辅助法制备氢氧化镍-石墨烯纳米复合结构及在葡萄糖检测中的应用
胡耀娟, 黄梦丹, 陈昌云, 张长丽
(南京晓庄学院环境科学学院, 南京 211171)
微波辅助法制备氢氧化镍-石墨烯纳米复合结构及在葡萄糖检测中的应用
胡耀娟, 黄梦丹, 陈昌云, 张长丽
(南京晓庄学院环境科学学院, 南京 211171)
采用微波辅助合成法制备了氢氧化镍-石墨烯[Ni(OH)2-graphene]纳米复合结构, 利用扫描电子显微镜(SEM)、 X射线光电子能谱(XPS)、 电子能谱(EDS)、 X射线衍射(XRD)及电化学阻抗谱(EIS)对其结构和性质进行了表征. 电化学实验结果表明, 与单独的Ni(OH)2相比, Ni(OH)2-graphene纳米复合结构对葡萄糖氧化反应表现出更高的电催化活性; 同时, 据此构建的无酶葡萄糖传感器具有良好的性能, 检测线性范围为10 μmol/L~7.5 mmol/L, 灵敏度为174.7 μA·cm-2·mmol·L-1, 检出限为2.0 μmol/L(S/N=3), 且该传感器具有良好的稳定性和选择性, 可用于实际样品检测.
氢氧化镍-石墨烯复合结构; 微波辅助法; 无酶葡萄糖传感器
葡萄糖是生命体新陈代谢过程中的重要化合物, 血糖的分析与传感对人类的健康及疾病的诊断和治疗具有重要意义, 因此, 制备高效的葡萄糖传感器具有重要的科学研究意义和实际应用价值[1,2]. 目前, 应用最广泛的是酶类葡萄糖电化学传感器, 它具有选择性好、 响应速率快和灵敏度高等优点; 然而, 酶容易失活, 且受温度和外界条件的影响较大, 从而导致酶类葡萄糖传感器制作过程复杂、 成本高且使用寿命短, 限制了此类传感器的应用[3,4]. 无酶葡萄糖电化学传感器是利用葡萄糖在电极表面的直接氧化电流进行检测的, 它克服了酶传感器对酶活性的依赖, 具有高的稳定性、 良好的重现性及低廉的价格等优点[5~7]. 随着纳米材料制备技术的发展, 已有多种纳米材料被引入葡萄糖电化学传感器的研制, 该方法除了可将纳米材料本身的物化特性引入电极界面, 还可拥有纳米材料的大比表面积, 粒子表面具有较多的功能基团等特性, 从而可对葡萄糖及其糖类化合物的电化学行为产生催化效应[8,9]. 最先用于葡萄糖检测的为贵金属纳米材料, 如Pt, Au和Pd等[10,11], 以及其合金Pt-Au和Pt-Pd等[12,13]; 此外, 过渡族金属, 如铜系、 镍系的纳米材料也被用于葡萄糖的无酶检测, 改善了贵金属价格昂贵的不足[14,15]. 石墨烯作为一种碳原子紧密堆积成单层二维蜂窝状晶格结构的碳质新型材料, 具有比表面积大、 导电率高等物理化学性质, 将铜系、 镍系等材料负载到石墨烯表面, 不仅可克服这些半导体材料导电性较差的缺点, 还可改善纳米材料的结构及其分散性, 有利于进一步提高其电催化性能[16~18]. 镍的氢氧化物中含有二价阳离子(Ni2+), 可有效吸附酶、 氨基酸和生物小分子等; 另外, 氢氧化镍在碱性环境中会生成Ni(OH)2/NiOOH氧化还原电对, 其中较高价态的羟基氧化物(NiOOH)对葡萄糖具有良好的电催化氧化作用[19~21].
Zhang等[20]采用水热法合成了片状结构的氢氧化镍-石墨烯纳米复合材料. 本文利用微波辅助法制备了氢氧化镍-石墨烯[Ni(OH)2-graphene]纳米结构, 该方法快速、 高效且低耗能, 且负载到石墨烯表面的Ni(OH)2形成了独特的二维花瓣状网络结构, 具有较大的比表面积, 更有利于对葡萄糖的电催化氧化; 据此构建了无酶葡萄糖传感器, 并对血清样品中的葡萄糖含量进行了检测.
1 实验部分
1.1 试剂与仪器
六水合硝酸镍[Ni(NO3)2·6H2O]、 尿素、 十六烷基三甲基溴化铵(CTAB)和抗坏血酸(AA)等均为分析纯, 购自上海化学试剂公司; 石墨烯(Graphene)购自南京先锋科技股份有限公司; 葡萄糖和多巴胺(DA)购自Alfa Aesar公司; 配制的葡萄糖溶液需放置24 h后再使用; 其它试剂均为分析纯; 实验用水为二次蒸馏水.
CEM-Discover型微波合成仪(美国CEM公司); CHI660D型电化学工作站( 上海辰华仪器公司); Su8010型扫描电子显微镜(日本电子公司).
1.2 实验过程
1.2.1 Ni(OH)2-graphene纳米复合结构的制备 将2.0 mg 石墨烯、 1.0 g CTAB和100 mL 去离子水置于250 mL 烧杯中, 搅拌30 min; 然后向烧杯中加入一定量的Ni(NO3)2·6H2O和沉淀剂尿素[尿素与Ni(NO3)2·6H2O的摩尔比为2∶1], 继续搅拌30 min. 将混合物转入微波玻璃管中, 装填度不超过50%, 放入微波仪中, 于120 ℃及483 kPa压强下反应20 min, 冷却至室温得到灰色沉淀; 依次用去离子水和无水乙醇离心洗涤3~4次, 即得Ni(OH)2-graphene纳米复合结构[22]. 为了便于比较, 采用相同方法在不加石墨烯的情况下, 制备了单独的Ni(OH)2纳米材料.
1.2.2 修饰电极的制备 先将玻碳电极(GCE, d=3 mm)依次用6号砂纸、 0.3和0.05 μm的Al2O3粉抛光至镜面, 然后用无水乙醇和二次蒸馏水各超声清洗1 min, 最后用二次蒸馏水将电极冲洗干净, 室温下晾干备用. 将制得的纳米材料分散到蒸馏水中, 分别取6 μL Ni(OH)2-graphene和Ni(OH)2分散液滴涂到预处理过的玻碳电极表面, 室温下自然晾干备用, 即制得Ni(OH)2-graphene/GCE和Ni(OH)2/GCE.
1.2.3 电化学测试 循环伏安和安培响应实验在电化学工作站上进行, 采用三电极系统, 以螺旋状铂丝和饱和甘汞电极(SCE)分别作为对电极和参比电极(文中给出的电位均相对于SCE). 制备的电极对葡萄糖的氧化反应在0.1 mol/L NaOH溶液中进行, 实验前需对缓冲溶液通高纯氮至少30 min, 且在实验过程中要一直保持通氮除氧.
电化学阻抗谱(EIS)的测定在Autolab电化学分析仪上进行, 测定的频率范围为10-2~105Hz, 电化学探针为含5.0 mmol/L K3Fe(CN)6/K4Fe(CN)6的0.1 mmol/L KCl溶液. 所有的电化学实验均在室温 [(23±2) ℃] 下进行.
2 结果与讨论
2.1 Ni(OH)2和Ni(OH)2-graphene纳米材料的表征
图1分别为Ni(OH)2纳米颗粒和Ni(OH)2-graphene纳米复合结构的SEM照片. 从图1(A)可以看出, 制备的Ni(OH)2为球状结构, 且有团聚现象; 由放大的SEM照片[图1(B)]可知其颗粒直径约为300 nm, 且形成了致密的表面结构; 然而加入石墨烯后, 原本表面致密的Ni(OH)2球状结构变成了表面疏松的二维花瓣状网络结构, 且均匀地负载到了石墨烯表面[图1(C)和(D)]. 利用XPS能谱对石墨烯进行了表征, 通过对C1s峰进行拟合分析(图S1, 见本文支持信息), 发现石墨烯表面含有不同的含氧官能团, 这些含氧官能团不仅改善了Ni(OH)2纳米结构的分散性, 还改变了其表面形貌, 而该表面疏松的二维花瓣状网络结构具有较大的比表面积, 有利于提高其催化活性.
图2分别为Ni(OH)2和Ni(OH)2-graphene的XRD谱图. 由谱线a可见, 在2θ=12.2°, 24.6°, 33.3°, 37.1°和59.5°处出现衍射峰, 分别对应于α-Ni(OH)2的(003), (006), (100), (101)和(110)晶面(JCPDS No.22-752), 未检测出其它衍射峰, 表明制备的纳米结构为α-Ni(OH)2; 谱线b中除了出现α-Ni(OH)2的特征衍射峰外, 在2θ=43.1°处出现了C(100)特征峰, 说明已制得α-Ni(OH)2-graphene复合纳米结构[23]. 进一步利用EDS对合成的纳米复合结构进行了元素组分分析(图S2, 见本文支持信息), 结果表明存在C, O和Ni 3种元素, 其中Ni的含量为18.31%(原子分数).

Fig.1 SEM images of Ni(OH)2(A, B) and Ni(OH)2-graphene nanostructures(C, D)
为了研究对Ni(OH)2及Ni(OH)2-graphene复合结构修饰电极的表面性质, 利用电化学阻抗谱(EIS)对这2种电极进行了表征. 在电化学阻抗谱图中, 高频部分的半圆对应于电子传输过程, 其直径大小相当于电子传输阻力Ret, 反映了电化学探针与电极之间进行电子传输的动力学性质. 由图3可见, Ni(OH)2-graphene修饰电极的半径比Ni(OH)2修饰电极的半径要小得多, 说明Ni(OH)2-graphene更有利于电化学探针的电子迁移, 这是由于石墨烯的加入增大了材料的导电性, 更有利于电化学探针在电极表面的电子传递.
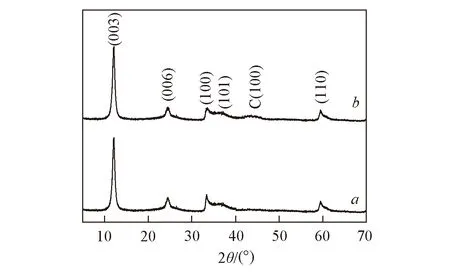
Fig.2 Typical XRD patterns of Ni(OH)2(a) and Ni(OH)2-graphene nanostructures(b)

Fig.3 EIS of Ni(OH)2/GCE(a) and Ni(OH)2-graphene/GCE(b) in 0.1 mol/L KCl electrolyte solution containing 5.0 mmol/L K3Fe(CN)6/K4Fe(CN)6
2.2 不同修饰电极的电化学特征

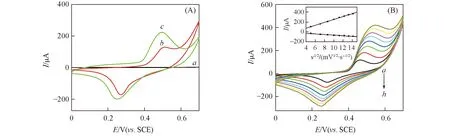
Fig.4 CVs of the bare GCE(a), Ni(OH)2/GCE(b) and Ni(OH)2-graphene/GCE(c) in 0.1 mol/L NaOH solution at scan rate of 50 mV/s(A) and CVs of Ni(OH)2-graphene/GCE in 0.1 mol/L NaOH solution at different scan rates(B)(B) Scan rate/(mV·s-1), a—h: 25, 50, 75, 100, 125, 150, 175, 200. Inset of (B) is plot of the peak current vs. the square root of scan rate.
图4(B)示出了Ni(OH)2-graphene修饰电极在不同扫描速率下的循环伏安曲线. 可见, 随着扫速的增加, 氧化峰电流和还原峰电流都随之增大, 且氧化峰电位逐渐正移, 还原峰电位逐渐负移; 且氧化还原峰电流值与扫速的平方根呈线性关系, 表明Ni(OH)2/NiOOH在电极表面发生的氧化还原反应是受OH-在电解质溶液与电极之间扩散控制的电化学过程[19].
2.3 葡萄糖在不同修饰电极表面的电催化氧化
图5(A)和(B)分别为Ni(OH)2/GCE和Ni(OH)2-graphene/GCE在空白0.1 mol/L NaOH溶液(曲线a)和含有10 mmol/L葡萄糖的NaOH溶液中(曲线b)的循环伏安曲线. 可见, 加入葡萄糖后, 氧化峰电流明显增大, 而还原峰电流减小, 表明修饰电极对葡萄糖氧化反应具有明显的电催化作用, 电催化机理如下[20]:

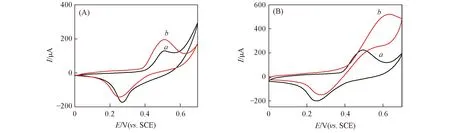
Fig.5 CVs of Ni(OH)2/GCE(A) and Ni(OH)2-graphene/GCE(B) in 0.1 mol/L NaOH without(a) and with(b) 10 mmol/L glucose The scan rate is 50 mV/s.
比较图5(A)和(B)可以看出, 由于石墨烯的加入, 葡萄糖的氧化峰电流明显增大, 这可能是由于石墨烯具有优异的导电性, 能够提高Ni(OH)2与电极表面之间的电子转移所致; 而且将Ni(OH)2负载到石墨烯表面后, Ni(OH)2纳米材料的形貌发生了很大改变, 与石墨烯形成了二维花瓣状的网络复合结构, 增加了催化剂的比表面积, 有利于提高催化剂的催化活性.
2.4 电极的葡萄糖检测性能
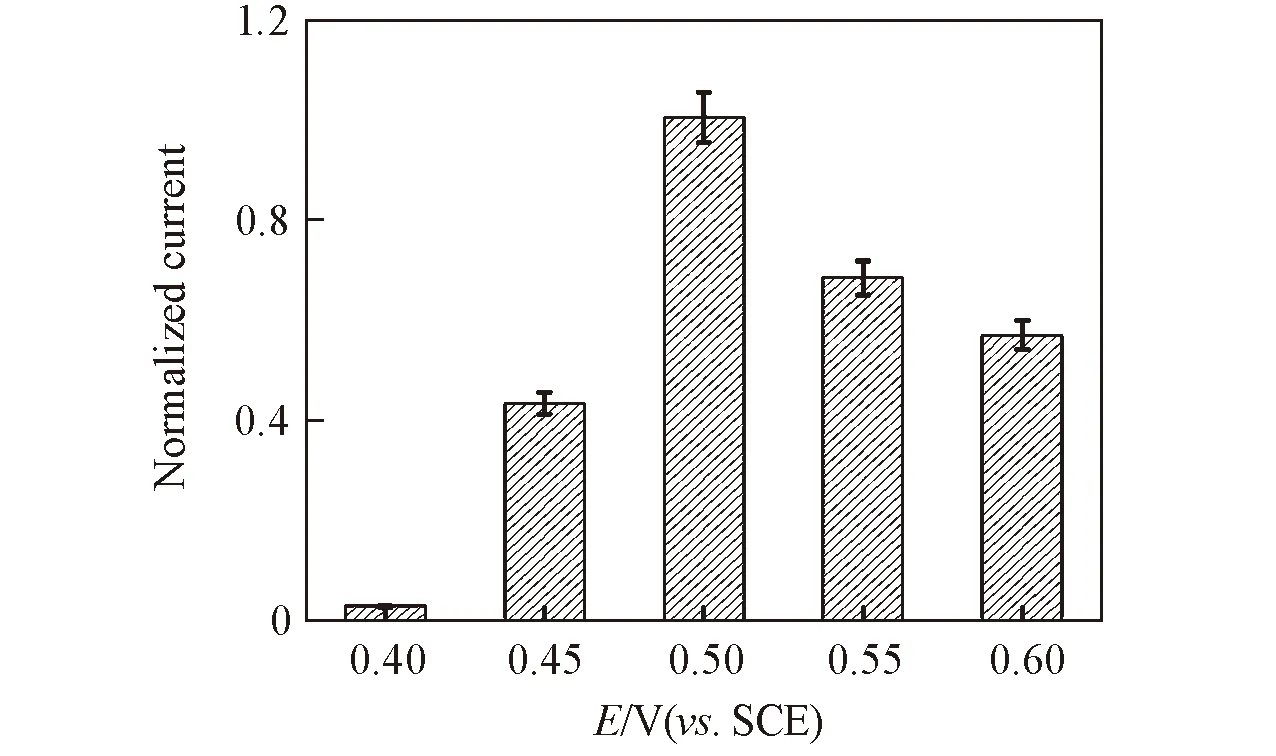
Fig.6 Dependence of the response of electrocatalytic oxidation of 1 mmol/L glucose at Ni(OH)2-graphene/GCE on the detection potential
将Ni(OH)2-graphene修饰电极用于无酶葡萄糖检测, 首先考察了不同检测电位下1 mmol/L葡萄糖的响应电流. 如图6所示, 随着检测电位的正移, 葡萄糖氧化电流先增大后减小, 在0.50 V处达到最大值, 因此实验选择0.50 V为最佳检测电位.
图7示出了Ni(OH)2-graphene修饰电极在0.1 mol/L的NaOH溶液中对葡萄糖的安培响应. 由图7(A)可见, 葡萄糖在Ni(OH)2-graphene修饰电极表面响应迅速, 达到95%响应值的时间为2~3 s; 由图7(B)可见, Ni(OH)2-graphene修饰电极对葡萄糖响应的线性范围为0.01~7.5 mmol/L, 响应灵敏度为174.7 μA·cm-2·mmol·L-1, 相关系数为0.9992, 检出限为2.0 μmol/L(S/N=3).
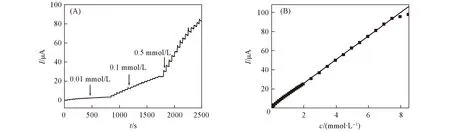
Fig.7 Amperometric response of Ni(OH)2-graphene/GCE to successive addition of glucose in NaOH at the applied potential of 0.50 V(A) and calibration curve for glucose obtained at the electrode(B)
为了评价该传感器的性能, 比较了单独的Ni(OH)2纳米材料以及近期报道的无酶葡萄糖传感器的检测性能. 由表1可见, 此传感器具有较高的灵敏度、 较宽的线性范围和较低的检出限. 此结果表明, Ni(OH)2-graphene修饰电极对葡萄糖具有良好的催化作用, 其主要原因是将Ni(OH)2纳米结构负载到石墨烯表面, 不仅加快了底物的电子传递速率, 而且形成的独特二维花瓣状网络结构增大了Ni(OH)2电极的电催化活性面积, 从而提高了该纳米复合结构对葡萄糖的检测性能.
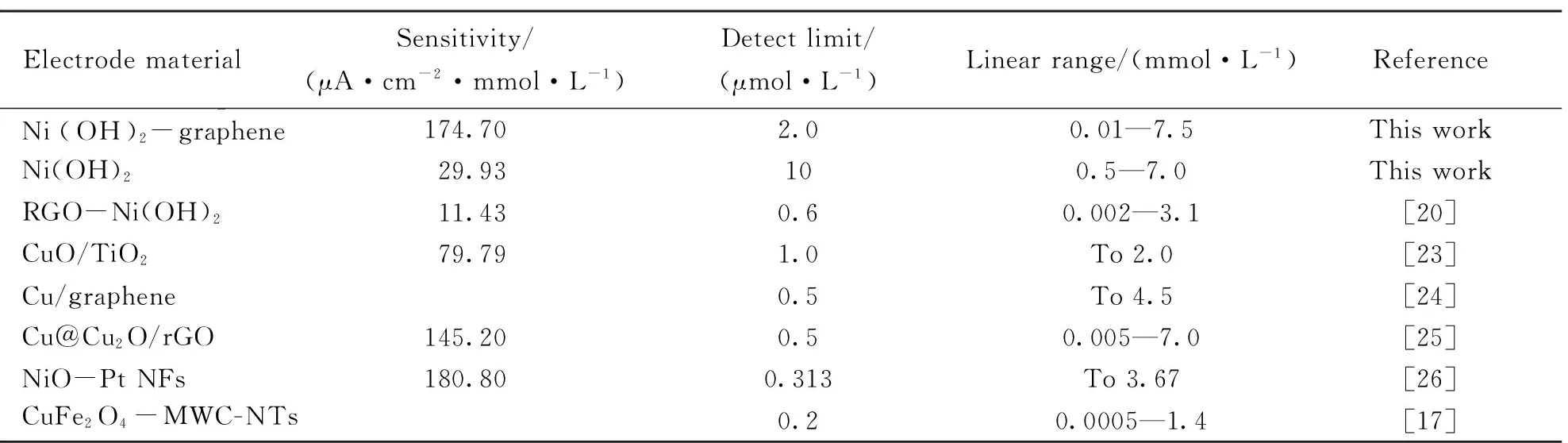
Table 1 Analytical parameters obtained at different glucose sensors
2.5 电极的稳定性和选择性
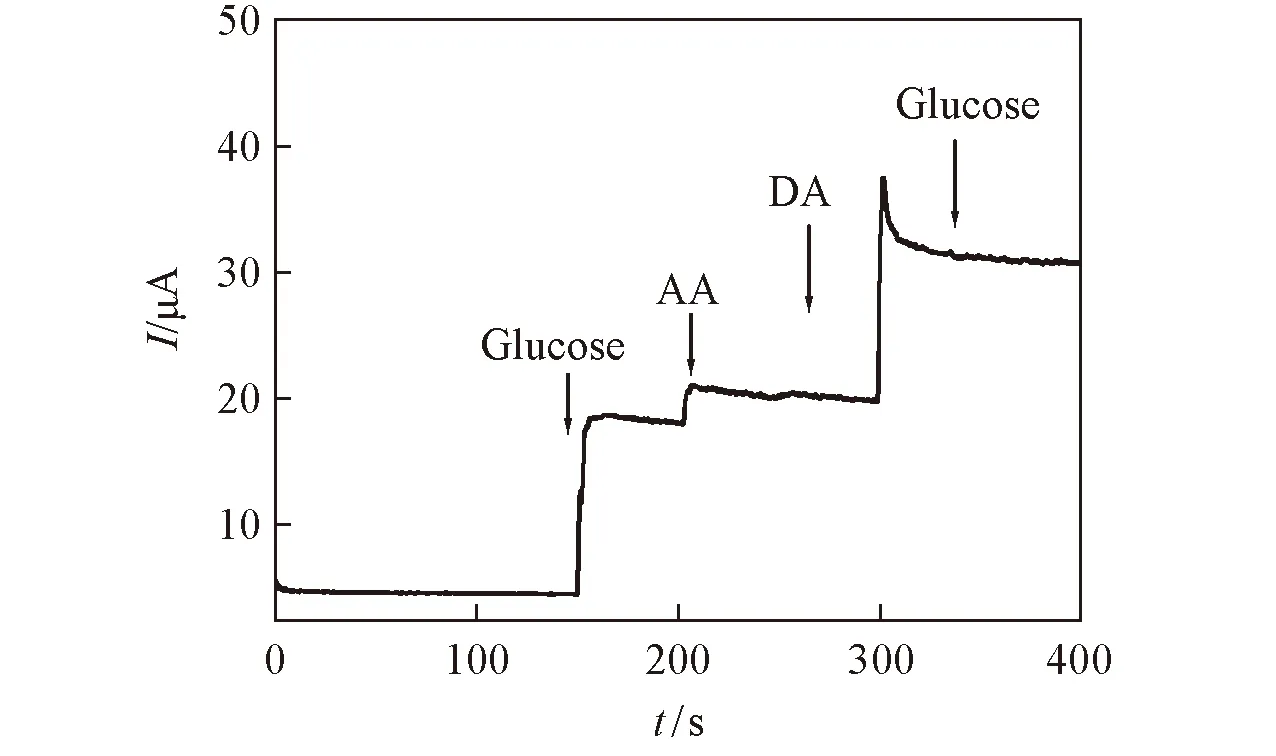
Fig.8 Amperometric responses of the Ni(OH)2-graphene/GCE to 1 mmol/L glucose, 0.1 mmol/L AA and 0.1 mmol/L DA at an applied potential of 0.50 V
为考察电极的重现性和稳定性, 用同一根Ni(OH)2-graphene/GCE对10 mmol/L的葡萄糖溶液平行测定5次, 相对标准偏差(RSD)为3.20%; 用相同方法制备5根Ni(OH)2-graphene/GCE并分别对同一葡萄糖溶液进行检测, 其RSD为3.62%, 表明该电极具有良好的重现性. 将该电极于4 ℃下放置1个月后, 该电极的电化学响应信号仍为初始信号的96%, 说明该电极具有良好的稳定性.
在实际样品中有许多电化学活性物质, 如抗坏血酸(AA)、 多巴胺(DA)等会干扰葡萄糖的检测, 为了考察该传感器的选择性, 在最佳检测电位(0.50 V)下, 对AA和DA进行了干扰测定. 图8结果表明, 在葡萄糖浓度为1 mmol/L时, 0.1 mmol/L的AA和0.1 mmol/L的DA所产生的干扰电流可以忽略不计; 当继续加入1 mmol/L葡萄糖时, 其响应电流几乎无变化, 说明基于Ni(OH)2-graphene修饰电极制备的葡萄糖传感器对葡萄糖具有良好的选择性.
2.6 实际样品测定
为了验证所构建传感器的实际应用性能, 将其用于人血清中葡萄糖的检测; 为了进一步检验该传感器的可靠性, 采用市售的血糖分析仪对同样的血清样品进行了检测. 表2结果表明, 2种方法的测定结果接近, 说明所构建的无酶葡萄糖传感器可用于实际样品分析.
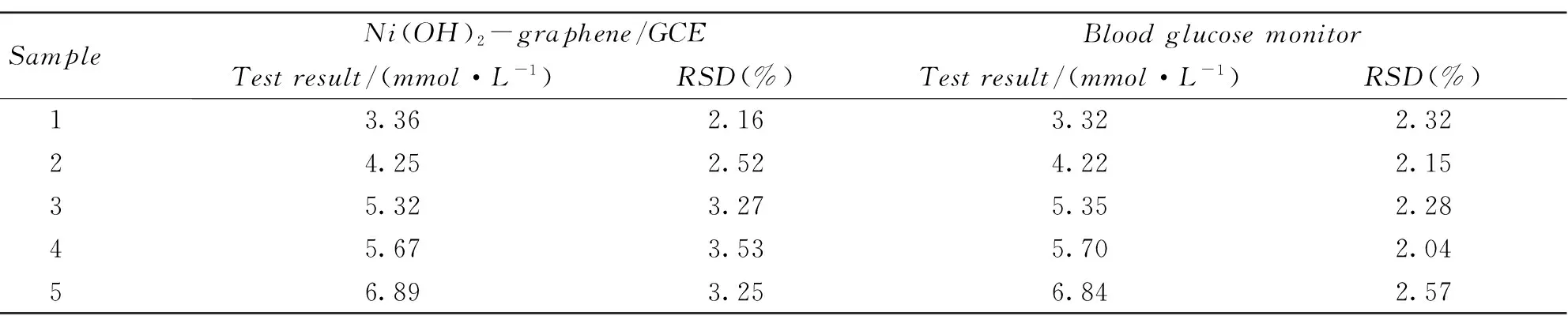
Table 2 Determination of glucose concentration in the blood sample by Ni(OH)2-graphene/GCE(n=5)
3 结 论
利用微波辅助合成法制备了具有独特二维花瓣状网络结构的Ni(OH)2-graphene复合材料. 由于Ni(OH)2独特的二维花瓣状网络结构与石墨烯大的比表面积和高电导率的协同作用, 该纳米复合结构对葡萄糖氧化反应表现出了优异的电催化活性, 据此构建的无酶葡萄糖传感器具有线性范围宽、 灵敏度高及检出限低等优点, 同时具有良好的稳定性和选择性, 可用于实际样品的分析检测.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20150593.
[1] Lin K. C., Hung Y. T., Chen S. M., RSC Adv., 2015, 5, 2806—2812
[2] Hui N., Wang W., Xu G., Luo X., J. Mater. Chem. B, 2015, 3, 556—561
[3] Cheng T., Huang T., Lin H., Tung S., Chen Y., Lee C., Chiu H., ACS Appl. Mater. Inter., 2010, 2, 2773—2780
[4] Yoon S. S., Ramadoss A., Saravanakumar B., Kim S. J., J. Electroanal. Chem., 2014, 717/718, 90—95
[5] Wei C., Li X., Xu F., Tan H., Li Z., Sun L., Song Y., Anal. Methods, 2014, 6, 1550—1557
[6] Wang L., Lu X., Wen C., Xie Y., Miao L., Chen S., Li H., Li P., Song Y., J. Mater. Chem. A, 2015, 3, 608—616
[7] Wang Q., Wang Q., Li M., RSC Adv., 2015, 5, 15861—15869
[8] Noh H., Naveen M. H., Choi Y., Choe E. S., Shim Y., Chem. Commun., 2015, 51, 6659—6662
[9] Kong C., Tang L., Zhang X., Sun S., Yang S., Song X., Yang Z., J. Mater. Chem. A, 2014, 2, 7306—7312
[10] Park S., Chung T. D., Kim H. C., Anal. Chem., 2003, 75(13), 3046—3049
[11] Yuan J. H., Wang K., Xia X. H., Adv. Funct. Mater., 2005, 15, 803—809
[12] Zhang H., Xu X., Yin Y., Wu P., Cai C., J. Electroanal. Chem., 2013, 690, 19—24
[13] Hu Y., He F., Ben A., Chen C., J. Electroanal. Chem., 2014, 726, 55—61
[14] Xin H., Chen L. B., Shi H. Y., Song W. B., Liu T. M., Chem. J. Chinese Universities, 2014, 35(3), 482—487(辛华, 陈丽波, 史鸿雁, 宋文波, 刘铁梅. 高等学校化学学报, 2014, 35(3), 482—487)
[15] Chang Y. B., Yang G. M., Xu F., Yang Y. H., J. Anal. Sci., 2012, 28(5), 669—672(常艳兵, 杨光明, 徐凤, 杨云慧. 分析科学学报, 2012, 28(5), 669—672)
[16] Kim W., Lee G., Ryu J., Park K., Park H., RSC Adv., 2014, 4, 48310—48316
[17] Zhang Y., Zhou E., Li Y., He X., Anal. Methods, 2015, 7, 2360—2366
[18] Liu Y., Zhang Y., Chen J., Pang H., Nanoscale, 2014, 6, 10989—10994
[19] Zhan B., Liu C., Chen H., Shi H., Wang L., Chen P., Huang W., Dong X., Nanoscale, 2014, 6, 7424—7429
[20] Zhang Y., Xu F., Sun Y., Shi Y., Wen Z., Li Z., J. Mater. Chem., 2011, 21, 16949—16954
[21] Luo Z., Yin S., Wang K., Li H., Wang L., Xu H., Xia J., Mater. Chem. Phys., 2012, 132, 387—394
[22] Xian Q. L., Li J., J. Inorg. Mater., 2010, 25(12), 1268—1272(鲜青龙, 李娟. 无机材料学报, 2010, 25(12), 1268—1272)
[23] Luo S., Su F., Liu C., Li J., Liu R., Xiao Y., Li Y., Liu X., Cai Q., Talanta, 2011, 86, 157—163
[24] Luo J., Jiang S., Zhang H., Jiang J., Liu X., Anal. Chim. Acta, 2012, 709, 47—53
[25] Huo H., Guo C., Li G., Han X., Xu C., RSC Adv., 2014, 4, 20459—20465
[26] Dinga Y., Liu Y., Zhang L., Wanga Y., Bellagamba M., Parisi J., Li C. M., Lei Y., Electrochim. Acta, 2011, 58, 209— 214
(Ed.: N, K)
† Supported by the National Natural Science Foundation of China(No. 21401106), the Natural Science Foundation of Jiangsu Province, China(No. BK20140090), the Open Project of Jiangsu Key Laboratory of New Power Batteries, China(No. Power-2013-1), the Jiangsu Provincial Undergraduate Innovation Training Programs, China(No. 201411460046X) and the Key Research Project of Nanjing Xiaozhuang University, China(No. 2015NXY02).
Microwave-assisted Fabrication of Nickel Hydroxide-Graphene Nanostructures and Their Application in Electrochemical Detection of Glucose†
HU Yaojuan*, HUANG Mengdan, CHEN Changyun, ZHANG Changli
(School of Environmental Science, Nanjing Xiaozhuang University, Nanjing 211171, China)
The nickel hydroxide-graphene[Ni(OH)2-graphene] nanostructures were fabricated by facile microwave method, and the structure and electrocatalytic activities of the synthesized nanostructures were characterized via scanning electron microscopy(SEM), X-ray photoelectron spectroscopy(XPS), X-ray powder diffraction(XRD), energy-dispersive spectroscopy(EDS), electrochemical impedance spectroscopy(EIS) and cyclic voltammetry. The results indicated that the Ni(OH)2-graphene nanotructures exhibited a higher electrocatalytic activity than the Ni(OH)2nanoparticles. A glucose nonenzyme sensor was developed based on the Ni(OH)2-graphene nanotructures. The sensor exhibited a low detection limit of 2 μmol/L, a wide linear range from 0.01 to 7.5 mmol/L, and a high sensitivity of 174.7 μA·cm-2·mmol·L-1. In addition, the sensor exhibited excellent stability and selectivity for the glucose detection, and it could be used to analyze real samples.
Nickel hydroxide-graphene nanostructure; Microware-assisted method; Nonenzyme glucose sensor
10.7503/cjcu20150593
2015-07-29.
日期: 2015-12-26.
国家自然科学青年基金(批准号: 21401106)、 江苏省自然科学青年基金(批准号: BK20140090)、 江苏省新型动力电池重点实验室开放课题(批准号: Power-2013-1)、 江苏省大学生实践创新训练计划项目(批准号: 201411460046X)和南京晓庄学院重点项目(批准号: 2015NXY02)资助.
O657
A
联系人简介: 胡耀娟, 女, 博士, 讲师, 主要从事电分析方面的研究. E-mail: huyaojuan@njxzc.edu.cn

