蓝莓组织RNA提取方法的研究*
余柯达,叶美娟,陈文荣,朱凯丽,张常晶,郭卫东
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
蓝莓组织RNA提取方法的研究*
余柯达,叶美娟,陈文荣,朱凯丽,张常晶,郭卫东
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
为建立蓝莓组织RNA提取方法,以蓝莓幼果为材料,比较了5种RNA提取方法,建立了改良的十六烷基三甲基溴化铵-乙酸钾(CTAB-KAc)提取方法,并比较了CTAB-KAc法对蓝莓根、成熟叶、幼茎、花、幼果和成熟果实组织RNA的提取效果.结果表明:CTAB-KAc法提取RNA的过程只需3 h,蓝莓幼果RNA的A260/A280和A260/A230值分别达到2.02和2.46,且无基因组DNA污染,RNA产量达到143.37 μg·g-1;用CTAB-KAc法成功提取了蓝莓成熟叶、幼茎、花、幼果和成熟果实组织的RNA,但是根的RNA提取方法还需优化.把上述RNA反转录成cDNA后进行PCR,扩增出预期大小的目的片段,可满足后续分子生物学实验的要求.
蓝莓;RNA提取;十六烷基三甲基溴化铵-乙酸钾法;多糖;逆转录PCR
高质量RNA的提取是进行蓝莓转录组、基因芯片及Northern分析等分子生物学研究的关键前提.由于多年生木本植物含有较多的多糖和多酚、单宁等次生代谢物,其中:多酚会与蛋白质和核酸形成高分子量复合物,减少总RNA的得率[1-3];在醇沉步骤中,多糖会与RNA共沉淀干扰后续的逆转录等反应[3-4].因此,一些常见的RNA提取方法(如Trizol法与十二烷基硫酸钠(SDS)法)和用于提取植物RNA的试剂盒提取的总RNA的含量低且质量差[5-6].目前,越橘属的蓝莓和黑果越桔主要使用LiCl沉淀RNA以分离多糖和DNA,以得到品质较高的总RNA[6-8].但是,LiCl沉淀RNA需要过夜,极其耗时,且不能沉淀小分子RNA,残留的Li+还会抑制RNA的反转录.在提取云杉[9]和酸模[10]等核酸时用醋酸盐可有效去除多糖.Lewinsohn等[11]认为在提取裸子植物RNA时在上清液中加入低浓度的乙醇可有效沉淀多糖;而在提取芒果[12]、铁皮石斛[13]、云杉和白杨[14]RNA时醋酸盐和乙醇结合使用效果更佳.
本研究以蓝莓幼果为实验材料,综合比较了5种不同的RNA提取方法,并用其中效果最佳的十六烷基三甲基溴化铵-乙酸钾(CTAB-KAc)法提取了蓝莓根、成熟叶、幼茎、花、幼果和成熟果实中的RNA,逆转录成cDNA进行PCR,以期为蓝莓不同组织RNA的提取提供有效方法,并为其他木本植物RNA的提取提供借鉴.
1 材料与方法
1.1 实验材料
蓝莓样品于2013年3-6月在浙江师范大学试验基地3年生蓝莓“比洛克西”上取样,田间采集后立即放入冰盒,回实验室后用液氮速冻,置-80 ℃超低温冰箱中备用.本研究以蓝莓根、成熟叶、幼茎、花、幼果和成熟果实为实验材料.
本研究所有试剂和离心管等耗材经0.1%焦碳酸二乙酯(DEPC)水处理24 h,灭菌烘干后使用;研钵、药匙等经180 ℃烘烤6 h.
1.2 RNA提取方法
1.2.1 CTAB-KAc法
取蓝莓幼果材料0.1~0.2 g于研钵中,用液氮研磨成粉末状并快速转移至65 ℃预热的2 mL离心管(含有0.9 mL CTAB提取液:20 g/L CTAB,20 g/L聚乙烯吡咯烷酮(PVP),100 mmol/L Tris-HCl(pH 8.0),25 mmol/L EDTA,2 mol/L NaCl+30 μLβ-巯基乙醇)中,用涡旋震荡仪震荡均匀,于65 ℃水浴中加热10 min,期间颠倒混匀3次;水浴后7 000 r/min离心5 min;取上清液,加入1/3体积的5 mol/L KAc溶液(pH 4.8),混匀后冰浴30 min,再加入700 μLV氯仿∶V异戊醇=24∶1混合试剂,涡旋混匀,4 ℃下12 000 r/min离心5 min;取上清液,加入500 μL水饱和酚溶液(pH 5.2),混匀后再加入500 μLV氯仿∶V异戊醇=24∶1混合试剂,涡旋混匀,4 ℃下12 000 r/min离心5 min;取上清液,加入等体积的V氯仿∶V异戊醇=24∶1混合试剂,涡旋混匀,4 ℃ 12 000 r/min离心5 min;取上清液,加入等体积的异丙醇,混匀后冰浴沉淀30 min,4 ℃ 12 000 r/min离心10 min;去上清,加入1 mL 75%乙醇溶液洗涤沉淀2次,4 ℃ 10 000 r/min离心5 min,室温自然干燥10 min,适量DEPC水溶解,-80 ℃保存备用.
1.2.2 CTAB-EtOH法
将“加入1/3体积的5 mol/L KAc溶液(pH 4.8)”改为“加入1/5体积的无水乙醇”,其他操作按照CTAB-KAc法进行.
1.2.3 CTAB-KAc-EtOH法
将“加入1/3体积的5 mol/L KAc溶液(pH 4.8)”改为“加入1/5体积的无水乙醇和1/10体积的5 mol/L KAc溶液(pH 4.8)”,其他操作按照CTAB-KAc法进行.
1.2.4 SDS-KAc法
取蓝莓幼果材料0.1~0.2 g于研钵中,用液氮研磨成粉末状并快速转移至65 ℃预热的2 mL离心管中(含有0.9 mL SDS提取液:5 g/L SDS,20 g/L PVP,100 mmol/L Tris-HCl(pH 8.0),25 mmol/L EDTA,0.2 mol/L NaCl+30 μLβ-巯基乙醇),用涡旋震荡仪震荡均匀,室温放置5 min,然后7 000 r/min离心5 min;其他操作按照CTAB-KAc法,从“取上清液,加入1/3体积的5 mol/L KAc溶液(pH 4.8)”这步开始进行.
1.2.5 Trizol-KAc法
根据Life Technologies公司提供的操作说明进行并适当改良:取蓝莓幼果材料0.1~0.2 g于研钵中,用液氮研磨成粉末状并快速转移至含有1 mL Trizol试剂的2 mL离心管中,充分混匀,室温放置5 min;加入200 μL氯仿,剧烈振荡15 s,室温放置3 min,4 ℃ 12 000 r/min离心15 min;取上清液,加入1/3体积的5 mol/L KAc溶液(pH 4.8),混匀后冰浴30 min,再加入500 μLV氯仿∶V异戊醇=24∶1混合试剂,剧烈混匀,4 ℃ 12 000 r/min离心15 min;取上清液,加入等体积的异丙醇,轻轻混匀后室温放置10 min,4 ℃ 12 000 r/min离心10 min;去上清,加入1 mL 75%乙醇溶液洗涤沉淀2次,4 ℃ 10 000 r/min离心5 min,自然干燥10 min,适量DEPC水溶解,-80 ℃保存备用.
1.3 CTAB-KAc法提取蓝莓不同组织的RNA
用CTAB-KAc法提取蓝莓根、成熟叶、幼茎、花、幼果和成熟果实6种不同器官的RNA.
1.4 测定方法
用1%琼脂糖凝胶电泳法检测蓝莓总RNA的完整度.RNA的含量和纯度采用NanoDrop2000C测定,记录其浓度、A260/A280和A260/A230的值.
1.5 RT-PCR检测
以蓝莓根、成熟叶、幼茎、花、幼果和成熟果实6种不同器官的RNA为模板,按TaKaRa公司PrimeScriptTM1st Strand cDNA Synthesis Kit操作手册进行cDNA的合成.以上述6种cDNA和蓝莓幼果RNA为模板,并用ddH2O为阴性对照.根据蓝莓过氧化氢酶(CAT)基因序列设计PCR检测所需引物(由上海生工生物工程有限公司合成),上游引物CAT-F:5′-ATGGTGGTTGTTGTGATG-3′,下游引物CAT-R:5′-TGATTTCCTTCGTGCC-3′.PCR反应程序为:94 ℃变性4 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,扩增30个循环;最后72 ℃保温10 min.扩增结束后用1%琼脂糖凝胶电泳检测.
2 结果与分析
2.1 5种方法提取蓝莓果实RNA的比较
5种方法对蓝莓幼果RNA的提取在耗时方面均为3 h以内.除Trizol-KAc法外,其他4种方法从蓝莓果实中提取的总RNA在异丙醇沉淀离心后为白色沉淀,干燥后为无色沉淀;而Trizol-KAc法在异丙醇沉淀离心后为无色胶状沉淀.电泳结果(见图1)表明:CTAB-KAc法、CTAB-EtOH法、CTAB-KAc-EtOH法和SDS-KAc法均能看到蓝莓果实RNA的28S,18S和5S rRNA条带,而Trizol-KAc法几乎看不到rRNA条带;CTAB-EtOH法、CTAB-KAc-EtOH法和SDS-KAc法所提RNA中还存在基因组DNA污染,尤其以CTAB-KAc-EtOH法和SDS-KAc法所提RNA中基因组DNA含量最高;RNA含量和质量方面,以CTAB-KAc法和SDS- KAc法为最佳,尤其是CTAB-KAc法提取的RNA的28S rRNA条带亮度约为18S rRNA条带的2倍,表明所提RNA无降解且较完整.
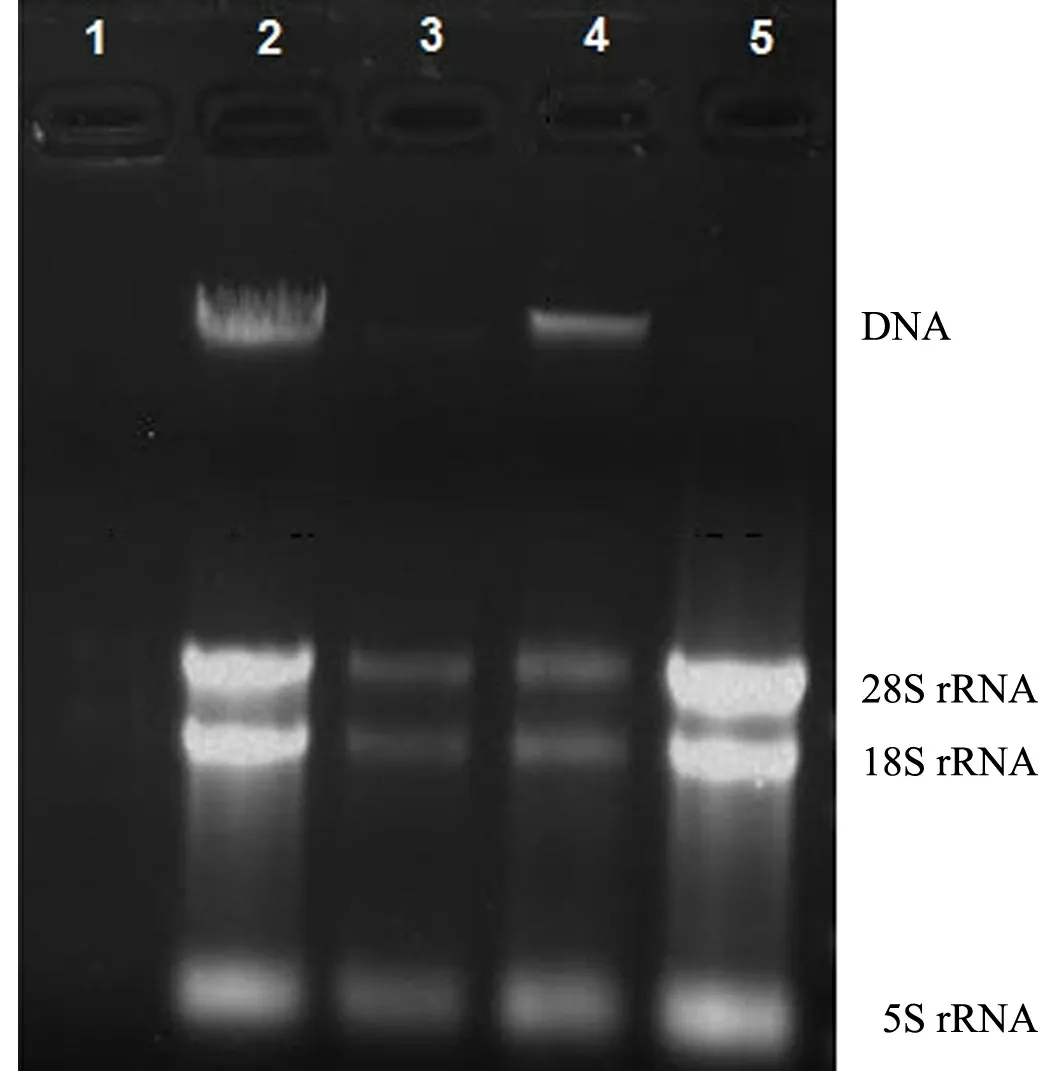
1:Trizol-KAc法;2:SDS-KAc法;3:CTAB-EtOH法;4:CTAB -KAc-EtOH法;5:CTAB-KAc法图1 5种提取方法所得RNA的电泳图
用NanoDrop2000C测定5种提取方法所得RNA的产量、A260/A280和A260/A230,结果见表1.Trizol-KAc法无法从蓝莓果实中提取出RNA.其他4种方法在RNA产量方面,以CTAB-KAc法和SDS-KAc法最高,均在100 μg·g-1以上.4种方法的A260/A280均为1.90~2.10,A260/A230都在2.0以上,表明无蛋白质、酚类和多糖等污染.结合电泳结果(见图1)进行综合分析,提取蓝莓果实RNA以CTAB-KAc法为最佳.
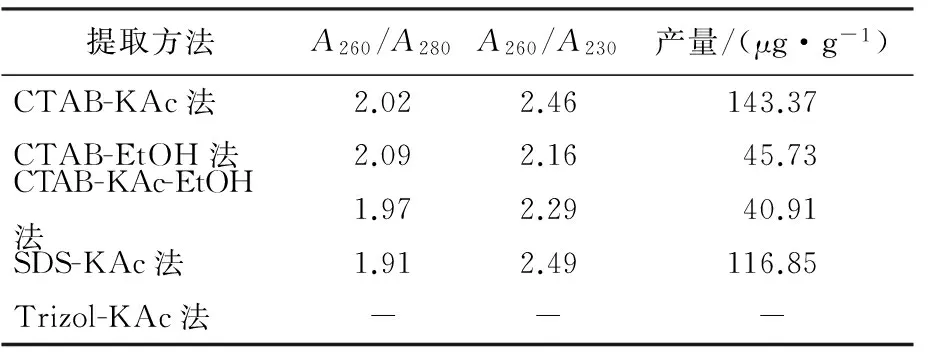
表1 5种提取方法所得RNA的产量和质量
2.2 CTAB-KAc法对不同蓝莓组织RNA的提取
用CTAB-KAc法提取了不同蓝莓组织的RNA.由表2可知:CTAB-KAc法在提取蓝莓成熟叶、绿茎和幼果组织RNA时,RNA产量达到100 μg·g-1以上,花的RNA产量也在80 μg·g-1以上,且A260/A280为2.00~2.10,A260/A230都在2.30以上,说明无蛋白质、酚类和多糖等污染;成熟果的RNA产量仅为18.95 μg·g-1,A260/A280为1.98,A260/A230仅为1.64,可能所得RNA含有多糖等杂质;根的RNA产量最低,只有9.36 μg·g-1,且A260/A280和A260/A230仅为1.77和1.44,A260/A280为1.70~2.00,在cDNA合成的可用范围内,但A260/A230过低,说明存在大量的蛋白质、酚类和多糖等杂质.电泳结果(见图2)也与上述结论一致.
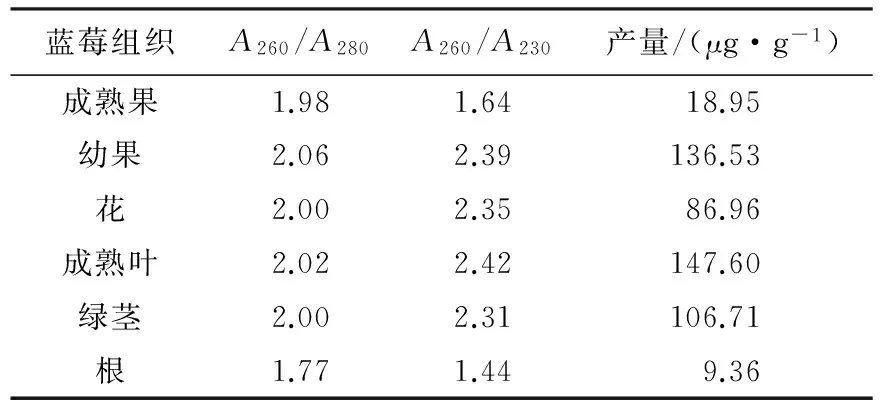
表2 CTAB-KAc法提取蓝莓不同组织中RNA的产量和质量
1:成熟果实;2:幼果;3:花;4:成熟叶;5:绿茎;6:根
图2 CTAB-KAc法提取各蓝莓组织RNA的电泳图
2.3 RT-PCR分析
以CTAB-KAc法提取的6种不同蓝莓组织RNA反转录成的cDNA、蓝莓幼果RNA和ddH2O为模板,用蓝莓CAT基因特异引物CAT-F和CAT-R进行PCR,幼果RNA和ddH2O为模板的对照中没有扩增出条带,6种不同蓝莓组织的cDNA中,成熟叶、绿茎、花、幼果和成熟果扩增出了预期的约850 bp的CAT基因片段,根没有扩增出任何条带(见图3).由此进一步说明CTAB-KAc法对蓝莓叶、茎、花和不同成熟度果实提取的RNA质量较好,且不存在基因组DNA污染,可以直接用于后续研究,但对根的RNA提取有难度.
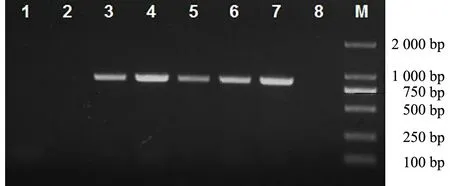
1:幼果RNA;2:ddH2O;3:成熟果cDNA;4:幼果cDNA;5:花cDNA;6:成熟叶cDNA;7:绿茎cDNA;8:根cDNA;M:Marker 2000
图3 不同蓝莓组织RT-PCR产物的电泳图
综上所述,本实验的5种RNA提取方法中,以CTAB-KAc法为最佳.本实验室目前已将CTAB-KAc法成功地应用于番茄、烟草、佛手和香橼的叶片、花瓣、雌蕊、雄蕊及樱桃花芽的RNA提取,用该方法提取的各种植物的RNA样品可用于RT-PCR和荧光定量PCR(结果未列).
3 讨 论
完整性好、纯度高的RNA是进行分子生物学研究的基础.本实验采用5种方法提取蓝莓幼果RNA,通过比较发现,将以CTAB为主要成分的RNA提取液和多糖沉淀试剂KAc结合的CTAB-KAc法是提取蓝莓幼果RNA的最佳方案.多糖是影响蓝莓RNA提取的主要干扰因素.多糖的许多理化性质与RNA极其相似,用一般方法很难将它们分开,去除多糖的同时RNA也会被部分带走,造成RNA产量降低[15];且RNA中残余的多糖还会抑制后续基因操作过程中的多种酶反应[16].本实验分别对KAc,EtOH和KAc-EtOH进行了比较,以探求最佳的蓝莓多糖去除试剂.结果显示:3种试剂获得RNA的A260/A230值相近,表明在多糖去除能力上3种试剂效果相近;但利用EtOH和KAc-EtOH得到的RNA产量远低于KAc(见表1),且EtOH和KAc-EtOH去除多糖后获得的RNA中存在基因组DNA污染(见图1).因此,KAc去除多糖的效果优于EtOH和KAc-EtOH.本实验还分别对CTAB提取液、SDS提取液和Trizol试剂进行了比较,以寻求最佳的RNA提取液.Trizol试剂无法从蓝莓幼果中提出RNA,可能与Trizol试剂所含的酚和异硫腈酸胍等组分的缓冲能力较差有关[17-18].CTAB提取液比SDS提取液在RNA产量上略优,且不存在基因组DNA污染.因此,CTAB提取液是提取蓝莓RNA的最佳提取液.其他植物RNA提取多以SDS等试剂与KAc,EtOH或KAc-EtOH组合的方法所得RNA质量较好[9-14],说明不同植物材料RNA提取的干扰因素不同,使用的RNA提取方法也可能不同[19].
本实验从5种方法中筛选出蓝莓RNA提取的最佳方法——CTAB-KAc法,并用该方法对蓝莓根、成熟叶、幼茎、花、幼果和成熟果实的RNA进行了提取,其中:对成熟叶、绿茎、花和幼果组织RNA的提取效果最佳,而成熟果RNA的A260/A280为1.98,A260/A230仅为1.64,可能有多糖等杂质污染,5种蓝莓组织的RNA可用于RT-PCR及其他后续研究;对根RNA的提取效果最差,不能用于后续实验.表明CTAB-KAc法并不适于所有蓝莓组织RNA的提取.这与Ainsworth[10]的观点一致,即:同一种植物不同组织的RNA提取方法会有很大的差异,主要原因是不同组织中的主要干扰物不同,对其高质量RNA的提取方法需进一步优化.孙莹等[6]和Vashisth等[8]用LiCl沉淀RNA的方法对蓝莓幼果提取得到的总RNA产量约为25 μg·g-1,而本实验CTAB-KAc法的RNA产量比之高出约110 μg·g-1,在成熟叶、幼茎和成熟果的RNA产量上也比文献[8]略高或相近.
蓝莓等多年生木本植物在分子生物学方面的研究目前仍处于起步阶段,且尚无高效的RNA提取方法的报道.使用目前较通用的LiCl法对木本植物材料进行RNA提取,不仅实验周期长达20 h,且会造成小分子RNA的丢失[6,8].本研究建立的CTAB-KAc法只需0.1~0.2 g实验材料,用时3 h,且可同时对多个样品进行RNA提取;此外,CTAB-KAc法中用异丙醇沉淀RNA,预计还可以用于小分子RNA的提取.CTAB-KAc法适用于蓝莓叶、幼茎、花、果实等各种组织RNA的提取,可为深入进行蓝莓分子生物学研究奠定基础.
[1]Salzman R A,Fujita T,Zhu-Salzman K,et al.An improved RNA isolation method for plant tissues containing high levels of phenolic compounds or carbohydrates[J].Plant Molecular Biology Reporter,1999,17(1):11-17.
[2]Gehrig H H,Winter K,Cushman J,et al.An improved RNA isolation method for succulent plant species rich in polyphenols and polysaccharides[J].Plant Molecular Biology Reporter,2000,18(4):369-376.
[3]Manickavelu A,Kambara K,Mishina K,et al.An efficient method for purifying high quality RNA from wheat pistils[J].Colloids and Surfaces B:Biointerfaces,2007,54(2):254-258.
[4]Wang L,Stegemann J P.Extraction of high quality RNA from polysaccharide matrices using cetyltrimethylammonium bromide[J].Biomaterials,2010,31(7):1612-1618.
[5]John M E.An efficient method for isolation of RNA and DNA from plants containing polyphenolics[J].Nucleic Acids Research,1992,20(9):2381.
[6]孙莹,侯智霞.蓝莓果实总RNA提取方法比较[J].黑龙江农业科学,2012(10):114-117.
[7]Jaakola L,Pirttilä A M,Halonen M,et al.Isolation of high quality RNA from bilberry (VacciniummyrtillusL.) fruit[J].Molecular Biotechnology,2001,19(2):201-203.
[8]Vashisth T,Johnson L K,Malladi A.An efficient RNA isolation procedure and identification of reference genes for normalization of gene expression in blueberry[J].Plant Cell Reports,2011,30(12):2167-2176.
[9]Bahloul M,Burkard G.An improved method for the isolation of total RNA from spruce tissues[J].Plant Molecular Biology Reporter,1993,11(3):212-215.
[10]Ainsworth C.Isolation of RNA from floral tissue ofRumexacetosa(Sorrel)[J].Plant Molecular Biology Reporter,1994,12(3):198-203.
[11]Lewinsohn E,Steele C L,Croteau R.Simple isolation of functional RNA from woody stems of gymnosperms[J].Plant Molecular Biology Reporter,1994,12(1):20-25.
[12]Lópezgómez R,Gómezlim M A.A method for extracting intact RNA from fruits rich in polysaccharides using ripe mango mesocarp[J].Hortscience,1992,27(5):440-442.
[13]Liu W,Wang B,Duan C,et al.A method for isolating functional RNA from callus ofDendrobiumcandidumcontented rich polysaccharides[J].Colloids and Surfaces B:Biointerfaces,2005,42(3):259-262.
[14]Natalia K,Barbara M,Steven R,et al.Isolation of high-quality RNA from gymnosperm and angiosperm trees[J].Biotechniques,2004,36(5):821-824.
[15]李宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999(1):36-39.
[16]Fang G,Hammar S,Grumet R.A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J].Biotechniques,1992,13(1):52-56.
[17]刘丹,高庆玉,张丙秀,等.树莓果实总RNA提取方法的比较研究[J].北方园艺,2011(1):136-138.
[18]袁晓丽,王蔚,孙光明,等.菠萝果实不同部位总RNA提取方法比较[J].广东农业科学,2011,38(10):132-134.
[19]Su X,Gibor A.A method for RNA isolation from marine macro-algae[J].Analytical Biochemistry,1988,174(2):650-657.
(责任编辑 薛 荣)
Methods for RNA isolation from blueberry tissues
YU Keda,YE Meijuan,CHEN Wenrong,ZHU Kaili,ZHANG Changjing,GUO Weidong
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
Tissues of blueberry were generally rich in polysaccharides,proteins,and polyphenols,resulting in the difficulties of RNA isolation with both high quantity and quality.To optimize the technology of RNA isolation from blueberry tissues,five methods for RNA extraction from immature fruit of blueberry were evaluated.The results showed that the most efficient technique for RNA isolation from blueberry fruits was the optimized CTAB-KAc-based method.A subsequent experiment showed that the optimized CTAB-KAc-based technique was also efficient in successful RNA isolation from full-expanded leaf,green stem,flower,immature fruit and mature fruit of blueberry,although protocol for roots still needed to be optimized.The method yielded 143.37 μg·g-1high-quality RNA without DNA contamination within 3 h.The ratios ofA260/A280andA260/A230of the total RNA from immature fruit of blueberry were 2.02 and 2.46,respectively.Reverse transcription-PCR confirmed that the isolated RNA was of appropriate quality and integrity for subsequent molecular biology studies.
blueberry; RNA isolation; CTAB-KAc method; polysaccharides; RT-PCR
10.16218/j.issn.1001-5051.2016.01.011
��2015-03-19;
2015-04-09
浙江省科技计划公益技术研究项目(2013C32074);浙江省重大科技专项(2013C02004)
余柯达(1990-),男,浙江余姚人,硕士研究生.研究方向:分子生物学.通信作者:郭卫东.E-mail:gwd@zjnu.cn
S663.9
A
1001-5051(2016)01-060-05

