限进材料固相萃取-高效液相色谱在线联用检测牛奶中四环素类抗生素残留
杨 旭 刘美娇 林 深 徐 丹 董襄朝
(南开大学化学学院, 天津 300071)
限进材料固相萃取-高效液相色谱在线联用检测牛奶中四环素类抗生素残留
杨 旭 刘美娇 林 深 徐 丹 董襄朝*
(南开大学化学学院, 天津 300071)
建立了一种限进材料固相萃取-高效液相色谱在线联用检测牛奶中四环素类抗生素残留的分析方法。利用原子转移自由基聚合法制备的限进型聚(苯乙烯-co-二乙烯苯)键合硅胶作为同时富集四环素类小分子和排阻蛋白大分子的固相萃取材料。经过限进萃取柱的净化和富集后,牛奶样品中的四环素类抗生素(土霉素、四环素和金霉素)被反冲进反相C18分析柱进行色谱分离和测定。牛血清蛋白在限进萃取柱上的洗脱率为96.0%,说明制备的限进材料具有很好的排阻大分子蛋白的效果。3种四环素类抗生素在牛奶样品中的加标回收率为88.3%~101.5%,RSD<8.0%;方法检出限为50~80 μg/L,线性范围为0.05~2.0 μg/mL。结果表明,本方法简单高效,准确度好,检出限达到了规定要求,可以作为检测牛奶样品中四环素类抗生素残留的方法。
限进型聚(苯乙烯-co-二乙烯苯)键合硅胶; 固相萃取-高效液相色谱在线联用; 四环素类抗生素; 牛奶
1 引 言
四环素类抗生素是养殖业中常用的兽药和饲料添加剂,具有抑菌范围广、杀菌能力强、成本低廉等优点,但是近年来抗生素的滥用逐渐导致动物源性食品中的药物残留超标。长期食用含有四环素类抗生素的食品容易造成肝和肾脏的损伤,引发过敏和中毒反应,还会使牙齿变黄,严重影响到人类的身体健康[1,2]。为此国内外严格制定了食品中四环素类抗生素的最高残留限量(Maximum residue limits,MRL),中国要求水产品中土霉素、四环素和金霉素的MRL为100 μg/kg[3],美国规定在牛奶中的四环素类抗生素总量(包括土霉素、四环素和金霉素)的MRL为300 μg/kg[4];欧盟要求四环素类抗生素在动物肝脏、乳汁和鸡蛋中的MRL分别为600,100和200 μg/kg[5]。
目前,检测动物源性食品中四环素类抗生素痕量残留的方法包括液相色谱-质谱联用法[6~8]、高效液相色谱法[9~11]、毛细管电泳法[12]、酶联免疫法[13]等,其中高效液相色谱法(HPLC)由于具有分析速度快、分离效能高、适用范围广等特点而被广范应用,但是大部分方法都需要经过沉淀蛋白以及离线固相提取过程,分析时间长,而且容易造成样品损失。
对牛奶、体液等生物样品进行分析测定前,由于待测物质在样品中浓度低,且干扰物质较多,会对检测的准确度和精密度产生影响,因此需要对样品进行预处理。固相萃取(Solid-phase extraction,SPE)是一种常用的样品预处理方法[14,15],其与液液萃取法相比具有适用范围广、有机溶剂用量少、选择性高和萃取材料可重复使用等优势。但传统的固相萃取材料容易使蛋白变性沉淀或对于生物样品中的蛋白质等大分子形成不可逆吸附,造成填料的堵塞和萃取性能的降低。为了解决这个问题,研究者发展了限进材料(Restricted access material,RAM),这种材料通过两种类型的排阻作用去除生物大分子,一种是利用亲水层造成阻隔作用的化学排阻,一种是依靠填料孔径限制的物理排阻,大分子物质可以在死体积或者接近死体积的情况下被洗脱排出,同时样品中的小分子物质能够进入填料内层被富集和分离。限进材料的这种特性使其能够在处理复杂样品时实现样品的直接进样分析,如果作为固相提取材料与其他仪器联用,可以简化实验操作,节省时间和人力,因此在样品前处理领域备受关注[16~21]。本研究以原子转移自由基聚合法制备的限进型聚(苯乙烯-co-二乙烯苯)键合硅胶作为固相萃取柱填料,通过条件选择,建立了固相萃取-高效液相色谱在线联用检测牛奶中四环素类抗生素的新方法。
2 实验部分
2.1 仪器与试剂
高效液相色谱仪(日本Shimadzu公司),包括LC-20AD高压输液泵,SPD-20A全波长紫外检测器,7725i手动进样器,7060六通切换阀;XW-80A旋涡混合仪(海门市其林贝尔仪器制造有限公司);LG16-C高速离心机(北京雷勃尔离心机有限公司);Luna C18(2)色谱柱(250 mm ×4.6 mm,美国Phenomenex公司)。
盐酸四环素(标准品,97.5%)、盐酸金霉素(标准品,97.5%)、土霉素(标准品,88.8%),均购自中国药品生物制品检定所;甲基丙烯酸缩水甘油酯(Glycidyl methacrylate, GMA)、二乙烯基苯(Divinylbenzene, DVB)、苯乙烯(Styrene, St)购自天津希恩思生化科技有限公司;乙腈(分析纯,天津市康科德科技有限公司);牛血清蛋白(Bovine serum albumin, BSA,北京索莱宝科技有限公司);牛奶购自当地超市。
Na2EDTA-McIlvaine提取液制备:1.86 g Na2EDTA,7.5 g Na2HPO4·12H2O和6.5 g C6H8O7·H2O用水溶解后定容至500.0 mL,并用H3PO4调节至pH 2.9。
0.05 mol/L Na2HPO4-柠檬酸缓冲溶液(pH 6.0)的配制:准确量取0.2 mol/L Na2HPO4溶液78.9 mL、0.1 mol/L柠檬酸溶液46.1 mL,用水定容至500.0 mL后混合均匀。
2.2 实验方法
2.2.1 限进型聚(苯乙烯-co-二乙烯苯)键合硅胶的制备 限进材料的制备方法参考文献[22],采用原子转移自由基聚合(Atom transfer radical polymerization,ATRP)方法,利用“Grafting from”技术在硅胶表面接枝聚(苯乙烯-co-二乙烯苯);再利用聚合物表面的ATRP基团,接枝聚甲基丙烯酸缩水甘油酯,酸性条件下水解成聚(丙三醇单甲基丙烯酸酯)后形成亲水性限进层,即制得限进型聚(苯乙烯-co-二乙烯苯)包覆硅胶色谱填料(Restricted accessed poly(styrene-co-divinylbenzene) bonded silica, Sil-p(St/DVB)-RAM)。材料的疏水性因子(kEtBz/kMeBz)为1.5,牛血清蛋白的排阻率>96%,表征结果说明,材料具有很好的保留疏水性小分子和排阻蛋白分子的能力。
2.2.2 Sil-p(St/DVB)-RAM柱的液相色谱性能评价 将制备好的限进材料Sil-p(St/DVB)-RAM 采用干法填充进不锈钢色谱柱(30 mm × 4.6 mm),填料质量为0.34 g。色谱柱用水、乙腈和甲醇反复冲洗后,用流动相进行平衡,待基线稳定后进样测定。分别以水、磷酸盐缓冲溶液、缓冲溶液/乙腈为流动相,以牛血清蛋白(BSA)的洗脱回收率为指标,测定不同流动相条件下Sil-p(St/DVB)-RAM柱对大分子蛋白质的排阻能力;以磷酸盐缓冲溶液/乙腈为流动相,测定限进材料对小分子物质的保留能力。
2.2.3 牛奶加标样品制备 10.0 mL牛奶样品中加入土霉素、四环素、金霉素混合标准溶液混匀,再加入10.0 mL Na2EDTA-McIlvaine提取液,旋涡混合2 min,随后离心分离15 min,转速5000 r/min。中层清液用0.45 μm滤膜过滤,得到牛奶加标样品;加标浓度为0.04~2.0 μg/mL。未加标的牛奶除不加入待测物质外,其它处理方式与加标样相同。
2.2.4 限进材料固相萃取-高效液相色谱在线联用检测牛奶中四环素类抗生素 牛奶样品通过限进固相萃取-HPLC在线联用方法进行检测,柱切换方式如图1所示。Sil-p(St/DVB)-RAM柱作为预处理柱用于排阻大分子蛋白质、富集待测物质,Luna C18(2)色谱柱(250 mm×4.6 mm,Phenomenex,USA)作为分析柱进行分离检测,以六通切换阀进行柱切换,切换阀通过岛津色谱工作站(LabSolutions)进行控制。样品进样体积为1.0 mL,四环素类检测波长355 nm。流动相A、流动相B均为0.05 mol/L 磷酸盐缓冲溶液(pH 6.0),流动相C为乙腈。六通阀在位置A (实线位置)时,以流动相A平衡Sil-p(St/DVB)-RAM柱,流动相B/C(93∶7,V/V)平衡分析柱,流速均为1.0 mL/min,平衡时间10 min。样品以1.0 mL/min的流速进入Sil-p(St/DVB)-RAM柱;5 min后切换至位置B (虚线位置),以流动相B/C梯度将富集在限进柱上的待测物质反冲到分析柱上,进入洗脱/分析过程。流动相B/C的梯度为0~20 min; 7%~47% C; 20~25 min,47% C。流速1.0 mL/min。分析过程结束后,切换六通阀至Position A,进行下一次分析过程。
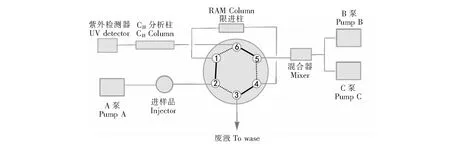
图1 RAM-SPE-HPLC在线联用法测定牛奶中四环素类抗生素的色谱柱切换示意图Fig.1 Schematic diagram of on-line restricted access materil (RAM)-SPE-HPLC for determination of tetracyclines in milk samples六通阀实线位置: 在线固相提取过程; 六通阀虚线位置: 分析过程。Solid line position of six-part valve: on-line solid-phase extraction; Dotted line position of six-part valve: analytical process.
3 结果与讨论
3.1 Sil-p(St/DVB)-RAM柱的排阻能力评价
以BSA为样品,分别以水、Na2HPO4-柠檬酸缓冲溶液(0.05 mol/L,pH 6.0)、 Na2HPO4-柠檬酸缓冲溶液(0.05 mol/L,pH 6.0)/乙腈(90∶10,V/V)为流动相,考察不同流动相条件下Sil-p(St/DVB)-RAM柱对大分子蛋白质的排阻能力,BSA的洗脱回收率及排阻时间列于表1,结果表明,流动相中盐溶液的存在有助于Sil-p(St/DVB)-RAM柱对BSA的排阻,而加入10%乙腈对蛋白的洗脱率影响不大。
表1 Sil-p(St/DVB)-RAM固相萃取柱排阻牛血清蛋白的流动相条件选择a
Table 1 Selection of mobile phase for BSA exclusion from the restricted accessed poly(styrene-co-divinylbenzene)bonded silica (Sil-p(St/DVB))-RAM SPE column
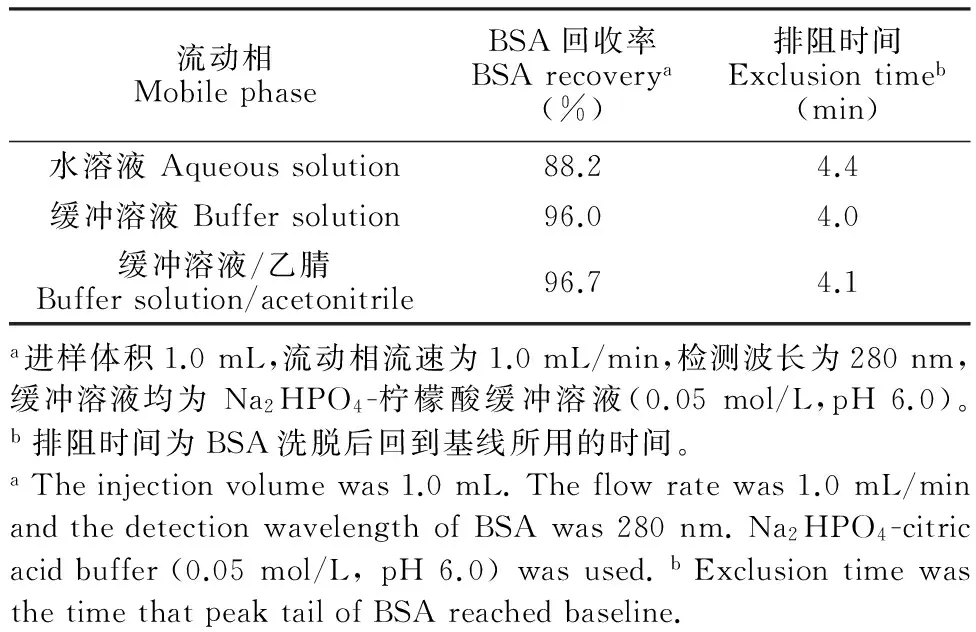
流动相MobilephaseBSA回收率BSArecoverya(%)排阻时间Exclusiontimeb(min)水溶液Aqueoussolution88.24.4缓冲溶液Buffersolution96.04.0缓冲溶液/乙腈Buffersolution/acetonitrile96.74.1a进样体积1.0mL,流动相流速为1.0mL/min,检测波长为280nm,缓冲溶液均为Na2HPO4-柠檬酸缓冲溶液(0.05mol/L,pH6.0)。b排阻时间为BSA洗脱后回到基线所用的时间。aTheinjectionvolumewas1.0mL.Theflowratewas1.0mL/minandthedetectionwavelengthofBSAwas280nm.Na2HPO4-citricacidbuffer(0.05mol/L,pH6.0)wasused.bExclusiontimewasthetimethatpeaktailofBSAreachedbaseline.
3.2 流动相条件对于Sil-p(St/DVB)-RAM柱的保留能力的影响
以四环素为样品,考察了Sil-p(St/DVB)-RAM柱对四环素类小分子的保留能力与流动相条件的关系(图2)。以 Na2HPO4-柠檬酸缓冲溶液(0.05 mol/L)/乙腈(50∶50,V/V)为流动相,考察了缓冲溶液pH值对四环素保留因子的影响(图2A)。随着缓冲溶液pH值升高,四环素在限进柱上的保留先增强、后减弱,在pH 6.0时保留能力最强。由于强酸或强碱环境下,四环素结构的稳定性较差[23],同时为了保证限进柱对四环素有较强的富集和净化能力,后续实验中选择pH 6.0为缓冲溶液酸度。以磷酸盐缓冲溶液(0.05 mol/L,pH 6.0)/乙腈为流动相,通过改变水相和有机相的比例发现,限进柱对四环素分子的保留能力随着缓冲溶液比例的增加而升高,此现象符合反相色谱保留机理(图2B)。图2C显示,以磷酸盐缓冲溶液(pH 6.0)/乙腈(50∶50,V/V)为流动相时,随着缓冲溶液盐浓度的升高,限进柱对四环素的保留逐渐减弱,表明Sil-p(St/DVB)-RAM对四环素的吸附能力受到溶液中离子强度的影响。
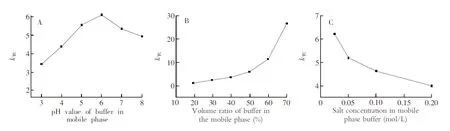
图2 流动相组成对四环素在Sil-p(St/DVB)-RAM柱上保留的影响Fig.2 Influence of mobile phase compositions on the retention of tetracycline on Sil-p(St/DVB)-RAM column(A)流动相为 Na2HPO4-柠檬酸缓冲溶液(0.05 mol/L)/乙腈(50∶50, V/V);(B)流动相为磷酸盐缓冲溶液(0.05 mol/L,pH 6.0)/乙腈;(C)流动相为磷酸盐缓冲溶液(pH 6.0)/乙腈(50∶50, V/V);流动相流速1.0 mL/min;进样量20 μL;检测波长355 nm。(A) Mobile phase: Na2HPO4-citric acid buffer (0.05 mol/L)/acetonitrile (50∶50, V/V); (B) mobile phase: Na2HPO4-citric acid buffer (0.05 mol/L, pH 6.0)/acetonitrile; (C) mobile phase: Na2HPO4-citric acid buffer (pH 6.0)/ acetonitrile (50∶50, V/V). The flow rate was 1.0 mL/min. The injection volume was 20 μL and the detection wavelength was 355 nm.
3.3 Sil-p(St/DVB)-RAM固相萃取-HPLC在线联用方法的建立
为实现大体积样品的直接进样分析,上样流动相的选用原则是,对杂质的排出能力强及待测物质在萃取柱上能够有效且充分的富集;洗脱及分析流动相的选取原则是,既能够保证待测物质能够从萃取柱上快速洗脱,又要保证待测物质被反冲到分析柱时不会因流动相洗脱能力太强而未能与固定相发生充分相互作用。综合考虑流动相选取原则及柱切换过程中上样和洗脱流动相之间匹配性问题,根据3.2节的实验结果,对色谱条件进行优化后,确定 Na2HPO4-柠檬酸缓冲溶液(pH 6.0,0.05 mol/L)为上样流动相,缓冲溶液(pH 6.0,0.05 mol/L)/乙腈为洗脱和分析流动相,按照2.2.4节所述程序,建立限进固相萃取-HPLC在线联用检测样品中土霉素、四环素、金霉素的分析方法,得到的色谱图见图3。
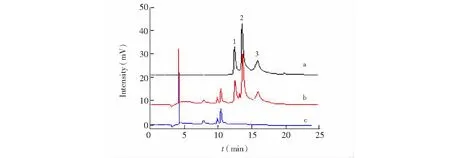
图3 限进固相萃取-高效液相色谱在线联用法测定四环素类抗生素的色谱图Fig.3 Chromatograms of on-line RAM-SPE-HPLC method for determination of tetracyclines(a)土霉素、四环素、金霉素浓度均为0.40 μg/mL的标准混合溶液;(b)加标浓度为0.40 μg/mL的牛奶样品;(c)未加标四环素类抗生素的牛奶样品。样品进样量1.0 mL,检测波长355 nm。1. 土霉素;2. 四环素;3. 金霉素。(a) Standard tetracyclines mixture solution; (b) spiked milk sample (0.40 μg/mL), (c) blank milk sample. The injection volume was 1.0 mL and the detection wavelength was 355 nm. 1. oxytetracycline; 2. tetracycline; 3. chlotetracycline.
3.4 Sil-p(St/DVB)-RAM固相萃取-HPLC在线联用方法的色谱评价
在优化的色谱条件下,以Sil-p(St/DVB)-RAM固相萃取-HPLC在线联用方法分别测定在牛奶中加标浓度为0.04, 0.08, 0.1, 0.25, 0.4, 1.0, 1.6和2.0 μg/mL的土霉素、四环素、金霉素混合标准溶液,每个样品平行测定3次,以峰面积对浓度作图,得到方法的线性方程;分别测定方法的定量限和检出限,结果(表2)表明,在0.05~2.0 μg/mL范围内,方法线性相关性良好,检出限较低,满足实际应用的需要。日内精密度和日间精密度见表3。
3.5 Sil-p(St/DVB)-RAM固相萃取-HPLC在线联用方法测定加标和空白牛奶样品
为验证方法的实用性,实验中采用未检出3种四环素类物质的牛奶为空白基质,进行加标待测物质的牛奶样品分析,每个样品平行测定5次。样品中土霉素、四环素、金霉素的回收率和RSD见表4。
表2 限进固相萃取-高效液相色谱在线联用测定四环素方法的线性及检出限(n=3)a
Table 2 Linearity and detection limits of on-line RAM-SPE-HPLC method for determination of tetracyclines(n=3)

分析物Analytes线性方程Linearequation线性相关系数CorrelationcoefficientR2检出限LOD(μg/mL)定量限LOQ(μg/mL)土霉素OxytetracyclineY=9.84×105X-184680.99950.050.18四环素TetracyclineY=2.45×106X-1127890.99910.080.25金霉素ChlotetracyclineY=1.09×106X-22340.99930.060.21a线性关系测定的浓度范围为0.05~2.0μg/mL。aThelinearitywasdeterminedinconcentrationrangeof0.05to2.0μg/mLforalltetracyclines.
表3 四环素类抗生素测定的日内和日间精密度
Table 3 Intra-day and inter-day precision in tetracyclines determination
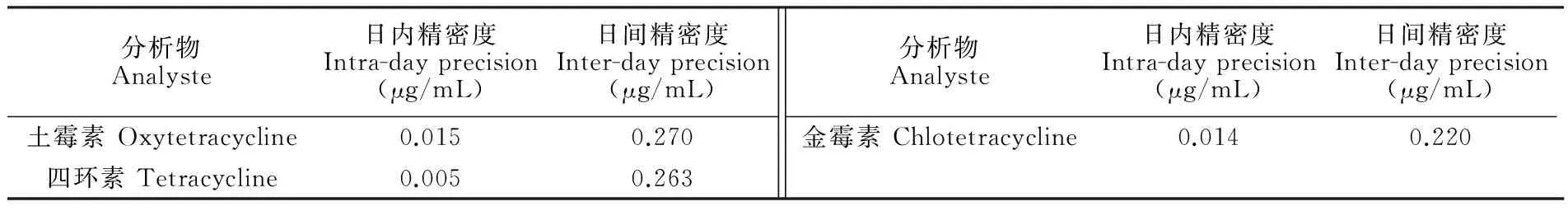
分析物Analyste日内精密度Intra-dayprecision(μg/mL)日间精密度Inter-dayprecision(μg/mL)土霉素Oxytetracycline0.0150.270四环素Tetracycline0.0050.263分析物Analyste日内精密度Intra-dayprecision(μg/mL)日间精密度Inter-dayprecision(μg/mL)金霉素Chlotetracycline0.0140.220
表4 加标牛奶样品测定的回收率和精密度 (n=5)
Table 4 Accuracy and precision of on-line RAM-SPE-HPLC method determined by tetracyclines spiked milk samples (n=5)
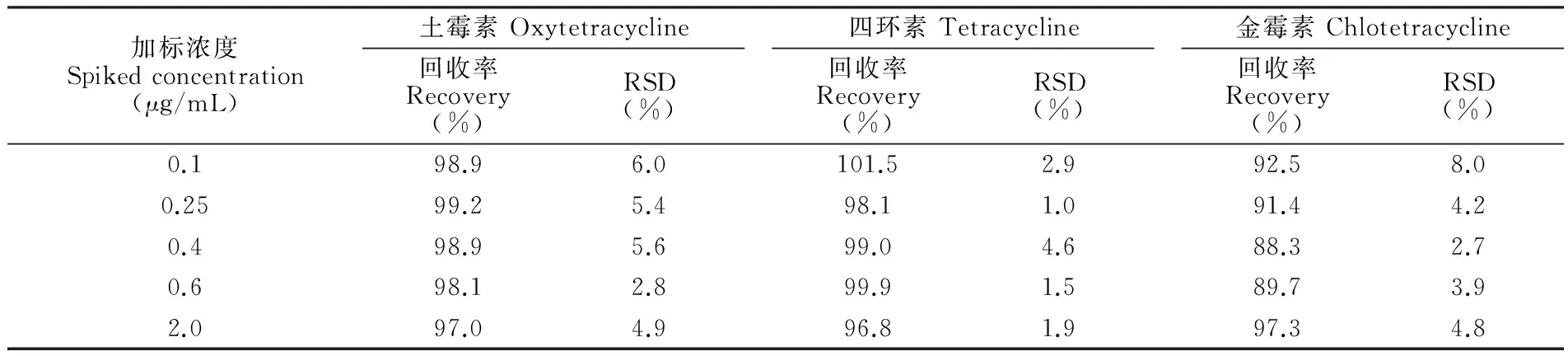
加标浓度Spikedconcentration(μg/mL)土霉素Oxytetracycline回收率Recovery(%)RSD(%)四环素Tetracycline回收率Recovery(%)RSD(%)金霉素Chlotetracycline回收率Recovery(%)RSD(%)0.198.96.0101.52.992.58.00.2599.25.498.11.091.44.20.498.95.699.04.688.32.70.698.12.899.91.589.73.92.097.04.996.81.997.34.8
表5 不同牛奶空白样品的检测结果 (n=3)
Table 5 Results of tetracyclines determination in milk samples (n=3)

牛奶Milk浓度(μg/mL)和相对标准偏差(%)Concentrations(μg/mL)andRSD(%)土霉素Oxytetracycline四环素Tetracycline金霉素ChlotetracyclineAn.d.2.1(3.7)n.d.Bn.d.n.d.n.d.n.d.:未检出(Notdetected)。
结果表明,本分析方法准确度和精密度都较高,具有实际应用价值。采用本方法分析了两种从当地超市购买的不同品牌的牛奶样中四环素类化合物,分析结果见表5。
4 结 论
以Sil-p(St/DVB)-RAM为固相萃取材料,建立了限进固相萃取-高效液相色谱在线联用测定牛奶样品中3种四环素类抗生素残留的方法,获得了较好的结果。实验中Sil-p(St/DVB)-RAM柱对牛血清蛋白的排阻率为96.0%;土霉素、四环素和金霉素在优化的色谱条件下能够实现有效分离,检出限为50~80 μg/L,加标回收率为88.3%~101.5%,RSD均低于8.0%;方法的线性范围为50~2000 μg/L。实验结果表明,建立的分析方法操作简单,测定结果准确、可靠,具有很好的应用价值。
1 Kemper N.Ecol.Indic., 2008, 8(1): 1-13
2 Daghrir R, Drogui P.Environ.Chem.Lett., 2013, 11(3): 209-227
3 P. R. China Bulletin of Ministry of Agriculture, no. 235, Veterinary Drug Maximum Residue Limits in the Food of Animal Origin, 2002
4 U. S. Code of federal regulations, Title 21, Part 556,TolerancesforResiduesofNewAnimalDrugsinFood, 2003
5 Council regulation (EEC) 2377/90,LayingDownaCommunityProcedurefortheEstablishmentofMaximumResidueLimitsVeterinaryMedicinalProductsinFoodstuffsofAnimalOrigin, 1990
6 Vidal J L M, Aguilera-Luiz M D M, Romero-González R, Frenich A G.J.Agric.Food.Chem., 2009, 57(5): 1760-1767
7 Spisso B F, de Araújo Júnior M G, Monteiro M A, Lima A M B, Pereira M U, Luiz R A, Nóbrega A W D.Anal.Chim.Acta, 2009, 656(1-2): 72-84
8 Tölgyesi L, Békési K, Sharma V K, Fekete J.MeatScience, 2014, 96(3): 1332-1339
9 Cinquina A L, Longo F, Anastasi G, Giannetti L, Cozzani R.J.Chromatogr.A, 2003, 987(1-2): 227-233
10 SUN Li-Xin.FoodResearchAndDevelopment, 2012, 33(9): 167-173
孙立新. 食品研究与开发, 2012, 33(9): 167-173
11 Yang X Q, Yang C X, Yan X P.J.Chromatogr.A, 2013, 1304: 28-33
12 Santos S M, Henriques M, Duarte A C, Esteves V I.Talanta, 2007, 71(2): 731-737
13 Pastor N N. Maquieira P R.Anal.Bioanal.Chem., 2009, 395(4): 907-920
14 Hennion M C.J.Chromatogr.A, 1999, 856(1-2): 3-54
15 Mehdinia A, Aziz-Zanjani M O.TrAC,TrendsAnal.Chem., 2013, 51: 13-22
16 Cassiano N, Lima V, Oliveira R, De Pietro A, Cass Q.Anal.Bioanal.Chem., 2006, 384(7): 1462-1469
17 Sadílek P, Satínsky D, Solich P.TrAC,TrendsAnal.Chem., 2007, 26(5): 375-384
18 Xu W, Su S, Jiang P, Wang H, Dong X, Zhang M.J.Chromatogr.A, 2010, 1217(46): 7198-7207
19 Wang Y, Wang Y, Chen L, Wan Q H.J.Magn.Magn.Mater., 2012, 324(4): 410-417
20 Barbosa A F, Barbosa V M P, Bettini J, Luccas P O, Figueiredo E C.Talanta, 2015, 131: 213-220
21 Beinhauer J, Bian L Q, Fan H, Sebela M, Kukula M, Barrera J A, Schug K A.Anal.Chim.Acta, 2015, 858: 74-81
22 Xu D, Dong X, Zhang H, Wang H, Jiang P, Zhang M.J.Sep.Sci., 2012, 35(13): 1573-1581
23 Oka H, Ito Y, Matsumoto H.J.Chromatogr.A, 2000, 882: 109-133
(Received 27 May 2015; accepted 13 September 2015)
Determination of Tetracycline Residues in Milk by On-line Coupling of Restricted Access Material Solid Phase Extraction with High Performance Liquid Chromatography
YANG Xu, LIU Mei-Jiao, LIN Shen, XU Dan, DONG Xiang-Chao*
(CollegeofChemistry,NankaiUniversity,Tianjin300071,China)
A new method has been developed for the determination of tetracycline residues in milk by on-line restricted access material solid phase extraction-HPLC analysis. Restricted accessed poly(styrene-co-divinylbenzene) bonded silica, synthesized by atom transfer radical polymerization, was used as solid phase extraction material in the experiment. This material played both functions of tetracylines extraction and biomacromolecule exclusion. Tetracyclines extracted from milk sample were back-flushed into a reversed phase C18analytical column and oxytetracycline, tetracycline and chlortetracycline were separated and quantified by HPLC analysis. The exclusion ratio of bovine serum albumin from the restricted access material column was 96.0%, which indicated that the restricted access material had the ability to exclude large biological molecules. The recoveries of three tetracylines in milk samples were 88.3%-101.5% with relative standard deviations <8.0%. The detection limits of 50-80 μg/L and the linear ranges from 0.05 μg/mL to 2.0 μg/mL for the analytes were obtained. The results demonstrated that the method could be used in the determination of tetracycline residues in milk samples with good sensitivity and efficiency.
Restricted accessed poly(styrene-co-divinylbenzene) bonded silica; On-line solid-phase extraction-high performance liquid chromatographic analysis; Tetracylines; Milk
10.11895/j.issn.0253-3820.150443
2015-05-27收稿;2015-09-13接受
* E-mail: xcdong@nankai.edu.cn

