荧光光谱法研究纳米二氧化钛光催化降解核壳型CdSe/ZnS量子点
李月生 宋智勇 秦江涛 黄海涛 韩 炎
1(湖北科技学院非动力核技术湖北省协同创新中心,咸宁 437100)2(武汉大学 化学与分子科学学院,武汉 430072)
荧光光谱法研究纳米二氧化钛光催化降解核壳型CdSe/ZnS量子点
李月生*1宋智勇1秦江涛1黄海涛1韩 炎2
1(湖北科技学院非动力核技术湖北省协同创新中心,咸宁 437100)2(武汉大学 化学与分子科学学院,武汉 430072)
在光诱导条件下,利用纳米二氧化钛(P25)对荧光物质核壳型CdSe/ZnS量子点进行光催化降解实验,通过荧光光谱法与传统分光光度法对比研究,测定降解液的吸光度来进行分析与评价降解率,从而判断降解程度和效率。光催化降解结果表明: 对荧光物质CdSe/ZnS量子点的荧光淬灭程度(F/F0)与反应时间(t)呈线性关系,符合CdSe/ZnS量子点光催化降解动力学拟合方程,证明了荧光光谱法与传统吸光光度检测结果的一致性。建立了一种高效灵敏检测光催化降解荧光物质方法,有助于分析荧光物质的光催化降解机理,为光催化降解其它荧光物质的相关研究提供参考。
荧光光谱法; 光催化; 荧光物质; 量子点
1 引 言
CdSe/ZnS量子点(CdSe/ZnS Quantum dots, CdSe/ZnS QDs)作为一种能够接受光激发产生荧光的半导体纳米颗粒,由于合成CdSe/ZnS量子点所用原料富含重金属源, 量子点自身表面残余的重金属离子存在缓慢释放而造成环境污染[1~4]。Jiu等[5]研究进一步证实,CdSe QDs引发的细胞毒性远高于同浓度的游离Cd2+,因而仅从Cd2+的重金属毒性效应考虑量子点的细胞毒性是不充分的。许多研究者对CdSe/ZnS量子点的毒性做了更加深入的研究。Dubertret 等[6]将胶束包裹的CdSe/ZnS QDs 注射到非洲爪蟾胚胎中。当每个细胞中注入5×109个QDs 时,胚胎开始出现畸形。 Hoshino等[7]通过在CdSe/ZnS 量子点表面修饰不同基团,并考察其对人类淋巴母细胞遗传的影响。结果表明,QDs-COOH 表现出较高的毒性。Kirchner 等[8]也对不同分子修饰的CdSe/ZnS量子点的毒性进行了研究。结果表明,除释放的Cd2+外,量子点的团聚也会对细胞产生较大毒性。Green 等[9]研究表明,CdSe/ZnS 量子点会严重损伤质粒DNA。本课题组前期的研究揭示了量子点等纳米材料的明显生物效应[10~12]。 Lovric'等[13,14]进一步研究了纳米粒子的尺寸与表面效应可能造成的纳米毒性。回收并有效处理难降解、低浓、高毒的量子点等污染物,是迫切需要科研工作者解决的问题。目前,仅针对污染物降解的研究方法[15~17]普遍集中在光诱导条件下,对水中或者空气中的有机染料、聚乙烯及某些有机污染物进行光催化降解,最终生成无毒、无味的CO2、H2O以及一些简单的无机物。
目前,有关光催化降解产物检测的研究手段[18,19]主要集中在利用传统分光光度法测定降解液的吸光度,从而判断降解程度和效率。而传统分光光度法的准确度与灵敏度远低于荧光光谱法[20],而且利用荧光光谱法研究具有荧光特性量子点的光催化降解及其分析评价的文献报道不多。本研究在光照条件下,利用催化性能较高的纳米TiO2(P25)对荧光物质CdSe/ZnS QDs进行光催化降解实验,通过荧光光谱法与传统分光光度法对比研究,验证荧光光谱法与传统吸光光度检测方法的一致性,建立一种光催化降解荧光物质的高效灵敏的检测新方法,为光催化降解其它荧光物质的相关研究提供理论依据和方法借鉴。
2 实验部分
2.1 仪器与试剂
TU-1900紫外-可见分光光度计(北京普析通用仪器有限责任公司);LS-55荧光分光光度计;JEM-2010FEF高分辨透射电子显微镜(日本JEOL公司);带有能量散射X光光谱仪的场发射扫描电子显微镜LEO1530(德国LEO公司);Rigaku D-Max粉末X射线衍射仪(日本Rigaku公司);SKL 12 X射线光电子能谱仪(德国Leybold Heraeus公司);ACE光催化反应系统(美国ACE GLASS公司)包括: 卤素-钨灯(400 W,)、滤光片(λ>420 nm)、Pyrex耐热玻璃反应器(300 mL)、磁力搅拌器及恒温水循环系统。
P25(纳米TiO2,平均粒径30~50 nm, 德国德固赛公司);巯基乙酸(MAA,99.0%,美国Sigma Aldrich公司);硬脂酸(99.0%)、氧化铬(CdO, 99.0%)、硼氢化钠(NaBH4,99%)、硒粉(Se, 99%)、三正丁基膦(TBP,99%)、二辛基胺(DOA,99%)、三正辛基氧化膦(TOPO,99%)、十六胺(HDA,99%)、硫粉(S, 99%),十八碳烯(ODE,99%)、Zn(Ac)2(99.0%)、孔雀石绿(MG,99%)均由上海国药集团提供。其它试剂均为分析纯,所有实验用水均为完全去离子二次蒸馏水。
2.2 水溶性CdSe/ZnS QDs制备
CdSe量子点制备[21]: 在真空厌氧厌水操作箱中,取2 mmol Se 粉加入到装有2.35 mmol TBP 和14 mmol DOA 于烧瓶中,制得Se 储备液。取0.2 mmol CdO、0.8 mmol 硬脂酸于三口Schlenk 反应容器中,采用Schlenk 技术[22],用真空泵抽真空后充入Ar 气,如此反复6次, 使反应容器中充满Ar 气后,加热至160℃并恒温30 min,使CdO 充分溶解。反应完后,将溶液降至室温,即制得Cd 储备液。在制好的Cd 储备液中加入10 mmol TOPO 和16 mmol HDA,采用Schlenk技术抽气充气反复6次后,搅拌并加热至320℃,然后将从操作箱中取出的Se储备液快速注入到反应容器中,在280℃反应2 ~ 5 min后,迅速撤去加热装置并使产物冷却至室温,加入适量氯仿以防止混合物形成固体,再加入甲醇离心沉淀,除去上清液,将最终得到的沉淀重新分散在正己烷中,即制得CdSe量子点。
CdSe/ZnS量子点制备[23]: 取0.6 mmol S粉,加入到装有4 mL ODE 的三口Schlenk 反应容器中,采用Schlenk技术抽气充气反复六次以后,搅拌加热至200℃并恒温约20 min,制得S储备液。称取0.25 mmol Zn(Ac)2、 4 mL ODE、 5 mmol TOPO和8 mmol HDA于三口Schlenk反应容器中,采用Schlenk技术抽气充气反复6次后,搅拌加热至200℃并恒温20 min,制得Zn储备液。将S和Zn的储备液混匀转移到一个恒压滴液漏斗中,缓慢滴加到上述制好的CdSe量子点溶液中。滴加完后,将温度降至90℃并恒温1 h,然后撤去加热装置,使产物冷却至室温,再依次加入适量氯仿和丙酮,离心沉淀,除去上清液,所得沉淀重新分散在正己烷中,即制得CdSe/ZnS量子点。
MAA-CdSe/ZnS量子点制备[24]: 取适量分散在正己烷中CdSe/ZnS量子点,加入3倍体积的丙酮沉淀离心,以除去TOPO配体,弃去上清液,将沉淀重新分散在氯仿中,加入MAA后静置1 h,待溶液变浑浊后离心弃去上清液,加入超纯水并用0.1 mol/L NaOH和Na2CO3-NaHCO3缓冲溶液调节至pH=10,再加入等体积的丙酮沉淀离心,将最终得到的红色沉淀溶解于超纯水中,即制得MAA-CdSe/ZnS量子点溶液。超滤纯化除去溶液中含有的过量配体,用超纯水分散。
2.3 P25对CdSe/ZnS QDs的光催化活性评价
光催化活性评价实验: 所有的实验都是在敞开体系,在恒温条件下进行的。光催化反应器系统包含一支400 W的卤素-钨灯和λ>420 nm的滤光片,可以将波长小于420 nm的光滤除,确保照射到反应系统的必是可见光区段的光。透射光直接照射在300 mL Pyrex耐热玻璃反应器上,反应器顶端有小孔取样,底部采用磁力搅拌器搅拌。每次实验都将适量P25(平均粒径为30~50 nm)分散在CdSe/ZnS QDs溶液中,得到催化剂待分析的悬浮液试样。进行光照前,悬浮液都在暗处搅拌0.5 h,以确保达到吸附-脱附平衡,以便测试对象的降解率均由光催化作用引发,避免了由于纳米TiO2的吸附导致的催化降解假象。光催化降解反应过程中,每隔0.5 h从反应器中收集3 mL悬浮液,经过离心分离(7000 r/min,10 min),滤除催化剂粒子。分别采用分光光度计和荧光光谱仪测量滤液吸光度和荧光强度。 通过C/C0和F/F0分别计算CdSe/ZnS QDs的吸光度变化率和荧光淬灭率(降解率)。
3 结果与讨论
3.1 CdSe/ZnS核/壳型量子点的TEM显微图像及其尺寸分布
图1A为合成的CdSe/ZnS核/壳型量子点的透射电子显微图像。从图1A可见,CdSe/ZnS核/壳型量子点呈现球形,且尺寸分布良好。利用Gatan Digital Micrograph软件测量200个以上的量子点,得到两种量子点的尺寸分布情况(图1B)。CdSe/ZnS核/壳量子点平均粒径约为3.10 nm,标准尺寸偏差<10%。

图1 CdSe/ZnS量子点的高分辨透射电镜图像(A)和尺寸分布图(B)Fig.1 High resolution TEM image (A) and the size distribution (B) of CdSe/ZnS QDs
3.2 CdSe/ZnS核/壳型量子点的FL和UV-vis表征
图2为包覆不同ZnS层厚度CdSe/ZnS量子点的紫外-可见吸收光谱图及荧光光谱图。由荧光光谱可见,激发波长为388 nm时,CdSe/ZnS量子点的荧光峰分别位于550, 561, 592和611 nm,半峰宽(FWHM)为25~40 nm,荧光量子产率(FLQY)为60%~80%。根据量子点激子吸收峰的位置可计算出4种量子点的平均粒径分别为2.89, 2.90, 3.20和4.30 nm。
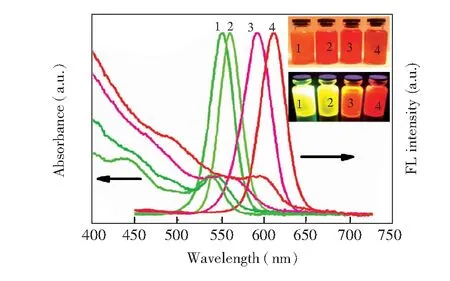
图2 包覆不同厚度ZnS层CdSe/ZnS量子点的紫外-可见吸收光谱图及荧光光谱图。插图为4种包覆不同厚度ZnS层CdSe/ZnS量子点的光学照片(上层: 自然光照射;下层: 紫外光激发)Fig.2 Photoluminescence spectra and corresponding UV-vis spectra of CdSe/ZnS QDs with increasing thickness of ZnS shell. Inner is the photographs of emission colors of CdSe/ZnS QDs under the radiation of room light (top) and a UV lamp(bottom)
3.3 CdSe/ZnS核/壳型量子点的XPS性能
图3 为CdSe/ZnS 量子点的XPS 光谱。从图3可见,Zn 和S 杂化轨道的俄歇电子的键能明显出现在XPS 光谱中,分别为1021.32和161.75 eV,与XPS 光谱的标准卡对比,分别指明了Zn元素为+2价态,S元素为-2价态,二者可能组合形成了ZnS化合物。与图2所示的CdSe/ZnS QDs的TEM图像进行联合分析表明,ZnS壳可很好地外延生长在CdSe核量子点表面。

图3 CdSe/ZnS量子点的XPS光谱图Fig.3 XPS spectra of CdSe/ZnS QDs
3.4 CdSe/ZnS核/壳型量子点的EDS光谱表征
利用EDS光谱(图4)进一步确认CdSe/ZnS核/壳结构量子点表面元素组成,各元素原子含量列于表1中。从表1可知,随着ZnS 层厚度的增加,量子点表面元素原子含量明显发生变化,Zn和S元素含量增加,而Cd和Se的含量逐渐减小,这表明ZnS壳逐渐外延生长在CdSe核量子点表面,而不是形成其它类型晶体结构或者合金结构。
3.5 CdSe/ZnS核/壳型量子点的XRD表征
图5是CdSe/ZnS 核/壳结构量子点的粉末X-射线衍射图谱,衍射峰较宽,表明所合成量子点的尺寸很小。同时,由于ZnS 壳的形成,CdSe/ZnS核/壳结构量子点的衍射谱图向更高的角度发生偏移,与体相立方形ZnS 的衍射相似。
表1 4种不同ZnS含量壳层的CdSe/ZnS量子点表面元素原子含量分布表
Table 1 Proportion of elements on the surface of CdSe/ZnS QDs with increasing thickness of shell (from 1 to 4 samples)

Samplesλem(nm)Cd(%)SeAtomic(%)ZnAtomic(%)SAtomic(%)155027.3327.9119.4025.36256022.9511.2726.2039.58359018.3311.2826.9243.47461014.5712.5932.6640.18

图4 4种不同ZnS含量壳层的CdSe/ZnS量子点的EDS光谱图Fig.4 EDS spectra of synthesized CdSe/ZnS QDs with increasing thickness of ZnS shell (from 1 to 4)
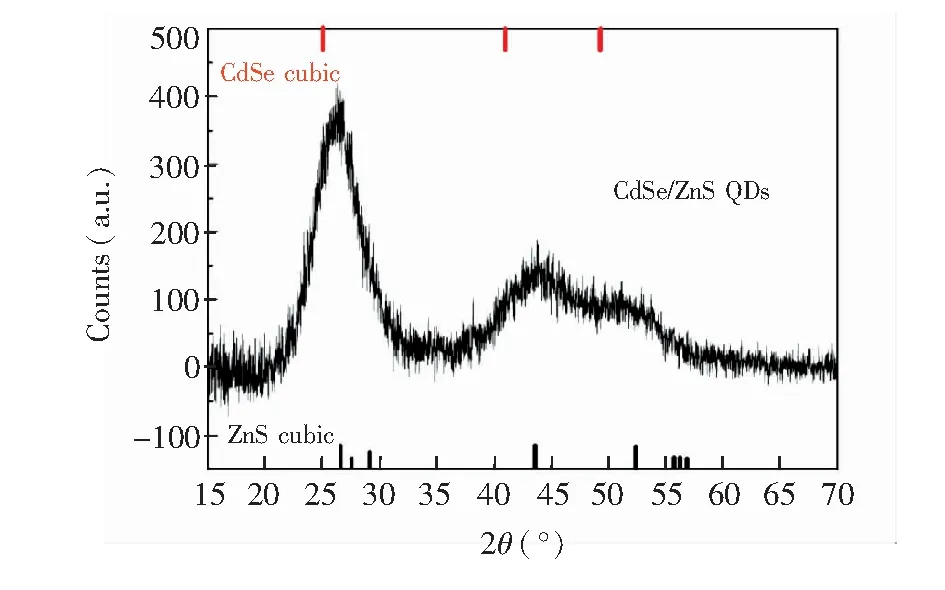
图5 CdSe/ZnS量子点的XRD谱图Fig.5 Powder XRD patterns of CdSe/ZnS QDs
3.6 CdSe/ZnS量子点吸附曲线的测定
为了排除催化剂的吸附行为对光催化降解产物浓度测定带来的误差,前期对催化剂进行了饱和吸附平衡的测定,等温吸附公式如下:
(1)
式中,Q为吸附量(mg/g);c0为起始质量浓度(mg/L);ct为平衡时质量浓度(mg/L);V为溶液的体积(L);m0为P25的质量(g)。

图6 CdSe/ZnS量子点的吸附曲线Fig.6 Asorption curve of CdSe/ZnS QDs by nano TiO2 (P25)
从图6所示的吸附曲线可见P25对CdSe/ZnS QDs 的吸附状况,CdSe/ZnS QDs 的初始吸附速率较大,随着吸附时间延长,吸附容量迅速提高。当吸附时间达到4 h 左右,吸附逐渐达到平衡,吸附曲线也趋于平缓,此时,吸附达到饱和。同时,也为后期的光催化降解作用下,计算准确的降解率提供了可靠的实验依据。
3.7 传统分光光度法测定P25对CdSe/ZnS QDs的光催化降解行为
在反应温度为25℃条件下,设置拟定的最佳实验条件,CdSe/ZnS QDs的浓度为1×10-6mol/L(实际环境中的模拟浓度),P25浓度为0.5 g/L, 将P25投入CdSe/ZnS QDs的溶液之中并置于暗处30 min后,保证分散体系达到充分的吸附脱附平衡,再进行光催化降解实验,如图7所示。当光催化降解时间为90 min时,CdSe/ZnS QDs的降解率达到了90.7%。由于在测定CdSe/ZnS QDs的降解液的吸光度时,要求对提取的液体进行多次离心分离,取上清液测定吸光度,并将测定完的上清液倒回反应器中,难免会导致催化剂P25和CdSe/ZnS QDs的降解液的损失,从而导致测定CdSe/ZnS QDs的降解液的吸光度存在误差,测定的降解率也产生了一定的误差。

图7 CdSe/ZnS量子点的光催化降解动力学曲线Fig.7 Photocatalytic degradation kinetic curve of CdSe/ZnS QDs
3.8 光催化降解核壳型CdSe/ZnS QDs的荧光淬灭行为
QDs具有激发光谱宽且连续分布,而发射光谱窄而对称,颜色可调,光化学稳定性高,荧光寿命长等优越的荧光特性,利用QDs的这一性质,采用荧光光谱法作为检测QDs残余量的方法,以跟踪P25对QDs的光催化降解过程中荧光强度的淬灭情况。在25℃下,以0.5 g/L P25为催化剂,CdSe/ZnS QDs的浓度为1×10-6mol/L,进行光催化降解实验,并对产物进行荧光强度测定。拟定CdSe/ZnS QDs的最大激发波长λex=493 nm 时,对应的最大发射波长为λem=573 nm。在未经P25光催化降解前,CdSe/ZnS QDs的荧光强度大约为1200(记为F0,图8A)。随着光照时间的延长,CdSe/ZnS QDs的荧光强度发生淬灭; 在光照射时间为60 min时,荧光淬灭率(降解率)达到了98.3%(图8B)。与图7对比分析可知,CdSe/ZnS QDs的荧光淬灭趋势与吸光度下降趋势基本一致,均与实验观察现象高度吻合。
CdSe/ZnS QDs的光催化降解过程并未出现最大吸收峰值蓝移现象,而是表现为略有一定的红移现象。分析可能是CdSe/ZnS QDs受到光催化降解解离,核壳结构的破坏,粒径发生改变等原因所致,详细的光催化降解机理还有待进一步研究与分析。

图8 不同光照时间下的CdSe/ZnS量子点的荧光淬灭光谱图(A)和荧光强度(F/F0)变化曲线(B)Fig.8 Fluorescence quenching spectrum (A) and fluorescence intensity (F/F0) changing curve (B) of CdSe/ZnS QDs at different irradiatin timea-i: 10, 15, 20, 25, 30, 40, 50, 60, 120, 180 and 240 min.
4 结 论
在光诱导条件下,利用光催化剂P25对MAA 修饰的水溶性的核/壳型CdSe/ZnS QDs进行光催化降解实验并对产物分别进行了吸光度和荧光强度测定。通过荧光光谱法与传统分光光度法对比研究,测定降解液的吸光度和荧光强度进行分析与评价降解率(荧光淬灭率),从而判断降解程度和效率。光催化降解结果表明: 对荧光物质CdSe/ZnS QDs的荧光淬灭程度(F/F0)与反应时间(t)呈线性关系,完全符合CdSe/ZnS QDs光催化降解(C/C0~t)动力学拟合方程,证明了荧光光谱法与传统吸光光度检测结果的一致性,建立了一种全新的光催化降解荧光物质高效灵敏检测方法。相对于传统吸光光度法,荧光光谱法灵敏度和精确度更高、适用范围更广,也有助于分析荧光物质的光催化降解机理。同时表明,荧光光谱法完全可以作为一种高效、灵敏、准确的检测方法,有望有效应用于光催化降解其它荧光物质的相关研究之中。
1 Zhang Z Z, Wang X X, Long J L, Gu Q, Ding Z X, Fu X Z.J.Catal., 2010, 276(2): 201
2 Joanna R, Tomasz G, Janusz W.Appl.Surf.Sci., 2014, 307: 333-345
3 JIN Min, HUANG Yu-Hua, LUO Ji-Xiang.SpectroscopyandSpectralAnalysis, 2015, 35(2): 420-423
晋 敏, 黄玉华, 罗吉祥. 光谱学与光谱分析, 2015, 35(2): 420-423
4 Susann N, Petra P, Christian W, Philipp W, Bastian M.Catal.Today, 2014, 230: 97-103
5 Jiu J T, Isoda S, Wang F M.J.Phys.Chem.B, 2006, 110(5): 2087-2092
6 Dubertret B, Skourides P, Norris D J, Noireaux V, Brivanlou A H, Libchaber A.Science, 2002, 298(5602): 1759-1762
7 Hoshino A, Fujioka K, Oku T, Suga M, Sasaki Y F, Ohta T, Yasuhara M, Suzuki K, Yamamoto K.NanoLett., 2004, 4(11): 2163-2169
8 Kirchner C, Liedl T, Kudera S, Pellegrino T, Javier A M, Gaub H E, Stölzle S, Fertig N, Parak W J.NanoLett., 2005, 5(2): 331-338
9 Green M, Howman E.Chem.Commun., 2005, 1: 121-123
10 LI Yue-Sheng, DU Ji-Fu, SUN Shao-Fa.Spectro.Spectr.Anal., 2014, 34(4): 1040-1043
李月生, 杜纪富, 孙绍发. 光谱学与光谱分析, 2014, 34(4): 1040-1043
11 Li Y S, Zhang Y, Sun S F, Liu Y.J.Photochem.Photobiol.B:Biology, 2013, 128: 12-19
12 Li Y S, Sun S F, Liu Y.ActaChim.Sinica, 2013, 71(12): 1656-1662
13 Lovric' J, Cho S J, Winnik F M, Maysinger D.Chem.Biolo., 2005, 12(11): 1227-1234
14 Lovric' J, Bazzi H S, Cuie Y, Genevieve R A, Winnik M., Maysinger D.J.Molecu.Model., 2005, 83(5): 377-385
15 YE Mei-Ying, LI Bao-Xing, YE Rong-Min, LIU Jin-Hua.ChineseJ.Anal.Chem., 2010, 38(5): 643-647
叶美英, 李宝兴, 叶荣民, 刘金华. 分析化学, 2010, 38(5): 643-647
16 Saif M, Aboul-Fotouh S M K, El-Molla S A, Ibrahim M M, Ismail L F M.Molecu.Biomolecu.Spect., 2014, 128: 153-162
17 ZHANG Hong-Man, CHEN Guo-song, DUAN He-Jun, YANG Zhu-Hong, LU Xiao-Hua.ChineseJ.Anal.Chem., 2005, 33(10): 1417-1420
张红漫, 陈国松, 段鹤君, 杨祝红, 陆小华. 分析化学, 2005, 33(10): 1417-1420
18 JIA Chen-Zhong, WAN Yan-Xin, ZHANG Cai-Xiang.ChineseJ.Anal.Chem., 2012, 40(11): 1710-1746
贾陈忠, 王焰新, 张彩香. 分析化学, 2012, 40(11): 1710-1746
19 Liu Y, Wang Y T, Li X G.J.Hazard.Mater., 2008, 150(2): 153-157
20 Liu Y, Li Q, Zhang J T, Sun W Z, Gao S A, Shang J K.Chem.Eng.J., 2014, 249: 63-71
21 Qu L H, Peng X G.J.Am.Chem.Soc., 2002, 124(9) : 2049-2055
22 Xie H Y, Liang J G, Liu Y, Zhang Z L, Pang D W, He Z K, Lu Z X, Huang W H.J.Nanosci.Nanotechnol., 2005, 5(6): 880-886
23 Chan W C W, Nie S M.Science, 1998, 281(5385): 2016-2018
24 Schmelz O, Mews A, Basché T, Herrmann A, Müllen K.Langmuir, 2001, 17(7): 2861-2865
(Received 29 May 2015; accepted 1 September 2015)
This work was supported by the National Natural Science Foundation of China (No. 11405050), the Key Projects of the Education Department of Hubei Province (No. D20142804), the National University Students Training and Entrepreneurial Practice Project (No. 201210927033, No. 20131092723), and the 12th Five Year Plan of Hubei Province (No. 2014B243).
Study on Photocatalytic Degradation of Core/Shell CdSe/ZnS Quantum Dots with Nano-TiO2by Fluorescent Spectrometric Methods
LI Yue-Sheng*1, SONG Zhi-Yong1, QIN Jiang-Tao1, HUANG Hai-Tao1, HAN Yan2
1(Non-powerNuclearTechnologyCollaborativeInnovationCenter,HubeiUniversityofScience&Technology,Xianning437100,China)2(CollegeofChemistryandMolecularSciences,WuhanUniversity,Wuhan430072,China)
The experiment of photocatalytic degradation on fluorescent substance core/shell CdSe/ZnS quantum dots by Nano-TiO2(P25) under visible light-induced was investigated. The degradation rate was analyzed and evaluated by determining the absorbance of degradation substance to determine the degree of degradation and efficiency. The results of photocatalytic experiment showed a good linear relationship between fluorescence quenching degree (F/F0) and reaction time (t) on fluorescent substance of CdSe/ZnS quantum dot, according to the photocatalytic degradation kinetics equation of CdSe/ZnS quantum dots. The consistency of experimental results was also confirmed with fluorescence spectroscopy and conventional spectrophotometry. Based on this, a new sensitive method was established for efficient determination of photocatalytic degradation fluorescent substance. The present method was helpful to analyze the photocatalytic degradation mechanism of fluorescent substance and provided a theoretical basis and reference to study the photocatalytic degradation on other fluorescent substances.
Fluorescent spectrometry; Photocatalysis; Fluorescent substance; Quantum dots
10.11895/j.issn.0253-3820.150450
本文系国家自然科学基金(No.11405050), 湖北省教育厅重点项目(No.D20142804), 国家级大学生创业训练和创业实践项目(Nos.201210927033,20131092723), 湖北省教育科学十二五规划课题(No.2014B243)资助。
2015-05-29收稿;2015-09-01接受
* E-mail: frank78929@163.com

