液相色谱-线性离子阱-静电场轨道阱回旋共振组合质谱法鉴定乙胺嘧啶在大鼠体内的代谢物
怀彬彬 郭春娜 李 强 郜 进 谢 顺 黄显会
(华南农业大学兽医学院,国家兽药残留基准实验室,广州 510640)
液相色谱-线性离子阱-静电场轨道阱回旋共振组合质谱法鉴定乙胺嘧啶在大鼠体内的代谢物
怀彬彬 郭春娜 李 强 郜 进 谢 顺 黄显会*
(华南农业大学兽医学院,国家兽药残留基准实验室,广州 510640)
研究乙胺嘧啶在大鼠体内的代谢方式与途径。大鼠以5 mg/kg单剂量口服乙胺嘧啶后,在不同时间点分别采集其血液、尿液和粪便样品。采用液相色谱-线性离子阱-静电场轨道阱回旋共振组合质谱仪(LC-LTQ-Orbitrap)检测乙胺嘧啶在大鼠体内的代谢物,结合相关代谢软件,共鉴定出10种代谢产物,主要的代谢途径包括苯环上的羟基化、N-氧化、双氧化、N-葡萄糖醛酸结合、甲基化+葡萄糖醛酸结合、羟基化+葡萄糖醛酸结合和N-氧化+葡萄糖醛酸结合。除乙胺嘧啶3-N-氧化物已经在大鼠体外代谢研究中被发现外,其余9种代谢产物均首次在大鼠体内发现。 根据其精确分子量及多级质谱的碎片特征,对这些代谢产物的化学结构做出推断,并建立乙胺嘧啶在大鼠体内的代谢谱系。研究表明,乙胺嘧啶在大鼠体内的Ⅰ相代谢方式主要是羟基化和N位氧化,Ⅱ相代谢方式主要是甲基化和葡萄糖醛酸结合。
乙胺嘧啶; 大鼠; 线性离子阱-静电场轨道阱回旋共振质谱; 代谢物
1 引 言
乙胺嘧啶(Pyrimethamine,PYR)又称2,4-二氨基-6-乙基-5-对氯苯基嘧啶,分子式为C12H13CIN4,是一种二氨基嘧啶的衍生物。二氨基嘧啶类化合物(Dia minopyrimidines)包括许多二氢叶酸还原酶抑制剂药物,除乙胺嘧啶外,还有三甲曲沙和吡曲克辛等[1],其中以乙胺嘧啶的抗原虫活性最强。乙胺嘧啶主要作用于二氢叶酸还原酶,阻断四氢叶酸的产生,导致核酸合成减少,使得原生生物的细胞核分裂受阻,繁殖受到抑制。因此,它被普遍用于疟疾的预防和治疗,另外乙胺嘧啶与磺胺类的联用也被认为是针对人畜共患的弓形虫病最有效的治疗方式[2]。在兽医临床,乙胺嘧啶还可用于防治禽类球虫病、疟原虫病和鸡的住白细胞原虫病等。但是, 许多研究表明,乙胺嘧啶对不同动物都表现出生殖毒性或基因毒性并且有着不同程度的致畸能力[3~7]。然而,关于乙胺嘧啶在动物体内代谢研究的基础资料却非常少。 除早期少量国外文献对大鼠体外代谢研究中可见代谢物乙胺嘧啶3-N-氧化物的报道[8,9],目前,对乙胺嘧啶在大鼠体内其它代谢方式并不明确,因此难以对乙胺嘧啶做进一步的毒性评估。
随着技术的成熟和发展,高分辨质谱仪越来越多地应用于药物的代谢研究[10~13]。本研究选用的分析仪器是线性离子阱-静电场轨道阱回旋共振组合质谱仪(LTQ-Orbitrap MS),其中LTQ能够获得化合物多级质谱(MSn)下的碎片离子,可提供化合物丰富的结构信息,而Orbitrap则保证了高质量精度和分辨率[14~16],再结合药物原型成分的质谱裂解行为和相应分析软件,可快速分析鉴定出可能的代谢产物[17]。采用本方法,在大鼠的生物样品中共鉴定出10种代谢产物,并建立起乙胺嘧啶在大鼠体内可能的代谢谱系。
2 实验部分
2.1 仪器与试剂
液相色谱系统配置FINNAGAN SURVEYOR MS Pump Plus和Autosampler Plus(美国Thermo Fisher公司);线性离子阱-静电场轨道阱回旋共振组合质谱仪(LTQ Orbitrap Discovery,美国Thermo Fisher公司); Xcalibur工作站和Mass Frontier 5.0软件(美国Thermo Fisher公司);Milli-Q 超纯水系统(美国Millipore公司);AUW120D型电子分析天平(日本岛津公司);HS250 Basic型旋涡振荡器(马来西亚IKA公司);N-EVAPTM11型氮气吹干仪(Organomation Asscociate公司);HS10260D型超声仪(Benchtop公司)。
乙胺嘧啶(99.6%,批号20140729,金坛市鑫达医药化工有限公司); 6mL Poly-Sery MCX小柱(上海安谱科学仪器有限公司); 甲醇、乙腈和甲酸为色谱纯(美国ThermoFisher公司),其它试剂均为分析纯。
2.2 实验动物与样品采集
SD大鼠10只,雌雄各半,体重为(203.8±6.4) g,购自南方医科大学实验动物中心。PYR按5 mg/kg单剂量灌服给药。给药前12 h及给药后4 h禁食,仅提供自由饮水。给药前经眼眶静脉采集空白血样,收集空白尿液和粪便。分别在给药3, 6, 12和24 h后采集血样, 并收集6, 12, 24, 36和48 h各时间段内的全部尿液和粪便。每次采血1 mL左右,置于含肝素钠生理盐水的 1.5 mL 塑料离心管中,混匀。在4℃下,4000 r/min离心10 min制备血浆;粪便70℃下烘干之后,研磨成粉末。所有血浆、尿液和粪便样品-20℃保存,待测。
2.3 实验方法
2.3.1 色谱-质谱条件 Agilent ZORBAX SB-Aq色谱柱(50 m×2.1 mm,3.5 μm);流动相:乙腈(A)和0.1%甲酸(B),梯度洗脱: 0~2 min,100% B; 2~13 min,100%~45% B; 13~17 min,45% B; 17~18 min,45%~100% B; 18~25 min,100% B。柱温35℃ ,流速0.25 mL/ min,进样量10 μL。
离子源:电喷雾电离(ESI);离子化方式:正离子模式;扫描范围:m/z50~800 Da; 质谱参数:喷雾电压4.5 kV;毛细管温度300℃;毛细管电压4.0 kV;鞘气(N2)流速25 units;辅助气(N2)流速:11 units;管状透镜电压:120 V;碰撞能:30~50 eV。
2.3.2 代谢产物的鉴定与分析 首先,对原形进行质谱分析,找出特征碎片离子,初步预测原形可能存在的代谢过程与途径。然后,结合软件Mass Frontier 5.0得到的结构式和通过Xcalibur 2.0软件优化色谱与质谱条件得到理想的样品色谱图,对软件 MetWorks 1.2的预测代谢途径与数据后处理参数进行设置,经质量亏损过滤(MMDF),若分子离子峰与预测代谢物分子量的误差范围在±5 mDa以内,则可初步判定该预测代谢物的存在。最后,对初步判定的预测代谢物进行MSn结构分析,如果预测代谢物具有与原形相同或相似的特征碎片离子,可确定其为代谢物。
2.3.3 样品的前处理 (1)血浆和尿液 取0.5 mL血浆或尿液样品于15 mL塑料离心管中,加入10%三氯乙酸(TCA)3 mL,涡旋10 s,超声提取10 min,振荡20 min,8000 r/min离心10 min,转移提取液至另一塑料离心管,重复一次,合并上清液,备用。选用MCX SPE小柱净化萃取,程序如下:依次加入5 mL甲醇,5 mL水活化小柱,然后加入备用提取液,待过滤完后,依次加入5 mL水,3 mL甲醇淋洗,真空抽干,最后加入5 mL氨化甲醇(氨水-甲醇,5∶95,V/V)洗脱,收集洗脱液于10 mL玻璃试管。在45℃下,N2吹干,之后用0.5 mL 50%乙腈复溶,过0.22 μm微孔滤膜,待测。(2)粪便 取1 g粪便样品于15 mL塑料离心管中,加入10%三氯乙酸(TCA)5 mL,涡旋10 s,超声提取10 min,振荡20 min,8000 r/min离心10 min,转移提取液,重复一次,合并上清液。残渣加入3 mL二氯甲烷-正己烷(1∶1,V/V), 涡旋10 s,超声提取10 min,振荡20 min ,6000 r/min离心10 min,转移提取液于玻璃试管,在45℃下,N2吹干,用1 mL 50%甲醇复溶后,合并至收集的提取液中,备用。选用MCX SPE小柱净化萃取,程序如下:依次加入5 mL甲醇、5 mL水活化小柱,然后加入提取液,待过完后,依次加入5 mL水,3 mL甲醇淋洗,真空抽干,最后加入5 mL氨化甲醇洗脱,收集洗脱液于10 mL玻璃试管。在45℃下,N2吹干,用 1 mL 50%乙腈复溶,过0.22 μm微孔滤膜,待测。
3 结果与讨论
3.1 乙胺嘧啶的代谢概况
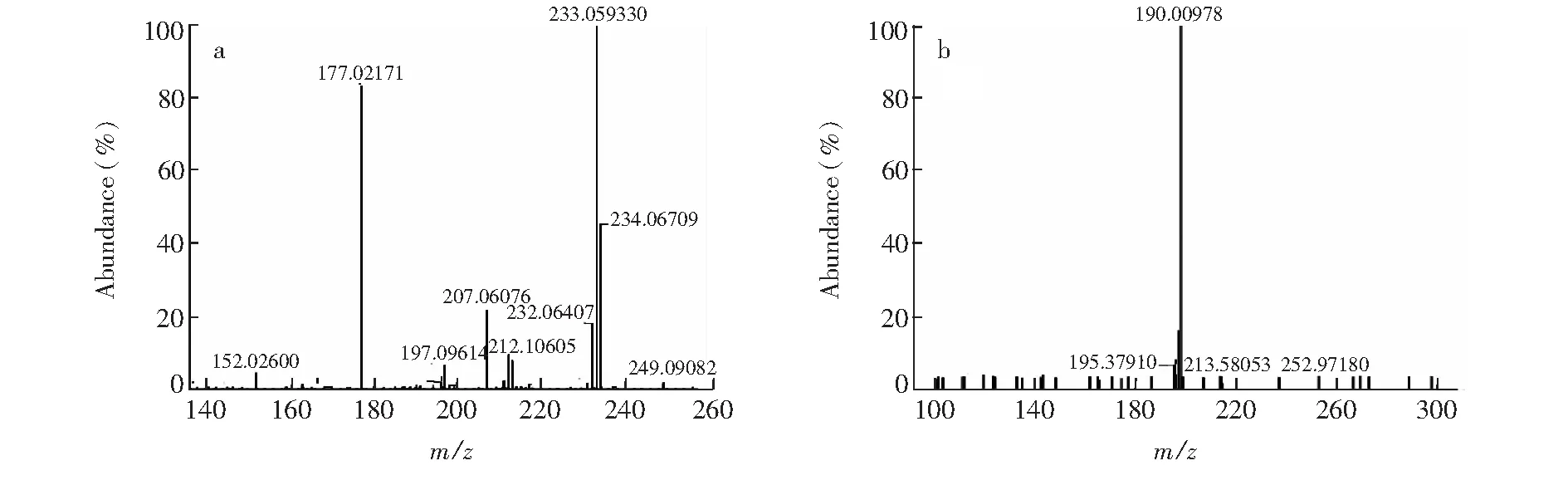
图1 PYR的MS2(a)和MS3(b)碎片离子的质谱图(m/z 234.07, 233.06, 177.02和198.09)Fig.1 MS2(a) and MS3 (b) spectra of pyrimethamine (PYR) showing product ions at m/z 234.07, 233.06, 177.02 and 198.09
3.1.1 乙胺嘧啶的主要碎片离子和裂解途径 PYR的一级准分子离子峰[M+H]+为m/z249.09015。如图1所示,其主要二级碎片离子有[M+H-CH4]+(m/z233.06),[M+H-C3H8N2]+(m/z177.02),[M+H-CH3]+(m/z234.07),以m/z233.06为先导碎片离子的三级碎片离子主要是[M+H-CH4-Cl]+(m/z198.09)。根据以上结果,推断 PYR可能的裂解途径,见图2。而所有这些碎片离子是用来鉴定PYR代谢物的重要依据。PYR及各碎片离子的分子量预测值和实测值,环和双键数及误差等信息见表1。
表1 PYR及其碎片离子的分子式、测定值、预测值、环和双键数及误差
Table 1 Elemental composition, observed and calculated masses, ring and double-bond equivalents (RDBs), and mass errors of protonated PYR and its fragmentations
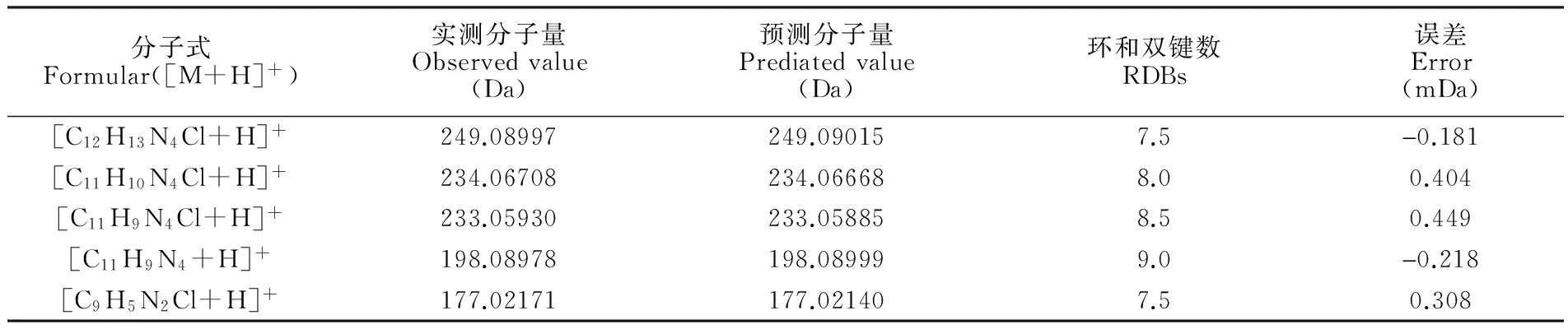
分子式Formular([M+H]+)实测分子量Observedvalue(Da)预测分子量Prediatedvalue(Da)环和双键数RDBs误差Error(mDa)[C12H13N4Cl+H]+249.08997249.090157.5-0.181[C11H10N4Cl+H]+234.06708234.066688.00.404[C11H9N4Cl+H]+233.05930233.058858.50.449[C11H9N4+H]+198.08978198.089999.0-0.218[C9H5N2Cl+H]+177.02171177.021407.50.308
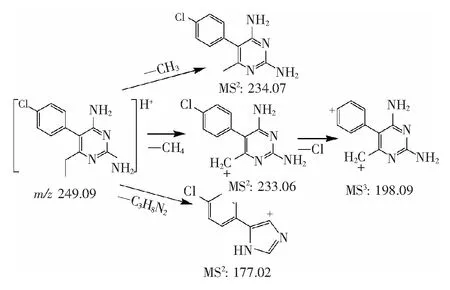
图2 PYR可能的裂解途径Fig.2 Fragmentation pathways for PYR
3.1.1 乙胺嘧啶在血浆中的代谢产物 如图3所示,大鼠单剂量内服PYR(5 mg/kg)后,在6 h的血浆样品中检测出最多代谢物,共8种可能代谢物。其中PM1,PM2, PM3和PM4是PYR的I相代谢物,而PM5, PM6, PM9和PM10为PYR的Ⅱ相代谢物。
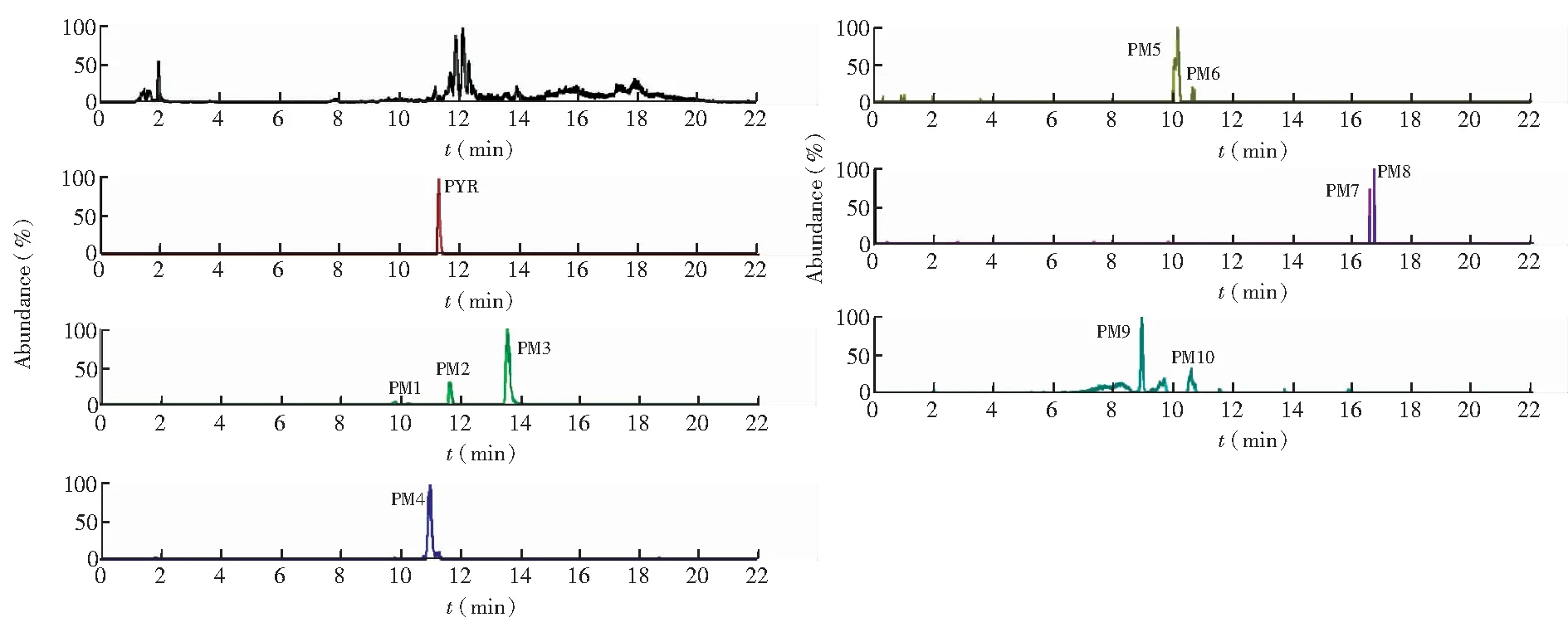
图3 大鼠单剂量内服PYR(5 mg/kg)后6 h血浆中代谢物的精确提取离子色谱图Fig.3 Ion chromatograms (EIC) of plasma from rat at 6 h after oral administration of PYR at 5 mg/kg
3.1.2 乙胺嘧啶在排泄物中的代谢产物 在12~24 h时间段的尿液样品中,检测出最多的10种代谢产物,其中PM7和PM8只在尿液种检出,见图4。而在12~24 h时间段粪便样品中,共检出9种代谢物,相比尿液中少了PM10,见图5。各代谢物的分子式、预测分子量、实测分子量,碎片离子信息及误差见表2。各代谢物实测精确分子量的误差均在5 ppm以内,表明各代谢物元素组成的可信度很高。
3.2 乙胺嘧啶的Ⅰ相代谢物
乙胺嘧啶Ⅰ相代谢物的精确MSn质谱图如图6。Ⅰ相代谢物PM1, PM2和PM3的保留时间(tR)分别为10.48,11.86和 13.77 min,质子分子离子峰[M+H]+均为m/z265.09,比质子化的PYR多16 Da,提示均为氧化所得,但氧化方式则可能是芳环上的氧化或嘧啶环N位的配位氧化。对三者进行MSn分析,发现PM2和PM3的主要二级碎片离子脱掉一分子H2O和OH-得到[M+H-H2O]+(m/z247.07)和[M+H-OH]+(m/z248.08),而m/z248.08恰好是未质子化的PYR的分子量,将m/z248.08继续碎裂得到的主要三级碎片离子为在苯环的3、4号位去掉HCl而得到的[M+H-OH-HCl]+(m/z212.11),从而推测PM2和PM3分别为PYR嘧啶环上3-N位和1-N位发生氧化的产物(3 or 1-N-oxide-PYR);而PM1的主要二级碎片离子只有[M+H-H2O]+(m/z247.07),其三级碎片离子[M+H-H2O-Cl]+(m/z212.11)却与PM2和PM3的相同,这说明PM1较PM2和PM3在氧化方式上可能有所不同,加之PM1的保留时间最早,故推测PM1为极性较强的苯环上羟基化产物。而芳环上的羟基化是芳香化合物首先被代谢为相应的环氧化物,之后发生NIH迁移重排成酚。有研究表明,含卤素的芳环也会发生NIH迁移,例如对-氯安非他明在大鼠肝脏中可代谢为3-氯-4-羟基安非他明[18]。据此推测出PM1的化学结构(4′-OH-PYR),见图8。
表2 PYR及其代谢物的可能分子式、保留时间、实测分子量、预测分子量和主要碎片离子
Table 2 Predicated formula, retention time, observed mass, predicated mass, mass errors and major fragment ions of PYR and its metabolites

代谢物Metabolites分子式Formular([M+H]+)保留时间Retentiontime(min)实测值Observedvalue(Da)预测值Predictedvalue(Da)碎片离子Fragmentions(m/z)代谢方式MetabolitedescriptionPYR[C12H13N4Cl+H]+11.42249.08997249.09015233.06,177.02,198.09-PM1[C12H13ON4Cl+H]+10.48265.08496265.08507247.07,212.114'-HydroxylationPM2[C12H13ON4Cl+H]+11.86265.08502265.08507247.07,248.08,212.113-N-oxidationPM3[C12H13ON4Cl+H]+13.77265.08496265.08507247.07,248.08,212.111-N-oxidationPM4[C12H13O2N4Cl+H]+11.09281.07977281.07998212.06,249.05,231.04DioxidationPM5[C18H21O6N4Cl+H]+10.33425.12198425.12224249.09,233.06,177.022-N-glucuronidationPM6[C18H21O6N4Cl+H]+10.85425.12183425.12224249.09,233.06,177.024-N-glucuronidationPM7[C19H23O6N4Cl+H]+10.92439.13733439.13789249.09,233.06,177.024-N-methylation+2-N-glucuronidationPM8[C19H23O6N4Cl+H]+11.42439.13733439.13789249.09,233.06,177.022-N-methylation+4-N-glucuronidationPM9[C18H21O7N4Cl+H]+8.97441.11853441.11715265.09,247.074'-Hydroxylation+glucuronidationPM10[C18H21O7N4Cl+H]+10.70441.11679441.11715265.09,247.07,248.083-N-oxidation+glucuronidation
PM4(tR=11.09 min)的质子分子离子峰[M+H]+为m/z281.08,比质子化的PYR多32 Da。PM4的二级碎片离子主要有[M+H-O-CH4]+(m/z249.05)和[M+H-O2-C2H4]+(m/z212.06),
以m/z249.05为先导离子的主要三级碎片为[M+H-O-CH4-H2O]+(m/z231.04),因此,推测PM4是PYR的双氧化产物(Dioxide-PYR),考虑其保留时间介于PM1和PM2之间,最可能是PYR经3-N-氧化和苯环上羟基化所得。

图4 大鼠单剂量内服PYR(5 mg/kg)后12~24 h尿液中代谢物的精确提取离子色谱图Fig.4 Ion chromatograms (EIC) of urine between 12 and 24 h from rat after oral administration of PYR at 5 mg/kg
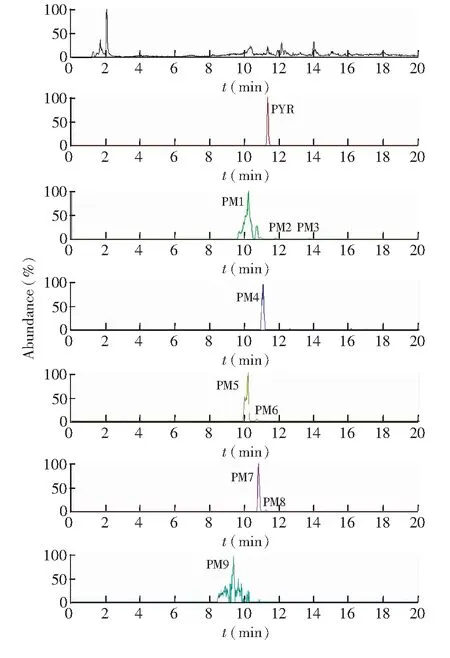
图5 大鼠单剂量内服PYR(5 mg/kg)后12~24 h粪便中代谢物的精确提取离子色谱图Fig.5 Ion chromatogram (EIC) of feces between 12 and 24 h from rat after oral administration of PYR at 5 mg/kg
3.3 乙胺嘧啶的Ⅱ相代谢物
乙胺嘧啶Ⅱ相代谢物的精确MSn质谱图如图7。
PM5(tR=10.33 min)和PM6(tR=10.85 min)的质子分子离子峰[M+H]+均为m/z425.12,比质子化的PYR多176 Da,恰是葡萄糖醛酸(C6H8O6)的分子量。在MSn分析中,二者的二级碎片离子主要有[M+H- C6H8O6]+(m/z249.09),并且以m/z249.09作为先导离子的三级质谱中得到了m/z233.06和177.02,这与质子化PYR的一级和二级质谱完全相同。由此判断PM5和PM6分别为PYR的2或4-N-葡萄糖醛酸结合物(2 or 4-N-Glucuronide-PYR)。
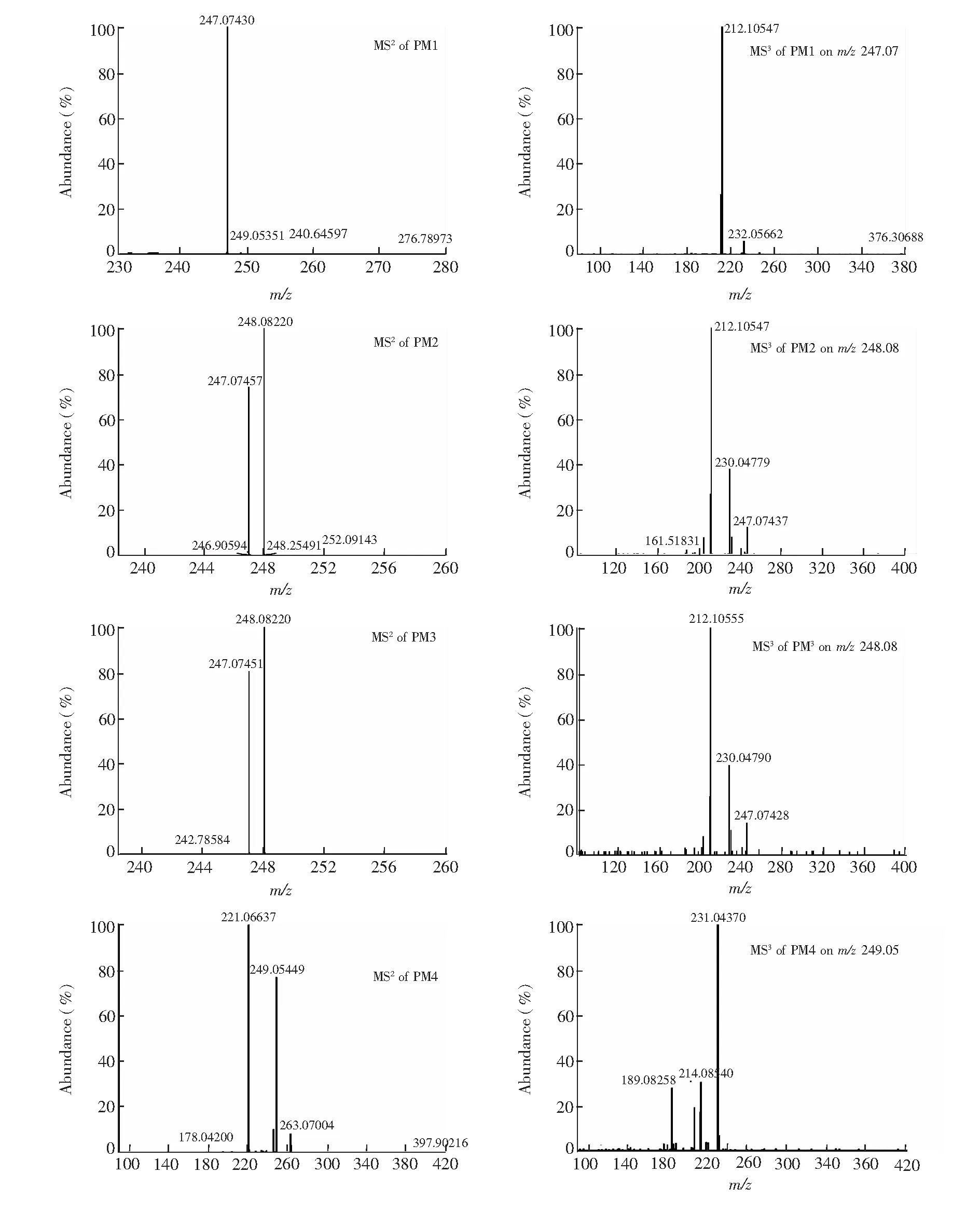
图6 PYRⅠ相代谢物的MSn质谱图(PM1~PM4)Fig.6 MSn spectra of phaseⅠPYR metabolites (PM1-PM4)
PM7(tR=10.92 min)和PM8(tR=11.42 min)的质子分子离子峰[M+H]+均为m/z439.14,比PM5和PM6多14 Da,恰与CH2的分子量相同,提示PM7和PM8可能分别是PM5和PM6的甲基化产物。在MSn分析中,两者的二级质谱也得到碎片离子[M+H-C6H8O6-CH2]+(m/z249.09),以m/z249.09作为先导离子的三级质谱扫描中同样得到与质子化PYR的二级质谱完全相同的碎片离子m/z233.06和177.02。由此推断PM7和PM8分别是PM5和PM6的2或4-N-甲基化产物(2-N-Methyl-4-N-Glucuronide-PYR or 4-N-Methyl-2-N-Glucuronide-PYR)。
PM9(tR=8.97 min)和PM10 (tR=10.70 min)的质子分子离子峰[M+H]+为m/z441.12,比m/z265.09(PM1, PM2和PM3)多176Da,比m/z425.12(PM5和PM6)多16 Da,提示PM9和PM10可能是PYR经过氧化和葡萄糖醛酸结合后的代谢产物。在MSn分析中,PM9和PM10的二级质谱均得到了碎片离子m/z265.09,但是以m/z265.09作为先导离子的三级碎片离子,两者略有不同。PM9的主要三级碎片是m/z247.07,而PM10的主要三级碎片却得到m/z247.07和 248.08,分别与PM1和PM2主要二级碎片离子相同,因此,推断PM9是PYR经过4′-羟基化,进一步葡萄糖醛酸结合后的产物(4′-OH-N-Glucuronide-PYR),PM10则是PYR经过3-N氧化,进一步葡萄糖醛酸结合后的产物(3-N-oxide-N-Glucuronide-PYR)。
3.4 乙胺嘧啶在大鼠体内可能的代谢谱系
综上所述,PYR在大鼠体内的所有可能Ⅰ相和Ⅱ相代谢途径,见图7。PYR的Ⅰ相代谢方式主要包括苯环上的羟基化,嘧啶环上N位的氧化;Ⅱ相代谢方式则主要是嘧啶环上NH2位的葡萄糖醛酸结合和NH2位的甲基化(见图8)。
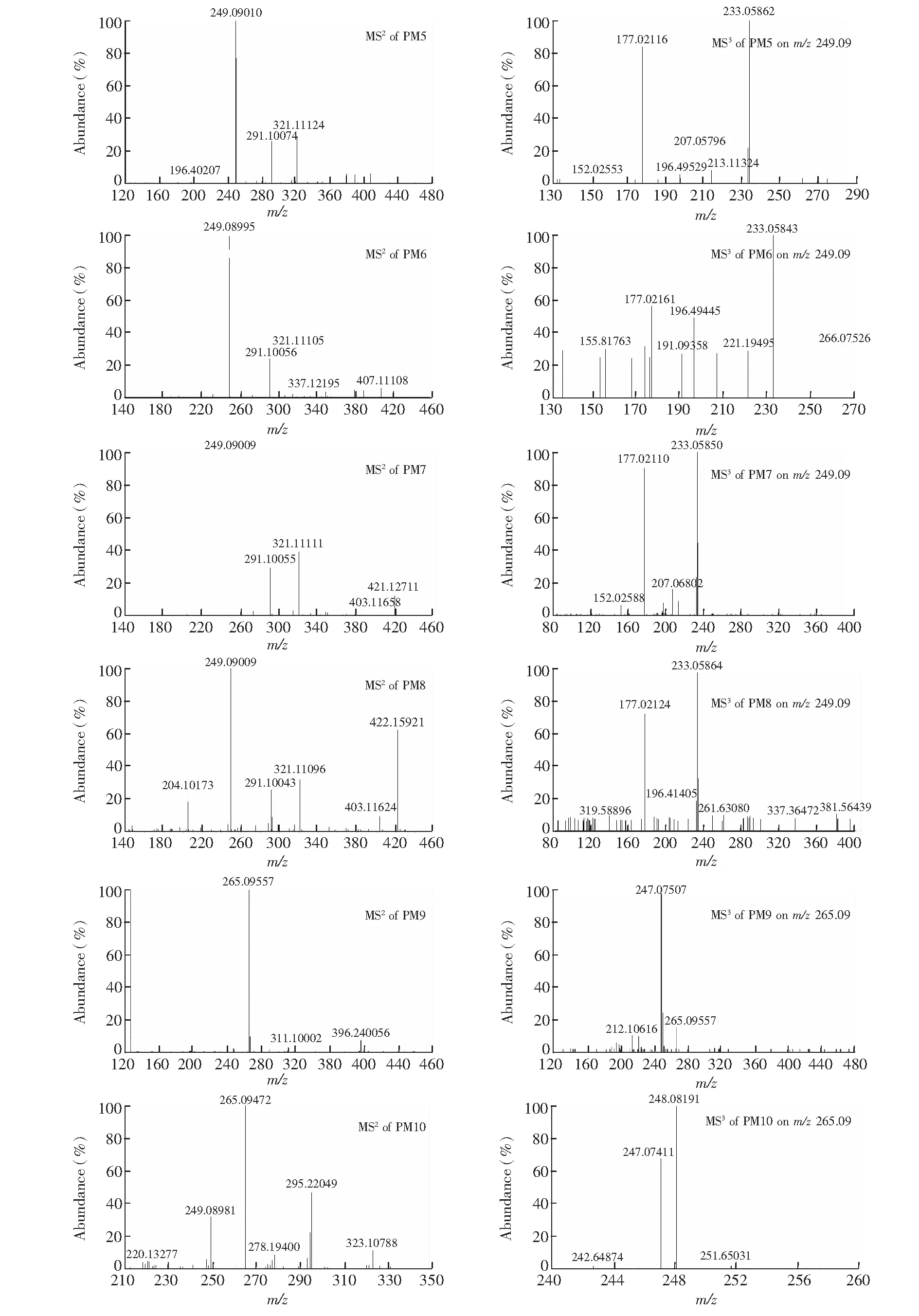
图7 PYRⅡ相代谢物的MSn质谱图(PM5~PM10)Fig.7 MSn spectra of phase II metabolites of PYR (PM5-PM10)
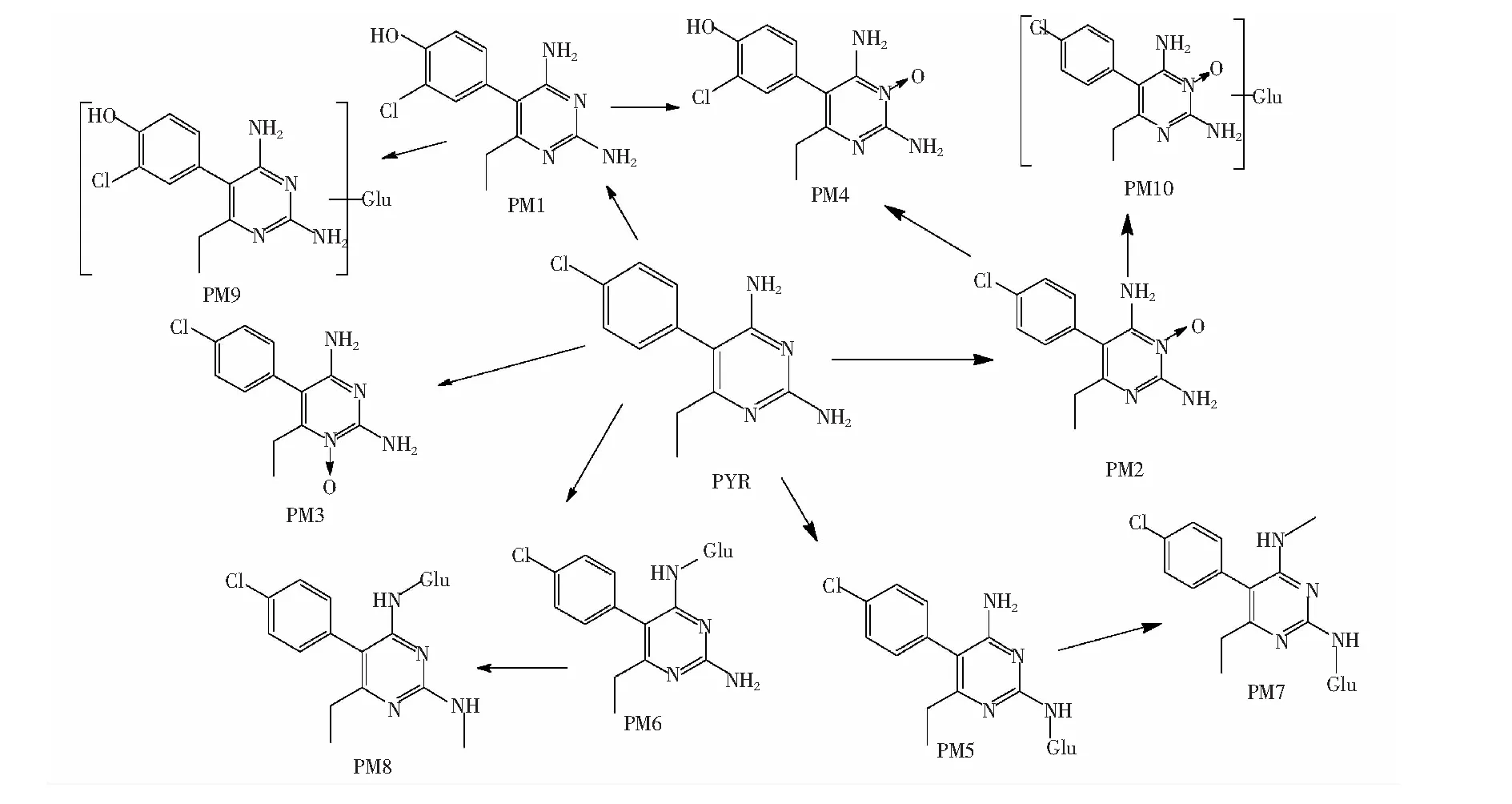
图8 PYR在大鼠体内可能的代谢途径Fig.8 Metabolic pathways of PYR in rats
4 结 论
在PYR早期的大鼠体外肝脏灌流代谢研究中,Coleman等[8]运用C14同位素标记法结合HPLC检测的方法,发现灌流液的PYR及PYR的3-N氧化物的AUC0~5h之和仅占C14总标记量AUC0~5 h的57%,表明PYR除3-N氧化物在肝脏中还被代谢成其它一些结构不明的代谢物。本研究以具有高分辨率和高精确度的LTQ-Orbitrap-MS的仪器方法结合MetWorks 1.2软件,分析鉴定出PYR在大鼠体内的代谢产物。除3-N-oxide-PYR外,首次发现了另外9种代谢物,分别是4′-OH-PYR(PM1), 1-N-Oxide-PYR(PM3), Dioxide-PYR (PM4), 2 or 4-N-Glucuronide-PYR(PM5和PM6), 2-N-Methyl-4-N-Glucuronide-PYR(PM7), 4-N-Methyl-2-N-Glucuronide-PYR(PM8), 4′-OH-N-Glucuronide-PYR(PM9)以及N-Oxide-N-Glucuronide-PYR(PM10)。
HPLC-LTQ-Orbitrap在本研究中展现出在复杂基质中鉴定未知代谢物的优势,提供了精确可靠的数据,使得PYR在大鼠体内的代谢产物得以顺利被鉴定出,这为PYR进一步的毒性评估和食品动物药物残留的研究提供了重要实验依据。
1 Nelson R G, Rosowsky A.AntimicrobAgentsChemother, 2001, 45(12): 3293-3303
2 Steeve G, Antimicrobial Therapy in Veterinary Medicine.Wiley-BlackwellPress, 2013: 293
3 Satoh K, Kojima N, Furuno M, Kokue E, Hayama T.CongenitalAnomalies, 1991, 31(4): 323-328
4 Kalla N R, Saggar S K, Puri R, Mehta U.Res.Exp.Med. (Berl), 1997, 197(1): 45-52
5 Vijayalaxmi K K, Vishalakshi M.TeratogCarcinogMutagen, 2000, 20(2): 65-71
6 Sullivan G E, Takacs E.Teratology, 1971, 4(2): 205-209
7 Peters P J, Thigpen M C, Parise M E, Newman R D.DrugSaf., 2007, 30: 481-501
8 Coleman M D, Mihaly G W, Ward S A, Edwards G, Howells R E, Breckenridge A M.Biochem.Pharmacol., 1985, 34(12): 2193-2197
9 El-Ghomari K, Gorrod J W.Eur.J.DrugMetab.Pharmacokinet, 1987, 12(4): 253-258
10 Junza A, Montane A, Barbosa J, Minguillon C, Barron D.J.Chromatogr.A, 2014, 1368: 89-99
11 GUO Yan-Lei, WU Ming-Jun, LI Wen-Juan, JIANG Zheng, YE Fang-Ting, YU Chao.ChineseJ.Anal.Chem., 2013, 41(7): 1074-1079
郭延垒, 吴明军, 李文娟, 江 峥, 叶芳挺, 于 超. 分析化学, 2013, 41(7): 1074-1079
12 Caprioli G, Logrippo S, Cahill M G, James K J.Int.J.FoodSci.Nutr., 2014, 65(8): 942-947
13 Shan Q, Liu Y, He L, Ding, H, Huang X, Yang F, Li Y, Zeng Z.J.Chromatogr.B, 2012, 881-882: 96-106
14 Van Meulebroek L, Bussche J V, Steppe K, Vanhaecke L.J.Chromatogr.A, 2012, 1260: 67-80
15 DING Tao, LÜ Chen, LIU Han, GUO Ling, WU Bin, CHEN Guo-Song, SHEN Chong-Yu, ZHANG Rui, FEI Xiao-Qing, ZHANG Xiao-Yan, YU Jin-Liang.JournalofInstrumentalAnalysis, 2014, 33(1): 27-32
丁 涛, 吕 辰, 柳 菡, 郭 玲, 吴 斌, 陈国松, 沈崇钰, 张 睿, 费晓庆, 张晓燕, 庾金良. 分析测试学报,2014, 33(1): 27-32
16 Wang H, Yuan B, Zeng Z, He L, Ding H, Guo C, Kong X, Wang W, Huang X.J.Chromatogr.B, 2014, 965: 91-99
17 JIANG Yan-Bin, SHAN Ji-Hao, WANG Ying, CAI Ying-Hua, TIAN Ya-Ping.Chin.J.Pharm.Anal., 2014, (3): 385-391
姜艳彬, 单吉浩, 王 莹, 蔡英华, 田亚平. 药物分析杂志, 2014, (3): 385-391
18 Silverman R B.TheOrganicChemistryofDrugDesignandDrugAction, Translated by GUO Zong-Ru, XIAO Zhi-Yan, LIU Zhan-Zhu, YU Xiao-Ming, XU Bo-Ling, Beijing: Chemical Industry Press, 2007: 320-322
Silverman R B. 有机药物化学(第二版). 郭宗儒, 肖志艳, 刘站柱, 俞晓明, 徐柏玲译. 北京: 化学工业出版社, 2007: 320-322
(Received 17 April 2015; accepted 12 September 2015)
In vivo Identification of Metabolites of Pyrimethamine in Rats by Liquid Chromatography-Linear Ion Trapped-Orbitrap Mass Spectrometry
HUAI Bin-Bin, GUO Chun-Na, LI Qiang, GAO Jin, XIE Shun, HUANG Xian-Hui*
(CollegeofVeterinaryMedicine,NationalReferenceLaboratoryofVeterinaryDrugResidues,SouthChinaAgriculturalUniversity,Guangzhou510640,China)
The metabolism of pyrimethamine (PYR) after a single oral administration at a dose of 5 mg/kg in rats was investigated. In vivo samples including rat plasma, urine and feces were collected respectively at different times. We performed liquid chromatography tandem two-dimensional linear ion trapped orbitrap mass spectrometry spectrometer (LC-LTQ-Orbitrap MS) to identify the unknown metabolites of PYR. Then 10 metabolites of PYR were found in rats with this approach, which indicates that hydroxylation on benzene ring,N-oxidation, dioxidation,N-glucuronidation, methylation+glucuronidation, hydroxylation+glucuronidation andN-oxidation+glucuronidation were the major metabolic pathways of PYR in rats. 9 of these metabolites were identified in vivo for the first time while the PYR 3-N-oxide was ever detected in vitro metabolism of PYR in isolated rat liver. We identified the structure of the metabolites according to their accurate mass data and the characteristic MSn product ions. Based on the above analyses, we proposed the phase I and II metabolic pathways for PYR in rat. The major phase I metabolites were formed via hydroxylation andN-oxidation pathways, and the major phase II metabolites were methylation and glucuronidation.
Pyrimethamine; Rats; Liquid chromatography tandem two-dimensional linear ion trapped-orbitrap mass spectrometry; Metabolites
10.11895/j.issn.0253-3820.150309
2015-04-17收稿;2015-09-12接受
本文系农业行业标准制修订项目(No.201391194)资助
* E-mail: xhhuang@scau.edu.cn
——α-葡萄糖醛酸酶的研究进展*

