G6P[5]型牛轮状病毒的分离鉴定
闻晓波,张玲玲,倪宏波,刘阳阳,曹思,冉旭华
(黑龙江八一农垦大学动物科技学院/动物医学省重点实验室,大庆163319)
G6P[5]型牛轮状病毒的分离鉴定
闻晓波,张玲玲,倪宏波,刘阳阳,曹思,冉旭华
(黑龙江八一农垦大学动物科技学院/动物医学省重点实验室,大庆163319)
轮状病毒(Rotavirus,RV)是全世界范围内引发多种幼龄动物及婴幼儿病毒性腹泻的最主要病原之一,给畜牧业发展和人类健康造成严重危害。通过RT-PCR对来自宁夏犊牛腹泻粪样进行检测,选取阳性样品经MA104细胞进行病毒分离。细胞盲传4代后出现CPE,至7代后细胞CPE现象明显,获得1株牛轮状病毒,扩增VP7、VP4基因并测序分析,结果表明该分离株属于G6P[5]型轮状病毒,命名为NX28。研究明确了G6P[5]型在国内牛群中的存在及流行,并为下一步的牛轮状病毒的分子流行病学研究奠定基础。
牛;轮状病毒;基因型;G基因型;P基因型
轮状病毒(Rotavirus,RV)是全世界范围内引发多种幼龄动物及婴幼儿腹泻的最主要病原之一,给畜牧业发展和人类健康造成严重危害[1-2]。牛轮状病毒(bovine rotavirus,BRV)性腹泻是由牛轮状病毒病毒引起的主要以腹泻、精神沉郁、厌食、脱水为特征,其中7日龄以内犊牛最易感染,发病率高达90%~100%,病死率达10%~50%。以英国为例,犊牛轮状病毒性腹泻的发病率为60%~80%,死亡率最高可达50%[3]。
RV为呼肠孤病毒科成员,呈二十面体结构,三层蛋白衣壳包绕着11节段的dsRNA,其基因组编码6种结构蛋白和6种非结构蛋白。其中外层衣壳由VP7和VP4蛋白组成,两者在病毒侵入、致病性以及RV感染组织嗜性上均起到重要作用,且均能够独立诱导中和抗体。VP7和VP4分别决定了RV的G基因型和P基因型。
1969 年美国Mebus等[4-5]首次通过电镜从犊牛腹泻粪便中鉴定出BRV,目前BRV呈全球性分布,给养牛业造成加大的经济损失。1981年我国首次于水牛、黄牛的腹泻样品中鉴定出BRV。哈尔滨兽医研究所于力课题组对2005~2006年期间在对来自国内12个地区收集的1 760份牛血清进行血清流行病学调查,总体阳性率高达99%,只是不同地区强阳性、中等阳性及弱阳性血清所占比例有所不同。数据表明BRV在国内牛群中的感染和流行不但非常广泛,而且极为严重[6]。近年来,随着我国养牛业的大力发展及进口牛只的增多,BRV流行株的基因型也呈多样化。例如,黑龙江八一农垦大学侯喜林课题组于2008年12月至次年6月在大庆地区分离出G10P[11]型RV[7]。常继涛等在新疆和内蒙古地区分离出G10(G10P[11])和G6(P基因型未知)型BRV[6]。因RNA病毒易通过点突变完成抗原变异或者抗原漂移,更重要的是RV为分节段的双链RNA病毒,又可以通过基因重配机制来实现抗原变异,甚至扩大宿主范围。例如从牛群中分离到一株禽源的G17P[17]基因型轮状病毒(Bo/993/83),推测其为种间传播的结果[8]。所以,掌握流行毒株的基因型不但为疾病的防控提供依据,而且更为评估疫苗免疫效力及新疫苗的研发提供指导。
研究中,利用RT-PCR方法鉴定来源于宁夏银川犊牛腹泻粪样,阳性样品经细胞分离,成功的分离到一株犊牛轮状病毒。选取VP4、VP7基因上相对保守区设计引物,扩增片段经测序验证,与GenBank所公布的牛轮状病毒经典参考毒株构建进化树,证实所分离的BRV为G6P型[5],为我国牛轮状病毒的鉴定、诊断及防治提供了依据。
1 材料和方法
1.1 菌株、质粒及主要试剂
E.coli TOP 10感受态细胞、pMD-19T Simple克隆载体、DNA Marker(TaKaRa)、TRIzo(lInvitrgon)、反转录试剂盒(Thermo Scientific),质粒小提试剂盒(Axygen),GoTaqGreen Master Mix(Promega),DMEM(Gibco BRL),胎牛血清(杭州四季青生物工程材料有限公司),其他试剂均为国产分析纯。
1.2 实验方法
1.2.1 引物设计
根据GenBank上公布的BRV参考序列设计鉴定引物RV Up/Low(VP6基因)及VP4、VP7扩增引物,委托北京六合华大基因科技股份有限公司合成,序列如下:

表1 轮状病毒引物序列信息Table 1The sequence of primers
1.2.2 病料处理
来自宁夏回族自治区某规模化牛场犊牛腹泻粪便,以0.01 mol·L-1PBS(pH 7.4)制成20%粪便悬液,2 000 rpm 4℃离心10 min,取上清(1 mL)经滤过除菌,300 μL用于RNA提取,剩余样品-20℃保存备用。
1.2.3 BRV鉴定
取粪样上清300 μL,TRIzol提取总RNA,参照Thermo反转录试剂盒说明书进行反转录,体系如下:RNA 3 μL,随机引物1 μL,Nuclease-free water 8.5 μL,65℃5 min,冰浴2 min;加入5×Reaction buffer 4 μL,dNTP(10 mmol·L-1)2 μL,RevertAid Reverse Transcriptase 1 μL,RiboLock RNase Inhibitor 0.5 μL,42℃2 h,70℃10 min。PCR反应体系如下:GoTaq○RGreen Master Mix 12.5 μL,cDNA3 μL, Up/Low引物各1 μL,ddH2O补至25 μL;PCR参数:95℃3 min;95℃30 s,55℃30 s,72℃1 min,35个循环;72℃10 min,1%琼脂糖凝胶电泳进行鉴定。
1.2.4 病毒扩增
取过滤的BRV阳性样品粪便上清以胰酶(终浓度5 μg·mL-1)于37℃处理30 min,PBS洗涤MA104单层细胞(25 cm2)3遍。处理后样品接种细胞,37℃吸附1 h后,补加5 mL DMEM(含0.5 μg·mL-1胰酶),37℃于5%CO2细胞培养箱中培养,盲传3-5代,直至产生细胞病变(CPE),所分离的病毒命名为NX28。
1.2.5 VP4、VP7基因的扩增
取600 μL病毒液,提取RNA并进行反转录,取cDNA以VP4 Up/Low、VP7 Up/Low分别进行扩增,体系如下:GoTaqGreen Master Mix 25 μL,cDNA 8 μL,Up/Low引物各2 μL,补加灭菌纯水至50 μL。PCR参数:95℃3 min;95℃30 s,47℃(VP4)/53℃(VP7)30 s,72℃1 min,35个循环;72℃10 min。
1.2.6 PCR产物的克隆与测序
PCR产物经1%琼脂糖凝胶电泳,Wizard○R SV Gel and PCR Clean-Up System试剂盒回收纯化后,与pMD19-T载体16℃连接5 h。连接产物转化至TOP 10感受态细胞,涂布于LB固体培养基(含氨苄青霉素100 μg mL-1),37℃过夜培养,挑取单个菌落于LB液体培养基过夜震荡培养。碱裂解法提取质粒,经通用引物M13R/F进行PCR鉴定为阳性的质粒命名为pMD19-T-RV-VP4及pMD19-T-RVVP7,并进行序列测定。
1.2.7 进化树分析
利用分子生物学软件对BRV分离株VP4、VP7部分编码序列测序结果进行分析,并参照GenBank已收录的BRV序列,采用Mega 6.0(邻近法)构建VP4、VP7部分基因系统进化树,系统发生统计学方法利用1 000 bootstrap进行计算。
2 结果与分析
2.1 RT-PCR鉴定结果
提取腹泻样品总RNA,随机引物反转录cDNA,经RV鉴定引物扩增到约183 bp的片段,与预期相符(图1)。

图1 牛轮状病毒的RT-PCR鉴定Fig.1Identification of bovine rotavirus with RT-PCR
2.2 VP4、VP7基因的扩增
分离毒株在MA104细胞传至4代,细胞出现CPE,传至7代细胞CPE明显,提取接毒细胞上清的总RNA,以VP4引物扩增到约874 bp的条带,VP7引物扩增出约901 bp的条带,与预期相符(图2)。

图2 轮状病毒分离株VP4、VP7基因片段的RT-PCR扩增Fig.2RT-PCR amplification of VP4 and VP7 segments of isolated rotavirus P4 and VP7 fragments
2.3 重组质粒的鉴定
以重组质粒为模板,以通用引物M13-R/F进行PCR鉴定,所得片段大小与预期相符。

图3 pMD19T-VP4和pMD19T-VP7重组质粒的PCR鉴定Fig.3Identification of pMD19T-VP4 and pMD19T-VP7 recombinant plasmids by PCR
2.4 进化树分析
进化树分析结果表明,NX28-VP7与G6型牛轮状病毒处于同一进化分支(图4)。NX28-VP7与JF693067(G6型)的核苷酸同源性为97%,与EF554120(G6型)的核苷酸同源性为92.4%,而与其他G基因型(G1、G8或G10)的同源性为75.4%~83.1%。NX28-VP4与P[5]型轮状病毒处于同一进化分支(图5)。NX28-VP4与KC815661(P[5]型)的核苷酸同源性为93.8%,与GU565088(P[5]型)的核苷酸同源性为93.4%,与AY050271(P[5]型)的核苷酸同源性为90.1%,而与其它P基因型(P[1]、P[11]或P[6])的同源性为68.9%~74.5%。
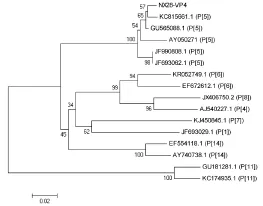
图5 NX28-VP4基因进化树分析Fig.5Phylogenic tree of VP4 of NX28
3 结论与讨论
早期的研究结果认为VP7与病毒的黏附有关,但现在越来越多的证据表明VP7具有稳定VP4结构的作用。在病毒侵入细胞的过程中,VP4起到关键作用。VP4能被胰蛋白酶(Trypsin)裂解为VP5*(60 kDa)和VP8*(26 kDa)。VP5*蛋白含有一个与有囊膜病毒,如流感病毒类似的区域,它能够增加细胞膜的通透性,提高病毒侵入细胞的能力,可以极大地提高RV的感染性。研究中,在接种MA104细胞前,使用终浓度为5 μg·mL-1的胰蛋白酶于37℃处理病毒接种物30 min,并在维持液中加入胰蛋白酶(终浓度为0.5 μg·mL-1)以此提高病毒的感染力。国内某些实验室在进行轮状病毒的分离过程中,使用20 μg·mL-1的胰蛋白酶处理病毒接种物,并在细胞维持液中添加5 μg·mL-1的胰蛋白酶。高浓度的胰蛋白酶将会对RV和细胞造成一定程度的伤害,降低病毒的感染性,易造成病毒丢失。试验中,病毒接种物在接种MA104细胞后并盲传几代,在盲传至第4代起,细胞开始表现出轻微的CPE现象。当传代至第7代后,CPE现象逐渐明显,细胞表现为圆缩、脱落。由于RV存在宿主范围限制现象,病毒分离需要逐渐适应细胞培养,才能表现出CPE。除了MA104细胞外,Marc145细胞(MA104细胞的克隆株)也可以用于BRV的分离,如苏小康等[9]通过Marc145细胞从犊牛腹泻粪便中成功分离到BRV。
全世界范围内,目前BRV至少已经鉴定出12个G基因型(G1~G3、G5、G6、G8、G10、G11、G15、G17、G21和G24)和11个P基因型(P[1]、P[3]、P[5~7]、P[11]、P[14]、P[17]、P[21]、P[29]和P[33])[10-11]。在G基因型中,以G6、G8和G10型最为常见,通常与P[1]、P[5]或P[11]型组合,较为常见的G-P基因型组合为G10P[11]、G6P[5]或G6P[1][12-13]。2007年姜向阳于陕西省分离了G10型BRV[14];2008年常继涛等人报道于新疆、内蒙古分离了G10P[11]型BRV,并于黑龙江分离到G6型BRV(P基因型未知)[6,15];2010年谢金鑫等[7,16]于黑龙江省大庆地区分离了一株G10型BRV(P基因型未知)。在全世界范围内,G6、G8和G10型BRV为主要的流行毒株,而我国流行的BRV为G6和G10型,尚未有G8型BRV的报道。
研究中,所分离的病毒证实为G6P[5]型BRV,虽然此前国内曾有G6型BRV的分离报道,但是确切的P基因型尚不清楚。对NX28分离株所扩增的部分VP4基因序列与KC815661(P[5]型)VP4(P[5]型)基因同源性较高,核苷酸同源性大于93%。另外,需要指出的是,Ghosh等[17]报道了从马体内分离到一株轮状病毒(OH-4),其全基因组序列分析表明,其VP7、VP4、VP3、NSP1、NSP3和NSP5基因均来自于牛轮状病毒,再一次证实了基因重配在RV进化和种间传播上的作用,BRV可以作为其他动物轮状病毒的潜在来源。下一步将对NX28分离株进行全基因组序列测定,分析其与经典病毒株及疫苗株的亲缘关系,为BRV分子流行病学和疫苗效力评价奠定基础。
[1]Anderson E J,Weber S G.Rotavirus infection in adults[J].Lancet Infect Dis,2004,4(2):91-99.
[2]Walker D,Rheingans R.Cost-effectiveness of rotavirus vaccines[J].Expert Rev Pharmacoecon Outcomes Res,2005(5):593-601.
[3]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[4]叶树华.犊牛轮状病毒病的防治[J].畜牧兽医科技信息,2008(6):48.
[5]倪艳秀,林继煌,陆承平,等.逆转录-聚合酶链反应(RT-PCR)检测轮状病毒[J].中国兽医学报,1998,18(5):22-25.
[6]常继涛,崔久辉,李建军,等.我国部分地区牛轮状病毒的病原学调查及一株G10P[11]型牛轮状病毒的分离鉴定[J].中国预防兽医学报,2008,30(10):755-759.
[7]谢金鑫.大庆地区牛轮状病毒的分离及其全序列分析[D].大庆:黑龙江八一农垦大学,2010.
[8]Mitake H,Ito N,Okadera K,et al.Detection of avian-like rotavirus A VP4 from a calf in Japan[J].J Vet Med Sci,2015,77(2):221-224.
[9]苏小庚,吴周良,王正秀,等.犊牛轮状病毒的分离鉴定[J].河北农业大学学报,2005,28(4):93-96.
[10]Martella V,Banyai K,Matthijnssens J,et al.Zoonotic aspects of rotaviruses[J].Vet Microbiol,2010,140(3-4):246-255.
[11]Matthijnssens J,Ciarlet M,McDonald S M,et al.Uniformity of rotavirus strain nomenclature proposed by the Rotavirus Classification Working Group(RCWG)[J]. Arch Virol,2011,156(8):1397-1413.
[12]翟凤艳,张柯,李娟,等.新乡地区链格孢菌病害病原鉴定[J].河南科技学院学报:自然科学版,2015,43(5): 30-35.
[13]李志强,何德,李翠新.基于兼并引物的PCR扩增特定基因的效果比较[J].湖北民族学院学报:自然科学版,2015(2):170-173.
[14]姜向阳.陕西省牛轮状病毒的分离鉴定及其VP7基因的遗传变异分析[D].陕西:西北农林科技大学,2007.
[15]常继涛.牛轮状病毒病原流行病学调查、基因重配毒株的构建及二价减毒株的免疫原性评价[D].北京:中国农业科学院,2009.
[16]谢金鑫,侯喜林,董华兴,等.新生牛轮状病毒的分离及其基因型鉴定[J].黑龙江八一农垦大学学报,2010,22(5):56-59.
[17]Ghosh S,Taniguchi K,Aida S,et al.Whole genomic analyses of equine group A rotaviruses from Japan:evidence for bovine-to-equine interspecies transmission and reassortment events[J].Vet Microbiol,2013,166(3-4):474-485.
Isolation and Characterization of Bovine Rotavirus with G6P[5]Specificity
Wen Xiaobo,Zhang Lingling,Ni Hongbo,Liu Yangyang,Cao Si,Ran Xuhua
(Provincial Key Laboratory,College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
Rotavirus was the infectious agents leading to the viral diarrhea among numerous species of young animals or infants and children worldwide,which created great impact on the animal industry or human health.The diarrhea samples from Ningxia Hui Autonomous Region were tested by RT-PCR,followed by inoculation of positive samples onto MA104 monolayer cells.The CPE was not observed until the fourth blind inoculation was carried on.The typical CPE was showed after seventh passage.An isolate was identified as G6P[5]genotype by amplification of VP4 and VP7 fragment and phylogenic analysis,which was designated as the NX28.It demonstrated that bovine rotavirus with G6P[5]specificity was circulating in cattle herds in China and would contribute to the analysis of molecular epidemiology of bovine rotaviruses.
bovine;rotavirus;genotype;G genotype;P genotype
S8
A
1002-2090(2016)04-0036-05
10.3969/j.issn.1002-2090.2016.04.009
2015-12-10
国家自然科学青年项基金目(31201909);黑龙江博士后科研启动资助项目(LBH-Q13134);黑龙江省自然科学基金(QC2013C028,C2015042)。
闻晓波(1977-),男,副教授,中国农业科学院哈尔滨兽医研究所毕业,现主要从事牛病毒性传染病的流行病学及致病机理研究。
冉旭华,女,副教授,硕士研究生导师,E-mail:ranxuhua@163.com。

