长白猪ESR、PRLR及FSH-β基因多态性及与繁殖性状关联分析
李传锋,王建勇,黄大鹏
(黑龙江八一农垦大学动物科技学院,大庆163319)
长白猪ESR、PRLR及FSH-β基因多态性及与繁殖性状关联分析
李传锋,王建勇,黄大鹏
(黑龙江八一农垦大学动物科技学院,大庆163319)
ESR基因、PRLR基因和FSH-β基因是调控猪繁殖性状的候选功能基因,以这三个基因为候选基因,以100头长白猪为研究对象,利用PCR-RFLP技术对检测到的多态性突变位点进行基因分型。同时,运用系统工程原理,建立繁殖性能指数,构建三个基因不同的多态位点与繁殖性能指数的最佳组合基因型,进而将不同的基因型分别与繁殖指数进行相关性分析,为人工筛选猪种最佳繁殖性能提供分子标记。三个基因的组合基因型基因效应分析结果表明:组合基因型AACDFF的繁殖指数与组合基因型ABCDFF和BBDDFF的繁殖指数分别相差3.34和3.16,表现为差异显著(P<0.05)。
长白猪;基因多态性;繁殖性状;组合基因型
研究表明,雌激素受体基因(ESR)、催乳素受体基因(PRLR)和促卵泡素亚基基因(FSH-β)是调控猪繁殖性状的候选功能基因,ESR可以激活配体转录因子[1],能转录调控蛋白,ESR广泛存在于动物的细胞浆或细胞核内,参与雌性动物性腺组织的基因表达和调控[2]。催乳素与乳腺上皮细胞的催乳素受体结合,从而刺激乳腺发育,促进乳汁的生成与分泌;PRLR基因可直接作用于卵巢的颗粒细胞,抑制颗粒细胞的芳香酶活性,减少合成雌二醇,抑制排卵[3];FSH-β基因主要是刺激卵泡的生长和发育,影响生长卵泡的数量,并在促黄体素的协同作用下,激发卵泡的最后成熟,诱发排卵[4]。试验以长白猪为实验对象,选用ESR、PRLR和FSH-β三个基因作为候选基因,采用PCR-RFLP技术,检测分析遗传多态性,获得不同猪群的基因频率和基因型频率,并通过与繁殖性状关联分析,获得这三个候选基因在长白猪群中对繁殖性状有显著影响的最佳基因型组合,从而实现高繁殖性能母猪的标记辅助选育,为猪种选育提供理论依据。
1 材料与方法
1.1 试验样品
研究选用哈尔滨谷实种猪繁育有限公司长白猪纯种经产母猪100头的血液样本,血液样本取自耳静脉。同时,现场完整记录所选经产母猪的出生活仔数、初生窝重、泌乳力、断奶窝重(28日龄)四个繁殖性能指标数据。
1.2 主要试剂
北京博凌科为生物科技有限公司:通用基因组DNA快速提取试剂盒;北京康为世纪生物科技有限公司:2×Es Tap Master Mix(含染料);ACD抗凝剂:将0.96 g柠檬酸、2.64 g柠檬酸钠、2.94 g葡萄糖,加ddH2O定容至200 mL,混匀,制备成抗凝剂,经高压灭菌后留存备用。
1.3 引物设计
1.3.1 试验引物设计与合成
根据Genebank中猪的ESR基因内含子3的序列(HF947275),PRLR基因外显子10(HF947279),FSH-β基因内含子1的序列(AF352695),利用Primer5.0设计软件,分别设计出三对引物,所用引物见表1,所有引物交由上海生物工程有限公司合成。其中,FSH-β基因座等位基因的差异是由于E等位基因在FSH-β基因的第1个内含子中存在一个220 bp转座子插入,发生突变,从而电泳产生不同图谱[5]。

表1 各基因引物序列、片段大小Table 1Primer sequences and size of PCR production
1.3.2 ESR、PRLR、FSH-β基因PCR反应体系
根据试验设计,使用北京康为世纪生物科技有限公司生产的2×Es Tap Master Mix(含染料)进行PCR反应,反应体系如表2:

表2 ESR、PRLR、FSH-β基因PCR反应体系Table 2The PCR reaction system of ESR、PRLR、FSH-β
1.3.3 ESR、PRLR、FSH-β基因PCR反应条件
根据表2中的引物,参照北京康为世纪生物科技有限公司生产的2×Es Tap Master Mix,建立最佳PCR反应条件,如表3:
1.3.4 ESR、PRLR、FSH-β基因PCR产物电泳检测
分别对每个体DNA进行PCR扩增反应,取扩增产物5 μL(无需再用上样缓冲液),加入1%的琼脂糖凝胶中,120 V电压电泳中20 min,与1 000 bp DNA Marker作为对照,在凝胶成像系统下观察PCR扩增情况,并照相。PCR产物无杂带,且扩增片段大小与设计相符,可进行下一步操作。
1.4 设计模型
根据系统工程原理和繁殖性能各性状的重要性,设计繁殖性能指数,计算公式如下:
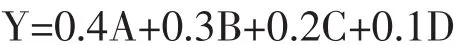
其中:A代表出生活仔数(头);B代表仔猪初生窝重(kg);C代表泌乳力(kg);D代表断奶窝重(kg)。
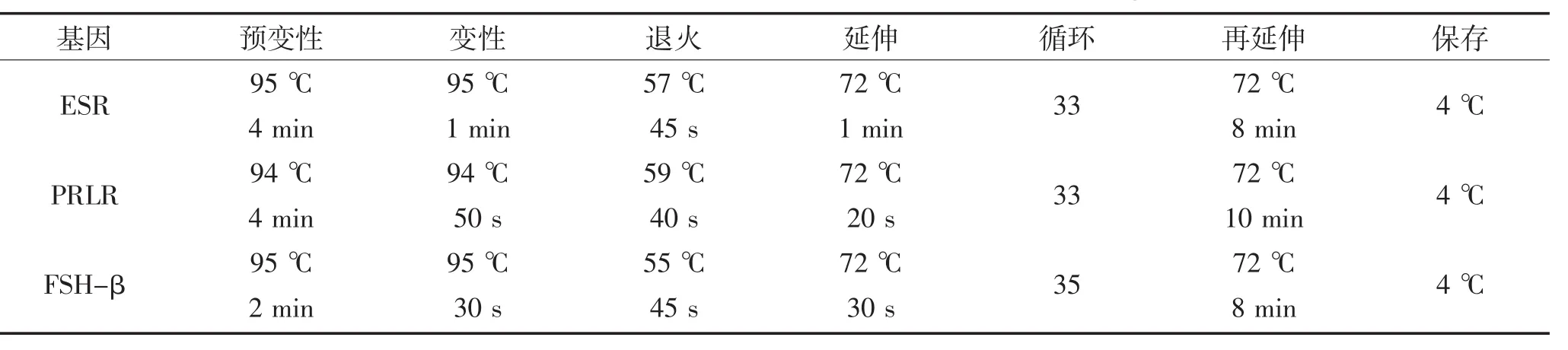
表3 ESR、PRLR和FSH-β基因PCR反应条件Table 3The PCR reaction conditions of ESR,PRLR and FSH-β
2 试验结果与分析
2.1 长白猪ESR、PRLR、FSH-β基因的PCRRFLP检测结果
在100头长白猪中,采用PCR-RFLP检测方法进行试验,结果如图2、图3和图4所示,其中图2泳道2、5为AA型,泳道1、4为AB型,泳道3为BB型,M为DL500Marker;图3中泳道3、5为CC型,泳道1、4为CD型,泳道2为DD型;图4中泳道2为EE型:泳道4、7、8为EF型;泳道1、3、5、6为FF型。
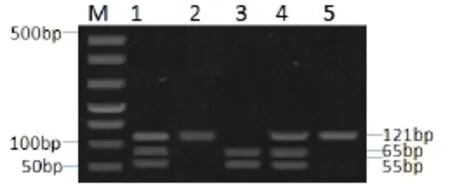
图1长白猪ESR基因扩增产物PCR-RFLP结果Fig.1Results of PCR-RFLP test of Landrace ESR gene amplification products

图2 长白猪PRLR基因扩增产物PCR-RFLP检测结果Fig.2Results of PCR-RFLP testof Landrace PRLR gene amplification products
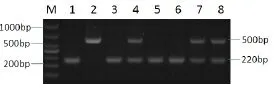
图3 长白猪FSH-β基因PCR-RFLP检测结果Fig.3Results of PCR-RFLP test of Landrace FSH-β gene amplification products
2.2 长白猪三个基因的基因型频率与等位基因频率
检测的100头长白猪中,ESR、PRLR、FSH-β基因基因型分布(头数)、基因型频率和基因频率见表4。
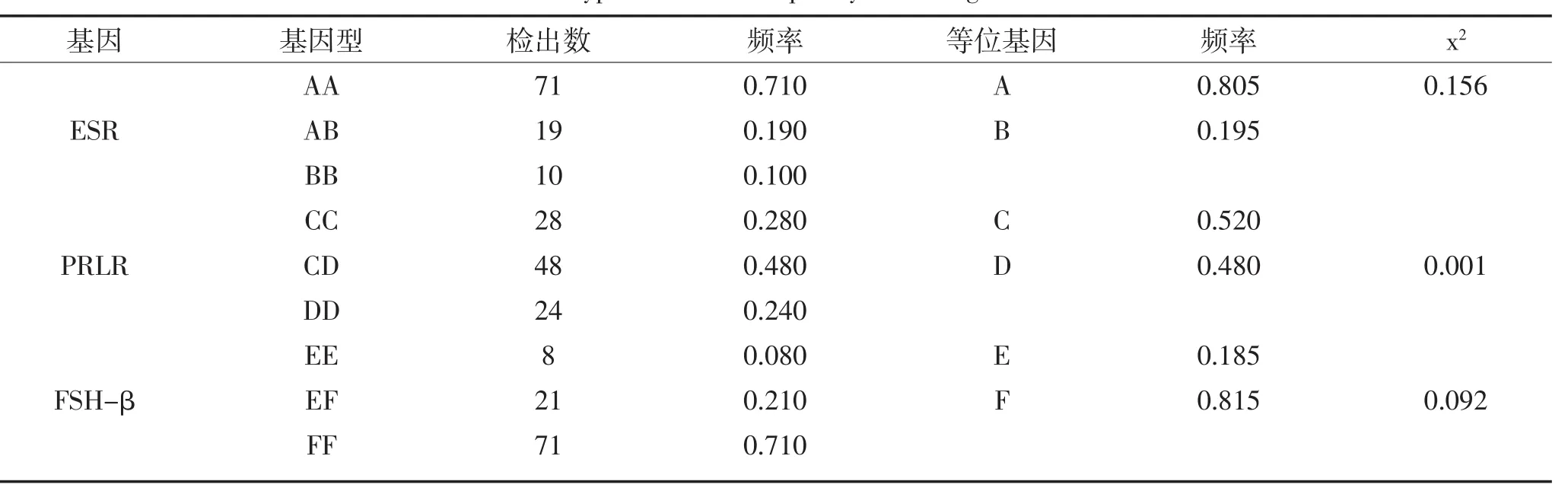
表4 长白猪三个基因的基因型频率与等位基因频率Table 4Genotype and allele frequency of three genes ofLandrace
表4可知,被检测的100头长白猪中,ESR基因第3内含子、PRLR基因第10内含子和FSH-β内含子1的扩增片段都存在多态性,分别表现出三种基因型。其中,ESR基因型频率表现为AA型>AB型>BB型,且A等位基因的频率0.805高于B等位基因的频率0.195;PRLR基因型频率表现为CD型>CC型>DD型,且D等位基因的频率0.480比C等位基因的频率0.52略低;FSH-β基因型频率表现为FF型>EF型>EE型,且E等位基因的频率0.185远远低于F等位基因的频率0.815。三个基因x2值都小于x20.05(2)=5.99,P>0.05,即在长白猪中,三种基因都处于哈迪-温伯格平衡状态。
2.3 长白猪ESR、PRLR、FSH-β基因的各基因型与繁殖性状的关系
用SPSS13.0单因素方差分析,计算长白猪ESR、PRLR、FSH-β基因的各基因型母猪的出生活仔数、产活仔数、初生窝重、断奶窝重及其标准差,结果如表5:
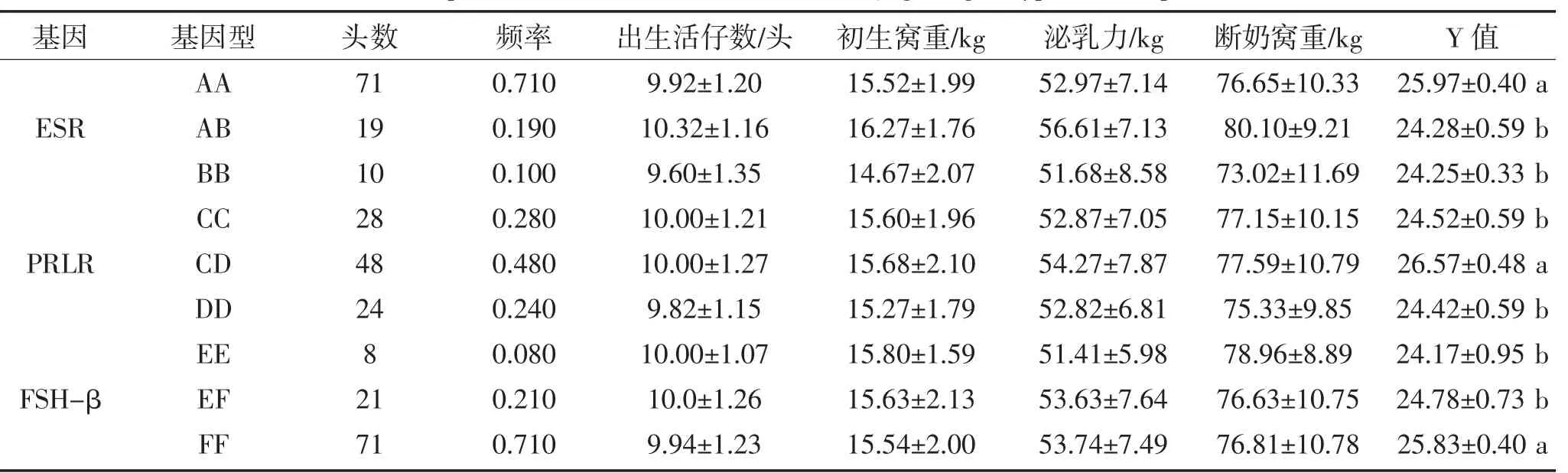
表5 长白猪ESR、PRLR和FSH-β基因的各基因型与繁殖性状的关系Table 5Relationships ofLandrace ESR,PRLR and FSH-β gene genotypes with reproductive traits
由表5可知,在长白猪中,ESR基因第3内含子、PRLR基因第10内含子和FSH-β内含子1的扩增片段都存在多态性,其中,ESR基因的AA型与繁殖指数的关系较AB、BB型,表现为差异显著(P<0.05);PRLR基因的CD型与繁殖指数的关系较CC型和DD型基因型,表现为差异显著(P<0.05);FSH-β基因的FF型与繁殖指数的关系较EE、EF型,表现为差异显著(P<0.05)。
2.4 长白猪ESR、PRLR、FSH-β基因的组合基因型与繁殖指数的相关性分析
用SPSS13.0单因素方差分析,计算长白猪ESR、PRLR、FSH-β基因的各组合基因型母猪的出生活仔数、产活仔数、初生窝重、断奶窝重及其标准误,如表6。
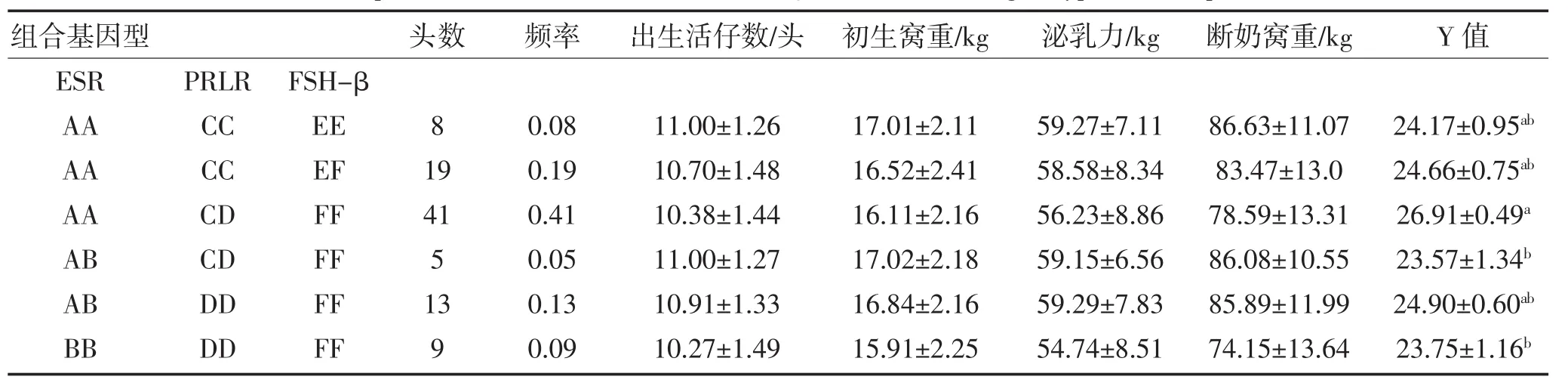
表6 长白猪ESR、PRLR和FSH-β基因部分组合基因型与繁殖指数Y的关系Table 6Relationshipsof Landrace ESR,PRLR and FSH-β combinations of genotypes wich reproductive index Y
由表6可知,三个基因的部分组合基因型基因效应分析结果表明:组合基因型AACDFF的繁殖指数与组合基因型ABCDFF和BBDDFF的繁殖指数分别相差3.34和3.16,表现为差异显著(P<0.05)。组合基因型AACDFF为长白猪中三种基因的最佳组合基因型。
3 讨论
诸多研究表明已经证实了ESR、PRLR和FSH-β单个基因的多态性与繁殖性能的关系,曹晶晶等[6]在检测地方猪品种和外来猪种ESR基因PvuⅡ位点的多态性时发现,A型等位基因是长白猪的优势等位基因。冯富彦等[7]研究表明,在豫南黑猪,杜洛克猪,长白猪,大约克夏猪4个种猪的PRLR基因中,AB基因型频率明显高于BB基因型频率,并呈现出AB>BB的趋势。王立辛等[8]报道PRLR基因在长白猪、大白猪和杜洛克猪群中基因频率及基因型频率情况,长白群中AB的基因频率最高,A等位基因在各种群中占主导地位。苏先敏等[9]分别检测出台系大白猪、杜洛克猪和大白猪存在FSH-β基因多态性,三个猪群中的BB基因型均为优势基因型,初产长白母猪繁殖性能BB基因型均显著高于AA型和AB型。试验研究结果上述等人的研究结果相一致。
在种群的遗传改良研究中,已有越来越多的学者探索组合基因型的分布频率和影响效应。毛同辉等[10]在宗地花猪ESR、FSH-β基因多态性及其与繁殖性能相关性表明,在宗地花猪基础群中,ESR、FSH-β合并基因型的遗传效应无明显规律性,只某些基因型下(如AAAA、AAAB、AABB基因型母猪的平均产活仔数)呈现递增趋势。赵西彪等[11]在AREG、ESR和FSH-β亚基基因与猪产仔数关系研究中发现,在小梅山猪中,三个基因的合并基因型基因效应分析结果表明,头胎总产仔数合并基因型BBBBAA最高,合并基因型ABAAAA最低,相差4.045头/胎;头胎产活仔数和经产胎总产仔数合并基因型BBABAB最高,合并基因型ABAAAA与合并基因型BBAAAA相等且为最低,分别相差4.063头/胎和2.188头/胎;经产胎产活仔数合并基因型BBBBAA最高,合并基因型ABAAAB最低,相差3.705头/胎。在大白猪群中,头胎总产仔数、经产胎总产仔数和经产胎产活仔数合并基因型ABBBBB最高,合并基因型AAABAB最低,分别相差4.667头/胎、4.300头/胎和5.667头/胎;头胎产活仔数合并基因型ABBBBB最高,合并基因型ABAABB最低,相差4.333头/胎。合并基因型的遗传效应高于单个基因基因型的遗传效应但不是各个基因型效应的简单加和。熊统安等[12]在通城猪中就ESR、PRLR两个基因在产仔数性状方面是否有互作效应进行了探讨,在6种组合基因型中,除了BBBB组合型在二胎比BBAB产仔数高出0.33以外,BBAB组合基因型母猪总产仔数在头胎、经产分别比其它4种组合基因型总产仔数都最高。
试验在长白猪中,ESR、PRLR和FSH-β三个基因的组合基因型基因效应分析结果表明:组合基因型AACDFF的繁殖指数与组合基因型ABCDFF和BBDDFF的繁殖指数分别相差3.34和3.16,表现为差异显著(P<0.05)。组合基因型AACDFF为长白猪中三种基因的最佳组合基因型。在长白猪的选育中,可以保留AACDFF组合基因型的母猪作为种用。
无论是单个基因型或多个基因的组合基因型,遗传背景和环境的不同,其影响效应也会不同[13-14]。母猪繁殖性能是由环境因素和遗传因素所共同决定的,因而繁殖性状在受ESR、PRLR和FSH-β基因影响的同时,还可能受如OPN(骨桥蛋白基因)、RBP4(视黄酸结合蛋白4)等其他基因和环境的影响,在今后的研究中,应考虑组合基因型的分布频率和影响效应,筛选出最佳繁殖性能基因型组合。
[1]Zhang W H,Sandra A,Cheng G J,et al.Update on estrogen signaling[J].FEBS Letters,2003,546(1):17-24.
[2]王建科,芮萍,程悦宁,等.貉源犬瘟热病毒昌黎株的分离鉴定及其H基因序列分析[J].河北科技师范学院学报,2015,29(3):12-16.
[3]BI Posner,PA Kelly,RP Shiu,et al.Studies of insulin,growth hormone and prolactin binding:tissue distribution,species variation and characterization[J].Endocrinology,1974,95(2):521-531.
[4]李丽莎,李祥龙.动物毛色候选基因TYRP1的研究进展[J].河北科技师范学院学报,2015,29(4):9-13.
[5]赵要风,李宁,肖璐,等.猪FSHβ亚基基因结构区逆转座子插入突变及其与猪产仔数关系的研究[J].中国科学C辑:生命科学,1999,29(1):81-86.
[6]曹晶晶,蔡家嘉,黄小国,等.不同猪种ESR基因多态性的PCR-RFLP分析[J].中国畜牧兽医,2009,36(6):82-84.
[7]冯富彦,李新建,吕刚,等.豫南黑猪及3个引进猪种FSHβ和PRLR基因多态性与产仔性能的关系[J].华北农学报,2011,26(5):66-70.
[8]王立辛,苏玉虹,高继红.猪ESR、FSH-β和PRLR基因合并基因型对产仔数的影响[J].中国农学通报,2011,27(29):18-22.[9]苏先敏,朱世平,赵乔辉,等.台系大白、长白和杜洛克猪FSHβ基因多态性及其与繁殖性能的关系[J].中国畜牧杂志,2013,49(19):5-8.
[10]毛同辉.宗地花猪ESR、FSHβ基因多态性及其与繁殖性能相关性研究[D].贵阳:贵州大学,2009.
[11]赵西彪.AREG、ESR和FSHβ亚基基因与猪产仔数关系研究[D].扬州:扬州大学,2008.
[12]熊统安.部分中外猪种ESR、PRLR、RYR1、RN、基因多态性检测及其与经济性状的关联分析[D].武汉:华中农业大学,2005.
[13]李松月,刘明明,贾立军.猪附红细胞体基因与蛋白研究进展[J].延边大学农学学报,2015,37(2):177.
[14]王建勇,黄大鹏.低温环境及营养水平对育肥猪生长性能影响效应研究[J].黑龙江八一农垦大学学报,2015,27(1)37-41.
ESR,PRLR and FSH-β Gene Polymorphism and Association Analysis with Reproductive Traits in Landrace
Li Chuanfeng,Wang Jianyong,Huang Dapeng
(College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
ESR,PRLR,and FSH-β were the candidate genes regulating porcine reproductive traits.Based on these three candidate genes,100 landraces were selected to genotype the detected polymorphism mutations using PCR-RFLP.Meanwhile,the systems engeering principle was used to establish reproductive performance index to build the best polygenic combination of distinct polymorphic sites of these three genes under the same breed,then the relation between the reproductive index and different genotypes was analyzed,finally the results of correlation analysis on genotypes and reproductive traits were usedto provide a molecular marker for optimal reproductive performance of artificially selected three breeds.The genetic effect analysis of combinative genotype showed that the reproduction index of the combined genotype AACDFF differed from ABCDFF and BBDDFF by 3.34 and 3.16 respectively,which was significantly different(P<0.05).
landrace;polymorphism;reproductive traits;combinative genotype
S828
A
1002-2090(2016)04-0025-05
10.3969/j.issn.1002-2090.2016.04.007
2015-02-15
李传锋(1987-),男,黑龙江八一农垦大学动物科技学院2012级硕士研究生。
黄大鹏,男,教授,硕士研究生导师,E-mail:hbf970304@163.com。

