地衣芽孢杆菌TG116诱导黄瓜抗病性相关防御酶系的研究
令利军,冯 蕾,雷 蕾,何 楠,丁 兰
(西北师范大学生命科学学院,甘肃兰州 730070)
地衣芽孢杆菌TG116诱导黄瓜抗病性相关防御酶系的研究
令利军,冯 蕾,雷 蕾,何 楠,丁 兰
(西北师范大学生命科学学院,甘肃兰州 730070)
为了探讨地衣芽孢杆菌TG116诱导黄瓜抗病性机理,研究其对黄瓜叶片防御酶活性的影响.采用比色法测定了地衣芽孢杆菌TG116诱导黄瓜根部后对叶片中多酚氧化酶(PPO)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)等3种防御酶活性及丙二醛(MDA)含量的影响.结果显示,经地衣芽孢杆菌TG116灌根处理后,黄瓜叶片中的POD、PPO、PAL等防御酶类活性升高,MDA含量略有下降并达到新的平衡;经黄瓜枯萎病病原菌灌根处理后,黄瓜叶片中的POD、PPO、PAL等防御酶活性及MDA含量迅速上升;尤其同时接种TG116和黄瓜枯萎病病原菌后,3种防御酶类活性上升的幅度比单独接种要高,同时黄瓜叶片中MDA含量比单独接种黄瓜枯萎病病原菌有所降低,减轻植株细胞膜脂过氧化损伤.研究表明,地衣芽孢杆菌TG116在一定程度上能够诱导黄瓜的系统抗病性.
地衣芽孢杆菌;防御酶系;诱导系统抗性;诱导抗病性
诱导植物抗性是生防菌防治植物病害的主要作用机制之一,一些微生物可作为植物激活剂,诱导植物产生系统抗性,因而具有良好的防病效果[1-5].其作用机制是通过组织木质化从而增强细胞机械屏障,以及产生植保素、积累酚类等物质[6-7],这些过程是通过防御酶系应答而实现,防御酶活力往往与抗病性呈正相关[8].寄主植物的防御酶系主要包括苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、过氧化物酶(POD)、β-1,3-葡聚糖酶和超氧化物歧化酶(SOD)等.
近年来研究发现芽孢杆菌(Bacillusssp)是生防菌的优势菌种,诱导植物抗性是其生防作用实现的重要机制之一[7-9]. 高伟[10]研究发现,海洋芽孢杆菌B-9987菌株能诱导番茄(Solanumlycopersicum)PAL,PPO,POD,CAT和SOD等5种防御酶的酶活性增强;陈刘军等[11]用蜡质芽孢杆菌(Bacilluscereus)处理水稻(Oryzasativa)后发现,水稻的SOD,POD,PAL和CAT酶活力明显增加;孙建波等[12]研究指出,香蕉经内生枯草芽孢杆菌(Bacillussubtilis)XBl6灌根处理后,香蕉假茎中PPO及POD的活性相对于清水对照和接种病原菌均显著提高,且与抗病性密切相关.生防菌处理植物后诱导其体内发生一系列有益于植物抗病性增强的生理反应现象,这对于农作物健康生长和防治植物病害具有重要意义.
TG116是由本课题组从独角莲(Typhoniumgiganteum)块茎分离到的1株地衣芽孢杆菌(Bacilluslicheniformis),其在平板对峙实验中表现出对植物病原真菌的广谱抗性,尤其对黄瓜枯萎病菌(Fusariumoxysporum)有较强的抑菌作用[13].本文阐述了在单独接种生防菌TG116及单独接种黄瓜枯萎病病原菌和先接种生防菌TG116再接种黄瓜枯萎病病原菌等3种不同情况下,黄瓜叶片PAL、PPO和POD酶活性及MDA含量的变化趋势,以期揭示TG116诱导黄瓜产生抗病性的作用机制,为进一步研究并阐明TG116对黄瓜植株的诱导抗性奠定基础.
1 材料与方法
1.1 材料
地衣芽孢杆菌TG116由本实验室分离并保存.
黄瓜枯萎病菌由甘肃省农业科学院植物保护研究所李继平研究员惠赠.
1.2 培养基
PDA培养基:马铃薯 200 g,琼脂 18 g,葡萄糖 20 g,蒸馏水1 000 mL,pH为7.0左右[14].
营养肉汤培养基:牛肉浸膏 3 g,氯化钠 5 g,蛋白胨 10 g,蒸馏水1 000 mL,pH为7.0~7.2[15].
1.3 植物病原真菌和诱抗细菌的培养及菌悬液的制备
TG116菌液的制备:将菌株TG116接种于营养肉汤培养基中,30 ℃、200 r·min-1振荡培养24 h,用无菌水配制成浓度为108CFU·mL-1的菌悬液.
植物病原真菌接种物的制备:将黄瓜枯萎病菌接种在PDA培养基上,25 ℃条件下培养7 d后,用无菌水洗脱孢子并配制成浓度为106CFU·mL-1的游动孢子悬浮液.
1.4 黄瓜的种植和诱导处理
用无菌水将籽粒饱满的黄瓜种子冲洗干净,置于55 ℃恒温水浴中浸泡15 min后30 ℃培养箱中催芽,挑选出芽情况一致的种子每盆2粒播种于装有灭菌营养土的花盆(80 mm×110 mm)中,待黄瓜幼苗长至3片真叶期时进行诱导处理[16].实验设4个处理:1)单独浇灌无菌水作为对照(CK);2)单独接种菌株TG116;3)单独接种黄瓜枯萎病菌(P);4)接种菌株TG116后间隔24 h再接种黄瓜枯萎病菌(TG116+ P).
1.5 PAL、PPO、POD活性和MDA含量的测定
PAL活性测定参照黄雪梅等[17]的苯丙氨酸法; PPO活性测定参照林植芳等[18]的邻苯二酚法; POD活性和MDA含量测定参照魏学玲等[19]的愈创木酚法和硫代巴比妥酸法进行测定.实验设3次独立重复试验.
2 结果与分析
2.1 PAL活性变化
由图1可知,在0~9 d内,对照组黄瓜叶片PAL活性变化平稳且处于较低水平.单独接种病原菌时,PAL活性在1~5 d内逐渐上升,而后缓慢下降,其酶活峰值(5.60 U·gFW-1)明显高于对照组(3.51 U·gFW-1).而经菌株TG116单独处理植株后,PAL活性在1~5 d快速升高至峰值,第7 d有明显的下降,但至第9 d时PAL酶活仍是对照组的1.49倍.TG116+P组PAL酶活变化趋势与单独接种TG116相似,但是酶活性要比对照组明显升高,同样在第5 d时PAL活性达到峰值(8.95 U·gFW-1),此时的PAL酶活分别是单独接种TG116和对照处理的1.20倍和2.55倍.实验表明,单独接种病原菌和TG116能够诱导黄瓜叶片中PAL活性的升高,而且在病原菌胁迫下,植物可以通过TG116诱导获得更高的PAL活性,以缓解生物胁迫造成的伤害.

图1 菌株TG116诱导处理对黄瓜叶片中 PAL酶活力的影响Fig 1 The activity of PAL in cucumber leaves after strain TG116 treatment
2.2 PPO活性变化
由图2可知,经菌株TG116单独诱导处理,PPO活性在1~3 d内逐渐上升达到峰值后再适度下降,至第9 d时酶活性又有所回升且保持在较高水平.TG116+P组PAL活性升幅最大,在第5 d时PPO活性达到峰值(15.43 U·gFW-1),分别是单独接种TG116和对照处理的1.27倍和1.87倍.病原菌单独接种后,叶片中PPO活性的增加幅度远小于单独接种TG116处理组及TG116+P处理组,且PPO活性回调速度比后2组要迅速,说明TG116诱导接种有利于PPO的积累.TG116处理组和TG116+P处理组相比,说明在病原菌的胁迫下,TG116有利于抗病相关酶PPO的积累,从而有利于植物对胁迫产生积极应答.

图2 菌株TG116诱导处理对黄瓜叶片中 PPO酶活力的影响Fig 2 The activity of PPO in cucumber leaves after strain TG116 treatmen
2.3 POD活性变化
由图3可知,TG116处理黄瓜叶片后,黄瓜叶片中POD酶活性明显增高,其中以TG116+P处理组POD酶活性升高最为明显,5 d后POD酶活性达到峰值(20.82 U·gFW-1),为CK的1.69倍.与之相比,单独接种病原菌组,黄瓜叶片POD活性明显高于对照组,但出现了上升、下降交替变化趋势,说明TG116诱导接种对黄瓜叶片中POD酶活性的表达有促进和稳定表达作用,在植株感病情况下,经TG116诱导可产生并积累更多的POD,帮助植株对病原菌等生物胁迫产生积极应答.
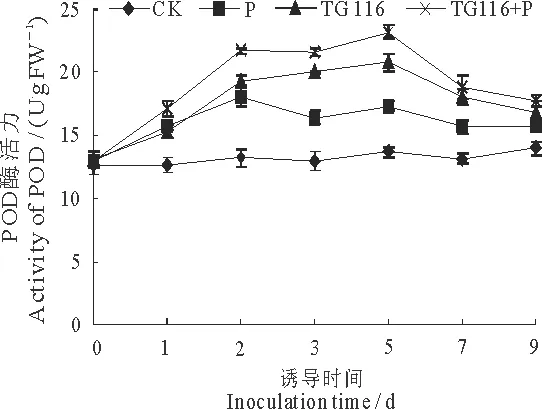
图3 菌株TG116诱导处理对黄瓜叶片中 POD酶活力的影响Fig 3 The activity of POD in cucumber leaves after strain TG116 treatment
2.4 MDA活性变化
由图4可知,单独接种病原菌黄瓜叶片中MDA含量明显上升,于第3 d达到最大值后逐渐下降,但5~9 d其含量仍高于对照组、单独接种TG116和TG116+P组.TG116+P组较单独接种病原菌相比,黄瓜叶片中MDA含量有较大幅度降低,并在第3 d后逐步恢复至接近正常水平.单独接种TG116,MDA含量在1~3 d内呈缓慢下降趋势,3 d后开始回升达到新的动态平衡,与对照相比略有下降.这可能是因为TG116菌液中含有某种保护膜脂过氧化的物质,也可能因其能够诱导黄瓜苗产生系统抗性激发黄瓜苗体内其他的活性氧代谢途径从而降低了细胞的膜脂过氧化程度,减少了MDA的生成,从而达到植物组织免受破坏作用.

图4 菌株TG116诱导处理对黄瓜叶片中 MDA酶含量的影响Fig 4 The content of MDA in cucumber leaves after strain TG116 treatment
3 讨论
诱导植物抗性现已成为植物病害生物防治和现代农药发展的新理念.研究发现[20],参与植物体内多种防卫反应的PAL、PPO及POD等酶系与植物抗病性密切相关.PAL活性升高有利于植物抗病作用的发挥,它是莽草酸途径的限速酶,由该途径合成的中间产物都是植物体内一些重要的抗菌物质,如酚类物质、植保素和木质素等[21];POD能够清理植物体内的活性氧,同时可催化酚类物质的前体合成木质素,加固植物细胞壁,形成防卫屏障从而抵御病原物的入侵[22-23];PPO可以氧化酚类物质生成具有更强毒性的醌类物质,直接毒杀入侵的病原菌[20].
很多研究表明[24-27],诱导抗性可使植株内PAL、PPO及POD活性增强,如短小芽孢杆菌(Bacilluspumilus)203-6和203-7诱导甜菜的抗病性与POD活性提高密切相关[24].徐韶等[25]研究发现,内生枯草芽孢杆菌(Bacillussubtilis)B6和木霉(Trzchocerma)T23复合接种能够诱导甜瓜根系PAL、POD和PPO活性有不同程度的提高.这些酶类的活性与植株抗病性呈正相关,在植物的抗病反应中起到非常重要的作用[24-27],因此通常以这3种酶作为衡量植物体内防御反应的重要指标.
本研究结果表明,TG116灌根处理黄瓜后,黄瓜叶片中PPO、POD及PAL活性均比无菌水对照组和接种病原菌明显提高,这与前人相关的研究结果相吻合[24-27].TG116与病原菌共同接种后, PPO、POD及PAL酶活性升高的幅度均高于单独接种病原菌,说明接种TG116有利于诱导植株抗性相关酶系的表达.MDA含量可以反映细胞的膜脂过氧化程度[28],单独接种植物病原真菌后MDA含量明显升高,菌株TG116和病原菌共同接种的处理MDA含量较单独接种植物病原真菌低,说明TG116能够抑制因病原菌胁迫而诱发的MDA含量升高,从而通过降低生物胁迫诱发的膜脂过氧化程度而达到保护植株的作用.以上结果均表明,TG116诱导的系统抗性可能是其生物防治作用的防治机制之一.
王淑霞等[26]用哈茨木酶(Trichodermaharzianum, Tr-92)诱导处理黄瓜根部后测定相关酶活力变化,发现施用生防菌后可促进相关酶活力的提高,与本实验结果的变化趋势一致.但是经哈茨木酶Tr-92单独诱导处理,POD、PPO及PAL酶活力均在第2 d达到峰值;经哈茨木酶Tr-92+H诱导处理,PAL于第3 d达到酶活峰值.本实验TG116单独诱导处理组和TG116+H诱导处理组POD、PPO、PAL酶活力均在第5 d达到高峰,说明不同的生防菌对同一种植物进行诱导处理时,酶活力高峰出现的时间是不同的.林陈强等[27]指出,枯草芽孢杆菌(Bsubtilis)CSl6诱导香蕉(Musanana)抗病性相关防御酶系的研究中发现,CS16也可以诱导香蕉叶片中PAL、POD和PPO酶活性的上升,但CS16诱导处理香蕉叶片中的PPO酶活性在第8 d已低至对照水平,而用地衣芽孢杆菌TG116处理黄瓜叶片PPO酶活性在第9 d仍明显高于对照水平.周林等[28]在枯草芽孢杆菌(Bsubtilis)TR21对香蕉抗病相关酶活的诱导作用的研究中发现,灌根处理TR21后测定香蕉叶片中3种防御酶类的活性表明,经TR21发酵液处理后叶片中PPO、POD和PAL活性均显著高于清水对照,但是TR21诱导处理香蕉叶片中的POD、PPO在第5 d已低至对照水平,PAL在第7 d明显降低.地衣芽孢杆菌TG116处理黄瓜叶片PAL,PPO,POD酶活性在第9 d处于较高水平,这些均说明地衣芽孢杆菌TG116诱导处理具有较好的持效性.
综上所述,地衣芽孢杆菌TG116发酵液不仅具有抑菌作用[11],还可以通过诱导植物防御酶系活性的提高从而增强植株的抗病性.有关地衣芽孢杆菌TG116发酵液中不同成分在防治黄瓜病害的过程中所起的作用还有待于进一步研究和探讨.
[1] LIU L,KLOEPPER J W,TUZUN S.Induction of systemic resistance in cucumber againstFusariumwilt by plant growth-promoting rhizobacteria[J].Phytopathology,1995,85(6):695.
[2] DE MEYER G,BIGIRIMANA J,ELAD Y,et al.Induced systemic resistance inTrichodermaharzianumT39 biocontrol ofBotrytiscinerea[J].EuropeanJournalofPlantPathology,1998,104(3):279.
[3] WEI G,KLOEPPER J W,TUZUN S.Induction of systemic resistance of cucumber toColletotrichumorbiculareby select strains of plant growth-promoting rhizobacteria[J].Phytopathology,1991,81(11):1508.
[4] MEERA M S,SHIVANA M B,KAGEYAMA K,et al.Plant growth promoting fungi from zoysiagrass rhizosphere as potential inducers of systemic resistance in cucumbers[J].Phytopathology,1994,84(12):1399.
[5] TIAN S,HARMAN G.Defense response induced by seed treatment withTrichodermaharzianumin Maize Mo17[J].ActaPhytopathologicaSinica,2008,38(6):626.
[6] 孔庆科,丁爱云,刘招舰,等.根际细菌诱导的系统抗性[J].山东科学,2001,14(4):18.
[7] 齐爱勇,赵绪生,刘大群.芽孢杆菌生物防治植物病害研究现状[J].中国农学通报,2011,27(12):277.
[8] ZHU Q,DABI T,BEECHE A,et al.Cloning and properties of a rice gene encoding phenylalanine ammonia-lase[J].PlantMolecularBiology,1995,29(3):535.
[9] 朱玥妍,刘姣,杜春梅.芽孢杆菌生物防治植物病害研究进展[J].安徽农业科学,2013,40(34):16635.
[10] 高伟.海洋芽孢杆菌B-9987生物防治机制研究[D].青岛:青岛科技大学,2009.
[11] 陈刘军,俞仪阳,王超,等.蜡质芽孢杆菌AR156防治水稻纹枯病机理初探[J].中国生物防治学报,2014,30(1):107.
[12] 孙建波,王宇光,赵平娟,等.抗菌XB16在香蕉体内的定殖及对抗菌相关酶活性的影响[J].热带作物学报,2010,31(2):212.
[13] 令利军,雷蕾,冯蕾,等.独角莲内生细菌TG116的分离鉴定及抑菌特性研究[J].西北师范大学学报(自然科学版),2014,50(5):91.
[14] 窦桂铭.植物病原真菌拮抗菌株的筛选与几丁质酶基因的克隆[D].海口:海口大学,2013.
[15] 任建国,王俊丽.芒果炭疽病拮抗菌J-15的鉴定及其生物学特性研究[J].广东农业科学,2010,37(7):101.
[16] 黄亚丽,王淑霞,杜晓哲,等.一株具有诱导抗性木霉菌株的筛选及其对黄瓜灰霉病诱导抗性的初步探究[J].植物保护,2013,39(1):38.
[17] 黄雪梅,张昭其,季作梁.青香蕉和黄熟香蕉果皮感病过程中5种酶活性的变化[J].果树学报,2006,22(6):662.
[18] 林植芳,李双顺.采后荔枝果皮色素,总酚及有关酶活性的变化[J].植物学报(英文版),1988,30(1):40.
[19] 魏学玲,史如霞,杨颖丽,等.Pb 2+胁迫对两种小麦幼苗生理特性影响的研究[J].植物研究,2009,29(6):714.
[20] 林陈强,李占飞,张慧,等.枯草芽孢杆菌CS16诱导香蕉抗病性相关防御酶系的研究[J].福建农业学报,2013,28(6):570.
[21] 王金生.分子植物病理学[M].北京:中国农业出版社,2001:270.
[22] 陈世苹,高玉葆,梁宇,等.水分胁迫下内生真菌感染对黑麦草叶内保护酶系统活力的影响[J].应用与环境生物学报,2001,7(4):348.
[23] 李德全,陈志谊,聂亚峰.生防菌Bs-916及高效突变菌株抗菌物质及其对水稻抗性诱导作用的研究[J].植物病理学报,2008,38(2):192.
[24] KLOEPPER J W,RYU C M,ZHANG S.Induced systemic resistance and promotion of plant growth byBacillusspp[J].Phytopathology,2004,94(11):1259.
[25] 徐韶,庄敬华,高增贵,等.内生细菌与木霉复合处理诱导甜瓜对枯萎病的抗性[J].中国生物防治,2005,21(4):254.
[26] 王淑霞,张丽萍,黄亚丽,等.哈茨木霉 Tr-92 诱导黄瓜对灰霉病系统抗性的研究[J].中国生物防治学报,2013,29(2):242.
[27] 林陈强,李占飞,张慧,等.枯草芽孢杆菌CSl6诱导香蕉抗病性相关防御酶系的研究[J].福建农业学报,2013,28(6):570.
[28] 周林,程萍,喻国辉,等.枯草芽孢杆菌TR21对香蕉抗病相关酶活的诱导作用[J].中国农学通报,2011,27(2):185.
(责任编辑 俞诗源)
Induction of defense-related enzymes in cucumber roots byBacilluslicheniformisStrain TG116
LING Li-jun,FENG Lei,LEI Lei,HE Nan,DING Lan
(College of Life Science,Northwest Normal University,Lanzhou 730070,Gansu,China)
To probe into the biocontrol mechanism ofBacilluslicheniformisStrain TG116 and develop effective biocontrol agents,we determine the activities of polyphenol oxidase(PPO),peroxidase(POD),phenylalanine(PAL) and content of maleic dialdehye(MDA) of cucumber after being inoculated with strain TG116.Results suggest that after inoculation of cucumber roots with TG116,activities of POD,PPO,PAL in cucumber leaves are increased,content of MDA is decreased slightly and reached a new equilibrium.After inoculation of cucumber roots withFusariumoxysporum,activities of defense enzymes and content of MDA in cucumber leaves are increased,especially after inoculated both strain TG116 andFusariumoxysporum,the ascensional range of three kinds of defense enzymes’ activities is higher than that of single inoculation.Meanwhile,the content of MDA in cucumber leaves after being inoculated Strain TG116 is decreased,it reduces the plant cell membrane lipid peroxidation damage.Our results suggest thatBacilluslicheniformisstrain TG116 can induce disease resistance of cucumber.
Bacilluslicheniformis;defensive enzymes;induced systemic resistance;induced resistance
10.16783/j.cnki.nwnuz.2016.01.019
2015-10-08;修改稿收到日期:2015-11-27
甘肃省科技支撑计划资助项目(1304NKCA143);甘肃省高校科研项目(2013A-011);西北师范大学青年教师提升计划资助项目(NWNU-LKQN-10-18)
令利军(1975—),男,甘肃天水人,副教授,博士,硕士研究生导师.主要研究方向为植物与微生物互作.
E-mail:linglijun@nwnu.edu.cn
Q 935
A
1001-988Ⅹ(2016)01-0100-05

