VB12协同Fe/Cu双金属去除二氯甲烷过程调控与机理
林英杰,张 硕,孙力平,邢 悦 (天津城建大学环境与市政工程学院,天津市水质科学与技术重点实验室,天津300384)
VB12协同Fe/Cu双金属去除二氯甲烷过程调控与机理
林英杰,张 硕,孙力平*,邢 悦 (天津城建大学环境与市政工程学院,天津市水质科学与技术重点实验室,天津300384)
针对地下水中低卤代烷烃的难修复问题,实验制备了Fe/Cu双金属功能性颗粒,研究其对以二氯甲烷为典型污染物的还原去除效能及强化控制方法.结果表明:维生素B12可有效提升Fe/Cu双金属还原能力,其中Fe/Cu-B12系统对二氯甲烷降解的准一级速率常数(0.444h-1)远大于Fe/Cu体系(0.018h-1)或Fe-B12体系(0.03h-1),证明Cu和B12协同环境可提升零价铁供电子能力.进一步针对Fe/Cu-B12体系开展了过程控制研究,提炼出Cu负载率5%以及pH9.5的弱碱性条件最有利于促成催化还原脱氯反应,并通过还原产物表征结合动力学响应变化对Cu和B12可能的催化协同机理进行了探讨,推测B12先作为活泼电子受体在Cu0表面将目标有机物脱氯形成中间体物质,而后迅速分解生成B12和加氢还原的卤代物,整个催化过程是在Fe(电子供体)、Cu和B12三者的协同作用下完成的.
Fe/Cu双金属;维生素B12;二氯甲烷;催化脱氯
二氯甲烷(DCM)是一种普遍存在的环境污染物,常被用作溶剂而广泛使用于化工生产与各种产品中.由于储存时的意外泄露、不当的排放,而进入环境中污染土壤与地下水.DCM在水中累积性强且半衰期长,具有生殖毒性和潜在致癌性[1],已被美国EPA列为12种优先控制的持久性污染物之一[2].目前在国内外地下水中均有二氯甲烷的污染案例报道,例如台湾地下水中检测到二氯甲烷浓度高达1120mg/L[3],在美国地下水中检测到二氯甲烷的浓度范围0~3600ug/L[4].
透水性反应墙(PRB)是一种有效的地下水修复技术,其中零价铁(ZVI)因价格低廉,无毒性等材质优势而被广泛使用,已被证实可去除多种污染物,包括含氯有机污染物[5-6]、重金属[7-8]、硝酸盐[9-10]和染料[11-12]等.其中纳米零价铁比表面积大,反应活性更高,能加速含氯有机物的降解[13].在纳米铁表面附加催化剂(Pd、Ni、Cu)形成复合金属(Pd/Fe、Ni/Fe、Cu/Fe等)既可有效抵抗零价铁表面的水合钝化等负面作用,又能进一步加强零价铁的反应活性,对强化去除卤代烷烃具有积极效应[14-16].
尽管用双金属体系可有效处理四氯化碳和三氯甲烷,但对以二氯甲烷为典型代表的低卤代烷烃的还原降解能力有限[17-18],因为二氯甲烷中C-Cl键的键能比多氯代甲烷的键能更强,不易被还原脱氯.通过引入电子传质体能够进一步加强含氯有机污染物的还原进程,其中维生素 B12是由生物体合成的金属辅酶(中心金属是活泼的钴元素),常见价态有B12(Co3+)[19]、B12r(Co2+)[19]以及B12s(Co+)[20].因钴离子价态之间相互转化而常常提升还原反应活性[21],这使得维生素 B12在利用零价金属还原含氯有机污染物过程中有望成为一种高效催化剂.
本研究制备了Fe/Cu双金属颗粒,考察在维生素B12协同辅助效应下对以二氯甲烷为典型持久性低卤代烷烃的去除效能.重点从反应动力学角度提取并考察了主要影响因素及调控方法,并对可能的反应过程机理进行了探讨.实验结果以期对利用活泼零价金属修复受污染地下水体提供参考.
1 材料与方法
1.1 试剂及仪器
主要试剂:NaBH4(分析纯,购自天津光复精细化工研究所);FeSO4·7H2O(分析纯,购自天津光复精细化工研究所);CuSO4(分析纯,购自天津光复精细化工研究所);二氯甲烷(≥99.99% (GC),含50-150ppm异戊烯稳定剂,购自上海阿拉丁生化科技股份有限公司);维生素 B12(≥98%,购自SIGMA-ALDRICH,中国).
主要仪器:恒温立式振荡器(HZQ-QG型,哈尔滨市东联电子技术开发有限公司);顶空气相色谱仪(Agilent 7890B型与HP4890型,美国安捷伦科技公司);阴离子色谱仪(ICS-1500型,美国戴安(Dionex)公司);紫外-可见分光光度仪(UV-2250型,日本岛津);原子吸收光谱仪(AAnalyst 800型,美国Perkin-Elmer公司);X射线晶体衍射仪(RigakuD/Max-2500/pc型,日本理学);比表面积分析仪(美国麦克仪器公司).
1.2 Fe/Cu材料制备
Fe0的制备:将10.856g NaBH4水溶液缓缓加入FeSO4·7H2O的水溶液中:
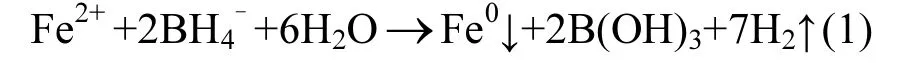
反应完全后将所生产的零价铁颗粒用无氧灭菌去离子水冲洗3次,置于无氧水中密封保存.
Fe/Cu双金属材料制备:将 80mL1.0g/L的CuSO4溶液加入缓慢加到零价铁的悬浮液中:

反应结束后按照上述方法洗涤,得到 Fe/Cu的悬浮液.
1.3 实验内容
在一系列250mL的锥形瓶中,各加入初始浓度为500mg/L的二氯甲烷溶液4.5mL后,向瓶中通氮气10min(一方面制造无氧环境,另一方面调控初始二氯甲烷浓度).随即加入一定质量新鲜合成的纳米 Fe/Cu,迅速用橡胶反口塞将样品瓶密封,置于恒温振荡器中振荡,转速为210r/min,温度为(23±1)℃,定时(0,5,15,30,60, 120,240,360,480min)用注射器取样,并经 0.45μm微孔滤膜过滤,用顶空气相色谱仪测定二氯甲烷的浓度,每个反应瓶只提供一个取样时间的反应数据.还需说明的是,在另一锥形瓶中只加入二氯甲烷做平行试验(即为控制样),对控制样二氯甲烷溶液浓度进行质量分析,结果表明其减少量不超过 6%,因此认为锥形瓶对二氯甲烷的吸附及二氯甲烷本身短时间内的挥发可不予考虑.
1.4 检测方法
二氯甲烷的质量浓度通过顶空气相色谱仪进行测定,色谱条件:用HP-VOC柱(30m×320μm ×0.25μm);分流进样,分流比为 1:1,分流流速为1.0mL/min;柱温:40℃;柱流速:0.005mL/min,恒定流模式;载气:高纯氮,纯度≥99.999%;检测器条件:电子捕获检测器(ECD);温度:320℃;尾吹速率:30mL/min.
氯离子浓度采用美国戴安(Dionex)公司的ICS-1500离子色谱仪对经过0.45µm混合纤维素微孔滤膜过滤的水样进行分析,分离柱为 4mm× 250mm阴离子交换分离柱.淋洗液为超纯水,发生器为EG40,用KOH梯度洗脱;柱加热温度30℃,流速:1.0mL/min,进样量:3mL,检测器为抑制型电导检测,自动抑制,抑制器电流为57mA.色谱峰的峰面积用于外标法定量分析.脱氯率由实测 Cl-浓度与氯代有机物中氯元素的理论含量的比值计算得到,见式(3):

式中: Ct(Cl-
)为t时刻实测Cl-的浓度,C(Cl-)为二氯甲烷完全脱氯所得理论Cl-总量.
甲烷的检测使用美国安捷伦(Agilent)公司HP4890顶空气相色谱仪,色谱柱为 13X填充柱(2m),进样量 60µL,检测器条件:氢火焰离子化检测器(FID),进样器温度200℃,柱温85℃,检测器温度300℃.
对维生素B12形态的扫描分析采用日本岛津公司的UV2250紫外-可见分光光度仪,采用优异的DDM技术,扫描速度3200nm/min,分辨率为0.1nm,测试波长分为为190~900nm.
实验中就溶解的铜离子的检测采用原子吸收光谱仪:以铜特征线324.7nm为分析线波长,采用乙炔-空气型火焰类,检测试剂使用 0.2%硝酸,然后吸入空白样和试样,测量其吸光度.
2 结果与讨论
2.1 Fe/Cu材料的相关性质表征
采用X射线多晶衍射仪对Fe/Cu双金属颗粒(铜负载率5%)进行扫描,扫描范围为10~80°,其XRD谱图如图1所示,在44.84°附近出现了零价铁的衍射峰(d=2.0196),在 43.44°附近出现了铜的特征峰(d=2.0814),可以证明有零价铜的存在,且没有检测到CuO以及Cu2O,说明此还原制备零价Fe/Cu双金属的方法较为彻底.有文献报道双金属表面有铜的氧化峰[21],而在新鲜制备的双金属的衍射图谱中未发现铜氧化物的峰,这可能是因为铜氧化物的含量很低未达到XRD的检测线.
利用BET测定仪进行Fe/Cu双金属颗粒的比表面积测定,在77.35K的温度下采用N2对材料进行吸附、脱附等温线的测定,Fe/Cu材料(铜负载率 5%)的比表面积是 39.932m2/g.本实验通过硝酸溶解新鲜制备的 Fe/Cu双金属颗粒,然后利用原子吸收法测定铜离子的含量,如表 1所示,Fe/Cu颗粒的实测铜负载率较接近理论值.

图1 Fe/Cu双金属材料的XRD谱图Fig.1 XRD spectrum of Fe/Cu bimetallic particles

表1 Fe/Cu双金属颗粒理论铜负载率与实测铜负载率比较(wt%)Table 1 Comparison of theoretical and detected Cu-loadings for Fe/Cu bimetallic particles(wt%)
2.2 不同体系下二氯甲烷的去除效率对比
通过设计对比研究,考察了维生素 B12协同环境下 Fe/Cu双金属反应体系对二氯甲烷的还原去除效果,结果如图 2(a)所示(实验条件:二氯甲烷质量浓度为10mg/L,Fe/Cu投加量为20g/L,维生素B12为20mg/L,pH为8.2).对比实验表明,零价铁或 Fe/Cu双金属体系对二氯甲烷均没有明显的去除效果,这与吴德礼等的实验结论一致
[22].而通过添加维生素B12构建“Fe/Cu-B12体系”能够有效提升去除效率.
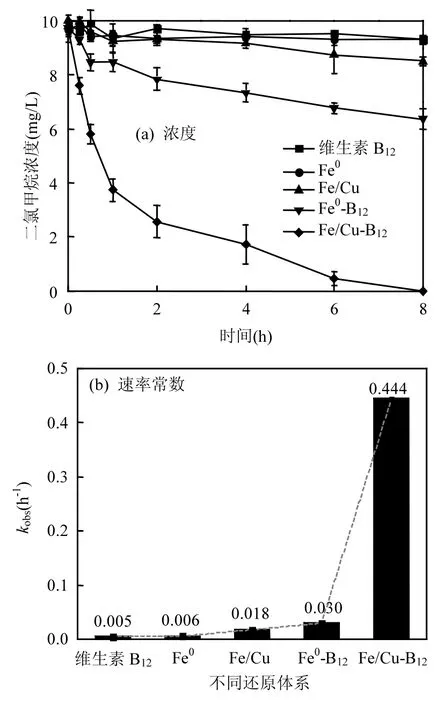
图2 不同还原体系对二氯甲烷的去除效率对比Fig.2 Comparison on reduction of dichloromethane for different reaction systems
利用气相色谱以及离子色谱对二氯甲烷还原产物进行分析,结果见图 3,根据氯离子含量检测分析表明,联合系统对二氯甲烷的降解为还原脱氯作用,二氯甲烷通过加氢脱氯作用生成了一氯甲烷和甲烷(23%),表达如下:
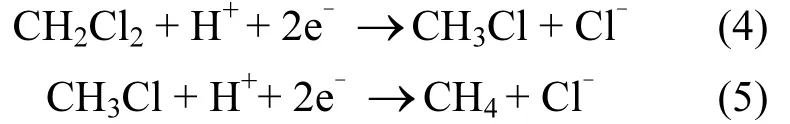
8h内,二氯甲烷几乎被全部降解,脱氯率为68%.说明“Fe/Cu-B12体系”相对能够对二氯甲烷进行较为彻底的还原去除(即生成甲烷),而这种高强度还原效果通常是零价金属体系所难以实现的.
分析得出二氯甲烷降解过程可近似用准一级动力学过程(R2= 0.972)描述,如公式(6)所示:
式中: c为二氯甲烷的浓度(mg/L); kobs为准一级速率常数(h-1); t为反应时间.
对公式(6)积分,kobs可通过ln(c/c0)与t的线性关系获得,c为二氯甲烷反应后浓度,c0为其初始浓度.结果如图2(b)所示,可见“Fe/Cu-B12”系统对二氯甲烷降解的准一级速率常数高达0.444h-1,远大于没有B12情况下的Fe/Cu体系(0.018h-1)或者没有Cu情况下的Fe-B12体系(0.03h-1).对比结果证明Cu和B12协同环境可大幅度提升零价铁供电子还原能力.

图3 还原脱氯过程中二氯甲烷及产物浓度变化情况Fig.3 Evolution of dichloromethane and the by-products concentrations during dechlorination process

2.3 “Fe/Cu-B12体系”影响因素研究与调控
2.3.1 铜负载率 通过材料表面修饰零价铜具有多重过程促进作用,包括(1)可避免因 Fe0反应所造成的表面钝化;(2)可有效提升 Fe0的供电子活性;(3)能够减弱二氯甲烷分子中 C-Cl键强度以便于还原加氢.本部分考察研究了不同铜负载率(即0%、2.5%、5%、10%、20%)条件下Fe/Cu材料的还原反应活性.结果如图4(a)所示.
当铜负载率小于等于 5%时,二氯甲烷去除率随着铜负载率的增加而增大,这说明Fe/Cu双金属材料去除二氯甲烷的反应发生在铜表面的反应活性位上.Fe/Cu的比表面积随着铜负载率的增加而增大,为其提供了较大的表面粗糙度、更多的反应活性位,使得二氯甲烷去除率增加.当铜负载率为5%时,在8h内大约96%的二氯甲烷被迅速降解.而当铜负载率高于一定程度时,进一步增加铜剂量会造成二氯甲烷去除率下降,反映出此时Fe/Cu材料反应活性受到负面抑制,分析可能是由于较高的铜负载率会抑制Fe0供电子进程.王陆涛等人考察了纳米Cu/Fe催化金属负载率对三氯乙烯的的去除效果,得出一致结论,继续增大铜的负载率对比表面积的增加贡献变小,且较高的铜负载率可能会抑制铁腐蚀和原子氢的生成[23].如图4(b)所示,当铜负载率为0%、2.5%、5%、10%、20%时,对应的kobs的值分别为0.06、0.114、0.444、0.191和0.085h-1.结果表明合理控制零价铜表面修饰剂量,可有效强化基于零价铁的卤代有机物还原修复能力.

图4 铜负载率对二氯甲烷降解的影响Fig.4 Reduction of dichloromethane as a function of Cu-loading
2.3.2 维生素B12根据图1(a)所示结果可以清晰得出维生素B12也是强化Fe/Cu体系反应的关键物质之一,本部分考察了投加剂量(即0、5、10、20、40mg/L)对二氯甲烷的去除效果影响,结果如图 5(a)所示.在其他条件一定时,随着维生素 B12浓度的增大,二氯甲烷的降解速率增大.当维生素B12的浓度为40mg/L,在2h内大约97%的二氯甲烷被迅速降解.如图5(b)所示,当维生素B12投加量为5、10、20、40mg/L时,对应的kobs的值分别为 0.064、0.128、0.444和 1.727h-1.推测维生素 B12在反应中具有氧化还原介体的重要作用(详细讨论可见2.4部分).

图5 维生素B12投加量对二氯甲烷降解的影响Fig.5 Reduction of dichloromethane as a function of vitamin B12concentration
2.3.3 Fe/Cu投加量 固相还原剂投加负荷会从化学剂量学角度直接影响反应动力学过程,本部分研究考察了Fe/Cu投加量(即2.5、5、10、20g/L)对二氯甲烷的去除效果影响,结果如图6(a)所示.二氯甲烷的去除效果随投加量的增加而显著增加.四种不同投加量条件下对二氯甲烷的还原脱氯去除在反应最初1h内非常迅速,这是由于Fe/Cu双金属材料对二氯甲烷的去除主要发生在颗粒表面,故在初始阶段,反应迅速进行.投加量较小时,Fe/Cu颗粒表面积较小,对应的表面活性位较少,反应速率慢;而投加量大时,反应位点和反应表面积也相对较大,降解能力增强,这与Wang等[14]的研究结论一致.当 Fe/Cu投加量为2.5g/L,在 8h内仅约 22%的二氯甲烷被降解.如图 6(b)所示,当 Fe/Cu投加量分别为 2.5,5,10,20g/L时,对应的kobs的值分别为0.03,0.065,0.147,0.444h-1.这说明,当其他条件固定不变时,增加Fe/Cu双金属的投加量,二氯甲烷的去除效果随之增强.还原剂剂量越小,抵抗溶液中其它反应过程的干扰能力相对较弱,例如部分零价铁表面会发生水合作用抑制反应能力.本实验建议最低投加剂量不低于10g/L以确保有效的接触还原反应.
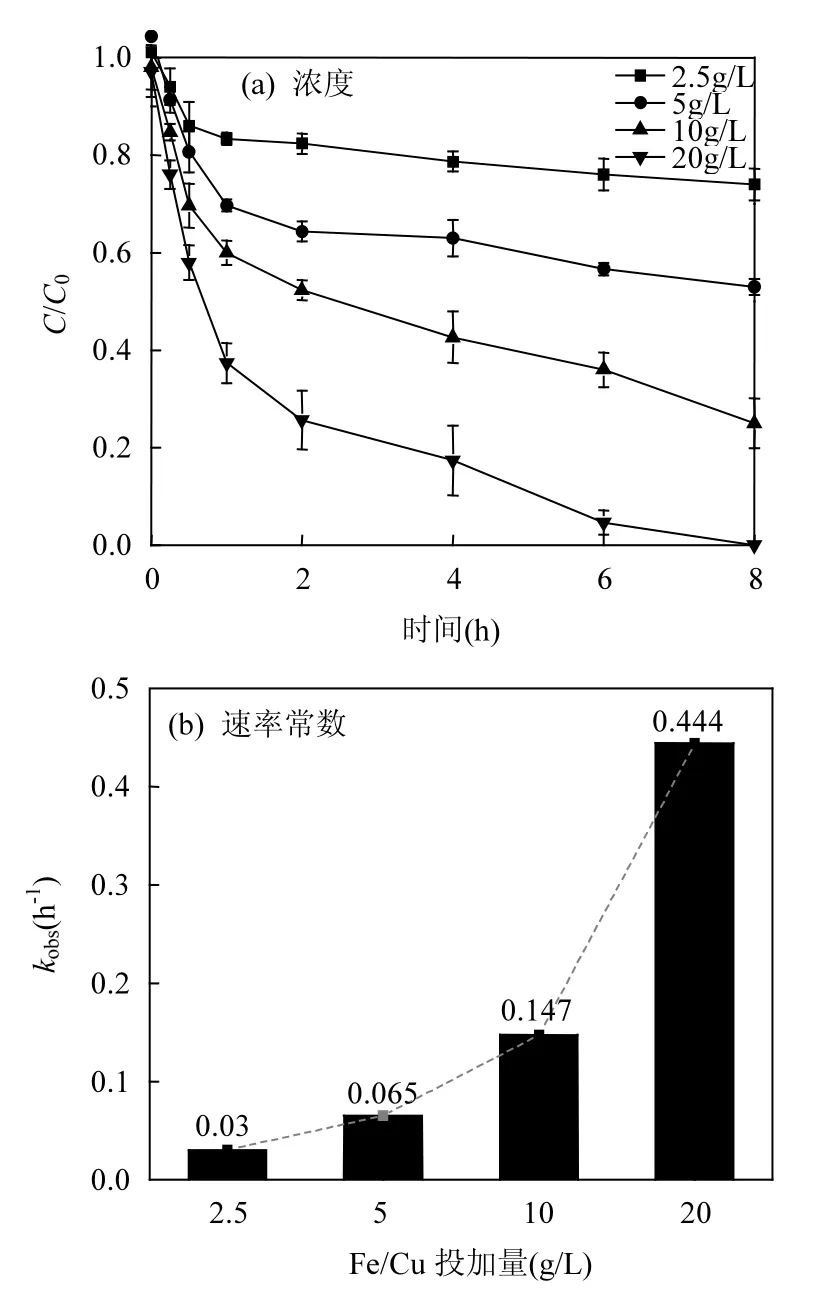
图6 Fe/Cu投加量对还原二氯甲烷的影响Fig.6 Reduction of dichloromethane as a function of Fe/Cu bimetallic dose
2.3.4 溶液pH值 在还原反应体系中,溶液pH值可造成包括还原剂表面性质、溶质的化学形态、还原过程中H+的迁移和转化等多方面影响.本部分在Fe/Cu、Fe0-B12和Fe/Cu-B12的三种反应情形下,对比考察了pH值变化(即4.5、6.8、7、8.2、9.5)对二氯甲烷去除可能的影响,结果见图7所示.
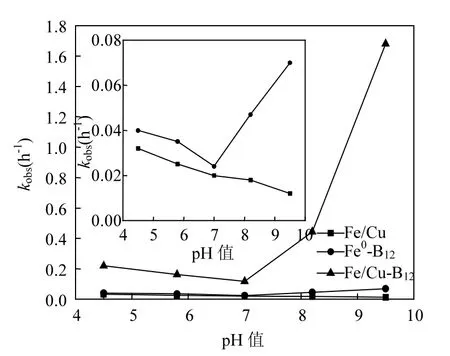
图7 不同还原体系下的速率常数对溶液pH值的响应变化Fig.7 Evolution of rate constant as a function of pH for various reduction systems
在不添加维生素B12情形时,Fe/Cu系统反应速率常数较低且呈现出随pH值增加而减小的趋势,因为酸性环境下可加快零价铁腐蚀,故适当提高了反应速率.
在纳米Fe0-B12和纳米Fe/Cu-B12系统中,二氯甲烷的降解速率呈现出随pH值的增加先减小后增大的相似趋势,推测可能跟Fe0及B12性质有关.随着pH值从4.5到7升高,反应速率常数逐渐降低,可能因为随着 pH值的增加,Fe2+被水中的溶解氧氧化,生成Fe(OH)3沉淀,并负载铁或催化剂的表面,导致还原剂纳米零价铁表面以及双金属钝化层增加,从而降低催化剂的活性,致使其还原维生素 B12的能力下降,使得所产生的维生素B12r浓度较低,还原反应速率减慢,二氯甲烷的脱氯动力学速率降低.
当pH值从7到9.5变化时,二氯甲烷的脱氯效果显著增强.pH值为7时,在8h内,有70%的二氯甲烷被降解,脱氯动力学速率常数为 0.14h-1;相比之下,pH值为9.5时在2h内,97%的二氯甲烷被降解,脱氯动力学速率常数为 1.68h-1,提升了将近 12倍.这可能是因为随着 pH值的继续增加,OH-浓度增大,亲核性增强,它能与还原产生的维生素 B12r结合生成羟维生素 B12r,而羟维生素B12r比维生素 B12r提供电子的能力更强[22],能加速对含氯有机物的还原降解.另外,当pH值高于10时,由于维生素 B12结构受到破坏,造成了 Fe/ Cu-B12体系反应失活.
2.4 Fe/Cu-B12体系反应机理
利用零价铁去除有机污染物过程已有较多研究[16,23],主要为经原电池作用所导致的加氢还原效应,可简单描述如下:

针对本研究的“Fe/Cu-B12”体系,铁作为还原性阳极提供电子,同时铜金属作为具有催化活性的阴极,在其表面促成二氯甲烷的脱氯反应.
通过UV-Vis光度计观察伴随还原过程的维生素 B12性质(见图 8),得出纯水中主要表现为B12(Co3+),而在反应体系中检测到 475nm 和405nm 时有 B12r(Co2+)大量生成,相应的关于B12(Co3+)含量下降,可见维生素 B12作为一个电子介体,起主要作用的更可能是B12r(Co2+).

图8 维生素B12分别在水相和Fe/Cu体系中的UV-Vis谱图(pH=8.2)Fig.8 UV/VIS spectra of vitamin B12respective in pure water and in Fe/Cu system(pH=8.2)
综合分析推测“Fe/Cu-B12”体系在碱性环境中对二氯甲烷还原过程的可能机理能够通过以下步骤表达:
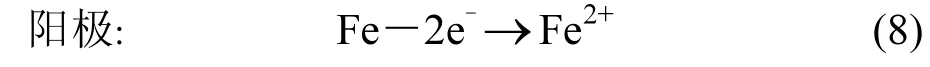

通过反应(8)~(12)可实现对低卤代二氯甲烷的强制还原降解,其中由维生素 B12促成的阴极链式反应均在Cu0表面进行,并借助B12在氧化还原过程中Co价态间的迅速转化完成了整个催化过程.针对伴随还原过程 B12在水相中的可能构象及具体结合形式仍需要开展更为深入的研究.
3 结论
3.1 水中二氯甲烷难以被零价铁直接去除,而通过构建Fe/Cu双金属联合维生素B12的强化体系可有效提升去除效率,因此利用Cu和B12的协同效应有望改善基于零价铁的地下水修复能力.
3.2 通过 Cu对零价铁表面修饰可抑制铁表面钝化,实验证明其还可促进B12的催化过程,且对比实验表明其存在最佳负载率(约为5%),从剂量
角度可为零价铁表面修饰提供参照.
3.3 通过改变溶液pH值可有效调控Fe/Cu-B12体系的反应强度,实验证明其存在一个较为理想的控制区间(8~10),且这种控制结果和B12在水相中的存在状态密切关联.
3.4 对 Fe/Cu-B12体系可能的反应机制进行了初步探讨,推测 B12先作为活泼电子受体在 Cu0表面将目标有机物脱氯形成中间体物质,而后迅速分解生成 B12和加氢还原的卤代物,整个催化过程是在Fe(电子供体)、Cu和B12三者的协同作用下完成的.
[1] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide [M]. IARC, 1999.
[2] Ruben L F, Jose G O, Jose L A, et al. Gas-phase catalytic combustion of chlorinated VOC binary mixtures [J]. Applied Catalysis B: Environmental, 2003,45(1):13-21.
[3] Huang C C, Lo S L, Lien H L. Zero-valent copper nanoparticlesfor effective dechlorination of dichloromethane using sodium borohydride as a reductant [J]. Chemical Engineering Journal,2012,203(5):95—100.
[4] EUA. Department of Health and Human Services. Agency for Toxic Substances and Disease Registry. Toxicological profile for methylene chloride [J]. Atsdr Toxicological Profile, 2000.
[5] 颜 爱,卞 琼,刘明华.改性纤维素负载零价铁去除三氯甲烷的研究 [J]. 中国环境科学, 2014,34(1):105-110.
[6] Johnson T L, Scherer M M, Tratnyek P G. Kinetics of halogenated organic compounds degradation by iron metal [J]. Environmental Science & Technology, 1996,30(8):2634-2640.
[7] Hen S, Chen W, Shih C. Heavy metal removal from wastewater using zero-valent iron nanoparticles [J]. Water Science & Technology, 2008,58(10):1947-1954.
[8] 张瑞华,孙红文.零价铁修复铬污染水体的实验室研究 [J]. 农业环境科学学报, 2004,23(6):1192-1195.
[9] Kassaee M Z, Motamedi E, Mikhak A, et al. Nitrate removal from water using iron nanoparticles produced by arc discharge vs.reduction [J]. Chemical Engineering Journal, 2011,166(2):490—495.
[10] 邓红卫,贺 威,胡建华,等.Fe0-PRB修复地下水硝酸盐污染数值模拟 [J]. 中国环境科学, 2015,35(8):2375-2381.
[11] Nam S, Tratnyek P G. Reduction of azo dyes with zero-valent iron [J]. Water Research, 2000,34(6):1837—1845.
[12] 陈 冰,王 晨,王西奎.超声波-零价铁协同降解废水中活性深蓝M-2GE的研究 [J]. 环境工程学报, 2009,3(9):1589—1591.
[13] Cheng R, Wang J L, Zhang W X, et al. Reductive dechlorination of 2,4-dichlorophenol using nanoscale Fe0: influencing factors and possible mechanism [J]. Science in China Series B:Chemistry, 2007,50(4):574-579.
[14] Wang X Y, Chen C, Chang Y, et al. Dechlorination of chlorinated methanes by Pd/Fe bimetallic nanoparticles [J]. Journal of Hazardous Materials, 2009,161(2/3):815—823.
[15] Feng J, Lim T T. Pathways and kinetics of carbon tetrachloride and chloroform reductions by nano-scale Fe and Fe/Ni particles:comparison with commercial micro-scale Fe and Zn [J]. Chemosphere, 2005,59(9):1267—1277.
[16] 陶宏林,单爱琴,李海花,等.Cu/Fe双金属去除四氯化碳的研究[J]. 安徽农业科学, 2011,33(7):10377-10379.
[17] Lien H L, Zhang W X. Transformation of chlorinated methanes by nanoscale iron particles [J]. Journal of Environmental Engineering, 1999,125(11):1042—1047.
[18] 吴德礼,马鲁铭,王 铮.氯代有机物结构性质对还原脱氯速率的影响 [J]. 工业用水与废水, 2005,23(3):22-25.
[19] Glod G, Brodmann U, Angst W, et al. Cobalamin-mediated reduction of cis- and trans-dichloroethene, 1,1-dichloroethene,and vinyl chloride in homogeneous aqueous solution: reaction kinetics and mechanistic considerations [J]. Environmental Science & Technology, 1997,31(11):3154—3160.
[20] Assaf-Anid N, Hayes K F, Vogel T M. Reductive dechlorination of carbontetrachloride by cobalamin(II) in the presence of dithiothreitol: mechanistic study, effect of redox potential and pH[J]. Environmental Science & Technology, 1994,28(2):246—252.
[21] 马少云,祝 方,商执峰.纳米零价铁铜双金属对铬污染土壤中Cr()Ⅵ的还原动力学 [J]. 环境科学, 2016,37(5):1953-1959.
[22] 吴德礼,马鲁铭,徐文英,等.Fe/Cu催化还原法处理氯代有机物的机理分析 [J]. 水处理技术, 2005,31(5):30-33.
[23] 王陆涛.纳米 Cu/Fe对三氯乙烯的催化脱氯研究 [D]. 北京:北京化工大学, 2013.
[24] Sorel D, Lesage S, Brown S, et al. Vitamin B12and reduced titanium for remediation of residual chlorinated solvents: field experiment [J]. Ground Water Monitoring and Remediation, 2001,21(4):140—148.
[25] Amir A, Lee W. Enhanced reductive dechlorination of tetrachloroethene by nano-sized zero valent iron with vitamin B12[J]. Chemical Engineering Journal, 2011,170(2/3):492-497.
[26] Kang W H, Hwang I, Park J Y. Dechlorination of trichloroethylene by a steel converter slag amended with Fe(II)[J]. Chemosphere, 2006,62(2):285-293.
Synergistic effect of vitamin B12 and Fe/Cu bimetal on reduction of dichloromethane: Mechanism study and process control.
LIN Ying-jie, ZHANG Shuo, SUN Li-ping*, XING Yue (School of Environmental and Municipal Engineering, Tianjin Chengjian University, Tianjin Key Laboratory of Aquatic Science and Technology, Tianjin 300384,China). China Environmental Science, 2016,36(9):2650~2657
Functionalized Fe/Cu bimetallic nanoparticles were prepared in this work for remediation of recalcitrant low-halogenated alkanes, for which the reducing capacity and process-enhancement control were investigated dealing with dichloromethane (DCM) as representative contaminant. Results show that vitamin B12significantly promoted the performance of Fe/Cu bimetal, since rate constant of DCM-reduction for Fe/Cu-B12system (0.444h-1) exhibited much higher than that of Fe/Cu system (0.018h-1) or Fe-B12system (0.03h-1), implying the synergistic effect of Cu and B12on electron-donating ability of zero-valent iron. Experiments were further conducted for process control, and results showed that 5% surface Cu-coverage and pH 9.5benefits better the catalytic reduction of DCM. Possible mechanism on catalytic performance of Fe/Cu-B12system was discussed referring to analysis on intermediate product as well as reduction kinetics. We speculated that the intermediate was prepared by dechlorination of target organic with B12as an active electron acceptor on surface of Cu0, and then quickly decomposed to B12and hydrogenated halide, the catalytic process was completed under synergistic effects of Fe (electron donor), Cu and B12.
Fe/Cu bimetal;vitamin B12;dichloromethane;catalytic dechlorination
X131.2
A
1000-6923(2016)09-2650-08
2016-01-20
国家自然科学基金(51478292)
* 责任作者, 教授, slpyqs@vip.sina.com
林英杰(1990-),女,河南商丘人,天津城建大学硕士研究生,主要从事水污染控制的相关研究.

