镉诱导HEK293细胞自噬和凋亡
刘宣宣,王文倩,毛伟平
(1.南京师范大学江苏省分子医学实验室,江苏南京210023;2.南京医科大学康达学院生理学教研室,江苏连云港222000)
镉诱导HEK293细胞自噬和凋亡
刘宣宣2,王文倩2,毛伟平1
(1.南京师范大学江苏省分子医学实验室,江苏南京210023;2.南京医科大学康达学院生理学教研室,江苏连云港222000)
目的探究镉(二氯化镉,CdCl2)能否诱导HEK293细胞自噬与凋亡以及细胞外调节蛋白激酶(ERK)1/2和AKT蛋白在自噬中的作用。方法将绿色荧光蛋白(GFP)-微管相关蛋白Ⅰ轻链3B(LC3B)重组质粒转染至HEK293细胞24 h后,以CdCl22,4,8和10μmol·L-1诱导细胞12 h,荧光显微镜观察自噬情况;以CdCl22,4,8和10μmol·L-1诱导未转染GFP-LC3B重组质粒的HEK293细胞12 h,透射电子显微镜下观察自噬泡;Western蛋白印迹检测LC3B-Ⅱ/Ⅰ的表达变化,以及ERK1/2和AKT蛋白的磷酸化表达;流式细胞仪检测CdCl2(≤10μmol·L-1)对HEK293细胞凋亡的影响。用3-MA(自噬抑制剂)预处理CdCl210μmol·L-1诱导的HEK293细胞12 h,Western蛋白印迹检测细胞内激活型胱天蛋白酶3的表达。结果CdCl2(≤10μmol·L-1)诱导HEK293细胞12 h,荧光显微镜下转染细胞出现绿色荧光点状聚集,电镜下观察到自噬泡,Western蛋白印迹检测到LC3B-Ⅱ/Ⅰ表达量增加(P<0.05,P<0.01),ERK1/2和AKT蛋白磷酸化水平均增加(P<0.05,P<0.01)。流式细胞仪检测出CdCl2(≤10μmol·L-1)诱导的HEK293细胞发生了细胞凋亡;加入3-MA 20μmol·L-1+CdCl210μmol·L-1后,细胞自噬被抑制,激活型胱天蛋白酶3表达增加(P<0.01)。结论低浓度CdCl2(≤10μmol·L-1)能引起细胞自噬,可能通过ERK1/2和AKT蛋白介导细胞自噬;自噬与凋亡相伴发生,自噬可能抑制凋亡。
镉;HEK293细胞;自噬;细胞凋亡
镉(cadmium,Cd)是一种有毒重金属,国际癌症研究组织将镉及其相关化合物确认为第一类致癌物。镉的化合物可引起人类肾、肝、肺、咽、前列腺等器官发生癌症。大量研究表明,长期低剂量接触镉主要引起近曲小管与肾小球系膜细胞的损伤[1]。
自噬是真核细胞自我保护的一种方式,是自噬泡包裹着部分细胞器如线粒体、高尔基体、内质网等被溶酶体所降解的过程。营养缺乏、感染及细胞器受损等均能激活自噬[2]。目前,自噬的检测方法主要有磺酰戊二胺(monodansylcadaverine,MDC)染色法、透射电子显微镜检测自噬小体、绿色荧光蛋白(GFP)-微管相关蛋白Ⅰ轻链3(lightchain 3,LC3)荧光定位和免疫印迹法检测LC3-Ⅰ到LC3-Ⅱ的转化等[3]。
目前的研究发现,如下几种信号转导途径诱发自噬:ClassⅠ磷脂酰肌醇3-激酶(phosphatidylino⁃ sitol3-kinases,PI3K)-蛋白激酶B(protein kinase B,PKB/AKT)-哺乳动物西罗莫习(雷帕霉素)靶蛋白〔mammalian target of sirolimus(Rapamycin),mTOR〕和Ras/Raf1-细胞外调节蛋白激酶(extracel⁃lular regulated protein kinases,ERK1/2)信号通路,ClassⅢPI3K复合物,Ca2+-钙调蛋白依赖性激酶激酶(calcium/calmodulin dependent protein kinase kinase,CaMKK)β-丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)信号通路及活性氧(reactive oxygen species,ROS)等[4]。有研究表明,激活的PI3K-Akt-mTOR信号通路能够通过抑制自噬增强细胞凋亡;而Ras/Raf-1/ERK激酶(ERK kinases,MEK)/ERK的信号通路中的Raf-1蛋白与PI3K/Akt串联的通路通过抑制Raf-1的表达,从而抑制自噬[5],说明ERK和Akt的激活在细胞自噬现象中也存在着相互作用。用ERK的抑制剂处理细胞可降低细胞色素c的释放,同时活化胱天蛋白酶3,提示ERK也可能介导细胞凋亡[6];也有研究表明,在系膜细胞中,ERK的抑制剂PD98059对镉诱导的CaMKⅡ信号介导的细胞凋亡并未起到作用[7]。
用不同浓度镉处理U937细胞,发现镉引起细胞凋亡呈浓度-效应关系和时间-效应关系[8]。肾小球系膜细胞已被证实是镉致毒的重要靶点[1],但尚无研究证实CdCl2(≤10μmol·L-1)能否诱导人胚肾细胞自噬,以及自噬与凋亡关系。本研究旨在使用GFP-LC3荧光定位法探究CdCl2(≤10μmol·L-1)能否引起人胚肾细胞自噬,相关蛋白在自噬信号通路中的作用,以及自噬与凋亡的关系。通过促进或抑制细胞自噬的发生,对疾病的预测和预防提供一定实验基础。
1 材料与方法
1.1 细胞和质粒
人胚肾细胞HEK293,GFP-LC3B重组质粒均由本实验室保存。人胚肾细胞HEK293贴壁培养于含10%胎牛血清的高糖DMEM培养基中,置于37℃,5%CO2的饱和湿度培养箱中培养,按1∶3用胰酶消化,传代。
1.2 试剂及仪器
高糖DMEM(美国Gibco公司),小牛血清(杭州四季青公司),DMSO(美国Amresco公司),磷酸钙转染试剂盒(上海碧云天公司),CdCl2、兔抗人LC3B多克隆抗体(美国Sigma公司),ERK1/2、AKT、激活型胱天蛋白酶3(cleaved caspase 3)抗体和3-MA(南京Bioworld公司),HRP标记羊抗兔IgG抗体(二抗)(北京中杉金桥公司),ECL发光液(美国Thermo公司),流式凋亡试剂盒(美国BD公司)。其他常规化学试剂均为国产分析纯(南京化学试剂厂)。Hera Cell150 CO2细胞培养箱(德国Heraeus公司),TE-2000U倒置相差显微镜(日本尼康公司),FACS Calibur流式细胞仪(美国BD公司)。
1.3 荧光显微镜观察GFP-LC3B在HEK293细胞中的表达
以每孔1×106L-1HEK293细胞接种于6孔板内,待细胞长至70%~80%时,准备转染。首先,换无抗生素培液(每孔加2 mL培液),30~60 min后将20μL GFP-LC3B质粒DNA加到600μL CaCl2溶液中混匀;将DNA-CaCl2溶液加入到600μL BBS(平衡盐溶液)溶液中,混匀,室温孵育10~20 min;将DNACaCl2-BBS混合物均匀滴加到6孔板内,于细胞培养箱内培养24 h后,荧光显微镜下检测转染基因的表达。转染成功后的细胞,随机分为GFP-LC3B对照组和CdCl2(2,4,8和10μmol·L-1)实验组,6孔板每孔加CdCl22μL,GFP-LC3B对照组加等量生理盐水,12 h后荧光显微镜下观察绿色荧光点状聚集细胞的形成并拍照。均匀分布于细胞中的LC3B-Ⅰ在CdCl2的诱导下向LC3B-Ⅱ转化,LC3B-Ⅱ一般只出现在自噬体膜或溶酶体膜上,从而形成集中于自噬体膜或溶酶体膜上的绿色荧光点状聚集。
1.4 透射电子显微镜观察自噬小体
以每孔1×106L-1HEK293细胞接种于6孔板内,实验组各孔依次加入2,4,8和10μmol·L-1的CdCl2溶液2μL,正常细胞对照组加等量灭菌生理盐水,24 h后胰酶消化移至离心管,626×g离心5 min,1×PBS洗涤2次,0.5 mL戊二醛固定样品,放4℃冰箱3~4 h。吸出戊二醛,将离心管放入60℃水浴锅内,每管中加入20μL液态琼脂,0.2 mL PBS和0.2 mL锇酸脱水,用30%,50%,70%,80%和90%的丙酮依次脱水,每次15 min,无水丙酮脱水2次,每次10 min。丙酮/树脂(0.2 mL/0.2 mL)浸透1 h、丙酮/树脂〔0.2 mL/(0.2 mL+0.2 mL)〕浸透1 h;纯树脂,浸透过夜;包埋。30℃,45℃和60℃各聚合1 d。半薄切片(1~10μmol·L-1),甲苯胺蓝染色。超薄切片,双染(醋酸双氧铀避光染色40 min,柠檬酸铅染色7 min)。透射电子显微镜下观察自噬小体并拍照。
1.5 Western蛋白印迹法检测自噬及凋亡相关蛋白的表达
HEK293细胞随机分为对照组和CdCl22,4,8和10μmol·L-1实验组。收集细胞,加入含PMSF的裂解液后超声3次,100℃煮5 min,4℃13 000×g离心2 min,-70℃保存。BCA法进行蛋白定量,蛋白上样量50μg进行SDS-PAGE(12%),电泳条件为恒压90 V,2 h;然后将蛋白转印至PVDF膜上,转膜条件为恒压24 V,2 h;用含5%脱脂奶粉的PBST封闭2 h,PBST洗膜4次,每次15 min;一抗(兔抗人LC3B、ERK1/2、AKT,1∶1000稀释)4℃孵育过夜;二抗(羊抗兔IgG-HRP,1∶1000稀释)4℃孵育8 h。ECL荧光显色,于暗室显影后扫描。目标蛋白与β肌动蛋白的积分吸光度值比值表示蛋白相对表达水平。
以3-MA(自噬抑制剂)20μmol·L-1、CdCl210μmol·L-1和3-MA 20μmol·L-1+CdCl210μmol·L-1分别处理HEK293细胞12 h后,检测LC3B-Ⅱ/Ⅰ和激活型胱天蛋白酶3的表达,一抗(兔抗人LC3B和激活型胱天蛋白酶3,1∶1000稀释);二抗(羊抗兔IgGHRP,1∶1000稀释)。
1.6 流式细胞术检测细胞凋亡
HEK293细胞实验组每孔依次加入2μL的CdCl22,4,8和10μmol·L-1溶液,对照组加等量生理盐水。凋亡检测试剂盒FITC Annexin-Ⅴ和PI检测。收集细胞(2000×g离心5 min),PBS洗涤2次(2000×g离心5 min),制备1×109L-1的细胞悬液,流式管每管加入100μL 1×结合缓冲液悬浮细胞,5μL FITC Annexin-V标记,避光染色10 min;加入10μL碘化丙啶染液,避光染色5 min;加350μL 1×结合缓冲液,1 h内用流式细胞仪检测。
1.7 统计计学分析
实验数据以x±s形式表示,统计学处理采用Image J软件分析。SPSS 19.0统计软件进行单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 CdCl2诱导的HEK293细胞中GFP-LC3B的表达
如图1所示,与GFP-LC3B细胞对照组相比,CdCl2处理各组细胞出现绿色荧光点状聚集现象(箭头所示),提示CdCl2(≤10μmol·L-1)可诱导HEK293细胞自噬。
2.2 CdCl2诱导HEK293细胞自噬
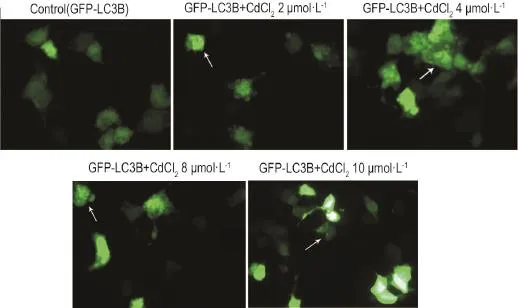
Fig.1 Expression of plasmid GFP-light chain 3(LC3)B in HEK293 cells detected by fluorescent microscope. HEK293 cells transfected with GFP-LC3B were exposed to 2,4,8 and 10μmol·L-1CdCl2for 12 h.Arrows show cytoplasmic GFP-LC3B punctuates.
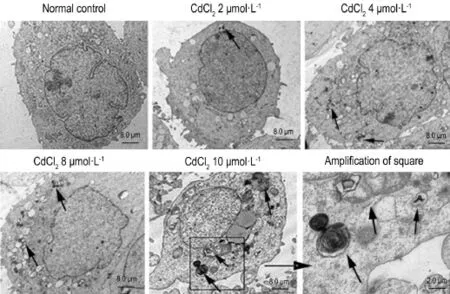
Fig.2 Electron micrographs of HEK293 cells exposed to CdCl2(A-E:×1000;F:×4000).HEK293 cells were exposed to CdCl22,4,8 and 10μmol·L-1for 12 h.Arrows show autophagic vacuoles.
如图2所示,正常细胞对照组细胞形态基本完好,CdCl2组均出现了自噬泡,CdCl210μmol·L-1时出现了损伤的细胞器,如内质网和线粒体出现肿胀破裂,其周围出现空泡状双层膜样结构,以及自噬溶酶体内最终不能降解的残体等(箭头所示)。提示CdCl2(≤10μmol·L-1)可诱导HEK293细胞自噬。
2.3 CdCl2诱导对HEK293细胞自噬蛋白LC3B-Ⅱ/Ⅰ表达的影响
以CdCl22,4,8和10μmol·L-1处理HEK293细胞12 h后,自噬蛋白LC3B-Ⅱ/Ⅰ的表达量均增加(P<0.05,P<0.01)(图3A);以CdCl210μmol·L-1处理HEK293细胞2,4,8,12和24 h后,LC3B-Ⅱ/Ⅰ的表达均增加(P<0.05,P<0.01)(图3B),提示CdCl2(≤10μmol·L-1)诱导了HEK293细胞的自噬。
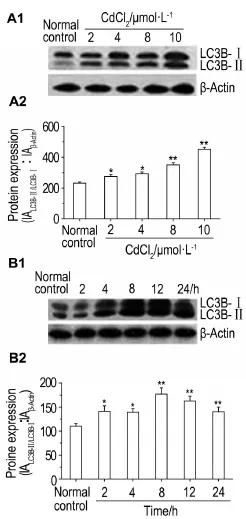
Fig.3 Effect of CdCl2on expression of LC3B-Ⅱ/Ⅰproteins in HEK293 cells detected by Western blotting. See Fig.2 for the celltreatment.A2 and B2 are semi-quantitative results of A1 and B1.*P<0.05,**P<0.01,compared with normalcontrolgroup.
2.4 CdCl2诱导对HEK293细胞自噬相关蛋白p-ERK1/2和p-AKT表达的影响
图4结果所示,以CdCl22,4,8和10μmol·L-1处理HEK293细胞12 h后,LC3B-Ⅱ/Ⅰ的表达量均增加,即细胞发生自噬;ERK1/2和AKT在不同CdCl2浓度下表达量相同时,p-ERK1/2和p-AKT蛋白表达均增加(P<0.05,P<0.01)。提示CdCl2(≤10μmol·L-1)诱导细胞自噬时,可能激活了ERK1/2和AKT蛋白的磷酸化,或激活了相关信号通路。
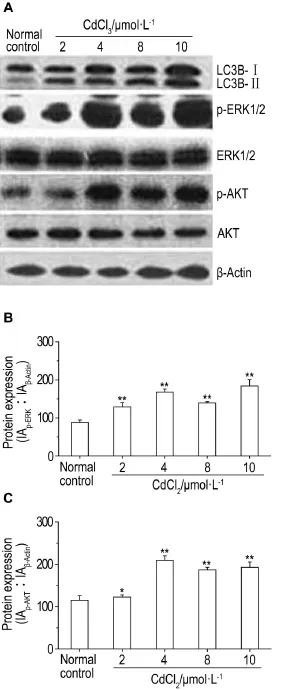
Fig.4 Effect of CdCl2on expression of p-extracellular regulated protein kinases(ERK)and p-protein kinase B(PKB/AKT)in HEK293 cells exposed for 12 h detected by Western blotting.See Fig.2 for the cell treatment.B and C:semi-quantitative results of p-ERK and p-AKT in A.*P<0.05,**P<0.01,compared with normal cell control group.
2.5 CdCl2诱导对HEK293细胞凋亡的影响
流式结果(图5)显示,以CdCl22,4,8和10μmol·L-1处理HEK293细胞12 h后,与对照组相比,CdCl22,4,8和10μmol·L-1组均出现细胞凋亡现象;同时,CdCl2(≤10μmol·L-1)可诱导HEK293细胞自噬。提示CdCl2(≤10μmol·L-1)时细胞自噬与凋亡相伴发生。
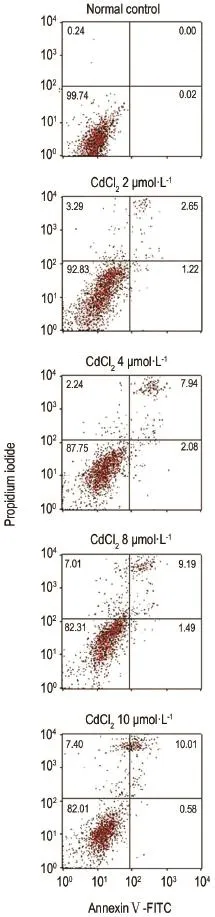
Fig.5 Effect of CdCl2exposure for 12 h on apoptosis of HEK293 cells by flow cytometry microscopy.See Fig.2 for the celltreatment.
2.6 3-MA对CdCl2诱导的HEK293细胞凋亡的增强作用
图6结果显示,与对照组相比,CdCl210μmol·L-1组自噬蛋白LC3B-Ⅱ/Ⅰ和凋亡蛋白激活型胱天蛋白酶3的表达增强,出现细胞自噬和凋亡;与CdCl210μmol·L-1组相比,3-MA 20μmol·L-1+CdCl210μmol·L-1组自噬蛋白LC3B-Ⅱ/Ⅰ的表达减弱(P<0.05,P<0.01),凋亡蛋白激活型胱天蛋白酶3表达量增加(P<0.05,P<0.01);提示3-MA抑制了细胞自噬,增强了细胞凋亡(图6A)。即低浓度CdCl2(≤10μmol·L-1)诱导细胞自噬同时可能抑制细胞凋亡。
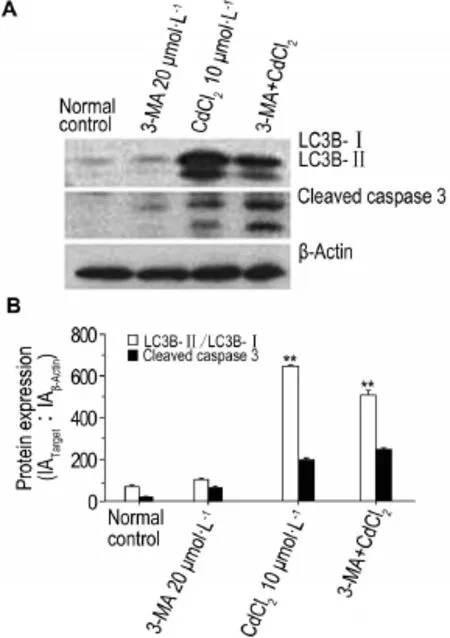
Fig.6 Effect of CdCl2on expression of LC3B-Ⅱ/Ⅰand cleaved capase 3 proteins in HEK293 cells exposed for 12 h by Western blotting.See Fig.2 for the cell treatment. B:semi-quantitative results of cleaved capase 3 in A*P<0.05,**P<0.01,compared with normalcontrolgroup.
3 讨论
自噬广泛存在于生物体内,是生物降解胞内蛋白,完成细胞器转化,保持内环境稳定的重要方式[8]。本研究运用重组质粒GFP-LC3B的转染、透射电子显微镜技术、Western蛋白印迹和流式细胞术等方法,表明CdCl2(≤10μmol·L-1)可诱导HEK293细胞自噬,与长期低剂量接触镉主要引起近曲小管与肾小球系膜细胞的损伤结果[1]一致;Lim等[9]和Oh[10]等通过对镉抵抗细胞RWI38(通过6个月逐渐增加镉浓度处理人肺上皮细胞WI38而诱导形成)进行镉处理后,也发现细胞凋亡特征不明显,而细胞自噬作用明显。由此初步证明,细胞自噬与凋亡相伴发生,细胞自噬可能早于凋亡出现。
本研究中,ERK1/2和AKT的磷酸化在镉诱导细胞自噬中起到了重要作用。ERK1/2具体在细胞自噬中如何发挥作用还未可知,因此,ERK1/2介导细胞自噬的具体机制仍值得探讨。
本研究显示,镉可诱导细胞自噬和凋亡。自噬抑制剂3-MA增加了细胞内激活型胱天蛋白酶3的表达和细胞凋亡的发生,推测细胞自噬在一定范围内抑制了凋亡,在一定程度上延长了细胞的存活时间,这与用三氧化二砷等药物处理细胞后,自噬与凋亡共存的实验结果[11]相一致。Dong等[12]在血管上皮细胞上发现低浓度镉(<10μmol·L-1)在无血清和bFGF条件下,能诱导自噬同时抑制凋亡。由此可见,自噬的发生为细胞内物质的重复利用提供了基础,这也可能是镉作为一种促细胞分裂剂,刺激细胞增殖,抑制细胞凋亡的一种途径。
镉诱导自噬和凋亡均通过细胞内Ca2+信号的介导,Ca2+信号介导的细胞自噬和凋亡的发生分别通过ERK依赖途径和线粒体胱天蛋白酶信号通路途径[13]。镉能够同时诱导自噬和凋亡的发生,最终介导肾细胞死亡,表明自噬是通过Ca2+-ERK及ROS-糖原合酶激酶3β两条途径所介导[14-15]。本研究显示,抑制细胞自噬后,凋亡增强,提示自噬的发生可能抑制凋亡,在细胞凋亡前期,自噬的发生可能是细胞的自我保护机制。尽管如此,细胞自噬和凋亡的具体关系仍然扑朔迷离,因为在细胞自噬和凋亡的信号通路中存在着众多的交叉和重叠。因此,后续实验中,将重点探究细胞自噬和凋亡的关系以及各信号蛋白在细胞自噬中的作用。以便通过促进或抑制细胞自噬的发生,为某些疾病的预测和预防提供一定理论基础。
[1]JohriN,Jacquillet G,Unwin R.Heavy metalpoisoning:the effects of cadmium on the kidney[J].Biometals,2010,23(5):783-792.
[2]Lum JJ,Bauer DE,Kong M,Harris MH,Li C,Lindsten T,et al.Growth factor regulation ofautophagy and cell survival in the absence of apoptosis[J]. Cell,2005,120(2):237-248.
[3]Eskelinen EL,Saftig P.Autophagy:a lysosomal degradation pathway with a central role in health and disease[J].Biochim Biophys Acta,2009,1793(4):664-673.
[4]Chen N,Karantza-Wadsworth V.Role and regulation of autophagy in cancer[J].Biochim Biophys Acta,2009,1793(9):1516-1523.
[5]Wu YT,Tan HL,Huang Q,Ong CN,Shen HM. Activation of the PI3K-Akt-mTOR signaling pathway promotes necrotic cell death via suppression of autophagy[J].Autophagy,2009,5(6):824-834.
[6]Wang X,Martindale JL,Holbrook NJ.Requirement for ERK activation in cisplatin-induced apoptosis[J].J Biol Chem,2000,275(50):39435-39443.
[7]McCubrey JA,Steelman LS,Chappell WH,Abrams SL,Wong EW,Chang F,et al.Roles of the Raf/MEK/ERK pathway in cell growth,malignant transformation and drug resistance[J].Biochim Biophys Acta,2007,1773(8):1263-1284.
[8]Monastyrska I,Klionsky DJ.Autophagy in organ⁃elle homeostasis:peroxisome turnover[J].Mol Aspects Med,2006,27(5-6):483-494.
[9]Lim SC,Hahm KS,Lee SH,Oh SH.Autophagy involvement in cadmium resistance through induction of multidrug resistance-associated protein and counterbalance of endoplasmic reticulum stress WI38 lung epithelial fibroblast cells[J].Toxicology,2010,276(1):18-26.
[10]Oh SH,Lee SY,Choi CH,Lee SH,Lim SC. Cadmium adaptation is regulated by multidrug resistance-associated protein-mediated Akt pathway and metallothionein induction[J].Arch Pharm Res,2009,32(6):883-891.
[11]Qian W,Liu J,Jin J,NiW,Xu W.Arsenic trioxide induces not only apoptosis but also autophagic cell death in leukemia cell lines via up-regulation of Beclin-1[J].Leuk Res,2007,31(3):329-339.
[12]Dong Z,Wang L,Xu J,LiY,Zhang Y,Zhang S,et al.Promotion of autophagy and inhibition of apoptosis by low concentrations ofcadmium in vas⁃cular endothelial cells[J].Toxicol In Vitro,2009,23(1):105-110.
[13]Li M,Kondo T,Zhao QL,Li FJ,Tanabe K,Arai Y,Kasuya M,et al.Apoptosis induced by cadmium in human lymphoma U937 cells through Ca2+-calpain and caspase-mitochondria-dependent pathways[J].J Biol Chem,2000,275(50):39702-39709.
[14]Huang YC,Hung WC,Chen WT,Yu HS,Chai CY. Sodium arsenite-induced DAPK promoter hypermethylation and autophagy via ERK1/2 phosphorylation in human uroepithelial cells[J].Chem Biol Interact,2009,181(2):254-262.
[15]Wang SH,Shih YL,Kuo TC,Ko WC,Shih CM. Cadmium toxicity toward autophagy through ROS-activated GSK-3beta in mesangialcells[J].Toxicol Sci,2009,108(1):124-131.
CdCl2induces autophagy and apoptosis in HEK293 cells
LIU Xuan-xuan2,WANGWen-qian2,MAO Wei-ping1
(1.Laboratory of Molecular and MedicalBiotechnology,Nanjing NormalUniversity,Nanjing 210023,China;2.DepartmentofPhysiology,Kangda College ofNanjing MedicalUniversity,Lianyungang 222000,China)
OBJECTIVE To evaluate the possibility that CdCl2induces autophagy and apoptosis in HEK293 cells,and the role of extracellular regulated protein kinases(ERK1/2)and AKT proteins in autophagy.METHODS Green fluorescence protein(GFP)-lightchain 3B(LC3B)expression plasmid was transfected into HEK293 cells.After 24 h,HEK293 cells were induced with CdCl22,4,8 and 10μmol·L-1for 12 h.The expression of GFP-LC3B was detected by fluorescent microscopy.HEK293 cells were induced with CdCl22,4,8 and 10μmol·L-1withouttransfection of GFP-LC3B for 12 h while autophagic vacuoles were observed by transmission electron microscopy.The expression of LC3B-Ⅱ/Ⅰproteins and the phosphorylation levels of ERK1/2 and AKT were analyzed by Western blotting.Apoptosis was detected by flow cytometry microscopy.HEK293 cells were treated with 3-MA 20μmol·L-1+CdCl210μmol·L-1for 12 h before cleaved caspase 3 protein was detected by Western blotting.RESULTS When HEK293 cells were exposed to CdCl2(≤10μmol·L-1)for 12 h,cytoplasmic GFP-LC3B punctuates were observed under the fluorescence microscope,and autophagic vacuoles were observed under an electron microscope.The expression of LC3B-Ⅱ/Ⅰ,p-ERK1/2 and p-AKT proteins was significantly increased in CdCl2-induced cells(P<0.05,P<0.01).Moreover,apoptosis was observed.The addition of 3-MA 20μmol·L-1+CdCl210μmol·L-1enhanced apoptosis.Cleaved capase 3 protein expression was significantly increased(P<0.01).CONCLUSION CdCl2(≤10μmol·L-1)can induce autophagy in HEK293 cells.ERK1/2 and AKT proteins mightbe associated with the activation ofautophagy thatis accompanied by apoptosis,suggesting thatautophagy can inhibitapoptosis atcertain concentrations ofCdCl2.
cadmium;HEK293 cells;autophagy;apoptosis
E-mail:maoweiping@njnu.edu.cn,Tel:(0518)80689625
R995
A
1000-3002-(2016)05-0569-07
10.3867/j.issn.1000-3002.2016.05.014
2015-05-08接受日期:2016-05-10)
(本文编辑:贺云霞)
刘宣宣,女,理学硕士,助教,主要从事重金属镉致细胞自噬与凋亡的研究。
毛伟平,E-mail:maoweiping@njnu.edu.cn.Tel:(0518)80689625

