西达本胺对结肠癌细胞能量代谢的调节作用
何 牧,乔志新,任素萍,李常兰,王艳冰,郐启源,王 钰,罗云敬,于 群
(1.北京工业大学生命科学与生物工程学院,北京100124;2.军事医学科学院野战输血研究所,北京100850;3.首都医科大学附属北京同仁医院中心实验室,北京100730)
西达本胺对结肠癌细胞能量代谢的调节作用
何 牧1,2,乔志新2,3,任素萍2,李常兰2,王艳冰2,郐启源2,王 钰2,罗云敬1,于 群2
(1.北京工业大学生命科学与生物工程学院,北京100124;2.军事医学科学院野战输血研究所,北京100850;3.首都医科大学附属北京同仁医院中心实验室,北京100730)
目的考察西达本胺对结肠癌细胞HCT-8和HT-29能量代谢调节的作用。方法西达本胺5,10和20μmol·L-1分别处理HCT-8和HT-29细胞,普通光学显微镜观察细胞形态变化,MTT法检测细胞存活,荧光细胞活性试剂盒检测ATP含量,糖酵解压力试剂盒检测代谢变化,荧光定量PCR和Western蛋白印迹法分别检测糖酵解关键酶乳酸脱氢酶A(LDH-A)在mRNA水平和蛋白水平的表达。结果与对照组相比,西达本胺处理组HCT-8和HT-29细胞形态不规则,出现变形、皱缩和细胞碎片,增殖抑制率显著升高(P<0.05);西达本胺5和10μmol·L-1处理16 h,HCT-8和HT-29细胞内ATP总含量均无差异,而20μmol·L-1处理组ATP总含量显著降低(P<0.05)。西达本胺20μmol·L-1处理HCT-8和HT-29细胞16 h,有氧呼吸水平均无差异,而糖酵解ATP产生速率分别降低30.7%和37.9%(P<0.05);LDH-A mRNA水平无差异,蛋白水平显著下调(P<0.01)。结论西达本胺具有抑制结肠癌细胞糖酵解能力的作用,可能与下调LDH-A有关。
结肠癌细胞;西达本胺;乳酸脱氢酶A;Warburg效应
结肠癌是一种常见的消化道肿瘤,据美国发布的《癌症统计2015》资料显示,2015年美国结肠癌预计新发病例为9万,居恶性肿瘤第4位;死亡约5万例,位于肺癌之后,居恶性肿瘤第2位[1]。我国结肠癌的发病率也呈上升趋势。临床上多采用以手术为主,化疗和放疗为辅的综合治疗方法,然而效果并不理想[2]。
研究表明,表观遗传学的改变对于恶性肿瘤的形成有非常重要的作用[3]。蛋白质的乙酰化是一种重要的翻译后修饰。乙酰化水平由组蛋白乙酰基转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)共同调节。通常情况下,HDAC在肿瘤细胞里是过表达的。HDAC参与恶性肿瘤的细胞分化、细胞转移、细胞黏附、血管形成、肿瘤抑癌基因沉默、细胞周期异常和信号转导等过程[4]。HDAC抑制剂(HDAC inhibitor,HDACi)可靶向作用于HDAC,恢复乙酰化水平,使得无法转录的抑癌基因等恢复转录,进而抑制肿瘤细胞增殖,诱导细胞凋亡。所以,HDACi正成为一类有广泛应用前景的抗癌新药。
西达本胺(chidamide,CS055)为我国自主合成的苯甲酰胺类HDACi。近年来,国内外多篇文献报道,西达本胺对胰腺癌、乳腺癌、前列腺癌和B细胞淋巴瘤等多种肿瘤细胞都有抗肿瘤作用。西达本胺是我国第一个被国家食品药品监督管理局(China Food and Drug Administration,CFDA)批准进入临床试验的HDACi类药物[5]。2014年12月23日被CFDA批准上市治疗外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL),成为全球第3个获批用于PTCL治疗的全新作用机制的药物。
Warburg效应指出,肿瘤细胞有别于正常细胞,在于能量代谢方式发生了改变。肿瘤细胞往往通过提高葡萄糖的利用率,采用有氧糖酵解途径快速获取能量以及合成代谢所需的各种前提物质[6-8]。肿瘤细胞相比正常细胞增加了乳酸的生成[9]。而乳酸作为有氧糖酵解的产物,增加了细胞生存环境的酸性[10],有利于肿瘤的侵袭[11],抑制了抗肿瘤免疫效应因子发挥作用[12]。乳酸脱氢酶A(lactate dehydrogenase A,LDH-A)是有氧糖酵解途径中的关键酶,催化糖酵解反应的最后一步,完成丙酮酸到乳酸的转化,并伴随NAD+的生成,对肿瘤的生长维持有关键作用。LDH-A在肿瘤细胞通常是过表达的,LDH-A不但在肿瘤的发生有重要作用,而且对于肿瘤生存维持和发展也有重要作用[13-14]。因此,肿瘤细胞特有的能量代谢方式可作为药物选择性杀伤肿瘤细胞的作用靶点,从而达到选择性抑制肿瘤增殖的目的。
本研究以结肠癌细胞HCT-8和HT-29为模型,观察西达本胺对于体外结肠癌细胞生长的影响,以及对结肠癌细胞能量代谢的调节作用。
1 材料与方法
1.1 细胞、试剂和仪器
人结肠癌细胞HCT-8和HT-29由军事医学科学院野战输血研究所惠赠,于含10%胎牛血清的DMEM培养液中,在37℃,5%CO2条件下培养细胞,细胞贴壁生长,待铺满90%培养瓶后用0.25%胰蛋白酶消化传代,取对数生长期细胞进行实验;西达本胺(深圳微芯生物科技责任有限公司),溶于DMSO中,存于-70℃;DMEM培养基(美国Gibco公司);FSP500胎牛血清(中国ExCell公司);0733MTT(美国Amresco公司);BCA蛋白定量试剂盒(美国Thermo Scientific公司);LDH-A抗体和β肌动蛋白抗体(美国Cell Signaling Technology公司);CellTiter-Glo®荧光细胞活性检测试剂盒、逆转录PCR试剂盒和实时PCR试剂盒(美国Promega公司);糖酵解压力试剂盒、XF基础培养基、XF96细胞培养板和XF96细胞代谢呼吸动态分析仪(美国海马Bioscience公司);Odyssey双色红外激光成像系统(美国LI-COR公司);LC96实时定量PCR仪(瑞士Roche公司)。
1.2 显微镜观察细胞形态的改变
取对数生长期HCT-8和HT-29细胞,每孔接种1 mL(1×108L-1)细胞于12孔板,将西达本胺储液(20 mmol·L-1的DMSO溶液)用DMEM培养基稀释至终浓度为10和20μmol·L-1,并加入到细胞培养液中。同时设置细胞对照组。细胞经西达本胺处理72 h后,普通光学显微镜下观察细胞形态的变化。
1.3 MTT法检测细胞存活
取对数生长期HCT-8和HT-29细胞,按每孔3000细胞接种96孔板,待细胞贴壁后,弃原培养液,西达本胺5,10和20μmol·L-1分别处理HCT-8和HT-29细胞72 h,同时设置细胞对照组。72 h后每孔加入MTT 5 mg·mL-1溶液10μl,培养箱中孵育4 h后,每孔加入SDS 100 mg·mL-1100μL溶解结晶,再放入培养箱中37℃孵育4 h,酶标仪测A570值,计算细胞存活抑制率:存活抑制率(%)=(1-实验组A570nm值)/(对照组A570nm值)×100%。
1.4 生物发光仪检测ATP生成
取对数生长期HCT-8和HT-29细胞,按每孔4000细胞接种96孔板,待8 h细胞贴壁后,弃原培养液,正常对照和本底孔加入完全培养基,给药孔分别加入含5,10和20μmol·L-1西达本胺的完全培养基,放入培养箱中孵育16 h。细胞培养结束后,每孔中加入100μL CellTiter-Glo®试剂,准备只含培养基不含细胞的对照孔,以得到背景发光值;在一个定轨振荡器上混合内容物4×g,2 min,诱导细胞裂解;将平板室温孵育10 min,使荧光信号值稳定,生物发光仪记录发光信号。
1.5 细胞外流量分析仪检测细胞能量代谢
取对数生长期HCT-8和HT-29细胞,按每孔9000细胞接种海马XF 96孔培养板,待8 h细胞贴壁后,弃原培养液,细胞对照和本底孔加入完全培养基,给药孔加入含20μmol·L-1西达本胺的完全培养基,放入培养箱中孵育16 h。细胞培养结束后,培养基更换为海马XF检测培养基,海马XF细胞外流量分析仪检测氧气消耗率(oxygen consumption rate,OCR)、细胞外酸化率(extracellularacidification rate,ECAR)和质子生成速率(proton production rate,PPR)。
1.6 实时PCR检测LDH-A mRNA的表达
用西达本胺20μmol·L-1处理HCT-8和HT-29细胞72 h,Trizol法提取总RNA,利用逆转录试剂盒将mRNA逆转录为cDNA,得到的cDNA用于实时PCR反应,以β肌动蛋白为内参,检测LDH-A mRNA的表达,mRNA相对表达水平采用比较Ct值法(2-△△Ct法)计算得出。
1.7 Western蛋白印迹检测LDH-A蛋白的表达
西达本胺5,10和20μmol·L-1分别处理HCT-8和HT-29细胞72 h,刮取细胞于15 mL离心管,再用PBS洗涤2次后,200×g离心5 min,去上清,向各组中加入细胞裂解液混匀,置于冰上30 min,13 200×g离心20 min,将上清液移入新的EP管中,BCA蛋白定量后加入5×蛋白上样缓冲液,100℃沸水煮5 min变性处理,经过SDS-PAGE,半干转膜仪转膜1 h,用5%脱脂奶粉封闭1 h,PBST洗膜4次,每次5 min,一抗孵育3 h,PBST洗膜4次,二抗避光孵育1 h,PBST洗膜4次后,Odyssey近红外双色激光成像系统检测PVDF膜,以β肌动蛋白作为内参照。蛋白相对表达水平以目标蛋白和内参蛋白的积分吸光度比值表示。
1.8 统计学分析
2 结果
2.1 西达本胺处理后结肠癌细胞的形态变化
光学显微镜观察发现(图1),72 h后,对照组细胞形态饱满完整,贴壁生长良好;而经西达本胺处理后,细胞形态不规则,出现变形和皱缩,且有从壁上脱落的现象,出现细胞碎片。提示西达本胺有阻滞细胞生长并诱导细胞死亡的作用。

Fig.1 Effect of chidamide on morphology of HCT-8 and HT-29 cells after 72 h treatment(×100).HCT-8 and HT-29 cells were treated with chidamide 10 and 20μmol·L-1for 72 h,respectively.
2.2 西达本胺对HCT-8和HT-29细胞存活的影响
MTT结果(图2)表明,西达本胺5,10和20μmol·L-1组处理HCT-8和HT-29细胞72 h后,细胞存活抑制作用具有浓度效应依赖性(r2分别为0.951和0.726)。其中西达本胺20μmol·L-1组HCT-8和HT-29的存活抑制率分别为(51.4± 6.6)%和(57.4±6.7)%,与细胞对照组相比明显升高(P<0.01)。

Fig.2 Effect of chidamide on proliferation of HCT-8(A)and HT-29(B)cells.HCT-8 and HT-29 cells were treated with chidamide 5,10 and 20μmol·L-1for 72 h.0.05,**P<0.01,compared with cellcontrolgroup.
2.3 西达本胺对HCT-8和HT-29细胞ATP生成的影响
荧光检测结果表明,西达本胺5和10μmol·L-1组处理HCT-8和HT-29细胞16 h后,细胞内ATP总含量并无显著性差异。而西达本胺20μmol·L-1处理ATP总含量分别由细胞对照组的(118±13)nmol·L-1和(332±33)nmol·L-1下降为(85±10)nmol·L-1和(222±17)nmol·L-1(P<0.05)(图3A)。鉴于低浓度组对于ATP总含量无影响,所以在后续检测中,仅选用西达本胺20μmol·L-1组进行实验。海马XF细胞外流量分析仪监测结果表明,与细胞对照组相比,西达本胺20μmol·L-1组耗氧率均无显著性差异(图3B),而糖酵解能力分别下降31.5%和35.2%(P<0.01)(图3C)。糖酵解产生ATP的速率分别降低30.7%和37.9%(P<0.05)(图3D)。
2.4 西达本胺对结肠癌细胞糖酵解关键酶LDH-A的影响
西达本胺20μmol·L-1处理72 h后,实时定量PCR结果(图4A)表明,HCT-8和HT-29细胞内LDH-A mRNA水平与对照组相比无显著性差异。Western印迹法结果(图4B和4C)表明,LDH-A蛋白表达显著下降(P<0.01)。提示西达本胺可能通过LDH-A翻译后修饰途径抑制LDH-A蛋白表达。

Fig.3 Effect of chidamide on total content of ATP(A),oxygen consumption rate(OCR,B),extracellular acidifi⁃cation rate(ECAR,C)and glycolysis ATP production were rate(D)in HCT-8 and HT-29 cells.A:HCT-8(A1)and HT-29 cells(A2)were treated with chidamide 5,10 and 20μmol·L-1for 16 h.B,C and D:HCT-8 and HT-29 cells treated with chidamide 20μmol·L-1for 16 h.n=3.*P<0.05,**P<0.01,compared with cellcontrolgroup.
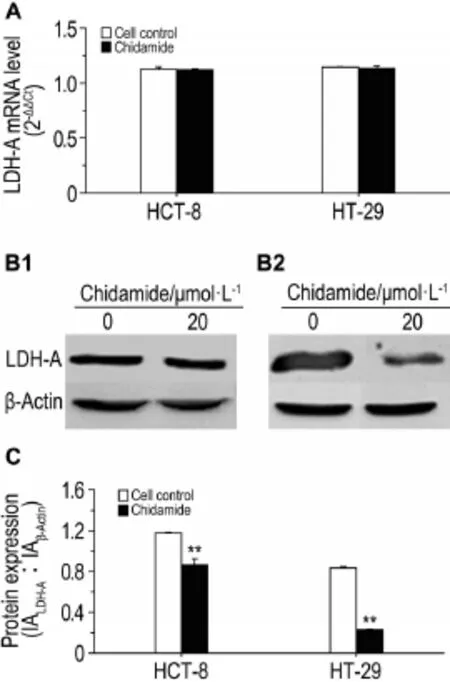
Fig.4 Effect of chidamide on key glycolytic enzyme LDH-A in HCT-8 and HT-29 cells by real-time PCR(A)and Western blotting(B and C). HCT- 8 and HT- 29 cells were treated with chidamide 20 μmol·L-1for 72 h. C:semi-quanti⁃tative result of B. B1:HCT- 8 cells;B2:HT- 29 cells.n=3. **P<0.01,compared with cell control group.
3 讨论
本研究结果表明,西达本胺处理72 h显著抑制HCT-8和HT-29细胞的生长,其作用机制可能涉及其对LDH-A的靶向调节作用。由于药物作用时间越长,细胞状态、数目及细胞间隙差异越大,所以在细胞能量代谢活力的监测进行过程中,本研究选择16 h取代72 h作为检测时间点,研究发现,西达本胺处理16 h后,结肠癌细胞的有氧呼吸水平无显著变化,而糖酵解能力减弱,无氧呼吸产生的ATP生成速率降低,以致结肠癌细胞总ATP生成量减少。
本研究发现,西达本胺可下调糖酵解途径关键酶LDH-A的蛋白水平,控制肿瘤细胞内ATP的合成。但它对LDH-A基因转录水平无明显影响,推测西达本胺是通过对LDH-A翻译后修饰的方法抑制LDH-A蛋白表达。目前已有报道,LDH-A蛋白存在磷酸化和乙酰化的修饰,当LDH-A在K5发生乙酰化时可促使其发生降解[15]。因此推测,西达本胺在结肠癌细胞中发挥HDACi活性,抑制LDH-A蛋白的去乙酰化过程,使其维持较高的乙酰化水平,进而促进其降解途径,下调LDH-A蛋白表达,抑制无氧呼吸供能。有研究表明,FX11处理或小干扰RNA(siRNA)抑制LDH-A表达后,ATP生成降低,显著增加了氧化应激,诱导细胞死亡,并且FX11与FK866(一种NAD+合成抑制剂)的联合用药处理后,可观察到在移植瘤模型中诱导淋巴瘤退化[13]。2009年,Xie等[16]发现在延胡索酸水化酶和LDH-A同时降低表达的情况下,导致ROS产生,增加细胞凋亡,抑制肿瘤增殖生长。表明LDH-A有潜力成为肿瘤治疗靶点。在乳腺癌治疗中,降低LDH-A的表达可恢复紫杉醇耐药性细胞对于紫杉醇的敏感性,而紫杉醇耐药细胞对于草氨酸盐敏感,草氨酸盐是一种丙酮酸类似物,通过抑制丙酮酸到乳酸的转化从而抑制糖酵解。表明LDH-A和乳酸代谢对于产生紫杉醇耐药性细胞的治疗改善有重要作用。此外,紫杉醇和草氨酸盐的联合使用对紫杉醇耐药肿瘤细胞表现出协同抑制作用,诱导肿瘤凋亡[17]。
本研究结果提示,西达本胺可通过下调LDH-A蛋白的表达水平,抑制结肠癌细胞无氧糖酵解途径,整体水平上降低细胞内ATP生成,从而减少蛋白质、核酸及脂类等合成代谢所需的前体物质,最终达到选择性地诱导肿瘤细胞凋亡并抑制肿瘤细胞快速增殖的目的。
综上所述,本研究提示西达本胺通过减弱糖酵解途径供能抑制结肠癌HCT-8和HT-29细胞增殖,其作用机制涉及LDH-A蛋白表达的调控,为揭示西达本胺等HDACi药物抗癌机制提供了实验依据。
[1]Chen WQ,Zeng HM,Zheng RS,Zhang SW,He J. Cancer incidence and mortality in China,2007[J]. Chin J Cancer Res(中国癌症研究),2012,24(1):1-8.
[2]Van Gijn W,Krijnen P,Lemmens VE,Den Dulk M,Putter H,Van De Velde CJ.Quality assurance in rectal cancer treatment in the Netherlands:a catch up compared to colon cancer treatment[J]. Eur J Surg Oncol,2010,36(4):340-344.
[3]Bolden JE,Peart MJ,Johnstone RW.Anticancer activities of histone deacetylase inhibitors[J].Nat Rev Drug Discov,2006,5(9):769-784.
[4]Witt O,Deubzer HE,Milde T,Oehme I.HDAC family:what are the cancer relevant targets?[J].Cancer Lett,2009,277(1):8-21.
[5]Dong M,Ning ZQ,Xing PY,Xu JL,Cao HX,Dou GF,et al.PhaseⅠstudy of chidamide(CS055/HBI-8000),a new histone deacetylase inhibitor,in patients with advanced solid tumors and lymphomas[J].Cancer Chemother Pharmacol,2012,69(6):1413-1422.
[6]KoppenolWH,Bounds PL,Dang CV.Otto Warburg′s contributions to current concepts of cancer metabolism[J].Nat Rev Cancer,2011,11(5):325-337.
[7]Dang CV,Hamaker M,Sun P,Le A,Gao P. Therapeutic targeting of cancer cell metabolism[J].J MolMed(Berl),2011,89(3):205-212.
[8]Cairns RA,Harris IS,Mak TW.Regulation of cancer cell metabolism[J].Nat Rev Cancer,2011,11(2):85-95.
[9]Brahimi-Horn MC,Chiche J,Pouysségur J.Hypoxia signalling controls metabolic demand[J].Curr Opin Cell Biol,2007,19(2):223-229.
[10]Koukourakis MI,Giatromanolaki A,Harris AL,Sivridis E.Comparison of metabolic pathways between cancer cells and stromal cells in colorectal carcinomas:a metabolic survival role for tumorassociated stroma[J].Cancer Res,2006,66(2):632-637.
[11]Swietach P,Vaughan-Jones RD,Harris AL. Regulation of tumor pH and the role of carbonic anhydrase 9[J].Cancer Metastasis Rev,2007,26(2):299-310.
[12]Fischer K,Hoffmann P,Voelkl S,Meidenbauer N,Ammer J,Edinger M,et al.Inhibitory effect of tumor cell-derived lactic acid on human T cells[J]. Blood,2007,109(9):3812-3819.
[13]Le A,Cooper CR,Gouw AM,Dinavahi R,Maitra A,Deck LM,et al.Inhibition of lactate dehydrogenase A induces oxidative stress and inhibits tumor progression[J].Proc Natl Acad Sci USA,2010,107(5):2037-2042.
[14]Fantin VR,St-Pierre J,Leder P.Attenuation of LDH-A expression uncovers a link between glycolysis,mitochondrial physiology,and tumor maintenance[J].Cancer Cell,2006,9(6):425-434.
[15]Zhao D,Xiong Y,Lei QY,Guan KL.LDH-A acety⁃lation:implication in pancreatic cancer initiation and diagnosis[J].Oncotarget,2013,4(6):802-803.
[16]Xie H,Valera VA,Merino MJ,Amato AM,Signoretti S,Linehan WM,et al.LDH-A inhibition,a therapeutic strategy for treatment of hereditary leiomyomatosis and renalcell cancer[J].Mol Cancer Ther,2009,8(3):626-635.
[17]Zhou M,Zhao Y,Ding Y,Liu H,Liu Z,Fodstad O,et al.Warburg effect in chemosensitivity:targeting lactate dehydrogenase-A re-sensitizes taxol-resistant cancer cells to taxol[J].MolCancer,2010,9(1):33.
Regulation ofenergy metabolism in colon cancer cells by chidamide
HE Mu1,2,QIAO Zhi-xin2,3,REN Su-ping2,LIChang-lan2,WANG Yan-bing2,GUIQi-yuan2,WANG Yu2,LUO Yun-jing1,YU Qun2
(1.College of Life Science and Bioengineering,Beijing University of Technology,Beijing 100124,China;2.Institute of Transfusion Medicine,Academy of Military MedicalSciences,Beijing 100850,China;3.MedicalResearch Center,Beijing Tongren Hospital,CapitalMedical University,Beijing 100730,China)
OBJECTIVE To observe the regulation effect of chidamide on energy metabolism in HCT-8 and HT-29 cells.METHODS HCT-8 and HT-29 cells were treated with chidamide 5,10 and 20μmol·L-1.Morphologicalchanges of these cells were observed under an ordinary opticalmicroscope. Cell proliferation was detected by MTT.ATP production was determined by CellTiter-Glo®assay kit. Metabolic changes were tested by glycolytic stress kit.The mRNA levelof lactate dehydrogenase A(LDH-A)was analyzed by real-time quantitative PCR,whereas the protein level of LDH-A was analyzed by Western blotting.RESULTS Compared with controlgroup,cellmorphology of HCT-8 and HT-29 cells in chidamide treated group was irregular,accompanied by deformation,shrinkage and cell debris,and the inhibitory rate of proliferation increased(P<0.05).There was no significant difference in ATP totalcontent between chidamide 5 and 10μmol·L-116 h treatment groups,but in chidamide 20μmol·L-1treatment group itwas decreased(P<0.05).Chidamide 20μmol·L-1had no effecton oxygen consumption rate,but glycolysis ATP generation rate was reduced by 30.7%and 37.9%(P<0.05),respectively. Chidamide 20μmol·L-1had no effect on LDH-A mRNA level,but it decreased the protein level of LDH-A(P<0.01).CONCLUSION Chidamide can abate the respiratory metabolic ability of HCT-8 and HT-29 cells.The mechanism may be related to the down-regulation of LDH-A.
colon cancercells;chidamide;lactate dehydrogenase A;Warburg effect
The projectsupported by Projectof Science and Technology of Beijing City(Z141100000214003)
YU Qun,E-mail:yuqun1970@outlook.com,Tel:13693377365;LUO Yun-jing,E-mail:luoyj@bjut.edu.cn,Tel:13521339608
R979.1
A
1000-3002-(2016)05-0539-06
10.3867/j.issn.1000-3002.2016.05.009
2015-12-18接受日期:2016-05-09)
(本文编辑:贺云霞)
北京市科技计划课题(Z141100000214003)
何牧,男,硕士研究生,主要从事生物化学研究。
于群,E-mail:yuqun1970@outlook.com,Tel:13693377365;罗云敬,E-mail:luoyj@bjut.edu.cn,Tel:13521339608

