肉苁蓉乙醇提取物抗大鼠免疫性肝纤维化的作用及其机制
由淑萍,赵 军,马 龙,木克热木·吐地买提,张石蕾,刘 涛
(1.新疆医科大学公共卫生学院毒理学教研室,新疆乌鲁木齐830011;2.新疆维吾尔自治区药物研究所,新疆乌鲁木齐830004)
肉苁蓉乙醇提取物抗大鼠免疫性肝纤维化的作用及其机制
由淑萍1,赵 军2,马 龙1,木克热木·吐地买提1,张石蕾1,刘 涛1
(1.新疆医科大学公共卫生学院毒理学教研室,新疆乌鲁木齐830011;2.新疆维吾尔自治区药物研究所,新疆乌鲁木齐830004)
目的探讨肉苁蓉乙醇提取物肉苁蓉苯乙醇样糖苷(CPhG)对大鼠免疫性肝纤维化的作用及其作用机制。方法SD大鼠75只,随机分为正常对照组、模型组、复方鳖甲软肝片(0.6 g·kg-1)阳性药对照组、CPhG 0.125,0.25和0.5 g·kg-1组,CPhG组每组13只,其他每组12只,皮下和尾静脉注射牛血清白蛋白诱导大鼠肝纤维化模型,造模同时ig给予相应药物,每日1次,共15周。测定大鼠肝指数,Masson染色法观察肝组织纤维化,全自动化分析仪测定血清谷丙转氨酶(GPT)、谷草转氨酶(GOT)、碱性磷酸酶(ALP)、总蛋白(TP)和白蛋白(ALB)含量变化,羟脯氨酸(HyP)测定试剂盒测定肝匀浆中HyP含量的变化;免疫组化法观察肝组织中Ⅰ型和Ⅲ型胶原蛋白表达的变化。结果与正常对照组比较,模型组大鼠肝指数显著升高(P<0.05)。模型组大鼠肝组织胶原纤维延伸连接,包绕整个肝小叶使正常肝小叶结构破坏,大方型假小叶形成;模型组大鼠血清中GPT,GOT,ALP,TP和ALB含量及肝匀浆中HyP含量显著升高(P<0.05,P<0.01),Ⅰ型和Ⅲ型胶原蛋白的表达均显著升高(P<0.01)。与模型组比较,CPhG 0.125,0.25和0.5 g·kg-1能降低肝纤维化大鼠肝指数(P<0.05),肝组织形态与正常对照组接近,血清中GPT,GOT,ALP,TP和ALB含量及肝匀浆中HyP含量降低(P<0.05,P<0.01),且能抑制肝组织中Ⅰ型和Ⅲ型胶原蛋白的表达(P<0.05,P<0.01)。结论CPhG能降低免疫性大鼠肝纤维化程度,其机制可能与降低Ⅰ型和Ⅲ型胶原蛋白表达进而抑制肝星状细胞活化、减少胶原生成有关。
肉苁蓉;苯乙醇样糖苷;肝纤维化;胶原蛋白
肉苁蓉属(Cistanche)植物是著名的名贵补益类中药。因其疗效确切,药性温和,所以自古就被视为强壮、滋补的中药,有“沙漠人参”之美誉。近年来,肉苁蓉以其显著的生物活性备受人们的关注。化学及药理学研究显示,肉苁蓉肉苁蓉苯乙醇样糖苷(Cistanche phenylethanoid glycosides,CPhG)是肉苁蓉发挥药效的主要物质基础之一[1-2]。CPhG具有抗氧化、抗抑郁、抗炎、抗病毒、抗肿瘤、抗菌和免疫调节等多种生物活性[3-6]。Peter于1989年首次发现CPhG类化合物松果菊苷具有显著的保肝护肝作用,随后引起人们对CPhG进行抗肝纤维化研究的兴趣。本课题组的前期研究已经发现,肉苁蓉的肉质茎部提取物类叶升麻苷和异类叶升麻苷,对于体外免疫性肝损伤模型和HepG2.2.15细胞模型均有较好的肝保护作用和抗乙肝病毒作用[7],但对于CPhG抑制肝纤维化的进程及抗肝纤维化的具体机制还未明确。本研究对大鼠皮下和尾静脉注射牛血清白蛋白(bovine serum albumin,BSA)制备免疫性肝纤维化模型,评价肝损伤及纤维化的程度,以探讨CPhG保肝、抗肝纤维化的作用及其可能的作用机制。
1 材料与方法
1.1 试剂和仪器
管花肉苁蓉(C.tabulosa)新鲜肉质茎6.0 kg,70%乙醇热回流提取3次,每次3 h,合并提取液。AB-8树脂纯化得到苯乙醇样糖苷提取物即CPhG类化合物,经新疆维吾尔自治区药物研究所赵军研究员用高效液相色谱法鉴定为CPhG,纯度为70%。用0.5%羧甲纤维素钠(CMC-Na)将药物配制成不同浓度,置4℃冰箱保存待用。复方鳖甲软肝片(compound Biejia-rangan tablets,BJRG)(内蒙古福瑞科技股份有限公司,批号:20131006),BSA(美国Sigma公司产品,CAS:9048-46-8,原装进口),羊毛脂(上海源叶生物科技公司),液体石蜡(天津市富宇精细化工有限公司),磷酸盐缓冲液〔飞世尔生物化学制品(北京)有限公司,批号:NZD1132〕。肝组织羟铺氨酸(hydroxyproline,HyP)检测试剂(南京建成生物工程研究所,批号:20140526),兔抗Ⅰ型胶原抗体0.2 mL(美国Abcain公司,批号:140619),兔抗Ⅲ型胶原抗体0.2 mL(中国Bioss公司,批号:980788W)。电热恒温培养箱(上海一恒科技有限公司),立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂),L-530多管架自动平衡离心机(长沙湘仪离心机仪器有限公司),全自动生化分析仪(迈瑞公司,系列号:A086A0182),化学发光分析仪(泰格科信,系列号:mp2808)。
1.2 动物、模型制备和给药
雄性健康SD大鼠,SPF级,体质量180~220 g,由新疆医科大学实验动物中心提供,动物生产许可证号SCXK(新)2011-0004。SPF环境实验动物使用许可证号:SYXK(新)2011-0004,饲养受控环境条件(25℃和12 h光/暗周期),大鼠自由进食与饮水,喂标准颗粒饲料,常规饲养3 d后使用。动物实验的所有相关程序由新疆医科大学第一临床附属医院动物伦理委员会批准。
75只SD大鼠随机分为6组,即正常对照组、模型组、BJRG阳性药对照组(0.6 g·kg-1)、CPhG 0.125,0.25和0.5 g·kg-1组,CPhG组每组13只,其他每组12只。参照药品说明书,进行人和大鼠间体表面积折算的等效剂量比值设定BJRG阳性药对照组剂量,CPhG剂量参照文献[8]及预实验结果设置。除正常对照组外,大鼠采用朱启贵等[9]方法制备免疫性肝纤维化模型,造模分为致敏阶段和尾静脉攻击阶段。致敏阶段:除正常对照组每只注射0.5 mL生理盐水以外,其余各组大鼠均多点sc给予含BSA 9 g·L-1弗氏不完全佐剂,每次0.5 mL,共5次。前2次注射间隔为14 d,后3次注射间隔为7 d。末次致敏注射后1周,每只大鼠于眼内呲静脉丛采血,采用双向扩散法检测大鼠血清抗BSA抗体。攻击阶段:抗体阳性大鼠作为模型组及给药组,继续尾静脉注射BSA,每周2次,连续5周,注射剂量由每只2 mL逐渐递增至每只4 mL;正常对照组尾静脉注射生理盐水。给药:造模同时按设定剂量ig给药(空白对照组和模型组ig给予蒸馏水)每日1次;造模结束后继续治疗4周,每日1次,实验周期共计15周。
1.3 肝指数测定
各组于末次ig后禁食(不禁水)24 h,称重,颈椎脱臼处死,取肝,用滤纸吸干脏器表面血液,剪去脂肪和系膜后称重,计算肝指数。肝指数=器官质量(g)/体质量(g)×100。
1.4 Masson染色观察肝组织纤维化
所有大鼠取同一部位肝组织,用10%多聚甲醛固定,常规石蜡包埋,切片并Masson染色,显微镜下观察组织学变化。肝纤维化分级参照文献[10]分为5级。0级:无纤维化;Ⅰ级:纤维结缔组织仅限于汇管区或汇管区有扩大,有向小叶发展的倾向;Ⅱ级:纤维结缔组织增生,超过小叶的2/3并伴有Ⅰ级改变;Ⅲ级:纤维结缔组织进入肝小叶中央静脉周围;Ⅳ级:纤维结缔组织在全小叶呈多处弥漫性增生,有假小叶形成,并有Ⅲ级改变。
1.5 血清生化指标的检测
各组大鼠于末次给药后禁食(不禁水)24 h,称重,经戊巴比妥钠(30 mg·kg-1,ip)麻醉后取血,12 000×g离心10 min分离血清,采用全自动生化仪检测血清谷丙转氨酶(glutamic-pyruvic transferase,GPT)、谷草转氨酶(glutamic-oxalacetic transferase,GOT)、碱性磷酸酶(alkaline phosphatase,ALP)、总蛋白(total protein,TP)和白蛋白(albumin,ALB)含量。
1.6 肝组织匀浆中羟脯氨酸含量的测定
精确称取肝组织0.1 g(湿重)放入试管中,准确加水解液1 mL,混匀。严格按照肝组织HyP检测试剂盒说明书操作测定肝组织HyP的含量。
1.7 免疫组化法测定肝组织纤维化Ⅰ型和Ⅲ型胶原蛋白表达
组织切片用Nikon DIGITAL SIGHTDS-Fi2型生物显微镜进行观察,并用K12320型显微摄像系统在低倍镜、高倍镜下选取清晰视野拍照。采用Motic Med 6.0 CMIAS彩色图像分析软件,通过显微摄像系统放大200倍,每片随机选取3个视野,每个视野随机选取5个2 cm×3 cm大小的区域,Ⅰ型和Ⅲ型胶原蛋白免疫组化阳性反应产物为出现位于细胞浆的棕黄色细颗粒状染色,测定其平均吸光度值,值越大表明组织中Ⅰ型和Ⅲ型胶原蛋白含量越高。计算公式:吸光度值=胶原面积(cm2)/肝组织面积(cm2)。
1.8 统计学分析

2 结果
2.1 肉苁蓉乙醇提取物对BSA致肝纤维化大鼠体质量和肝指数的影响
由表1可见,与正常对照组比较,模型组大鼠体质量减轻,肝指数增加(P<0.05);与模型组比较,BJRG组及CPhG 0.125,0.25和0.5 g·kg-1组大鼠体质量增加,肝指数下降(P<0.05),表明注射BSA后大鼠肝细胞受损,CPhG对大鼠肝损伤具有一定的防护作用。
2.2 肉苁蓉乙醇提取物对BSA致肝纤维化大鼠肝组织纤维化的影响
由图1可见,正常对照组大鼠肝组织并无异常,未见炎细胞浸润,肝小叶结构完整清晰,肝细胞呈索状分布,未见有不规则血窦,汇管区无扩大。模型组大鼠呈Ⅲ~Ⅳ级纤维化,胶原纤维延伸链接,包绕整个肝小叶使正常肝小叶结构破坏,假小叶形成,但以大方型假小叶为主。阳性药BJRG组和CPhG组治疗效果显著,病理组织切片示形态基本上与正常对照组接近。
根据Masson染色的肝纤维化标准评分,与正常组比较,模型组肝纤维化程度显著增加(P<0.01);阳性药BJRG组和CPhG 0.125,0.25和0.5 g·kg-1组肝纤维化程度显著低于模型组(P<0.01)。Ridit分析表明,CPhG对免疫性肝纤维化有防治作用(表2)。
2.3 肉苁蓉乙醇提取物对BSA致肝纤维化大鼠肝功能的影响
表3可见,与正常对照组比较,模型组大鼠血清GPT,GOT和ALP活性及TP含量显著增加(P<0.05,P<0.01),ALB含量显著降低(P<0.05);与模型组比较,BJRG组和CPhG组大鼠血清GPT,GOT和ALP活性及TP含量降低(P<0.05,P<0.01),ALB含量增加(P<0.05,P<0.01)。表明CPhG对BSA诱导的大鼠肝细胞损伤具有一定的防护作用。
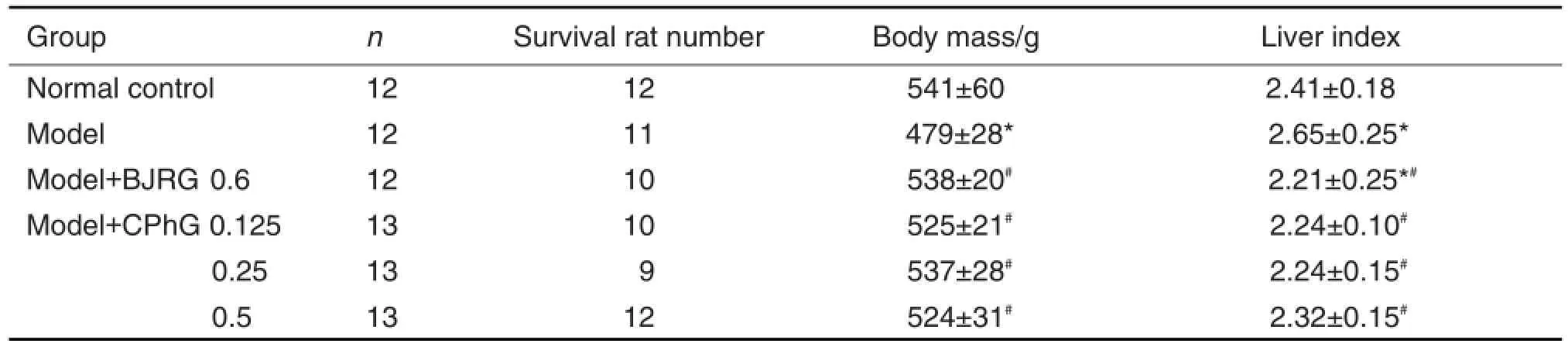
Tab.1 Effect of Cistanche phenylethanoid glycosides(CPhG)on body mass and liver index in hepatic fibrosis rats induce by bovine serum albumin(BSA)

Fig.1 Effect of CPhG on histopathological changes of liver tissues in hepatic fibrosis rats(Masson).Arrows show that fibrous tissue of the centralleaflet was proliferated into the liver parenchyma,and that collagen fibers extended their links around the entire lobule.
2.4 肉苁蓉乙醇提取物对BSA致肝纤维化大鼠肝组织中HyP含量的影响
表4结果显示,与正常对照组比较,模型组大鼠肝组织中HyP含量显著增加(P<0.01);与模型组比较,CPhG 0.125,0.25和0.5 g·kg-1组和BJRG组HyP含量显著降低(P<0.05,P<0.01)。表明CPhG减少了细胞外基质(extracellular matrix,ECM)在肝内的沉积。
2.5 肉苁蓉乙醇提取物对BSA致肝纤维化大鼠肝组织Ⅰ型和Ⅲ型胶原表达的影响
表5可见,与正常对照组相比,模型组肝组织Ⅰ型和Ⅲ型胶原表达升高(P<0.01)。与模型组相比,阳性药BJRG组和CPhG 0.125,0.25和 0.5 g·kg-1组大鼠肝组织中Ⅰ型和Ⅲ型胶原表达降低(P<0.05,P<0.01),其中以CPhG 0.5 g·kg-1组最为显著。表明CPhG对大鼠肝纤维化具有预防及治疗作用,能减轻大鼠胶原纤维增生程度,与肝组织形态观察结果一致。

Tab.2 Effect of CPhG on levelof histopathologicalchanges of hepatic fibrosis rats induced by BSA

Tab.3 Effect of CPhG on serum glutamic-pyruvic transferase(GPT),glutamic-oxalacetic transferase(GOT),alkaline phosphatase(ALP),totalprotein(TP)and albumin(ALB)of hepatic fibrosis rats induced by BSA
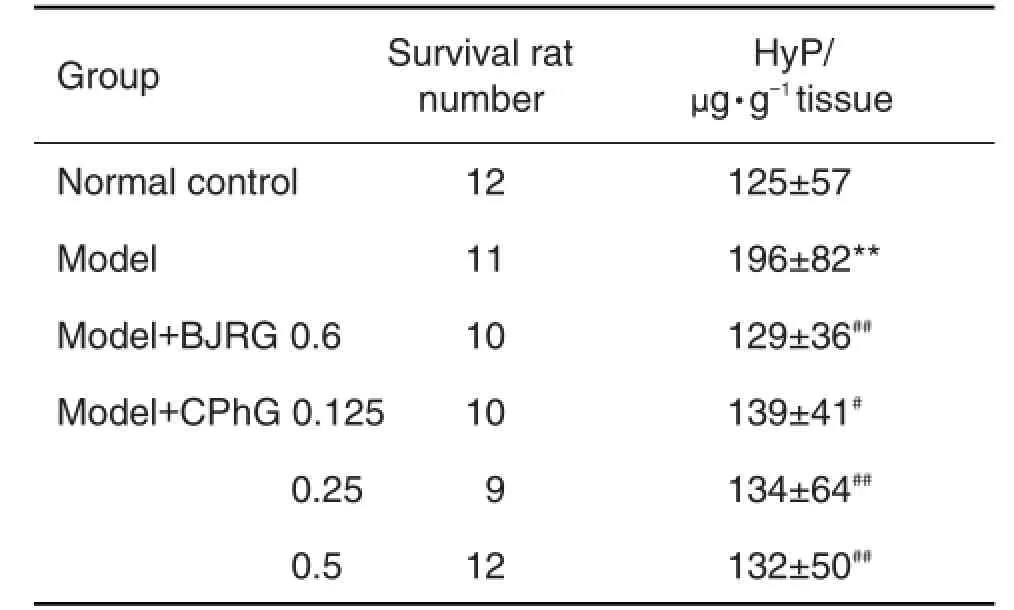
Tab.4 Effect of CPhG on hydroxyproline(HyP)content of hepatic fibrosis rats induced by BSA

Tab.5 Effect of CPhG on expression of collagens typeⅠand typeⅢin BSA-induced hepatic fibrosis rats
3 讨论
肝纤维化是肝遭受反复或慢性损伤后的一种损伤与修复过程,主要与慢性炎症和引起慢性肝损伤的化学因素相关[11-13],已成为发病率和死亡率都很高的一个世界医学难题,各种肝病多数经肝纤维化最后发展为晚期的肝硬变,成为肝病死亡的主要原因[14]。本研究采用BSA免疫性肝纤维化大鼠模型,BSA免疫后大鼠经10次尾静脉攻击注射BSA后,其肝组织结构受到严重破坏,炎性细胞浸润,由胶原纤维构成的纤维间隔正在或已形成。据报道,BSA免疫损伤所致的肝纤维化与临床上的慢性肝炎所致的肝纤维化在发病机制上更加接近,适用于抗原抗体复合物反应所致的肝纤维化机制、防治和中药筛选研究,纤维化可>260 d[15]。
本研究使用BSA诱导的大鼠免疫性肝纤维化模型的结果与明志君等[16]和张桂灵等[17]研究报道一致,提示本研究成功复制了免疫性肝纤维化模型。CPhG干预可降低血清GPT,GOT,ALP,TP和ALB水平,表现出抗大鼠肝纤维化的作用,长期使用CPhG不会对肝功能造成不良影响。
本研究结果表明,预防性地给予CPhG治疗,能有效地抑制肝纤维化进程,减轻病变程度,且随给药剂量增大,改善更为明显。提示CPhG对肝纤维化具有较好的防治作用,与BJRG阳性对照组效果相当。
肝纤维化也是向肝硬变发展的中心环节。据报道,细胞因子参与了门静脉高压和肝纤维化的形成[18]。肝纤维化的显著特征是Ⅰ和Ⅲ型胶原及玻璃酸(透明质酸)等ECM合成与降解失去平衡导致ECM沉积,特别是与Ⅰ和Ⅲ型胶原的沉积有关[19],占ECM总量>80%。正常肝ECM中Ⅰ型胶原与Ⅲ型胶原比值为1;肝纤维化时,肝内胶原增加5~7倍以上,Ⅲ型胶原通常发生在纤维化早期,Ⅰ型胶原则在纤维化晚期增加最显著,故Ⅰ和Ⅲ型胶原的增生与肝纤维化程度成正相关。而肝纤维化是ECM合成与降解失衡的动态过程[20]。本研究发现,CPhG减少了ECM在肝内的沉积,进一步表明CPhG对实验性肝纤维化有防治作用。
采用免疫组化检测肝组织Ⅰ和Ⅲ型胶原含量变化可以客观、直接观察到CPhG抗肝纤维化的治疗效果。本研究显示,CPhG组大鼠肝组织中Ⅰ和Ⅲ型胶原仅见于中央静脉周围及汇管区,着色减少且浅,呈细丝状,免疫组化染色呈弱阳性,提示CPhG能减少胶原生成,抑制肝纤维化进程,其机制可能是通过抑制肝星状细胞的激活,减少ECM合成,从而发挥抗纤维化作用。
综上所述,CPhG抗大鼠肝纤维化的作用机制可能为抑制胶原生成,促进胶原降解,降低肝纤维化大鼠肝组织中胶原及HyP含量,从而抑制ECM的合成、起到抗肝纤维化的作用,具体的作用机制还有待深入研究。
[1]Li Y,Song YY,Zhang HQ.Advances in research of chemical constituents and medicinal activity of Cistanche[J].Chin Wild Plant Resour(中国野生植物资源),2010,29(1):7-12.
[2]Liu GK,Tu PF,Yang TX,Gao Q.Processing in biology research of Cistanche tubulosa(Schenk)R. Wight[J].Mod Chin Med(中国现代中药),2015,17(4):400-405.
[3]Ma H,Yin RX,Guo M,Bao Y,Cui ZH,Li G. Effect of Cistanche deserticola polysaccharides on expression of CREB in D-galactose induced aging modelmice[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2014,20(20):137-141.
[4]Chen HY,Hao CQ,Guo HY,Leng XH.Research progress of the development and application of Cistanche medicinalresources[J].Value Eng(价值工程),2012,31(3):303-305.
[5]Zhao W,Pan YN.Advances in research of phar⁃macological activity of phenylethanoid glycosides in Cistanche[J].Asia-Pacific Tradit Med(亚太传统医药),2013,9(5):77-79.
[6]Gao XX,Chen J,Peng YL.Research situation of pharmacololgical effects of Cistanche deserticola polysaccharides[J].Food Drug(食品与药品),2015,17(2):136-139.
[7]Zhao J,Liu T,Ma L,Yan M,Zhao Y,Gu Z,et al.Protective effect of acteoside on immunological liver injury induced by Bacillus Calmette-Guerin plus lipopolysaccharide[J].Planta Med,2009,75(14):1463-1469.
[8]Shimoda H,Tanaka J,Takahara Y,Takemoto K,Shan SJ,Su MH.The hypocholesterolemic effects of Cistanche tubulosa extract,a Chinese traditional crude medicine,in mice[J].Am J Chin Med,2009,37(6):1125-1138.
[9]Xu Y,Liu W,Fang B,Gao S,Yan J.Artesunate ameliorates hepatic fibrosis induced by bovine serum albumin in rats through regulating matrix metalloproteinases[J].Eur J Pharmacol,2014,744:1-9.
[10]Tsai JH,Liu JY,Wu TT,Ho PC,Huang CY,Shyu JC,et al.Effects of silymarin on the resolution of liver fibrosis induced by carbon tetrachloride in rats[J].J ViralHepat,2008,15(7):508-514.
[11]Cohen-Naftaly M,Friedman SL.Current status of novel antifibrotic therapies in patients with chronic liver disease[J].Ther Adv Gastroenterol,2011,4(6):391-417.
[12]Puche JE,Saiman Y,Friedman SL.Hepatic stellate cells and liver fibrosis[J].Compr Physiol,2013,3(4):1473-1492.
[13]Hernandez-Gea V,Friedman SL.Pathogenesis of liver fibrosis[J].Annu Rev Pathol,2011,6:425-456.
[14]Kostadinova R,Montagner A,Gouranton E,Fleury S,Guillou H,Dombrowicz D,et al.GW501516-activated PPARβ/δpromotes liver fibrosis via p38-JNK MAPK-induced hepatic stellate cell proliferation[J].CellBiosci,2012,2(1):34.
[15]Lai LN,Fang BW.Effect of artesunate on hepatic fibrosis induced by bovine serum albumin in rats[J].Pharmacol Clin Chin Mater Med(中药药理与临床),2006,22(3):35-37.
[16]Ming ZJ,Gao L,Wang WX,Chen KJ.Effect of extract of Paeonia lactiflora and Salvia miltiorrhiza on liver fibrosis induced by BSA in rats[J].Acta Acad Med Nanjing(南京医科大学学报),2006,26(10):925-928.
[17]Zhang GL,Shi XF,Ran CQ,Xu M,Zhu ZJ. Effects of total saponins of Panax notoginseng against liver fibrosis in rats[J].Acta Acad Med Mil Tert(第三军医大学学报),2007,29(23):2212-2214.
[18]Yu JG.Progress in the prevention and treatment of hepatic fibrosis and cirrhosis[J].J Pract Hepatol(实用肝病杂志),2004,7(4):245-247.
[19]Wang LC,Zhao LS,Tang H,Liu L,Liu C,Zhang HY,et al.Study on the relationship between hyaluronic acid,typeⅢprocollagen peptide,typeⅣcollagen,laminin and experimental hepatic fibrosis[J].West China Med J(华西医学),2005,20(1):91-92.
[20]Wei P,Li JT.The clinical observation on spiral CT perfusion imaging in patients with hepatic fibrosis[J].China Med Herald(中国医药导报),2010,7(9):15-17.
Effect and mechanism of Cistanche phenylethanoid glycosides on rats with immunologicalliver fibrosis
YOU Shu-ping1,ZHAO Jun2,MA Long1,Mukaram TUDIMAT1,ZHANG Shi-lei1,LIU Tao1
(1.Department of Toxicology,College of Public Health,Xinjiang MedicalUniversity,Urumqi830011,China;2.Institute of Materia Medica,Xinjiang Uygur Autonomous Region,Urumqi 830004,China)
OBJECTIVE To study the anti-fibrotic effect of Cistanche phenylethanoid glycosides(CPhG)in bovine serum albumin(BSA)-induced liver fibrosis in rats and its possible mechanism METHODS Seventy-five SD rats were randomly divided into six groups:normalcontrol(distilled watertreated),model(BSA-treated),positive drug〔BSA-treated+compound Biejiarangan tablets(BJRG)0.6 g·kg-1〕,and BSA-treated+CPhG(0.125,0.25 and 0.5 g·kg-1)groups.There were thirteen rats ineach BSA-treated+CPhG(0.125,0.25 and 0.5 g·kg-1)group and twelve rats in othergroups.Subcutaneous injection and tailvein injection of BSA immunity were used to induce the ratliverfibrosis model.Meanwhile,differenttherapeutic drugs were ig adminstered to rats.After the experimentalperiod,rats were fasted for 12 h prior to 10%chloralhydrate administration and immediately euthanized.The liver was weighed to calculate the liver index.Glutamic-pyruvic transaminase(GPT),glutamic-oxalactic transaminase(GOT),alkaline phosphatase(ALP),totalprotein(TP)and albumin(ALB)were evaluated by the Mind-R ay automatic biochemicalanalyzer.The density of hydroxyproline(HyP)in liver tissues was determined using a spectrophotometric method according to the kit′s instructions.Histopathologicalchanges and expressions oftypeⅠand typeⅢcollagens in liver tissues were also determined by immunohisto⁃chemicalstaining.RESULTS Compared with the normalcontrolgroup,collagen fibers of liver tissues in the model group extended their links and enveloped the entire lobule,causing lobular structural damage and the formation ofpseudolobules.The liver index(P<0.05),GPT,GOT,ALP,TP and ALB serum levels(P<0.05),HyP content(P<0.01)were significantly increased,so was the expression oftypeⅠcollagens and typeⅢcollagens(P<0.01)in the modelgroup.Compared with modelgroup,various doses(0.125,0.25 and 0.5 g·kg-1)of CPhG significantly reduced the BSA-induced elevation of the liver index;GPT,GOT,ALP,TP and ALB serum levels(P<0.05),and HyP contentdecreased(P<0.01);the morphology of the pathologicaltissue sections was close to that of the normalcontrolgroup,and CPhG significantly reduced the expression of two types of collagens(P<0.01).CONCLUSION CPhG can significantly reduce the degree of BSA-induced liver fibrosis in rats.The mechanism may be associated with down-regulation oftwo types ofcollagens and suppression ofthe activation ofhepatic stellate cells.
Cistanche;phenylethanoid glycosides;liver fibrosis;bovine serum albumin;type collagen
The projectsupported by NationalNatural Science Foundation of China(81260624)
LIU Tao,E-mail:xjmult@163.com,Tel:(0991)4365561
R285.5
A
1000-3002-(2016)05-0504-07
10.3867/j.issn.1000-3002.2016.05.004
2015-06-23接受日期:2016-04-10)
(本文编辑:贺云霞)
国家自然科学基金资助项目(81260624)
由淑萍,女,博士研究生;刘涛,女,教授,硕士研究生导师,主要从事食品毒理学研究。
刘涛,E-mail:xjmult@163.com,Tel:(0991)4365561

