植物根系研究进展
张鋆鋆+刘冰洋+王一凡+许志文+张小全

摘 要:根系是植物吸收水分、养分的重要器官。根系的生长发育以及活力直接影响着植物体地上部的生长发育、营养状况。本文从根系构型研究、生理生化、细胞学以及分子生物学等四个方面着手,总结、分析了根系研究的最新进展,并对以后根系的研究重点内容进行了展望,旨在为植物根系研究和作物遗传育种提供参考。
关键词:植物;根系;构型;生理;细胞学;分子生物学
中图分类号:Q945.12 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.11.003
Abstract: Root is a vital organ of the plants absorbing moisture and nutrition, the growth and vitality of root directly affects the growth, nutritional status, and yield of the plant aboveground. This paper discussed from the following 4 aspects: the root of the architecture research, the root of the physiology, the root of cytology and the root of the molecular biology and so on, the latest progress in the study of root system were summarized and analyzed, and the root research emphasis in the future was discussed, it can provide reference for the study of the plant root system and genetic breeding.
Key words: plant; root; architecture; physiology; cytology; molecular biology
植物根系是支持植物地上部生长发育的重要组成部分,其生长发育是一个非常复杂的过程。如果根系受到了逆境胁迫,则必然会影响植物体地上部分的生长。近年来,随着全球气温变暖、海平面上升等环境因素的不确定性的增强,植物在生长发育的过程中,受到干旱、高温等极端天气胁迫的几率急剧增加,这些逆境胁迫对植物的生长发育造成了严重的影响。目前,在世界的许多地方,特别是发展中国家,粮食安全仍然受到干旱和土壤肥力差的威胁,干旱和土壤肥力是影响作物产量的重要因素[1]。另一方面,由于化肥成本的提高、水资源的持续短缺以及其他一些负面环境因素的影响,在发展中国家通过增施化肥而提高粮食产量的办法已不是经济可行之道[2-3]。植物根系是连接植物地上部与土壤水分、养分的桥梁,植物根系对于植物体具有重要的意义。国内外学者对植物根系的生长发育不断探索研究,取得了丰硕的研究成果。笔者从根系的构型、生理生化、细胞学以及分子生物学等方面进行了探讨,总结并分析了根系研究的进展,旨在通过总结前人的研究成果,为以后更加深入地研究植物根系以及选育根壮品种提供参考。
1 植物根系构型研究
植物根系构型是不同层次的根系在土壤中的空间分布,是重要的植物学性状和生态学指标,既受遗传因素的控制,又受多种环境因子的调控。根系构型主要包括根系形态、根系拓扑结构、根系的延长速率、根系的生长角度和根系的扭曲程度等。研究表明,侧根是影响植物根系构型最主要的内在因子,环境因子往往通过影响侧根的发生来影响根系构型。相关研究表明,土壤微生物、水分、重力效应、养分等对植物根系侧根的生长具有很大的影响。
1.1 土壤微生物调控
土壤微生物调控植物根系构型可能是受到根际微生物的作用。研究发现[4],土壤根际微生物确实能调控植物的根系构型,而且影响植物的一系列生理与生态过程。由表1可知,根际微生物主要通过与植物体形成共生体或者产生激素等变化调节植物根系构型。丛枝菌根真菌(AFM)可以与植物建立共生关系,建立共生体后,提高植物根系对土壤中水分、养分的吸收,这是因为AFM侵染植物根系改变了根系构型,使根系形成丛枝结构,根系的长度也得到增加,而且基根角度有增大的趋势[5]。根瘤菌广泛分布于土壤中,能够侵染豆科植物的根部形成根瘤或者茎瘤,根瘤是根瘤菌与根系形成的共生体,可将空气中的氮素或者土壤氮素固定为植物可直接吸收利用的氨。研究表明,根瘤菌可以促进蒺藜状苜蓿的根毛卷曲及增加分枝的程度,进而侧根数量增多[6-7]。植物根际促生菌(PGPR)是一种土壤细菌,栖居在植物根围之中,通过产生生长素与赤霉素、氮固定等改善根系构型[8-9]。枯草芽孢杆菌是植物根际周围的有益微生物,通过分泌激素类、抗菌素类等物质促进宿主植物根系的生长,提高植物的抗病性、耐盐性以及整体抵抗逆境的能力[10]。
1.2 水分调控
水分调控对根系构型的影响主要与植物的避逆性有一定的关系。土壤中水分、养分分布不均匀时,植物会向生长在资源丰富区域的根系分配更多的同化产物,促进这部分根的生长。现代种植作物与其近缘野生种具有不同根系构型,例如,种植莴苣与野生莴苣相比具有较浅的根系系统。种植莴苣通过无意地选择具有更多侧根系的直根,帮助植物吸收土壤表层水,相反野生莴苣展现出能够吸收土壤深水域的能力[17]。根系构型的变化在某种意义上反映了植物对干旱胁迫的响应,根系构型的变化也被描述为植物耐旱性不同的表现。在干旱条件下与种植品种相比,野生品种表现出不同的根系长度、根系干重以及根体积[18-19]。其他研究也发现,不同近缘种的根系伸展角度不同,干旱地区的番茄为了在雨期更有效地吸收地表水分,其根系伸展角度为60°,而非干旱地区伸展角度为10°。谢志良等[20]研究膜下滴灌水氮对棉花根构型的影响,研究发现增加滴水量,根干质量增加,根表面积与根长均降低,高氮对根系生长具有抑制作用,各土层根长、根干质量均下降。水氮互作对根系各指标的影响较为明显,灌水300 mm、施氮量276 kg·hm-2是根系生长发育的最优水氮组合。
1.3 重力效应(向地性)调控
重力效应(向地性)调控根系构型即是根系的向地性。根系构型的可塑性反映了根系调整其形态以适应不同的土壤理化性质。这种可塑性很大程度上源于不同根系发展类型以及对土壤条件独一无二的生理响应[21]。初生根与侧根最明显的不同在于对重力的敏感度,即向地性。初生根具有较明显的向地性,建立了横向根的深度发展[22-23]。Dinneny实验室的研究发现,在干旱条件下,植物根系为了向高湿度的土壤区域靠近,根系侧根表现出反向地性的生长。这表明在干旱条件下,植物根系的生长表现为独立的向水性,干旱条件的改善,可以提高根系生长的向地性[24-25]。
1.4 养分调控
营养元素对主根、侧根的生长有较大影响,其中侧根的生长是植物根系构型的关键。此外,营养元素也影响根的生长角度、根体积、根质量等。研究发现,在植物生长发育过程中,有 17种营养元素是必不可少的,其中P、N元素是主要的矿质营养元素,在缺P或者缺N的条件下,植物的生长以及根系构型受到影响[26]。在对水稻、小麦及玉米的研究中发现,在低N条件下,根系主要是通过提高根系的伸长、产生深层根系的办法来吸收硝酸盐[27-28]。这与玉米根系研究的结论一致,具有较少根冠基因型的玉米,通过产生较多的深根来提高N的利用率[29]。P在土壤中具有低流动性,植物为了吸收土壤中P元素,往往依靠根系在土壤中的伸长[30]。现已发现几种作物为了提高P的吸收率,形成了特殊的根系构型,像豆科和山龙眼科植物产生密集的侧根。在豆科植物中,这些根来源于最早横向根的中柱鞘,而次要的根很短,平均长度为5 mm且布满根毛[31-32]。对拟南芥的根系研究发现,在外部谷氨酸的作用下,C∶N比高可以促进根系侧根的生长,刺激根系产生分支,抑制初生根的生长[33]。此外,微量营养元素不足也可以明显改变植物根系构型,特别是低Fe、低B情况下,不过到目前为止,并没有关于微量元素改变根系构型的具体证据[34]。
2 植物根系的生理研究
2.1 植物激素
植物内源激素是植物体内代谢产生的极微量产物,对植物生长发育等生理过程具有重要的调控作用,同时也是根系生命活动的调节者[35]。在拟南芥的根系研究中发现,随着主根数量的减少,侧根上精确的生长素转运起始位点比生长素重新合成重要[36]。而生长素极性运输导致的生长素侧向浓度梯度,则是植物根系向地性的必要条件[37]。Fu 等[38]研究提出,GAS促进主根的伸长是由不稳定的DELLA蛋白类GA1(RGA)的阻滞物刺激伸长区域细胞膨胀完成的。根系是植物合成细胞分裂素的主要场所,细胞分裂素在根系中高表达时,根系的生长发育受到抑制,转基因拟南芥通过降低细胞分裂素的表达水平,可以实现对植物根系分支及根系的生长发育的调控[39]。脱落酸能够促进根系的生长发育,增加侧根数以及不定根的数量,增加根系质量,但过量的ABA对主根的生长产生负面影响。在根系系统中,ABA通过控制侧根分生组织的活动,进而影响根系的生长和构型[40]。大多情况下,植物激素对根系的影响是相互作用的,在干旱条件下,植物内源ABA迅速累积,由于ABA抑制CTK的合成,这时根系的生长往往受阻。在研究生长素与赤霉素对植物生长发育的影响时发现,这两种激素不仅影响根系的发育及构型,对种子发芽、开花结果等生理过程也起着重要的调控作用[41]。
2.2 碳氮代谢
在供水充足、中度干旱、严重干旱3种处理下研究矮竹根系的碳氮代谢,发现在中度干旱下,矮竹的碳代谢参数并没有发生改变,NO3 -的含量同样没有变化。在严重干旱下,同化NH4+的关键酶受到刺激。只有在供水充足的情况下,老叶中碳水化合物的水解产物向根系转移,同时,根系向新叶分配更多的N素营养,这些变化调节了矮竹的代谢平衡[42]。糖类物质作为信号分子影响植物根系的生长发育,在光刺激幼苗根系的情况下,子叶感知到刺激后,将光合作用产生的糖类运输到根尖,促进植物根系主根的伸长。NO分子等其它信号分子也能影响根系的生长,研究表明,外源的NO可以促进盐胁迫下幼苗的碳氮代谢,提高植物根系的抗逆性[43]。此外,葡萄糖作为信号分子可以促进主根伸长,从不同浓度葡萄糖处理的幼苗根尖 CYCB1;1::GUS、QC25::GUS和QC46::GUS 表达来看,葡萄糖不是通过影响分生区细胞分裂活性,而是通过抑制根尖分生区的长度来调节主根生长[44]。
2.3 根系呼吸
代谢植物根系的呼吸作用是一个复杂的过程,呼吸代谢中的关键酶、中间产物等都能对根系构型造成一定的影响。在干旱、盐分等胁迫下,葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G-6-PDH)和6-磷酸葡萄糖酸脱氢酶(6-phosphoglu-conate dehydrogenase, 6-PGDH)的基因表达水平显著增加,提高了植物根系抵抗逆境的能力[45-47]。研究表明,琥珀酸脱氢酶(succinate dehydrogenase, SDH)、苹果酸脱氢酶(malate dehydrogenase, MDH)、交替氧化酶(alternative oxidase, AO)、细胞色素氧化酶(cytochrome oxidase, CO)等其他呼吸代谢的关键酶也与植物的抗逆性密切相关[48-51]。植物根系呼吸的中间产物主要是有机酸,有机酸与植物的新陈代谢密切相关,能够调控植物根系构型的变化。高浓度的有机酸是一种呼吸抑制剂,在低pH值条件下,明显抑制根系的呼吸作用,由于氧化磷酸化作用受到阻碍,植物茎干基部淀粉的合成受到抑制,还原糖含量增加,光合作用减弱。与此同时,根系伸长受阻,根毛数量减少,细胞膜透性发生改变,阻碍了根系对水分和养分的吸收[52]。另外,Rakonczay等[53]以沼地红栎、红花槭为材料研究根系呼吸,研究发现切除细根后,根呼吸随着时间的推移明显下降。
3 植物根系的细胞学研究
植物根系生长包括初生生长和次生生长 [54]。根系的主根(Primary root)来源于胚根[55],侧根(Lateral root)起源于中柱鞘,并且侧根的输导组织与主根相连,构造与主根相同。不定根(Adventitious root)产生于次生木质部外侧。根尖由下而上依次为根冠、分生区、伸长区和根毛区,成熟的根由外到内依次为皮层、内皮层、中柱鞘以及由中柱鞘包围着的微管组织[56]。根系皮层组织包括皮层、内皮层、外皮层。外皮层在皮层的最外一层,其细胞结构较为紧密,伴随着根系的发育,内、外皮层的细胞形态发生木质化,形成了植物的质外体屏障,能降低逆境胁迫对植物的伤害。
盐胁迫研究发现,植物通过内皮层细胞的栓质化来适应盐胁迫[57]。不过外皮层的木质化使根系细胞与土壤溶液的接触面积减少,影响根系的吸收功能[58]。例如,根系外皮层细胞木质化后,洋葱根系细胞Ca离子向维管柱运输的能力大大减弱[59]。重金属研究方面,重金属对根系分生组织细胞、维管束及凯氏带等均有影响[60]。当土壤中铜的浓度达到50 mg· kg-1时,紫云英的根系颜色变褐,根毛变短、变少,当铜的浓度增加到200 mg· kg-1时,紫云英的根开始腐烂,根细胞出现死亡[61]。研究发现,小麦吸收重金属后,在表皮和皮层细胞中的累积最多[62]。分布在根系内、外皮层的初生壁上的凯氏带,能够有效阻止根系对重金属Zn、Cd的吸收[63-64] 等。干旱胁迫研究方面,曲贵敏等[65]、赵祥等[66]研究了根系木质部导管干旱胁迫下的变化,结果发现,水分胁迫下木质部导管的分子直径增大。不过其他学者认为,在干旱胁迫下,植物根系导管直径变小[67-68]。对于干旱胁迫下植物根系导管的变化的不一致情况,这可能说明不同植物对逆境胁迫具有不同的应对之道。总而言之,植物根系的细胞学仍需要进一步的研究。
4 植物根系的分子生物学研究
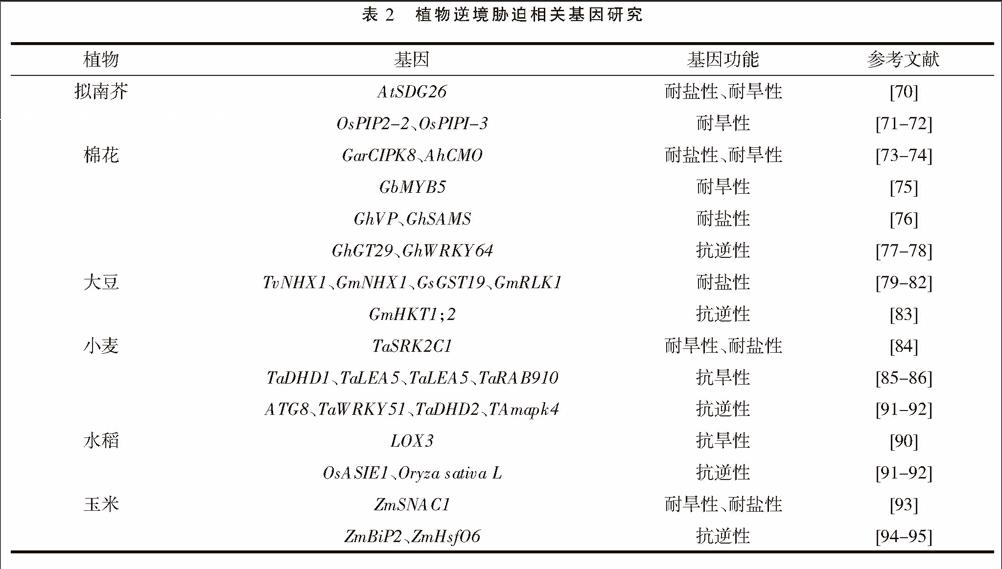
植物根系的分子生物学是在分子水平上研究根系的蛋白质结构、核酸等生物大分子的结构,通常进行QTL定位研究。而大多的根系分子生物学研究都与逆境胁迫的条件有关,这表明根系逆境胁迫基因在根系分子生物学研究中的重要性。大量的研究表明,植物在逆境条件下相关基因的表达调控机制具有复杂性、多样性,不是以单一的机制调控逆境胁迫,而是由众多的激素分子、信号分子、转录因子、蛋白质相互作用、相互调控的。例如,脱落酸(ABA)与水杨酸(SA)可以调控逆境胁迫,主要有两种机制:一是在逆境胁迫下,植物中的ABA与SA诱导mRNA的合成,并使其以稳定的形式存在;二是在逆境刺激下,ABA与SA引起逆境响应蛋白质的积累和翻译调控[69]。此外,Ca2+作为第二信使,可以刺激植物相关基因对逆境做出响应。由于篇幅有限,本文主要介绍植物根系逆境胁迫相关基因的研究,如表2。
5 展 望
近年来,植物根系的研究日益增多,覆盖了植物根系构型、生理学、细胞学、分子生物学的各个方面,取得的研究成果颇丰。植物根系的生理学、细胞学研究已经相对成熟,人们已掌握了根系发育的基本规律;构型研究是最近的研究热门,尚未形成系统的研究体系;植物根系分子生物学的研究较多,且取得了一系列的研究成果。为了深入研究植物根系,未来还需要做好以下几个方面的工作:第一,深入研究植物的根系构型,选择合适的根系研究方法,进行根系构型的原位观察和定量测定分析研究;第二,研究不同信号途径调控根系发育的基本机制,以及根系发育与地上部分生长之间的关系;第三,植物分子生物学研究方面,加大植物逆境胁迫相关基因的研究,加大QTL定位研究与大田生产相结合的力度,并与遗传育种相结合,提高科研成果的转化率。
参考文献:
[1]PACHAURI K R, REISINGER A. IPCC fourth assessment report: climate change 2007-Synthesis report (AR4)[R/OL].[2016-07-06]. http://www.preventionweb.net/go/2335.
[2]LYNCH J P.Roots of the second green revolution[J].Australian journal of botany,2007,55(5):493-512.
[3]RELLN-LVAREZ R,LOBET G,DINNENY J R.Environmental control of root system biology[J].Annual review of plant biology,2016,67(1):619-642.
[4]MICALLEF S A,SHIARIS M P,COLN-CARMONA A.Influence of Arabidopsis thaliana accessions on rhizobacterial communities and natural variation in root exudates[J].Journal of experimental botany,2009,60(6):1729-1742.
[5]YAO Q,ZHU H H,CHEN J Z,et al.Influence of an arbuscular mycorrhizal fungus on competition for Phosphorus between sweet orange and a leguminous herb[J].Journal of plant nutrition,2005,28(12):2179-2192.
[6]CATOIRA R,TIMMERS A C,MAILLET F,et al.The HCL gene of Medicago truncatula controls Rhizobium-induced root hair curling[J].Development (Cambridge, England),2001,128(9):1507-1518.
[7]BAREA J M, TOBAR R M, AZCN-AGUILAR C. Effect of a genetically modified Rhizobium meliloti, inoculant on the development of arbuscular mycorrhizas, root morphology, nutrient uptake and biomass accumulation in Medicago sativa[M]// SULLIVAN, EDMUND V. Theory and problems of child development. New York: Grune & Stratton, 1980,134(2) :361-369.
[8]NOSHEEN A,BANO A,ULLAH F,et al.Effect of plant growth promoting rhizobacteria on root morphology of safflower (Carthamus tinctorius L.)[J].African journal of biotechnology,2011,10(59):12669-12679.
[9]BABALOLA O O.Beneficial bacteria of agricultural importance[J].Biotechnology letters,2010,32(11):1559-1570.
[10]NICHOLS S N,CRUSH J R,WOODFIELD D R.Effects of inbreeding on nodal root system morphology and architecture of white clover (Trifolium repens L.)[J].Euphytica,2007,156(3):365-373.
[11]WU Q S,ZOU Y N,HUANG Y M.The arbuscular mycorrhizal fungus Diversispora spurca ameliorates effects of waterlogging on growth, root system architecture and antioxidant enzyme activities of citrus seedlings[J].Fungal ecology,2013,6(1):37-43.
[12]HARLEY J L,SMITH S E.Mycorrhizal symbiosis[J].Mycorrhizal symbiosis,1997,3(3):273-281.
[13]CAMPANELLI A,RUTA C,DE MASTRO G,et al.The role of arbuscular mycorrhizal fungi in alleviating salt stress in Medicago sativa L. var. icon[J].Symbiosis,2013,59(2):65-76.
[14]ARANDA E,SCERVINO J M,GODOY P,et al.Role of arbuscular mycorrhizal fungus Rhizophagus custos in the dissipation of PAHs under root-organ culture conditions[J].Environmental pollution (Barking, Essex : 1987),2013,181(6):182-189.
[15]DOBBELAERE S,CROONENBORGHS A,THYS A,et al.Phytostimulatory effect of Azospirillum brasilense wild type and mutant strains altered in IAA production on wheat[J].Plant and soil,1999,212(2):153-162.
[16]张金林,吴永娜,李剑,等.土壤有益细菌调控草类植物抗逆性及代谢产物积累的研究[C]//全国植物生物学大会论文集.南京: 全国植物生物学大会,2013:171.
[17]JACKSON L E.Root architecture in cultivated and wild lettuce(Lactuca,spp.)[J].Plant cell & environment,1995,18(8):885-894.
[18]NAZ A A,ARIFUZZAMAN M,MUZAMMIL S,et al.Wild barley introgression lines revealed novel QTL alleles for root and related shoot traits in the cultivated barley (Hordeum vulgare L.)[J].Bmc genetics,2014,15(1):1-12.
[19]NAZ A A,EHL A,PILLEN K,et al.Validation for root-related quantitative trait locus effects of wild origin in the cultivated background of barley (Hordeum vulgare L.)[J].Plant breeding,2012,131(3):392-398.
[20]谢志良,田长彦,卞卫国.膜下滴灌水氮对棉花根系构型的影响[J].棉花学报,2009,21(6):508-514.
[21]TIAN H,DE SMET I,DING Z.Shaping a root system: regulating lateral versus primary root growth[J].Trends in plant science,2014,19(7):426-431.
[22]LYNCH J P.Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems[J].Annals of botany,2013,112(2):347-357.
[23]UGA Y,SUGIMOTO K,OGAWA S,et al.Control of root system architecture by DEEPER ROOTING 1 increases rice yield under drought conditions[J].Nature genetics,2013,45(9):1097-1102.
[24]RELLN-LVAREZ R,LOBET G,LINDNER H,et al.GLO-Roots: an imaging platform enabling multidimensional characterization of soil-grown root systems[J].Elife,2015,4(2):422-430.
[25]MORIWAKI T,MIYAZAWA Y,KOBAYASHI A,et al.Molecular mechanisms of hydrotropism in seedling roots of Arabidopsis thaliana (Brassicaceae)[J].American journal of Botany,2013,100(1):25-34.
[26]LI X,ZENG R,LIAO H.Improving crop nutrient efficiency through root architecture modifications[J].Journal of integrative plant biology,2016,58(3):193-202.
[27]WANG X B,WU P,HU B,et al.Effects of nitrate on the growth of lateral root and nitrogen absorption in rice[J].Acta botanica sinica,2002,44(6):678-683.
[28]YU P,LI X,WHITE P J,et al.A large and deep root system underlies high nitrogen-use efficiency in maize production[J/OL].(2015-05-15)[2016-07-08].http://dx.doi.org/10.1371/journal.pone.0126293.
[29]SAENGWILAI P,TIAN X,LYNCH J P.Low crown root number enhances nitrogen acquisition from low-nitrogen soils in maize[J].Plant physiology,2014,166(2):581-589.
[30]NIU Y F,CHAI R S,JIN G L,et al.Responses of root architecture development to low Phosphorus availability: a review[J].Annals of botany,2013,112(2):391-408.
[31]NEUMANN G,MASSONNEAU A,LANGLADE N,et al.Physiological aspects of cluster root function and development in phosphorus-deficient White Lupin(Lupinus albus,L.)[J].Annals of botany,2000,85(6):909-919.
[32]DINKELAKER B,HENGELER C,MARSCHNER H.Distribution and function of proteoid Roots and other root clusters[J].Journal of the German botanical society,1995,108(3):183-200.
[33]ZHANG H,RONG H,PILBEAM D.Signalling mechanisms underlying the morphological responses of the root system to Nitrogen in Arabidopsis thaliana[J].Journal of experimental botany,2007,58(9):2329-2338.
[34]LPEZ-BUCIO J, CRUZ-RAMIREZ A,HERRERA-ESTRELLA L.Tthe role of nutrient availability in regulating root architecture[J].Current opinion in plant biology,2003,6(3):280-287.
[35]未晓巍,吕杰,武慧,等.植物根系研究进展[J].北方园艺,2012 (18):206-209.
[36]ALONI R,ALONI E,LANGHANS M,et al.Role of cytokinin and auxin in shaping root architecture: regulating vascular differentiation, lateral root initiation, root apical dominance and root gravitropism[J].Annals of botany,2006,97(5):883-893.
[37]SWAIN S M,SINGH D P.Tall tales from sly dwarves: novel functions of gibberellins in plant development[J].Trends in plant science,2005,10(3):123-129.
[38]FU X,HARBERD N P.Auxin promotes Arabidopsis root growth by modulating gibberellin response[J].Nature,2003,421(6924):740-743.
[39]VESCOVI M,RIEFLER M,GESSUTI M,et al.Programmed cell death induced by high levels of cytokinin in Arabidopsis cultured cells is mediated by the cytokinin receptor CRE1/AHK4[J].Journal of experimental botany,2012,63(7):2825-2832.
[40]BEAUDOIN N,SERIZET C,GOSTI F,et al.Interactions between abscisic acid and ethylene signaling cascades[J].The plant cell,2000,12(7):1103-1115.
[41]KAZAN K.Auxin and the integration of environmental signals into plant root development[J].Annals of botany,2013,112(9):1655-1665.
[42]LIU C G,WANG Y J,PAN K W,et al.Carbon and nitrogen metabolism in leaves and roots of dwarf bamboo (fargesia denudata Yi) subjected to drought for two consecutive years during sprouting period[J].Journal of plant growth regulation,2014,33(2):243-255.
[43]郑春芳,姜东,戴廷波,等.外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响[J].生态学报,2010,30(5):1174-1183.
[44]李慧敏, 梁永书, 南文斌,等.糖调控植物根系生长发育的研究进展[J].中国农学通报, 2015,31(14):108-113.
[45]HEERDEN P D R V,VILLIERS M F D,STADEN J V,et al.Dark chilling increases glucose-6-phosphate dehydrogenase activity in soybean leaves[J].Physiologia plantarum,2003,119(2):221-230.
[46]NEMOTO Y,SASAKUMA T.Specific expression of glucose-6-phosphate dehydrogenase (G6PDH) gene by salt stress in wheat (Triticum aestivum L.)[J].Plant science,2000,158(1/2):53-60.
[47]FONOVICH DE SCHROEDER T M.The effect of Zn2+ on glucose 6-phosphate dehydrogenase activity from Bufo arenarum toad ovary and alfalfa plants[J].Ecotoxicology and environmental safety,2005,60(2):123-131.
[48]胡晓辉,郭世荣,李璟,等.低氧胁迫下钙调素拮抗剂对黄瓜幼苗根系多胺含量和呼吸代谢的影响[J].应用与环境生物学报,2007,13(4):475-480.
[49]YAO Y X,DONG Q L,ZHAI H,et al.The functions of an apple cytosolic malate dehydrogenase gene in growth and tolerance to cold and salt stresses[J].Plant physiology and biochemistry ,2011,49(3):257-264.
[50]RIBAS-CARBO M,TAYLOR N L,GILES L,et al.Effects of water stress on respiration in soybean leaves[J].Plant physiology,2005,139(1):466-473.
[51]EDERLI L,MORETTINI R,BORGOGNI A,et al.Interaction between nitric oxide and ethylene in the induction of alternative oxidase in ozone-treated tobacco plants[J]. Plant physiology,2006,142(2):595-608.
[52]刘世亮,杨振民,化党领,等.不同有机酸对烤烟生长发育和生理生化特性的影响[J].中国农学通报,2005,21(5):248-252.
[53]RAKONCZAY Z,SEILER J R,KELTING D L.Carbon efflux rates of fine roots of three tree species decline shortly after excision[J].Environmental and experimental botany,1997,38(3):243-249.
[54]陈红,冯云,周建梅,等.植物根系生物学研究进展[J].世界林业研究,2013,26(5):25-29.
[55]DE JAGER S M,MAUGHAN S,DEWITTE W,et al.The developmental context of cell-cycle control in plants[J].Seminars in cell & developmental biology,2005,16(3):385-396.
[56]吴娇娇,张谦,刘士平.细胞周期因子与植物根系发育[J].植物生理学报,2008,44(4):621-629.
[57]LPEZ-PREZ L,CARVAJAL M.The phi thickening in Roots of broccoli plants: an acclimation mechanism to salinity [J].International journal of plant sciences,2007,168(8):1141-1149.
[58]KAMULA S A,PETERSON C A,MAYFIELD C I.The plasmalemma surface area exposed to the soil solution is markedly reduced by maturation of the exodermis and death of the epidermis in onion roots[J].Plant cell & environment,2008,22(17):1183-1193.
[59]CHOLEWA E,PETERSON C A.Evidence for symplastic involvement in the radial movement of calcium in onion roots[J].Plant physiology,2004,134(4):1793-1802.
[60]仇硕,黄苏珍.镉胁迫对黄菖蒲不同部位组织结构的影响[J].江苏农业科学,2008 (1):109-111.
[61]何龙飞,刘友良,沈振国,等.铝对小麦幼苗营养元素吸收和分布的影响[J].电子显微学报,2000,19(5):685-694.
[62]倪才英,李华,骆永明,等.铜、镉及其交互作用对泡泡草细胞超微结构的影响[J].环境科学学报,2004,24(2):343-348.
[63]LUX A,MARTINKA M,VACULK M,et al.Root responses to cadmium in the rhizosphere: a review[J]. Journal of experimental botany,2011,62(1):21-37.
[64]VACULK M,KONLECHNER C,LANGER I,et al.Root anatomy and element distribution vary between two Salix caprea isolates with different Cd accumulation capacities[J].Environmental pollution (Barking, Essex : 1987),2012,163(2):117-126.
[65]曲桂敏,李兴国,赵飞,等.水分胁迫对苹果叶片和新根显微结构的影响[J].园艺学报,1999,26(3):147-151.
[66]赵祥,董宽虎,张垚,等.达乌里胡枝子根解剖结构与其抗旱性的关系[J].草地学报,2011,19(1):13-19.
[67]宋凤斌,刘胜群.不同耐旱性玉米根系解剖结构比较研究[J].吉林农业大学学报,2008,30(4):377-381, 393.
[68]王静, 黄薇. 初生根的形态解剖结构与春小麦抗旱性的关系初探[J].兰州大学学报(自然科学版), 1998(4):154-156.
[69]赵虎成,王伯初,刘堰,等.逆境胁迫下植物基因的表达与调控[J].重庆大学学报(自然科学版),2000,23(5):146-148.
[70]马惠.AtSDG26基因在植物抗逆中的功能研究[D].长沙:湖南农业大学,2012.
[71]GUO L,WANG Z Y,LIN H,et al.Expression and functional analysis of the rice plasma-membrane intrinsic protein gene family[J].Cell research,2006,16(3):277-286.
[72]SAKURAI J,ISHIKAWA F,YAMAGUCHI T,et al.Identification of 33 rice aquaporin genes and analysis of their expression and function[J].Plant & cell physiology,2005,46(9):1568-1577.
[73]冯娟,范昕琦,徐鹏,等.棉属野生种旱地棉蛋白激酶基因GarCIPK8的克隆与功能分析[J].作物学报,2013 (1):34-42.
[74]朱玉庆.转AhCMO基因棉花苗期对干旱、盐胁迫的生理反应[D].泰安:山东农业大学,2008:19.
[75]李文娟.GbMYB5基因在棉花耐干旱胁迫中的功能研究[D].南京:南京农业大学,2014.
[76]宋丽艳. 陆地棉耐盐相关基因GhVP与GhSAMS的克隆、分析与表达[D].北京:中国农业科学院, 2010.
[77]李月,刘晓东,董永梅,等.棉花Trihelix转录因子GhGT29基因的克隆及功能分析[J].遗传,2015 (12):1218-1227.
[78]杜皓,丁林云,何曼林,等.受多逆境诱导表达的GhWRKY64基因启动子克隆与功能分析[J].作物学报,2015,41(4):593-600.
[79]张海波.TvNHX1基因转化大豆及其耐盐性分析[D].哈尔滨:哈尔滨师范大学,2011.
[80]范龙,孙天杰,杨郡,等.大豆GmNHX1基因克隆及其在酵母中的耐盐性分析[J].河北农业大学学报,2015,38(6):7-12, 24.
[81]王臻昱,才华,柏锡,等.野生大豆GsGST19基因的克隆及其转基因苜蓿的耐盐碱性分析[J].作物学报,2012,38(6):971-979.
[82]孙怀娟.大豆根特异表达基因GmRLK1的克隆与功能的初步研究[D].南京:南京农业大学,2012.
[83]殷桂香,张磊,佘茂云.大豆TRK-HKT家族基因结构及逆境胁迫响应机制[J].作物学报,2015,41(2):259-275.
[84]杜小明.小麦SnRK2家族成员TaSRK2C1分子特征及介导植株抵御干旱和盐分逆境功能研究[D].保定:河北农业大学,2012.
[85]冉彩华.小麦中3个水分胁迫相关基因的克隆与表达[D].郑州:河南农业大学,2010.
[86]陈雷.小麦根系中4个水分胁迫诱导基因的克隆及功能分析[D].郑州:河南农业大学,2010.
[87]田丽娟.小麦ATG8基因在植物抵抗逆境胁迫中的功能研究[D].保定:河北农业大学,2014:13.
[88]王瑞,吴华玲,张铭,等.小麦TaWRKY51基因的克隆、表达分析和转基因功能鉴定[J].农业生物技术学报,2013,21(9):1019-1027.
[89]文延丽.小麦激酶基因TaMAPK2B;1和TaMAPK4分子特征及耐逆功能研究[D].保定:河北农业大学,2014.
[90]刘南南,江玲,张文伟,等.水稻种胚LOX3基因在逆境胁迫中的作用[J].中国水稻科学,2008,22(1):8-14.
[91]吴慧敏.水稻AP2/EREBP转录因子基因OsASIE1抗逆功能分析[D].北京:中国农业科学院,2011.
[92]于耸.水稻(Oryza sativa L.)碳酸酐酶基因在逆境胁迫下的功能解析[D].哈尔滨:东北林业大学,2006.
[93]卢敏,张登峰,石云素,等.玉米胁迫诱导表达基因ZmSNAC1的功能分析[J].作物学报,2013,39(12):2177-2182.
[94]宋仲戬,张登峰,李永祥,等.玉米分子伴侣基因ZmBiP2在逆境下的功能分析[J].作物学报,2015,41(5):708-716.
[95]李慧聪,李国良,郭秀林.玉米热激转录因子基因(ZmHsf06)的克隆、表达和定位分析[J].农业生物技术学报,2015,23(1):41-51.

