熊果酸对人结肠癌HT—29细胞增殖抑制和诱导凋亡的研究
江华++++++张奕颖++++++尹素改++++++张小莉++++++冯黎++++++刘胜利++++++张秋萍


[摘要] 目的 探讨熊果酸(UA)诱导人结肠癌细胞HT-29凋亡的作用机制。 方法 MTT法观察UA对HT-29细胞增殖的抑制作用;荧光显微镜和流式细胞术观察HT-29细胞的凋亡情况;Western blot检测细胞色素c(cyt-c)、caspase-3及Livin蛋白的表达。 结果 UA对HT-29细胞具有明显的的增殖抑制作用,并呈一定的浓度和时间依赖性;荧光显微镜观察结果显示,50 μmol/L的UA作用24 h后,较多细胞呈现出凋亡的特征性改变;流式细胞术检测发现,UA可将HT-29细胞阻滞于G1期,随着UA浓度的增高,细胞凋亡率也相应增加;Western blot结果显示,UA作用24 h后,Livin蛋白和caspase-3酶原的表达逐渐降低,线粒体释放的cyt-c逐渐增多,活化的caspase-3片段逐渐增加。 结论 UA对HT-29细胞具有明显的增殖抑制作用,其机制可能与UA阻滞HT-29细胞的细胞周期、激活线粒体凋亡途径以及下调凋亡抑制蛋白Livin的表达有关。
[关键词] 熊果酸;人结肠癌细胞HT-29;凋亡
[中图分类号] R735.3+5 [文献标识码] A [文章编号] 1674-4721(2016)09(a)-0025-05
[Abstract] Objective To investigate the apoptosis-inducing mechanism of ursolic aicd (UA) in human colon cancer cell HT-29. Methods The inhibitory effect of UA on the growth of HT-29 cells was evaluated by MTT assay. Apoptosis was determined by fluorescence microscopy and flow cytometry. The expressions of apoptosis-associated proteins including cytochrome c (cyt-c), caspase-3 and Livin were assessed by Western blot analysis. Results UA inhibited HT-29 cell proliferation in a time- and dose-dependent manner. Fluorescent microscope indicated characteristics of apoptosis present in cells after UA-treated (50 μmol/L, 24 h). Flow cytometry showed that UA inhibited HT-29 in G1 phase, and the apoptosis rate of HT-29 cell exposured to UA increased, corresponding to the concentration of UA. The inceasing of the release of cyt-c from the mitochondria and the activated fragment of caspase-3 were detected by Western blot, while the expression of procaspase-3 and Livin was decreased gradually. Conclusion UA can inhibit the proliferation of HT-29 cells effectively in vitro. The mechanism of above-mentioned phenomena may be related with the arrest effect of UA in the cell cycle of HT-29, activated mitochondrial apoptotic pathway, and down-regulating the expression of Livin.
[Key words] Ursolic acid; Human colon cancer cell HT-29; Apoptosis
熊果酸(Ursolic acid,UA),又叫乌苏酸、乌索酸,它在自然界中存在广泛,是熊果、白花蛇舌草、乌梅等多种植物的主要活性成分,具有多种生物学活性,包括护肝[1]、抗炎[2-3]、抗血管生成[4]、降血糖[5]以及抗肿瘤[6-8]等作用。现在人们日益重视UA的抗肿瘤作用,它可以抑制肿瘤细胞的转移、减少肿瘤血管的生成、诱导肿瘤细胞的凋亡等,但UA通过何种途径诱导肿瘤细胞的凋亡尚不完全清楚。本实验研究了UA对HT-29细胞增殖和凋亡的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 材料
人结肠癌细胞HT-29购自北京大学;UA、胰酶、四甲基偶氮唑蓝(MTT)、DMSO、Hoechst33258和碘化丙啶(PI)染料均购自Sigma公司;RPMI-1640培养基购自HYCLONE公司;新生小牛血清购自杭州四季青有限公司;鼠抗人cyt-c单克隆抗体和鼠抗人caspase-3单克隆抗体均购自Neomarkers公司;鼠抗人Livin单克隆抗体购自Stratagene Corporation公司;Western blot试剂盒购自Kirkegaard Perry Laboratories公司;二氧化碳细胞培养箱为美国NUAIRE公司产品;荧光酶标仪为TECAN公司产品,型号:GENiOS VA200;流式细胞仪为BECKMAN产品。
1.2 方法
1.2.1 细胞培养 用含10%新生小牛血清的RPMI-1640培养基于37℃、5% CO2的培养箱中培养HT-29细胞,每2~3天传代1次,用对数生长期的细胞进行实验。
1.2.2 MTT法检测UA对HT-29细胞的增殖抑制情况 将HT-29细胞调节浓度至5×104个/mL,加入96孔培养板中,待其贴壁后加入UA,使终浓度分别为10、20、30、40、50 μmol/L,并设立不含UA(0 μmol/L)的对照组,每组设3个复孔,各组中DMSO的最终含量均为0.5%(V/V)。将96孔板放在培养箱中分别培养12、24、36、48 h后加入5 mg/mL的MTT溶液20 μL,然后置于培养箱中继续培养4 h,弃上清,每孔加入DMSO 100 μL,震荡混匀后用酶标仪在570 nm波长下检测各孔的吸光值(OD值)。计算细胞增殖抑制率=[(对照组OD值-实验组OD值)/对照组OD值]×100%。
1.2.3 荧光显微镜观察细胞凋亡情况 将HT-29细胞接种于24孔培养板中,接种浓度为1.25×105个/mL,加入UA至终浓度为50 μmol/L,同时设立不含UA(0 μmol/L)的对照组。UA作用24 h后,0.25﹪胰酶消化,2000 r/min离心10 min收获细胞,PBS洗涤,加入Hoechst 33258染液避光孵育10 min。离心弃上清,加入PI染液4℃孵育30 min,离心,PBS洗涤,滴片,用荧光显微镜进行观察。
1.2.4 流式细胞术(FCM)检测细胞周期和细胞凋亡率 分别以0、20、30、40、50 μmol/L的UA作用于HT-29细胞24 h,胰酶消化,离心弃上清,冷PBS洗2次,用预冷的70%乙醇4℃固定过夜。离心弃固定液,冷PBS洗2次,弃上清,加入RNA酶(1 mg/mL)240 μL,37℃水浴箱中放置30 min,加入PI染液避光染色30 min,流式细胞仪检测。
1.2.5 Western blot检测蛋白表达 将HT-29细胞以5×106个/mL浓度培养于培养瓶中,加入UA使其终浓度分别为0、20、30、40、50 μmol/L作用24 h后,2000 r/min离心10 min,PBS洗涤,弃上液。分别加入100 μL蛋白裂解液裂解30 min,离心取上清,荧光酶标仪检测蛋白浓度。各实验组蛋白液与等体积上样缓冲液混匀,煮沸3 min,以15%SDS-聚丙烯酰胺凝胶电泳分离蛋白,并转印蛋白至硝酸纤维素膜。然后将其放在封闭液中封闭2 h,分别加入鼠抗人cyt-c单克隆抗体、鼠抗人caspase-3单克隆抗体和鼠抗人Livin单克隆抗体,4℃孵育2 h。TBS漂洗3次,加入辣根过氧化物酶标记的二抗室温孵育1 h。TBS漂洗3次,用Western blot蛋白质印迹(ECL)检测试剂盒检测,并用图像分析软件分析蛋白条带的光密度。
1.3 统计学方法
采用SPSS 21.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 UA对HT-29细胞的增殖抑制作用
MTT结果表明,UA对人结肠癌细胞HT-29具有增殖抑制作用,并呈现出明显的剂量和时间依赖性(图1)。直线回归方程显示,UA作用于HT-29细胞12、24、36、48 h,其IC50值分别为(52.73±1.50)、(43.23±1.94)、(37.39±1.69)、(32.04±1.16)μmol/L。
2.2 荧光显微镜观察细胞凋亡情况
荧光显微镜观察结果显示,50 μmol/L的UA作用于HT-29细胞24 h后,许多细胞呈现出凋亡的特征性改变,HT-29细胞内的染色质分布不均匀,呈浓染的块状或颗粒状;而0 μmol/L的UA作用24 h后,HT-29细胞内的染色质分布比较均匀,呈均匀弥散的蓝白色荧光。坏死细胞呈红色荧光(图2,封三)。
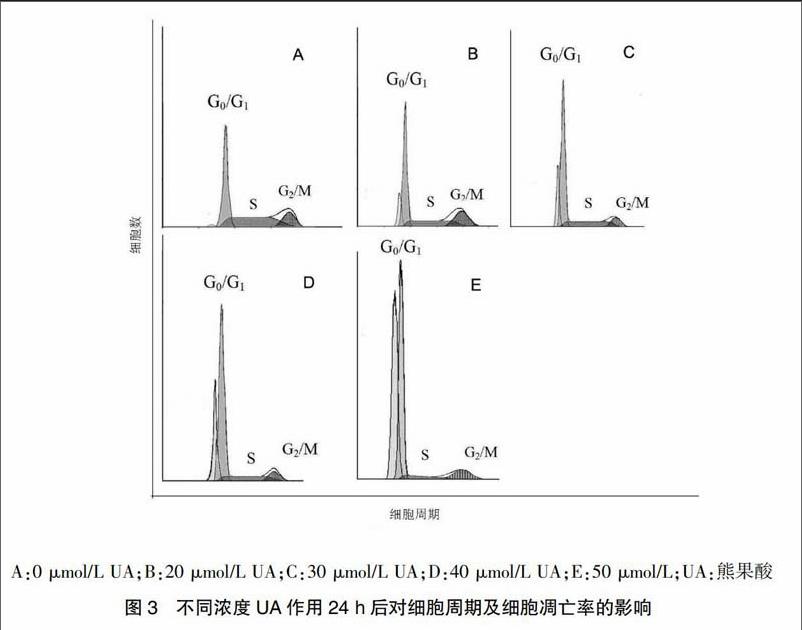
2.3 流式细胞术(FCM)检测细胞周期及细胞凋亡率情况
细胞经不同浓度UA作用24 h后,随着UA浓度的增加,G0/G1期细胞比例逐渐增高,S期细胞比例逐渐降低;流式细胞仪分析显示,随着UA浓度的增高,在G1期前出现亚二倍体峰(细胞凋亡峰)逐渐增高,与0 μmol/L UA比较,凋亡率差异有高度统计学意义(P < 0.01)。见表1、图3。
2.4 Western blot检测Livin、caspase-3、cyt-c蛋白表达情况
Western blot结果显示,随着UA浓度(0、20、30、40、50 μmol/L)的增加,Livin蛋白和caspase-3酶原蛋白表达逐渐降低,而从线粒体中释放出来的cyt-c逐渐增多,活化后的caspase-3片段的表达也逐渐升高,与0 μmol/L UA比较,差异有统计学意义(P < 0.05)。见图4。
3 讨论
UA在自然界中分布较为广泛,具有多种多样的生物学效应,其突出作用是抗肿瘤,它对多种致癌物有抵抗作用,并且对多种恶性肿瘤细胞具有明显的细胞毒作用、诱导分化以及抗血管生成作用。因此,人们越来越重视UA的抗癌防癌作用。
本试验研究了UA对于人结肠癌HT-29细胞的作用,细胞增殖抑制实验表明从30 μmol/L起,UA开始较显著地抑制HT-29细胞的增殖作用,并呈浓度和时间依赖性。
PI只能透过坏死的细胞膜与细胞核结合,因此在紫外光激发下坏死细胞呈红色。而Hoechst 33258属于脂溶性染液,可以通过完整的细胞膜与靶细胞的细胞核结合,在紫外光的激发下会发出蓝白色荧光。若细胞核染色均匀一致,呈弥散的蓝白色荧光,则是活细胞;若细胞核染色不均匀,呈现出浓染的块状或颗粒状,则是凋亡细胞。本试验中采用Hoechst 33258和PI染色,通过荧光显微镜观察HT-29细胞的凋亡现象,发现在50 μmol/L UA作用下,比较多的HT-29细胞呈现出凋亡的改变,其细胞内染色质分布不均匀,在荧光显微镜下可看到荧光斑点形成,而0 μmol/L的UA作用24 h后,HT-29细胞的细胞膜完整,染色质分布均匀,呈弥散的蓝白色荧光。在两个浓度的UA作用下都可以观察到表现为红色荧光的坏死细胞。
通过FCM检测发现,UA可以将HT-29细胞阻滞在细胞周期的G1期,具体表现为G0/G1期的细胞比例增加,而S期的细胞比例降低。随着熊果酸浓度的增加,HT-29细胞的凋亡率也在逐渐升高,体现在HT-29细胞的凋亡峰逐渐增高。因此,UA对HT-29细胞的凋亡作用可能是通过影响HT-29细胞从G1期向S期转变,从而将该肿瘤细胞阻滞在G1期,减少了HT-29细胞进入S期的数量,从而抑制了肿瘤细胞DNA的复制,并导致HT-29细胞凋亡。
研究表明,肿瘤的发生和失控性生长是细胞增殖和细胞凋亡两个过程失衡的结果。参与细胞凋亡的通路有三条,线粒体通路[9]、死亡受体通路[10]和内质网通路[11],而线粒体通路中细胞色素c(cyt-c)是关键的分子。当细胞受到损伤后,cyt-c从线粒体中释放出来,与凋亡活化因子1(Apaf-1)结合,并且激活caspase-9的前体,再进一步激活caspase-3,引发caspase的级联反应,而caspase活化以后又可以促进靶细胞内的线粒体释放cyt-c,同时其降解底物后的产物可以引起线粒体通透性的改变从而导致靶细胞凋亡的发生[12-15]。
在细胞凋亡的过程中,天冬氨酸特异的半胱氨酸蛋白酶(caspase)发挥着很重要的作用。根据caspase在细胞凋亡中的作用和N-末端的长度,可以将其分成为两大类:一类是起始型caspase(initiator caspase),如caspase-8、caspase-9,它们可以激活下游的caspase;另一类为效应型caspase(effector caspase),如caspase-3、caspase-6、caspase-7,它们可以直接降解靶细胞内的相关功能蛋白,导致凋亡的发生。这些caspase都是以无活性的前体形式存在,需要相关的激活因子将其激活为活性形式后才能发挥作用[16]。
在机体内还存在有抗凋亡基因和其相关表达产物,凋亡抑制蛋白家族(inhibitor of apoptosis protein,IAPs)就是其中一类,它对于调节细胞凋亡具有重要的作用[17],某些IAPs成员的异常高表达可以导致细胞的凋亡过程受阻,其中,Livin是近些年来发现的人类IAP家族的新成员[18],它与肿瘤的发生有着密切的关系[19-21]。研究证实,IAPs主要通过与特异性的caspase蛋白结合并抑制caspase蛋白的活性,从而阻断凋亡的发生[22-23]。
本研究Western blot结果表明,UA作用24 h后,随着药物浓度的增加,15 kD处cyt-c的释放增多,caspase-3酶原和Livin蛋白的表达降低,而活化后的caspase-3片段的表达逐渐增高。据此推测,UA有可能通过改变HT-29细胞内线粒体膜的通透性,促进cyt-c的释放,释放出来的cyt-c进而导致caspase-3的活化。同时,UA还可以下调HT-29细胞内Livin蛋白的表达,故UA有可能解除Livin蛋白对caspase-3的抑制作用。上述两个过程均可以增强靶细胞内caspase-3的活化作用,而活化的caspase-3可以作用于HT-29细胞质中的相关细胞骨架蛋白,或者是作用于靶细胞内的DNA酶,引起DNA的断裂,从而导致HT-29细胞凋亡。
综上所述,在体外UA可明显抑制HT-29细胞增殖,并诱导其凋亡,它的作用机制可能是通过下调HT-29细胞内Livin蛋白的表达,促进线粒体内膜中的cyt-c释放到胞浆中,继而激活caspase-3,导致靶细胞的凋亡,其具体分子机制还有待进一步研究。
[参考文献]
[1] 欧阳灿晖,朱萱,张焜和,等.熊果酸对肝纤维化大鼠肝组织TGF-β1和α-SMA表达的影响[J].世界华人消化杂志,2009,17(22):2237-2243.
[2] Wang YJ,Lu J,Wu DM,et al. Ursolic acid attenuates lipopolysaccharide induced cognitive deficits in mouse brain through suppressing p38/NF-κB mediated inflammatory pathways [J]. Neurobiol Learn Mem,2011,96(2):156-165.
[3] 王翔,阎昭,王旭,等.熊果酸纳米脂质体的镇痛作用和抗炎活性[J].山东医药,2013,53(29):31-32.
[4] Kanjoormana M,Kuttan G. Antiangiogenic activity of ursolic acid [J]. Integr Cancer Ther,2010,9(2):224-235.
[5] Lee J,Yee ST,Kin JJ,et al. Ursolic acid ameliorates thymic atrophy and hyperglycemia in streptozotocin-nicotinamide-induced diabetic mice [J]. Chem Biol Interact,2010,188(3):635-642.
[6] Zhang T,HE YM,Wang JS,et al. Ursolic acid induces HL60 monocytic differentiation and up-regulates C/EBPβ expression by ERK pathway activation [J]. Anticancer Drugs,2011,22(2):158-165.
[7] Yie YY,Zhao SY,Tang Q,et al. Ursolic acid inhibited growth of hepatocellular carcinoma HepG2 cells through AMPKα-mediated reduction of DNA methyltransferase 1 [J]. Mol Cell Biochem,2015,402(1):63-74.
[8] 唐丹,李剑萍,郑锡凤,等.熊果酸通过STAT3信号通路调控胃癌细胞增殖和凋亡[J].中国药理学通报,2012,28(2):179-184.
[9] 郑天胜,李翔.线粒体凋亡通路的研究进展[J].医学综述,2013,19(18):3282-3285.
[10] Spencer SL,Sorger PK. Measuring and modeling apoptosis in single cells [J]. Cell,2011,144(6):926-939.
[11] Breckenridge DG,Germain M,Mathai JP,et al. Regulation of apoptosis by endoplasmic reticulum pathways [J]. Oncogene,2003,22(53):8608-8618.
[12] 宋必卫,樊俏玫,何治宇.线粒体calpains与细胞凋亡关系的研究进展[J].中国药理学通报,2014,30(6):757-760.
[13] Zhang S,Zhang Y,Zhuang Y,et al. Matrine induces apoptosis in human acute myeloid leukemia cells via the mitochondrial pathway and Akt inactivation [J]. PloS One,2012,7(10):e46853.
[14] Herr I,Debatin K. Cellular stress response and apoptosis in cancer therapy [J]. Blood,2001,98(9):2603-2604.
[15] Wang Z,Liu Y,Cui Y. Pathways to caspase activation [J]. Cell Biol Int,2005,29(7):489-496.
[16] Thomberry NA,Lazebnik Y. Caspase:Enemies within [J]. Science, 1998,281(5381):1312-1316.
[17] LaCasse EC,Baird S,Korneluk RG,et al. The inhibitors of apoptosis(IAPs)and their emerging role in cancer [J]. Oncogene,1998,17(25):3247-3259.
[18] Kasof GM,Gomes BC. Livin,a novel inhibitor of apoptosis protein family member [J]. J Biol Chem,2001,276(5):3238-3246.
[19] 杨立军,郑文武,周安传,等.Livin蛋白生物学特性及在肿瘤表达中的研究进展[J].河北医药,2016,38(6):935-937.
[20] 刘军辉,赵永灵,喻军.Livin蛋白表达于结直肠癌组织病理参数间关系研究[J].中华实用诊断与治疗杂志,2015, 29(12):1160-1162.
[21] 王留霞.Survivin和Livin在初诊急性白血病患儿中的表达[J].肿瘤基础与临床,2015,28(3):200-202.
[22] Li G,Zhang H,Liu Y,et al. Effect of temozolomide on livin and caspase-3 in U251 glioma stem cells [J]. Exp Ther Med,2015,9(3):744-750.
[23] Hsieh CH,Lin YJ,Wu CP,et al. Livin contributes to tumor hypoxia-induced resistance to cytotoxic therapies in glioblastoma multiforme [J]. Clin Cancer Res,2015,21(2):460-470.

