低温胁迫下小麦幼穗中差异表达蛋白质的鉴定
程西永,呼晓贤,李海霞,董中东,任 妍,陈树林,詹克慧,许海霞
(河南农业大学/小麦玉米作物学国家重点实验室/河南粮食作物协同创新中心, 河南郑州 450002)
低温胁迫下小麦幼穗中差异表达蛋白质的鉴定
程西永,呼晓贤,李海霞,董中东,任 妍,陈树林,詹克慧,许海霞
(河南农业大学/小麦玉米作物学国家重点实验室/河南粮食作物协同创新中心, 河南郑州 450002)
为探究低温胁迫下小麦幼穗中胁迫响应差异表达蛋白,采用IEF/SDS-PAGE双向凝胶电泳及质谱技术,以低温敏感品种SW601和低温不敏感品种陇麦157为材料,对常温生长、0 ℃低温胁迫12 h和72 h 的幼穗全蛋白进行了分析。结果表明,在pH 4~7时,SW601和陇麦157各处理幼穗蛋白图谱中均可重复检测到800~900个有效蛋白质点;低温胁迫12 h、72 h后,SW601和陇麦157中上调表达的蛋白点分别有120个和101个,下调表达的蛋白点分别有92个和60个。对2种胁迫处理下均差异表达且Ratio>2的54个蛋白点进行质谱分析,成功鉴定出43个差异蛋白。经数据库搜索匹配和蛋白质鉴定,这43个差异蛋白分别属于胁迫应激/防御相关蛋白、光合作用蛋白、蛋白代谢相关蛋白、碳水化合物代谢相关蛋白、信号传导相关蛋白、能量产生和运输相关蛋白和未知功能蛋白等7类蛋白。其中,抗坏血酸过氧化物酶、Cu/Zn超氧化物歧化酶和胚胎后期发育富集(LEA)同源蛋白14-A等蛋白的表达量在低温不敏感材料陇麦157中变化显著,而在低温敏感材料SW601中没有表达,这可能与小麦幼穗在低温逆境下的代谢调控和低温敏感特性有一定关系。
小麦;幼穗;低温胁迫;双向电泳;胁迫响应蛋白
小麦是我国主要粮食作物之一,提高小麦产量对保证我国粮食安全具有重要意义。小麦生长过程中经常遭遇干旱、极端温度(低温和高温)和高盐等非生物胁迫,使小麦生长发育和代谢受到抑制,甚至导致植株死亡[1]。在各种非生物胁迫中,低温对小麦产量的影响尤为突出,是制约小麦高产、稳产的重要因素[2]。小麦发育进程中,低温会影响穗部发育和结实,在二棱末期-雌雄蕊分化期遭遇低温,会直接影响小麦的产量和品质[3]。近年来,黄淮麦区春季低温发生频率呈增加趋势,探究小麦春季低温受害机理,选育抗春季低温能力较强的新品种,可有效降低“倒春寒”对小麦生产的危害。低温逆境下,植物组织内部生理生化代谢和蛋白质表达都会发生变化。目前,双向凝胶电泳和质谱技术是研究逆境胁迫下蛋白质组学的核心技术之一。Cui等[4]对渐进温度处理下水稻幼苗叶片差异表达蛋白研究中,获得60个与低温诱导相关的差异蛋白点,质谱分析发现分子伴侣蛋白有利于提高植物的低温耐受性。韩巧霞等[5]对-5 ℃冷冻处理1 d和3 d小麦叶片的全蛋白进行了分离,质谱鉴定发现与应激胁迫相关的抗坏酸过氧化物酶(APX)、超氧化物歧化酶和LEA蛋白等在适应低温胁迫过程中发挥了重要作用。Cabane等[6]的研究表明,热休克蛋白HSP70与大豆抗寒性密切相关。前人在油菜、菠菜、番茄、杨树等植物中也鉴定出大量耐冷相关蛋白[7-8],这些蛋白通过感知逆境转导信号,并通过信号转导途径中的关键转录因子来调控细胞内逆境胁迫响应蛋白的表达,从而响应胁迫条件下植物生长和代谢[9]。因此,寻找逆境胁迫响应相关蛋白对于提高植物的抗逆性具有重要意义。
目前,蛋白质表达的研究大多集中在植物叶片、根、茎、胚乳、花药、花粉、种子等器官中,而关于低温敏感期小麦幼穗受到低温胁迫后差异蛋白的研究较少。本研究以低温敏感和不敏感的两个小麦品种为供试材料,采用IEF/SDS-PAGE双向凝胶电泳技术,对常温及低温胁迫12 h和72 h的小麦幼穗全蛋白进行分离,利用质谱技术对差异表达蛋白进行分析和鉴定,旨在寻找小麦幼穗中与低温胁迫诱导相关的差异蛋白,从蛋白质组学水平研究小麦幼穗的抗寒机理,以期为小麦抗寒育种提供一定的理论依据。
1 材料与方法
1.1 试验材料与设计
试验材料为低温敏感品种SW601和低温不敏感品种陇麦157,均由河南农业大学小麦遗传育种研究室提供。
试验于2013-2014年在河南农业大学科教园区试验田进行。采用盆栽,盆直径24 cm,高20 cm,底部各打6个小孔,每盆装土10 kg左右,埋入土中,盆内土壤与大田持平。2013年10月10号播种,每个材料种植9盆,每盆定苗10株。2014年3月20日开始通过形态学观察和镜检判断幼穗的发育时期,幼穗发育至雌雄蕊分化期时,进行室内低温胁迫处理。
低温胁迫温度设为0 ℃,处理时间为12 h和72 h,每个处理3次重复,以常温条件下生长的幼穗材料为对照(CK);低温处理结束后,在冰上剥取小麦幼穗,并立即放入离心管中液氮速冻,-80 ℃冰箱保存待用。
1.2 试验方法
1.2.1 小麦幼穗蛋白质的提取
采用TCA/丙酮沉淀法[10]进行蛋白质提取。取-80 ℃冰箱保存的雌雄蕊分化期小麦幼穗1 g,加入少量的PVPP和石英砂,在研钵中迅速研磨成细粉,加入5 mL预冷的10%(w/v)的TCA和0.07% DTT的丙酮溶液,-20 ℃沉淀过夜;4 ℃, 16 000 r·min-1离心30 min,弃上清液,沉淀中加入2 mL预冷的80%丙酮(含0.07% DTT),充分混合后,放在-20 ℃静置过夜;4 ℃,16 000 r·min-1离心15 min,弃上清液,洗涤沉淀,重复洗涤2~3次至蛋白为纯白色;用纯丙酮替代80%丙酮洗涤,沉淀后真空冷冻干燥成干粉,向蛋白干粉中加入裂解液[8 mol·L-1urea,2 mol·L-1Thisoua, 4% CHAPS(w/v),40 mmol·L-1DTT],25 ℃水浴2 h,期间振荡数次,室温14 000 r·min-1离心40 min,取上清液保存于-80 ℃冰箱备用[11]。蛋白含量的测定参考Bradford法[12],用BSA(牛血清蛋白)标准品配制不同浓度蛋白溶液,绘制标准曲线。
1.2.2 幼穗全蛋白的双向凝胶电泳
第一向等电聚焦(IEF)电泳:按照Bio-rad公司的电泳操作指南进行,采用pH 4~7、24 cm的胶条,根据已测蛋白浓度,取900 μg蛋白样品和一定体积的缓冲液[8 mol·L-1urea,2 mol·L-1thisoua,4% CHAPS(w/v),40 mmol·L-1DTT、Bio-lyte pH 3~7]至总体积450 μL,在室温20 ℃泡胀IPG胶条,12~14 h后进行等电聚焦,设置聚焦程序为250 v/30 min、500 v/90 min、1 000 v/2 h、9 000 v/5 h、9 000 v/99 000 Vh、500 v/12 h,采用50 uA电流进行电泳。
第二向SDS-PAGE凝胶电泳:第一向等电聚焦电泳结束后,将胶条放在平衡液I[6 mol·L-1urea,2%(w/v)SDS,20%(v/v)甘油,1.5 mol·L-1Tris-HCl(pH 8.8),2%(w/v) DTT]中平衡15 min,平衡结束后润洗胶条2~3 min,再放入平衡液II[6 mol·L-1urea,2%(w/v)SDS,20%(v/v)甘油,1.5 mol·L-1Tris-HCl(pH 8.8),2.5%(w/v)碘乙酰胺]中平衡15 min,用镊子将平衡结束的胶条转移至12%的垂直SDS-PAGE凝胶中,加入少量低熔点琼脂糖固定胶条,凝固后20 ℃水浴电泳,待溴酚蓝指示剂达到底部边缘时停止电泳,进行凝胶的固定、染色和脱色。
1.2.3 图像扫描及差异蛋白点筛选
采用UMAX PowerLook 2100XL凝胶成像系统扫描图像,用PDQuest 7.3 software(Bio-Rad)软件对图像进行斑点检测、背景扣除、凝胶匹配和差异蛋白点的定量分析。电泳重复3次,从各处理中选取一张质量高的胶图进行PDQuest软件分析,以常温下SW601和陇麦157幼穗蛋白电泳图为对照(CK),利用PDQuest软件筛选低温胁迫后蛋白表达丰度变化在2倍以上的差异蛋白点。
1.2.4 质谱分析和数据库检索
将在2种低温处理下均差异表达且Ratio>2的蛋白点用修剪过的Eppdorf枪头挖出,置于盛有少量去离子水的1.5 mL离心管中,标记序号送往中国科学院上海生命科学研究所进行质谱分析,获得肽指纹图谱。检测仪器型号为5800 MALDI-TOF/TOF/质谱仪,检测方式为正离子反射模式。质谱鉴定结果利用MASCOT(http://www.matrixscience.com)网站的相关软件,在NCBI数据库中检索,获得差异蛋白的种类等相关信息。
1.2.5 差异蛋白质功能鉴定和分类
鉴定成功的蛋白质利用UniProt(http://www.ebi.uniprot.org)软件来确定其功能,利用COG(cluster of orthologous groups of proteins)功能分类软件进行功能分类。
2 结果与分析
2.1 低温胁迫下小麦幼穗差异表达蛋白分析
采用双向电泳技术对CK和低温胁迫12 h、72 h的小麦幼穗全蛋白进行分离(图1)。利用PDQuest software(Bio-Rad)软件对图像进行蛋白点匹配和检测,在CK和低温胁迫12 h、72 h的SW601和陇麦157的幼穗中均检测到800~900个有效蛋白质点。与CK对比发现,SW601和陇麦157中分别有41个和52个蛋白点在低温胁迫12 h和72 h后均呈差异表达,其中Ratio>2的蛋白点分别有23个和31个。利用MALDA-TOF-MS技术对Ratio>2的蛋白点进行质谱分析和蛋白质鉴定,在SW601和陇麦157中分别成功鉴定出18个和25个蛋白点(表1和表2)。
从表1可以看出,低温胁迫处理后,陇麦157中上调表达的蛋白点为抗坏血酸过氧化物酶(点17、18)、Cu/Zn超氧化物歧化酶(点19)、胚胎后期发育富集同源蛋白14-A(点13、14)、T-complex蛋白1γ亚基(点1)、T-complex蛋白1亚基(点4)、1,6-二磷酸果糖转移酶β亚基(点2)、5-同型半胱氨酸甲基转移酶(点3)、40S核糖体蛋白(点15)、烯醇化酶(点5)、 2,3-二磷酸甘油酸不依赖甘油酸变位酶(点6)、蛋白酶β亚基type-7-A(点22)和细胞周期依赖性蛋白激酶(点23)。表达量下调的蛋白点为真核转运起始因子4A-1(点7)、蛋白质二硫键异构酶TaPDIL1-1(点9)、放氧增强蛋白(点16)、β-微管蛋白5、1、3(点10、11、12)、Rubisco大亚基(点24)、核酮糖-1,5-二磷酸羧化酶/加氧酶大亚基(点25)和磷酸丙糖异构酶(点20、21)。
从表2可以看出,低温胁迫后,SW601中上调表达的蛋白点为谷胱甘肽S-转移酶(点33)、冷休克主导蛋白2(点30)、α-1,4-葡聚糖蛋白合酶(点38)、3-磷酸甘油醛脱氢酶(点39)和14-3-3蛋白(点32)。表达量下调的蛋白点为40S核糖体蛋白(点26)、亚精胺合酶1(点27)、真核转运起始因子3亚基(点28)、核酮糖二磷酸羧化酶α亚基结合蛋白(点29)、核酮糖二磷酸羧化酶β亚基结合蛋白(点31)、70 kDa热激同源蛋白1(点43)、烯醇化酶(点34、35)、胞质3-磷酸甘油酸激酶(点36)、异柠檬酸脱氢酶(点41)和ATP合成酶CF1α亚基(点42)。
陇麦157中的蛋白点17和18(抗坏血酸过氧化物酶)、13和14(胚胎后期发育富集同源蛋白)以及SW601中的蛋白点34和35(烯醇化酶),这些蛋白点虽然在同一块凝胶的不同位置,但却具有相同的分子量(Mr)和PI值,质谱鉴定结果显示为同一种蛋白质。
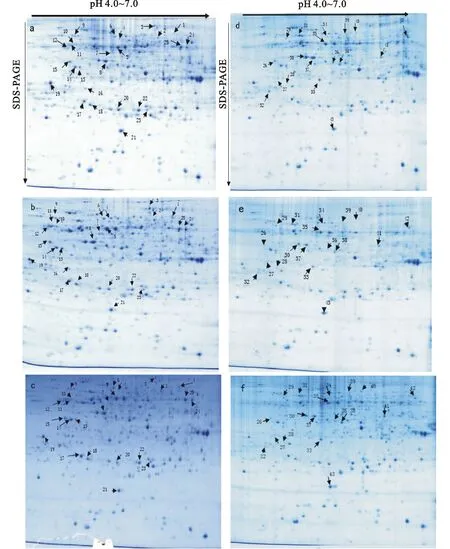
a、b、c分别代表CK和低温胁迫12 h、72 h的陇麦157幼穗2-DE图谱;d、e、f 分别代表CK和低温胁迫12 h、72 h的SW601幼穗2-DE图谱。
a, b, c represent the 2-DE map of Longmai 157 spike with low temperature for 0 h, 12 h and 72 h,respectively; d, e, f represent the 2-DE map of SW601 spike with low temperature for 0 h, 12 h and 72 h,respectively.

图1 低温胁迫下陇麦157和SW601幼穗蛋白质双向凝胶电泳图谱

表2 低温胁迫下SW601幼穗差异蛋白点质谱分析结果
2.2 不同小麦品种幼穗差异表达蛋白的功能分析
低温胁迫后,40S核糖体蛋白、烯醇化酶和真核转运起始因子蛋白在2个小麦材料中(陇麦157 中蛋白点15、5、7,SW601中蛋白点26、34、35、28)均出现差异表达。抗坏血酸过氧化物酶(蛋白点17和18)、Cu/Zn超氧化物歧化酶(蛋白点19)和胚胎后期发育富集同源蛋白(蛋白点13和14)等胁迫应激蛋白在陇麦157中的表达量发生了明显变化,而在SW601中的CK和低温处理图谱中均没检测到这些蛋白质。冷休克主导蛋白2(蛋白点30)、70 kDa热激同源蛋白1(蛋白点43)和谷胱甘肽S-转移酶(蛋白点33)在SW601中发生了差异表达,而在陇麦157中则没有检测到(表1和表2)。
从差异表达蛋白的功能分类来看,低温敏感材料SW601和低温不敏感材料陇麦157 在蛋白种类和数量上均存在一定的差异。SW601中18个差异表达蛋白点的功能可以分为7类,其中碳水化合物代谢相关蛋白所占例最大(33.3%),陇麦157中25个差异表达蛋白点的功能可以分为6类,蛋白质代谢相关蛋白所占比例最大(40%)。低温胁迫后SW601中存在1个能量产生和运输蛋白和2个光合作用相关蛋白,而陇麦157中不存在能量产生和运输蛋白,但增加了1个光合作用相关蛋白(3个)。
3 讨 论
低温胁迫下,植物的形态结构、生理生化代谢以及与胁迫相关蛋白质的表达均会发生变化,且植物抗寒能力高低与胁迫响应相关蛋白的合成和表达有直接关系。研究表明,参与蛋白合成、蛋白折叠和细胞壁合成有关的蛋白与水稻叶片对低温的耐受性密切相关[5],蛋白表达量的变化与小麦自身耐冷性强弱有直接的关系[13]。
3.1 参与胁迫应激或防御的蛋白
低温逆境下抗坏血酸过氧化物酶、Cu/Zn超氧化物歧化酶的过量表达可有效清除环境胁迫下植物体内产生的ROS,提高植物抗逆性[14-15],LEA蛋白在低温条件下具有保护细胞膜及维持蛋白质结构稳定性的作用[16]。本研究结果表明,低温处理后,抗坏血酸过氧化物酶、Cu/Zn超氧化物歧化酶和胚胎后期发育富集同源蛋白14-A在低温不敏感材料陇麦157的幼穗中均上调表达,而在低温敏感材料SW601幼穗中没有表达。推测陇麦157中抗坏血酸过氧化物酶、Cu/Zn超氧化物歧化酶参与了低温胁迫下氧化应激反应,在清除H2O2和ROS中发挥了一定作用。
在低温敏感材料SW601中鉴定出了热激同源蛋白、冷休克主导蛋白2和谷胱甘肽S-转移酶。热激蛋白主要在动物疾病和寄生虫中研究较多[17],具有分子伴侣的功能,逆境胁迫下可形成具有一定空间结构的蛋白质,增强细胞对逆境胁迫的耐受性[18-19]。低温胁迫可诱导植物中热激蛋白(HSP70)的蛋白质合成。本研究中,低温胁迫后敏感材料SW601中70 kD热激同源蛋白下调表达,这可能与低温敏感材料SW601中的热激蛋白在低温胁迫下蛋白质合成受到抑制有关。
3.2 参与光合作用的相关蛋白
光合作用对低温最为敏感,低温逆境下植物叶绿体光化学结构遭到破坏,光合速率下降,CO2的利用受阻, 同时可使光合系统中多种酶的活性受到抑制,从而影响光合作用过程中一系列电子传递系统[20-21],最终导致核酮糖二磷酸羧化酶(Rubisco)发生降解[22]。本研究中,陇麦157中鉴定出3个参与卡尔文循环的蛋白,分别为Rubisco 大亚基、核酮糖-1,5-二磷酸羧化酶/加氧酶大亚基和放氧增强蛋白;而SW601中仅鉴定出2个,即核酮糖二磷酸羧化酶亚基结合蛋白的α、β亚基。其中,Rubisco大亚基、Rubisco α、β亚基结合蛋白的亚基等都是光合作用过程中影响CO2固定的关键酶[23]。Santos等[24]通过对6 ℃低温处理6 h、24 h的水稻叶片差异表达蛋白的研究发现,Rubisco大亚基和Rubisco亚基结合蛋白大亚基的表达都下调,且降解加速。在本研究中,陇麦157和SW601中的5个光合作用相关蛋白在低温胁迫12 h和72 h后均下调表达,这与Santos的研究结果基本一致,表明低温胁迫下植物光合系统受到了破坏。
3.3 碳水化合物代谢相关蛋白
碳水化合物代谢主要控制糖的代谢、转化及分配,磷酸丙糖异构酶是糖代谢过程的关键酶,在糖酵解途径中发挥重要作用。研究表明,小麦在长期低温驯化过程中磷酸丙糖异构酶会增加[25]。低温胁迫下,烯醇化酶、2,3-二磷酸甘油酸不依赖磷酸甘油酸变位酶和磷酸丙糖异构酶等参与糖酵解途径的蛋白,在低温不敏感材料陇麦157中上调表达;而烯醇化酶、胞质3-磷酸甘油酸激酶和D-3-磷酸甘油醛脱氢酶则在低温敏感材料SW601中下调表达。在糖酵解过程中,磷酸丙糖异构酶可将二羟丙酮磷酸转变为甘油醛-3-磷酸,只有甘油醛-3-磷酸才可继续进入糖酵解途径。然而,SW601中没有出现磷酸丙糖异构酶,可能与低温胁迫下其表达量太低或其表达受到抑制有关,这将使SW601糖酵解途径中糖代谢及能量产生和运输无法顺利进行,从而导致SW601糖代谢途径相关蛋白酶的表达量下调,最终影响植物生长发育,使其抗性减弱。
3.4 蛋白代谢相关蛋白
蛋白质二硫键在二硫键及氨基酸支链的结合与形成方面发挥着重要作用[26]。低温胁迫对植物核糖体蛋白的合成具有较大影响,在大豆中发现3个受低温胁迫诱导的核糖体蛋白[27]。低温胁迫下,40S核糖体蛋白SA在陇麦157幼穗中呈上调表达,而在SW601中则呈下调表达,这可能与参与蛋白质翻译的核糖体蛋白在对低温敏感度不同材料中的表达模式有关,上调表达可能有利于提高小麦幼穗抗低温的能力。二硫键异构酶在陇麦157中下调表达,在SW601中没有表达,这与Yan等[28]的研究结果基本相似。
3.5 能量运输与信号转导蛋白
ATP合酶是一种膜结合转运蛋白,在叶绿体和线粒体能量转换中可以催化ATP的合成和水解,进行跨膜质子运输,同时缓解植物胁迫伤害[29]。信号转导途径中,14-3-3蛋白和某些蛋白激酶可以作为信号转导中介,通过不同的关键转录因子协调逆境胁迫下细胞的正常代谢和响应[30]。
低温胁迫处理后,SW601中的ATP合酶CF1α亚基表达下调,这可能与逆境胁迫下植物原生质结构遭到破坏,ATP的合成以及光合作用受到抑制有关。SW601中的14-3-3 蛋白和陇麦157中细胞周期依赖性蛋白激酶的表达丰度都有所增加,推测低温胁迫下它们在信号转导过程中通过调控耐冷相关基因表达而提高植物抗逆性方面发挥了一定作用。
[1]潘瑞炽,董愚得.植物生理学[M].北京:高等教育出版社,1995:322.
PAN R Z,DONG Y D.Plant Physiology [M].Beijing:Higher Education Press,1995:322.
[2]安飞飞,李庚虎,陈 霆,等.植物耐寒生理及蛋白质组学研究进展[J].中国农学通报,2015,31(14):96.
AN F F,LI G H,CHENG T,etal.Research progress on physiology and proteomics for cold tolerance in plants [J].ChineseAgriculturalScienceBulletin,2015,31(14):96.
[3]KOO B C,PARK M W,LEE C W,etal.Classification for types of damages caused by cold stress at different young spike development stages of barley and wheat [J].KoreanJournalofCropScience,2003,48(3):252.
[4]CUI S X,HUANG F,WANG J,etal.A proteomic analysis of cold stress response in rice seedlings [J].Proteomics,2005,12(5):3162.
[5]HAN Q X,KANG G Z,GUO T C.Proteomic analysis of spring freeze-stress responsive proteins in leaves of bread wheat(TritiumaestivumL.) [J].PlantPhysiologyandBiochemistry,2013,63:236.
[6]CABANE M,CALVET P,VINCENS P,etal.Characterization of chilling-acclimation related protein sin soybean and identification of one as a member of the heat shock protein(HSP70) family [J].Planta,1993,190(3):346.
[7]王 巍,魏力军,王俊敏,等.空间诱变水稻多蘖矮突变体不同分蘖期蛋白质组研究[J].核农学报,2011,25(3):405.
WANG W,WEI L J,WANG J M,etal.Comparative proteomic analysis of a high-tillering dwarf mutant induced by spaceflight at different tillering stages [J].JournalofNuclearAgricultureSciences,2011,25(3):405.
[8]阮松林,马华升,王世恒,等.植物蛋白质组学研究进展Ⅱ.蛋白质组技术在植物生物学研究中的应用[J].遗传,2006,28(12):1633.
RUAN S L,MA H S,WANG S H,etal.Advances in plant proteomicsⅡ.Application of proteomics techniques to plant biology research in research of plant biology [J].Hereditas,2006,28(12):1633.
[9]程思思,乙 引,张习敏,等.双向电泳技术在植物应答非生物胁迫蛋白质组学研究中的应用[J].安徽农业科学报,2010,38(3):1135.
CHENG S S,YI Y,ZHANG X M,etal.Application of two-dimensional electrophoresis technology in plant resistance to abiotic stress proteomical research [J].JournalofAnhuiAgriculturalSciences,2010,38(3):1135.
[10]陈蕊红,张改生,刘 卫,等.小麦花药蛋白质组双向电泳技术体系的优化[J].核农学报,2008,22(4):404.
CHENG R H,ZHANG G S,LIU W,etal.Optimization of two-dimensional gel electrophoresis for Proteome from wheat anthers [J].JournalofNuclearAgricultureSciences,2008,22(4):404.
[11]LI G Z,PENG Q X,GUO T C,etal.Proteomic analysis of leaves and roots of common wheat(TriticumaestivumL.) under copper-stress conditions [J].JournalofProteomeResearch,2013,12(11):4846.
[12]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principal of protein-dye binding [J].AnalyticalBiochemistry,1976,72:248.
[13]DANYLUK J,RASSART E,SARHAN F.Gene expression during cold and heat shock in wheat [J].BiochemistryCellBiology,1991,69(5-6):383.
[14]李泽琴,李静晓,张根发.植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J].遗传,2013,35(1):45.
LI Z Q,LI J X,ZHANG G F.Expression regulation of plant ascorbate peroxidase and its tolerance to abiotic stresses [J].Hereditas,2013,35(1):45.
[15]GEPSTEIN S,GLICK B R.Strategies to ameliorate abiotic stress induced plant senescence [J].PlantmolecularBiology,2013,82(6):623.
[16]张林生,赵文明.LEA蛋白与植物的抗旱性[J].植物生理学通讯,2003,39(1):61.
ZHANG L S,ZHAO W M.LEA protein functions tolerance drought of the plants [J].PlantPhysiologyCommunicatio,2003,39(1):61.
[17]练冬梅,王会芳,陈绵才.植物寄生线虫Hsp70研究进展[J].基因组学与应用生物学,2013,32(6):820.
LIAN D M,WANG H F,CHEN M C.Research progress on Hsp70 in plant parasiticNematodes[J].GenomicsandAppliedBiology,2013,32(6):820.
[18]WATERS E R,LEE G J,VIERLING E.Evolution,structure and function of the small heat shock proteins in plants [J].JournalofExperimentalBotany,1996,47(3):325.
[19]BALLINGER D G,PARDUE M L.The control of protein synthesis during heat-shock in drosophila cells involves altered polypeptide elongation rates [J].Cell,1983,33(1):103.
[20]ALLEN D J,ORT D R.Impacts of chilling temperatures on photosynthesis in warm-climate plants [J].TrendsinPlantScience,2001,6(1):36.
[21]OQUIST G,HUNER N P A.Photosynthesis of overwintering evergreen plants [J].AnnualReviewofPlantBiology,2003,54(1):329.
[22]姜籽竹,朱恒光,张 倩,等.低温胁迫下植物光合作用的研究进展[J].作物杂志,2015(3):23.
JIANG Z Z,ZHU H G,ZHANG Q,etal.Progress of influence of low temperature on plant photosynthesis [J].Crops,2015(3):23.
[23]孙 勇,王 丹,仝 征,等.香蕉幼苗叶片响应低温胁迫的比较蛋白质组学研究[J].中国农学通报,2015,31(34):216.
SUN Y,WANG D,TONG Z,etal.Proteomic analysis of banana seedling leaf response to low temperature [J].ChineseAgriculturalScienceBulletin,2015,31(34):216.
[24]SANTOS E,REMY S,THIRY E,etal.Characterization and isolation of a T-DNA tagged banana promoter active during in vitro culture and low temperature stress [J].BMCPlantBiology,2009,9(1):77.
[26]HOUSTON N L,FAN C Z ,XIANG QY ,etal.Phylogenetic analyses identify 10 classes of the protein disulfide isomerase family in plants,including single-domain protein disulfide isomerase-related proteins [J].PlantPhysiology,2005,137(2):762.
[27]KIM K Y,PARK S W,CHUNG Y S,etal.Molecular cloning of low-temperature-inducible ribosomal proteins from soybean [J].JournalofExperimentalBotany,2004,55(399):1153.
[28]YAN S P,ZHANG Q Y,TANG Z C,etal.Comparative proteomic analysis provides new insights into chilling stress responses in rice [J].MolecularCellProteomics,2006,5:484.
[29]CHIVASA S,HAMILTON J M,SLABAS A R,etal.Proteomic analysis of extracellular ATP-regulated proteins identifies ATP synthase β-subunit as a novel plant cell death regulator [J].Molecular&CelularlProteomics,2010,10:1.
[30]WANG C,MA Q H,LIN Z B,etal.Cloning and characterization of a cDNA encoding 14-3-3 protein with leaf and stem specific expression from wheat [J].DNASequence,2008,19(2):130.
Identification and Analysis of Differentially Expressed Proteins in Wheat Young Spike under Cold Stress
CHENG Xiyong, HU Xiaoxian, LI Haixia, DONG Zhongdong,REN Yan, CHEN Shulin, ZHAN Kehui, XU Haixia
(Henan Agricultural University/National Key Laboratory of Wheat and Maize Crop Science/Collaborative Innovation Center of Henan Grain Crops, Zhengzhou, Henan 450002, China)
In order to study the proteins responsing to low temperature(LT) in wheat(TriticumaestivumL.) spike, two varieties SW601(LT sensitive ) and Longmai 157(LT insensitive) were used to analyze the total protein profile under low temperature at 0 ℃ for 12 h and 72 h by two-dimensional electrophoresis and matrix-assisted laser desorption/ionisation time-of-flight mass spectrometry method,the spike under normal growth temperature conditions was control. The results show that there are 800 to 900 protein spots for each variety within pH 4 to 7. After 12 h and 72 h low temperature stress treatment,120 up-regulated and 92 down-regulated protein spots were found in SW601, while 101 up-regulated and 60 down-regulated protein spots were detected in Longmai 157. Fifty-four proteins spots which were significantly expressed with the expression ratio more than 2 under two temperature stress conditions were selected. There were 43 protein spots identified by mass spectrometry analysis.Using protein blast methods, the identified cold stress responsive proteins were classified into seven groups including stress/defense, photosynthesis, protein metabolism, carbohydrate metabolism, signal transduction, energy pathways and other unknown function. Some of the expressed proteins were enhanced significantly in LT insensitive varieties Longmai 157,such as ascorbate peroxidase,Cu/Zn superoxide dismutase,and late embryogenesis abundant,while they were not expressed in LT sensitive SW601.These protein may related to metabolic regulation or response characteristics of wheat spike under low temperature stress.
Wheat; Young spike; Low-temperature stress; Two-dimensional electrophoresis; Stress response protein
时间:2016-10-08
2016-03-12
2016-04-14
国家重点基础研究发展计划(973计划)项目(2014CB138105);河南省教育厅重点项目(15A180039)
E-mail:xyc634@163.com
许海霞(E-mail:hauxhx@163.com)
S512.1;S330
A
1009-1041(2016)10-1342-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161008.0932.018.html

