ERCC1、XPD、XPC单核苷酸多态性与局部晚期宫颈癌新辅助化疗敏感性的相关性
祁丽芳,吕杰强,朱雪琼,夏露,黄秋穗,屈王蕾,陈文兵
(温州医科大学附属第二医院育英儿童医院 妇产科,浙江 温州 325027)
ERCC1、XPD、XPC单核苷酸多态性与局部晚期宫颈癌新辅助化疗敏感性的相关性
祁丽芳,吕杰强,朱雪琼,夏露,黄秋穗,屈王蕾,陈文兵
(温州医科大学附属第二医院育英儿童医院 妇产科,浙江 温州 325027)
目的:探讨DNA修复切除修复交叉互补基因1(ERCC1)、人类着色性干皮病D组基因(XPD)、人类着色性干皮病C组基因(XPC)基因多态性与局部晚期宫颈癌(LACC)铂类为基础的新辅助化疗(NACT)敏感性的关系。方法:经病理学确诊的LACC患者114例,所有病例化疗前抽取静脉血并提取DNA,采用聚合酶链式反应-限制性片段长度多态性分析(PCR-RFLP)技术检测单核苷酸多态性(SNPs),比较不同基因型与NACT疗效的关系。结果:携带ERCC1 Asn118Asn C/T基因型的化疗敏感率高于C/C基因型,差异有统计学意义(P<0.05),携带C/T基因型化疗敏感性比C/C基因型增加4.48倍(OR=4.480;95%CI=1.436~13.976)。携带XPD Lys751Gln A/A基因型化疗敏感性高于A/C基因型,但差异无统计学意义(P>0.05)。XPC Lys939Gln基因型与化疗敏感性差异无统计学意义(P>0.05)。结论:ERCC1 Asn118Asn多态性可以预测以铂类为基础的LACC患者化疗疗效。
局部晚期宫颈癌;新辅助化疗;单核苷酸多态性
局部晚期宫颈癌(locally advanced cervical cancer,LACC)是一组具有不良预后因素的高危宫颈癌,广义包括宫颈癌Ib~IVa期,狭义指局部肿瘤直径≥4 cm的早期巨块型宫颈癌。此类宫颈癌单纯行手术或放疗不易控制,术后容易发生转移,治疗的失败率更高、生存率更低[1-2]。而宫颈癌是妇女最常见的恶性肿瘤之一,病死率在女性癌症病死率中排行第二,是威胁妇女健康与生命的严重疾病。新辅助化疗(neoadjuvant chemotherapy,NACT)的临床疗效已被多数学者所肯定,故LACC患者在NACT后实行宫颈癌根治术+盆腔淋巴清扫术,是目前比较推荐的治疗方案[3]。
宫颈癌化疗是以铂类药物为主的联合化疗,由于肿瘤耐药性的存在,使患者非但没有取得预期疗效,反而遭受化疗不良反应。研究[4]表明,这种耐药性和DNA修复基因的表达和单核苷酸多态性(single nucleotide polymorphisms,SNPs)存在相关性。核苷酸切除修复系统(nucleotide excision repair,NER)是人类DNA损伤修复系统的重要组成部分,在NER途径中,与铂类药物抵抗有关的关键因子有切除修复交叉互补基因1(excision repair cross-complementing group 1,ERCC1)、人类着色性干皮病D组基因(xeroderma pigmentary group D,XPD)、人类着色性干皮病C组基因(xeroderma pigmentosum group C,XPC)等。这3种基因的多态性往往影响内在顺铂(cisplatin,DDP)的敏感性,铂类药物引起的DNA损伤修复主要由这个系统完 成[5-6]。目前ERCC1、XPD、XPC基因多态性与铂类化疗的相关研究主要集中在肺癌、食管癌、卵巢癌、头颈部及胃肠道肿瘤方面,关于LACC DNA修复基因的SNP与铂类化疗的相关研究报道甚少,本研究将探讨ERCC1、XPD和XPC基因多态性与铂类为基础的NACT敏感性的关系,希望在化疗前预测化疗疗效,制定最佳治疗方案,减少患者痛苦。
1 资料和方法
1.1 一般资料 选择2009年1月至2013年1月在我院初次治疗并经宫颈活组织检查确诊为宫颈癌的患者114例,经盆腔磁共振及阴道B超证实存在可测量病灶,并符合以下条件者纳入本研究:①国际妇产科联盟(Federation of International Gynecology Obstetrics,FIGO)临床分期为Ib~I I Ia期且肿瘤直径≥4 cm的巨块型宫颈癌;②无化疗禁忌证;③患者及家属知情同意;④无重要脏器功能损害。临床分期采用2009年的FIGO分期标准。患者年龄为25~63岁,中位年龄为44岁。其中,鳞癌102例,腺癌12例。FIGO临床分期Ib期54例,I Ia期42例,I Ib期12例,I I Ia期6例。本研究经我院伦理委员会批准,治疗前患者签署知情同意书。
1.2 化疗方案 所有患者均接受以DDP为基础的联 合化疗,均经双侧子宫动脉介入性化疗。化疗前血常 规、肝肾功能、血电解质及心电图均正常。化疗方案为DDP+博来霉素(bleomycin,BLM)+5-氟尿嘧啶(5-fluorouracil,5-Fu),化疗剂量:DDP为70 mg/m2, BLM为30 mg/d,5-Fu为15 mg/kg。化疗疗程为1~2个,其中1个疗程的为102例,2个疗程的为12例,所有患者化疗后进行水化,计算24 h尿量。
1.3 化疗疗效评价及分组 所有患者完成1~2个 周期的化疗后,根据末次疗程进行评价。对于可测量实体瘤按照1979年WHO抗瘤药物客观疗效标准(response evaluation criteria in solid tumors,RECIST)进行评价,完全缓解(CR):全部可测量病灶完全消失持续4周;部分缓解(PR):病灶的最大直径与最大垂直横径乘积总和减小≥50%,持续至少4周;稳定(SD):各病灶最大直径与最大垂直横径乘积总和减小<50%,或增大<25%,持续至少4周且无新病灶出现;进展(PD):病灶的最大直径与最大垂直横径乘积总和增大≥25%,或出现新的病灶。以CR和PR归为敏感病例计算敏感率。以SD和PD归为化疗不敏感组。
化疗后2周进行评估,所有疗效判定及分期均由2名或2名以上从事妇科肿瘤专业的高年资医师共同判定。化疗前后肿瘤病灶的大小主要依靠妇科检查以及影像学检查来确定,若局部肿瘤未缩小或增大,追加1个疗程,待第2疗程化疗结束后再次评估。若NACT无效,分期较晚,建议行放射治疗;若NACT有效,行根治性子宫切除术+盆腔淋巴结清扫术,年轻者保留一侧或两侧卵巢。
1.4 基因型分析检测 所有患者在化疗前抽取静脉血2 mL,放入EDTA抗凝管于-70 ℃冰箱中保存,使用时在37 ℃水浴箱解冻。采用天根生物试剂公司的DNA提取试剂盒提取基因组DNA,以基因组DNA为模板进行PCR反应。所有引物序列由上海捷瑞生物工程有限公司合成,ERCC1 code 118:上游引物为5′-CGGGGACCCTTTAGGAAAG-3′,下游引物为5′-GGCTTCTCATAGAACAGTCC-3′;XPC code 939:上游引物为5′-GGAGGTGGACTCTCTTCTGATG-3′,下游引物为5′-TAGATCCCAGCAGATGACC-3′;XPD code 751:上游引物为5′-CCCCCTCTCCCTTTCCTCTGTTC-3′,下游引物为5′-GGACCTGAGCCCCCACTAACG-3′。PCR反应体系共 25 μL:2×Taq MasterMix 12.5 μL,DNA模板2 μL, ddH2O 8.5 μL,上下游引物各1 μL。PCR循环参数分别为:ERCC1 Asn118Asn:94℃预变性3 min,94 ℃ 30 s,62 ℃ 36 s,72 ℃ 50 s,共40个循环,72 ℃ 延伸5 min;XPD Lys751Gln:95 ℃预变性10 min,94 ℃ 1 min,63 ℃ 1 min,72 ℃ 1 min,共31个循环,72 ℃延伸5 min;XPC Lys939Gln:95 ℃预变 性5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共 35个循环,72 ℃延伸5 min。取10 μL PCR产物(含 ERCC1 Asn118Asn、XPD Lys751Gln、XPC Lys939Gln) 分别与限制性核酸内切酶(PvuI I、PstI、BsrDI,Fermentas生物试剂公司)1 μL、ddH2O 7 μL、10× Buffer G 2 μL,37 ℃消化16 h,产物4 ℃冰箱保存。
吸取10μL酶切产物进行3%琼脂糖凝胶电泳鉴定,以100 bp DNA Marker为参照。分型的基本依据为:①突变纯合子型:因2个碱基无突变,均有酶切位点,形成2条条带。②野生纯合子型:因2个碱基发生突变,没有酶切位点,只有最长片段,在电泳图上只有1条条带。③杂合子型:1个碱基发生突变,没有酶切位点,形成最长片段;另1个碱基未发生突变,有酶切位点,形成2个小片段,最终在电泳图上形成3个条带。
1.5 统计学处理方法 采用SPSS16.0统计学软件进行数据分析。计算各种基因型的频率,确定是否符合Hardy-Weinberg平衡,率的比较采用x2检验或Fisher精确概率法,以比值比(OR)及95%可信区间(CI)表示各种基因型与宫颈癌患者铂类药物化疗敏感性的关联强度,OR值及其95%CI以非条件logistic 模型计算。所有的统计检验均为双侧概率检验。P< 0.05为差异有统计学意义。
2 结果
2.1 酶切结果
2.1.1 ERCC1 Asn118Asn基因型:分为C/C、C/T和 T/T 3种类型;C/C基因型没有酶切位点,只有474 bp 1个片段;C/T基因型产生474 bp、311 bp和163 bp 3个片段;T/T基因型有311 bp和163 bp 2个片段(本实验未发现该基因型)。见图1。
2.1.2 XPD Lys751Gln基因型:分为A/A、A/C、C/C 3种类型;A/A基因型没有酶切位点,只有413 bp 1个片段;A/C基因型产生413 bp、322 bp和91 bp 3个片段;C/C基因型有322 bp和91 bp 2个片段(本实验未发现该基因型)。见图2。
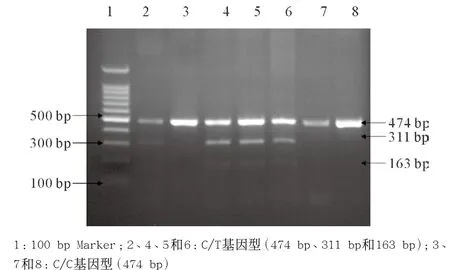
图1 ERCC1 Asn118Asn基因型电泳图

图2 XPD Lys751Gln基因型电泳图
2.1.3 XPC Lys939Gln基因型:分为A/A、A/C和C/C 3种类型;A/A基因型没有酶切位点,只有1个765 bp 片段;A/C基因型产生765 bp、582 bp和183 bp 3个片段;C/C基因型有582 bp和183 bp 2个片段。见图3。
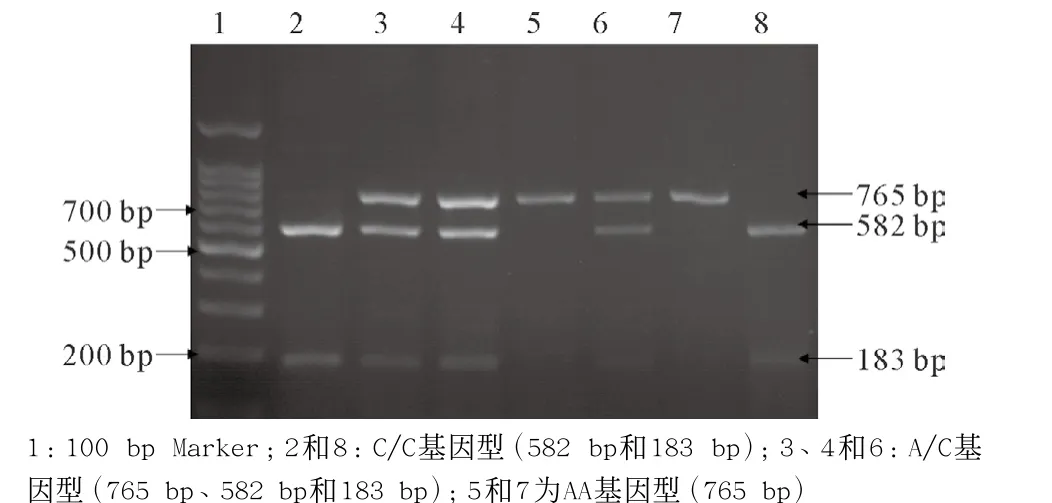
图3 XPC Lys939Gln基因型电泳图
2.2 疗效分析 114例LACC患者中,CR为26.3%(30/ 114),PR为42.1%(48/114),SD为30.7%(35/114),PD为0.87%(1/114),总敏感率为68.4%(78/114)。患者基本资料见表1。经检验,腺癌的化疗敏感性高于鳞癌,差异有统计学意义(P<0.05),化疗敏感组和不敏感组患者的年龄以及临床分期差异无统计学意义(P>0.05)。

表1 患者基本资料(例)
2.3 基因分型 114例LACC患者中,ERCCl基因Asn118Asn的C/C和C/T基因型的频率分别为52.6%和47.4%,未检测到该位点的突变纯合基因型;XPD基因Lys751Gln的A/A和A/C基因型的频率分别为89.5%和10.5%,未检测到该位点的突变纯合基因型;XPC基因Lys939Gln的A/A、A/C和C/C基因型的频率分别为26.3%、26.3%和47.4%。结果显示,ERCC1、XPD和XPC的基因型分布均符合Hardy-Weinberg平衡(分别为x2=3.05,P>0.05;x2=0.60,P>0.05;x2=3.33,P>0.05),表明该组病例具有群体代表性。2.4 基因型与化疗敏感性的关系 ERCC1 Asn118Asn 基因多态性C/C和C/T的化疗敏感率分别为61.0%和88.5%,C/T基因型化疗敏感性高于C/C基因型,差异有统计学意义(P<0.05)。携带ERCC1第118位密码子C/T基因型的LACC患者化疗敏感性高于C/C基因型患者4.48倍(OR=4.480,95%CI:1.436~13.976;校正年龄、临床分期及病理类型后OR=8.466,95%CI: 2.084~34.392)。见表2。

表2 LACC化疗敏感性与基因型的关系
XPD Lys751Gln基因多态性A/A和A/C的化疗敏感率分别为70.5%和50.0%,A/A基因型化疗敏感性高于A/C基因型,但差异无统计学意义(P>0.05)。携带XPD A/A基因型与A/C基因型的LACC患者对铂类药物化疗敏感性差异无统计学意义(OR=2.400,95%CI:0.716~8.041)。见表2。
XPC Lys939Gln基因多态性A/A和A/C+C/C基因型化疗敏感率分别为66.7%和69.1%,两者差异无统计学意义(P>0.05)。携带XPC Lys939Gln A/A基因型与携带至少1个C等位基因(A/C和C/C)的LACC患者对铂类药物化疗敏感性差异无统计学意义(OR= 0.897,95%CI:0.369~2.18)。见表2。
3 讨论
近几年发现宫颈癌渐趋年轻化,中青年宫颈癌患者更多地考虑治疗后的生活质量。LACC患者采用放疗会导致卵巢功能的永久破坏及阴道上皮角化,严重影响正常性生活。NACT后(以铂类药物为主)行手术治疗,能提高宫颈癌患者的手术率和治愈率,以及术后的生活质量。本研究NACT总敏感率为68.4%,Takekida等[7]研究发现:宫颈鳞癌和腺癌化疗有效率分别为69.7%和68.9%,与本研究NACT敏感率相近。目前较多学者认为宫颈鳞癌静脉化疗敏感性高于腺癌[8],而本研究发现腺癌NACT敏感性高于鳞癌,且差异有统计学意义。与既往研究结果存在差异可能与给药途径有关,本研究经双侧子宫动脉化疗,单次给药,局部药物浓度高亦可能提高腺癌化疗敏感性。故病理类型和化疗敏感性的关系尚需进一步研究证实。
铂类药物的作用机制主要是与DNA上的鸟嘌呤、腺嘌呤和胞嘧啶结合形成Pt-DNA加合物,导致DNA的链间交联或链内交联,抑制DNA复制,从而抑制瘤细胞分裂,导致肿瘤细胞的凋亡[9],故清除Pt-DNA加合物则引起临床铂类药物抵抗。有研究[10]已经证明肿瘤组织低水平的DNA损伤修复可以减少铂类和DNA加合物的切除,增加化疗敏感性,可能是改善铂类化疗生存的预后因素之一,而这种化疗差异(耐药)和DNA修复基因的SNPs存在相关性。
ERCC1是第一个克隆而得的人类DNA损伤修复基因[11]。ERCC1 codon118是一种保守的同义核苷酸突变(AAC-AAT),两者皆编码天冬酰胺(Asn),但基因多态性导致基因转录变化。本研究发现ERCC1第118位密码子C/C和C/T 2种基因型,携带C/T基因型的LACC患者化疗敏感率较C/C基因型增加4倍,差异有统计学意义,表明ERCC1 codon118基因型与化疗敏感性有相关性,其基因型变异可提高化疗敏感性。Kang等[12]发现:携C/T和T/T基因型的卵巢癌患者铂类化疗敏感性高于C/C型。Yu等[13]发现ERCC基因型与食管癌化疗疗效相关,携带C/T基因型与C/C、T/T基因型相比,能显著延长总生存时间。张胜利[14]指出ERCC1基因SNPs与晚期非小细胞肺癌(non-small-cell lung cancer,NSCLC)含铂类化疗疗效有关,T等位基因(T/T+C/T)较C等位基因(C/ C)型患者对化疗敏感。Ren等[15]研究:携带ERCC1 condon118 C/T或T/T基因型的NSCLC患者接受铂类化疗后的平均生存时间为18个月,而C/C为13.8个月,差异有统计学意义。Chen等[16]也在神经胶质瘤ERCC1多态性研究中发现118 T/T基因型比C/C基因型的中位生存时间要长(HR=0.67,95%CI:0.35~0.96)。以上均表明ERCC1 Asn118Asn C到T的多态与化疗疗效有相关性,可以提高化疗敏感性,延长生存时间,改善预后,ERCC1基因多态性可能可以作为降低铂类化疗耐药的预测因子。本研究结果与上述学者相似,故推测ERCC1 Asn118Asn基因多态性可能可以作为预测宫颈癌患者铂类化疗疗效的指标。本研究未发现ERCC1 Asn118Asn T/T基因型,考虑可能系样本量偏少所致,有必要在扩大样本量的基础上继续研究。
XPD是DNA解旋酶,在DNA修复过程中可通过NER途径中去除各种因素导致的DNA损伤。有研究[17]证实,XPD基因751密码子A→C多态导致的Lys751→ Gln751氨基酸替代,与个体DNA修复能力差异密切相关,影响肿瘤对抗癌药物(铂类药物)的敏感性。本研究发现XPD基因751密码子A/A和A/C化疗敏感率分别为70.5%和50.0%,A/A基因型化疗敏感性高于 A/C基因型,但差异无统计学意义,未发现XPD基因多态性与化疗敏感性的相关性。Wu等[18]在NSCLC中未发现XPD751基因多态性与化疗疗效、总生存率及无进展生存率有相关性。一项系统回顾和荟萃分析也显示,XPD751基因多态性在铂类为基础的NSCLC化疗中,与化疗疗效及生存时间无相关性[19],与本研究结果相同。但Li等[20]和Bradbury等[21]发现在顺铂治疗的食管癌患者中,XPD 751基因的多态性变异的确能提高总生存率(和无进展生存率)。王连云等[22]在卵巢癌化疗患者中发现,携带XPD Lys751Gln基因杂合突变型基因型LG和野生基因型LL相比,LL基因型化疗敏感性是LG基因型的2.88倍,XPD Lys751Gln基因与上皮性卵巢癌铂类化疗敏感性存在相关性。根据Li等[20]和王连云等[22]研究结果推测,XPD基因751密码子的SNP可能可以提高化疗反应及生存率,与本次研究结果完全不同。综上所述,目前关于XPD基因多态性与化疗疗效是否相关尚不明确,可能与研究肿瘤类别不同、人种差异有关。故XPD Lys751Gln多态性作为预测铂类治疗方案效果的遗传学标志尚需进一步探讨。
XPC是一个重要的核苷酸切除修复酶,是核苷酸 切除修复系统的重要成分。XPC蛋白与HHR23B形成复合物,在切除修复初始阶段发挥识别DNA损伤的功能[23]。本研究发现XPC Lys939Gln A/A、A/C、C/C基 因型,A/A和A/C+C/C基因型化疗敏感率分别为66.7% 和69.1%,差异无统计学意义(P>0.05)。携带XPC Lys939Gln A/A基因型与携带至少1个C等位基因(A/ C和C/C)的LACC患者对铂类药物化疗敏感性差异无统计学意义(OR=0.897,95%CI:0.369~2.18)。Ott等[24]对DNA修复基因多态性预测铂类化疗的疗效研究中,指出XPC多态性与铂类化疗敏感性无相关性,与本研究结论相同。而Zhu等[25]研究表明携带XPC Lys939Gln A/C基因型的NSCLC I I I期患者化疗反应比A/A基因型者差。又有研究指出,XPC基因多态性与降低卵巢癌复发及死亡风险关联[26],可以延长无进展生存率[27]。故关于XPC基因多态性与化疗疗效相关性的研究存在诸多争议,因此要明确XPC Lys939Gln基因多态性与铂类药物化疗的敏感性究竟是否相关,尚需要加大病例数做进一步的研究。
综上所述,本研究未发现XPD、XPC基因多态性与NACT之间具有相关性,但ERCC 118基因多态性与化疗敏感性有关,这一位点基因多态性的检测可能可以作为预测LACC NACT疗效的指标之一,从基因水平上预测化疗效果,设计个体化化疗方案,减少临床耐药,提高药物的疗效。
[1] ROTMAN M, SEDLIS A, PIEDMONTE M R, et al. A phase III randomized trial of postoperative pelvic irradiation in Stage IB cervical carcinoma with poor prognostic features: follow-up of a gynecologic oncology group study[J]. Int J Radiat Oncol, 2006, 65(1): 169-176.
[2] DELGADO G, BUNDY B, ZAINO R, et al. Prospective surgical-pathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix:a Gynecologic Oncology Group study[J]. Gynecol Oncol, 1990, 38(3): 352-357.
[3] Al-MANSOUR Z, VERSCHRAEGEN C. Locally advanced cervical cancer: what is the standard of care[J]. Curr Opin Oncol, 2010, 22(5): 503-512.
[4] 魏嘉, 刘宝瑞, 王亚平, 等. DNA修复基因单核苷酸多态性与铂类药物抵抗研究进展[J]. 中华肿瘤杂志, 2006, 28(3): 161-163.
[5] ROSELL R, LORD R V, TARON M, et al. DNA repair and cisplatin resistance in non-small-cell lung cancer[J]. Lung Cancer, 2002, 38(3): 217-227.
[6] FARNEBO L, JEDLINSHI A, ANSELL A, et al. Proteins and single nucleotide polymorphisms involved in apoptosis, growth control, and DNA repair predict cisplatin sensitivity in head and neck cancer cell lines[J]. Int J Mol Med, 2009, 24(4): 549-556.
[7] TAKEKIDA S, FUJIWARA K, NAGAO S, et al. Phase II study of combination chemotherapy with docetaxel and carboplatin for locally advanced or recurrent cervical cancer[J]. Int J Gynecol Cancer, 2010, 20(9): 1563-1568.
[8] 董霞, 王刚. 局部晚期宫颈癌新辅助化疗影响因素研究进展[J]. 中华临床医师杂志(电子版), 2012, 6(15): 153-155.
[9] ROSE M C, KOSTYANOVSKAYA E, HUANG R S. Pharmacogenomics of cisplatin sensitivity in non-small cell lung cancer[J]. Genomics Proteomics Bioinformatics, 2014, 12(5): 198-209.
[10] World Health Organization. WHO handbook for reporting results of cancer treatment[M]. Geneva: WHO Offset publication, 1979: 16-21.
[11] REED E. Platinum-DNA adduct, nucleotide excision repair and platinum based anti-cancer chemotherapy[J]. Cancer Treat Rev, 1998, 24(5): 331-344.
[12] KANG S, JU W, KIM J W, et al. Association between excision repair cross-complementation group 1 polymorphism and clinical outcome of platinum-based chemotherapy in patients with epithelial ovarian cancer[J]. Exp Mol Med, 2006, 38(3): 320-324.
[13] YU X, XIAO H, ZHAO B, et al. DNA repair gene ERCC1 C118T polymorphism predicts sensitivity of recurrent esophageal cancer to radiochemotherapy in a Chinese population [J]. Thorac Cancer, 2015, 6(6): 741-748.
[14] 张胜利. ERCC1和XPD基因SNPs与晚期NSCLC含铂类药物化疗敏感性的关系[D]. 苏州: 苏州大学, 2011.
[15] REN S, ZHOU S, WU F, et al. Association between polymorphisms of DNA repair genes and survival of advanced NSCLC patents treated with platinum-based chemotherapy [J]. Lung Cancer, 2012, 75 (1): 102-109.
[16] CHEN D Q, YAO X, ZHAO H Y, et al. DNA repair gene ERCC1 and XPD polymorphisms predict glioma susceptibility and prognosis[J]. Asian Pac J Cancer Prev, 2012, 13(6):2791-2794.
[17] TISEO M, BORDI P, BORTESI B, et al. ERCC1/BRCA1 expression and gene polymorphisms as prognostic and predictive factors in advanced NSCLC treated with or without cisplatin[J]. Br J Cancer, 2013, 108(8): 1695-1703.
[18] WU W, LI H, WANG H, et al. Effect of Polymorphisms in XPD on clinical outcomes of platinum-based chemotherapy for Chinese non-small cell lung cancer patients[J]. Plos One, 2012, 7(3): e33200.
[19] QIU M, YANG X, HU J, et al. Predictive value of XPD polymorphisms on platinum-based chemotherapy in nonsmall cell lung cancer: A systematic review and metaanalysis[J]. Plos One, 2013, 8(8): e72251.
[20] LI C, JIANG Z, LIU X. XPD Lys(751) Gln and Asp(312) Asn polymorphisms and bladder cancer risk:a meta-analysis[J]. Mol Biol Rep, 2010, 37(1): 301-309.
[21] BRADBURY P A, KULKE M H, HEIST R S, et al. Cisplatin pharmacogenetics, DNA repair polymorphisms, and esophageal cancer outcomes[J]. Pharmacogenet Genomics, 2009, 19(8): 613-625.
[22] 王连云, 吕杰强, 朱雪琼, 等. XRCC1和XPD多态性基因型与上皮性卵巢癌铂类药物敏感性的关系[J]. 温州医学院学报, 2013, 43(4): 227-227.
[23] VAN HOFFEN A, BALAJEE A S, VAN ZEELAND A A, et al. Nucleotide excision repair and its interplay with transcription[J]. Toxicology, 2003, 193(1-2): 79-90.
[24] OTT K, RACHAKONDA P S, PANZRAM B, et al. DNA repair gene and MTHFR gene polymorphisms as prognostic markers in locally advanced adenocarcinoma of the esophagus or stomach treated with cisplatin and 5-fluorouracil-based neoadjuvant chemotherapy[J]. Ann Surg Oncol, 2011, 18(9): 2688-2698.
[25] ZHU X L, SUN X C, CHEN B A, et al. XPC Lys939Gln polymorphism is associated with the decreased response to platinum based chemotherapy in advanced non-small-cell lung cancer[J]. Chin Med J (Engl), 2010, 123(23): 3427-3432.
[26] SALDIVAR J S, LU K H, LIANG D, et al. Moving toward individualized therapy based on NER polymorphisms that predict platinum sensitivity in ovarian cancer patients[J]. Gynecol Oncol, 2007, 107(1): 223-229.
[27] FLEMING N D, AGADJANIAN H, NASSANIAN H, et al. Xeroderma pigmentosum complementation group C singlenucleotide polymorphisms in the nucleotide excision repair pathway correlate with prolonged progression-free survival in advanced ovarian cancer[J]. Cancer, 2012, 118(3): 689-697.
(本文编辑:吴昔昔)
Association between ERCC1, XPD, XPC polymorphisms and chemosensitivity of platinum-based neoadju-vant chemotherapy in patients with locally advanced cervical cancer
QI Lifang, LYU Jieqiang, ZHU Xueq-iong, XIA Lu, HUANG Qiusui, QU Wanglei, CHEN Wenbing. Department of Gynecology, the Second Affiliated Hospital & Yvying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To investigate whether single-nucleotide polymorphisms of ERCC1, XPD, XPC affected response in locally advanced cervical cancer (LACC) receiving platinum-based neoadjuvant chemotherapy (NACT). Methods: A total of 114 patients who were pathologically diagnosed as cervical carcer treated with platinum-based neoadjuvant chemotherapy were examined for genotyping of ERCC1, XPD and XPC in peripheral blood lymphocytes with the method of polymerase chain reaction-restriction fragment length polymorphism (PCR-RPLF), and than the correlation between different genotypes with NACT curative effect was analized. Results: Variant genotypes of ERCC1 Asn118Asn were significantly associated with /C genetype LACC chemosensitivity (P<0.05). To compare ERCC1 Asn118Asn C/T genetype with ERCC1 Asn118Asn C/C genetype, chemosensitivity increased 4.48 times (odds ratio 4.48; 95%CI: 1.436-13.976; P<0.05). While no significant difference was found between chemotherapy response and SNPs of XPD condon 751 and XPC condon 939 (P>0.05). Conclusion: Our study provides evidence for the predictive role of ERCC1 Asn118Asn on chemotherapy response in LACC patients treated with.
locally advanced cervical cancer; neoadjuvant chemotherapy; polymorphism
R737.33
A
10.3969/j.issn.2095-9400.2016.10.005
2016-01-04
温州市科技局对外合作项目(H20080032);正大青春宝肿瘤科研专项(2012ZYC-A34)。
祁丽芳(1985-),女,浙江温州人,住院医师,硕士。
陈文兵,副教授,硕士生导师,主任医师,Email:fccwbqlf@sina.com。

