急性单核细胞白血病特异性miRNA分子标志物的鉴定
刘金立,刘淑阁,熊倩,韩丽,李伟,王万恒,张昭军,,4,李全贞
(1.温州医科大学 检验医学院与生命科学学院,浙江 温州 325035;2.中国科学院北京基因组研究所 中科院基因组科学与信息重点实验室,北京 100101;3.山西国信凯尔生物技术有限公司,山西 太原 030006;4.中国科学院大学,北京 100049)
·论 著·
急性单核细胞白血病特异性miRNA分子标志物的鉴定
刘金立1,刘淑阁2,熊倩2,韩丽3,李伟1,王万恒3,张昭军1,2,4,李全贞1
(1.温州医科大学 检验医学院与生命科学学院,浙江 温州 325035;2.中国科学院北京基因组研究所 中科院基因组科学与信息重点实验室,北京 100101;3.山西国信凯尔生物技术有限公司,山西 太原 030006;4.中国科学院大学,北京 100049)
目的:鉴定急性单核细胞白血病中特异高表达的microRNA(miRNA)。方法:通过分析急性单核细胞白血病细胞系(THP-1)与慢性粒细胞白血病细胞系(K562)的miRNA-seq数据,筛选一批在THP-1细胞系中显著高表达的miRNA,通过实时荧光定量PCR技术对这些miRNA在THP-1和K562细胞系中进行验证,获得在THP-1细胞系中特异高表达的miRNA,再通过实时荧光定量PCR技术在急性单核细胞白血病患者骨髓样品中进行验证,鉴定有望应用于该类疾病临床诊断的分子标志物。结果:最终筛选得到了3个在急性单核细胞白血病中特异高表达的miRNA分子标志物:let-7d-5p、miR-222-3p、miR-221-3p。结论:通过结合组学数据,利用实时荧光定量PCR技术在细胞系及临床样本中的验证,最终鉴定了3个在急性单核细胞白血病中特异高表达的miRNA分子标志物。
急性单核细胞白血病;miRNA;实时荧光定量PCR;miRNA-Seq
急性髓系白血病(acute myeloid leukemia,AML)是一种或多种造血干细胞及祖细胞发生克隆性恶变,从而造成正常造血功能紊乱的高度恶性疾病[1-2]。急性单核细胞白血病(M5)属AML形态学分型中的一种,除具有其他类型急性白血病常见的临床症状外,其主要特征为皮肤及黏膜病变,肾功能衰竭也较其他白血病多见,起病急骤,病死率较高。目前,急性单核细胞白血病的临床诊断方法主要以临床症状为前提,形态学检测为基础,同时结合免疫学及细胞遗传学指标。形态学和免疫学的方法检测,需有丰富临床经验的检测人员,且由于主观性偏差的存在易造成误诊;另外,单一的检测方法也会使诊断效率和准确率大大降低[3]。近年来,分子诊断技术在急慢性白血病的临床诊断中正发挥着重要作用。
microRNA(miRNA)是一类内源性、高度保守的非蛋白编码的小分子RNA,主要通过抑制蛋白编码基因的翻译或降解mRNA来发挥调控作用[4]。研 究[5-7]表明:miRNA可广泛参与发育周期、细胞增殖 和分化、细胞凋亡、新陈代谢、神经调控、肿瘤发生 等各种生理和病理的调控过程。已有诸多研究[8-10]结果证实:miRNA的表达及功能异常调控可导致白血病的发生。目前绝大多数研究都是针对所有FAB分型的AML进行分析,由于AML各个分型在形态学及细胞遗传学等方面不尽相同,使得现阶段鉴定的miRNA在临床分子诊断应用中受到极大限制,因此,鉴定特定类型的AML中特异性表达的miRNA分子标记物具有重要意义。
1 材料和方法
1.1 材料 急性单核细胞白血病细胞系(THP-1)和 慢性粒细胞白血病细胞系(K562)购于ATCC,TRIzol® Reagent购于Life Technologies公司,sRNA sample prep kit购于Illumina公司,E.coli Poly(A)Polymerase和ATP购于New England Biolabs公司,RevertAidTMFirst Strand cDNA Synthesis Kit购于Fermentas公司。
1.2 方法
1.2.1 生物信息技术筛选在M5型AML细胞系中特异表达的miRNA:利用项目组已有的THP-1与K562细胞系miRNA-Seq数据[11-12],根据miRNA在2种细胞系中表达量的差异倍数进行初步筛选。
1.2.2 miRNA在细胞系中的筛选验证:THP-1和K562 的细胞培养参照厂商操作指南,细胞内miRNA表达检 测的主要步骤如下:以TRIzol® Reagent提取总RNA, 利用E.coli Poly(A) Polymerase和ATP对RNA进行加尾反应,通过RevertAidTMFirst Strand cDNA Synthesis Kit反转录获得cDNA。采用Maxima® SYBR Green/ROX qPCR Master Mix进行实时定量PCR 扩增。扩增体系为18 μL:cDNA 1 μL,SYBR Green 9 μL,上下游引物共6 μL,ddH2O 2 μL。扩增条件为:第一步50 ℃,2 min;第二步95 ℃,10 min;第三步95 ℃ 15 s,62 ℃,40 s,40个循环。内参对照标准U6及各miRNA正向及反向引物见表1。miRNA表达水平分析时,将其在K562细胞系中的表达水平标准化为1。

表1 引物序列
1.2.3 miRNA在M5型AML临床病例骨髓样品中的筛选验证:患者行骨髓穿刺采集2 mL样本后保存在乙二胺四乙酸抗凝管中,加入2 mL Trizol试剂吹打混匀后保存在-80 ℃以提取总RNA。所有病例均按照第3版《血液病诊断及疗效标准》AML的诊断标准进行诊断。RNA的提取和miRNA的检测参照1.2.2。以健康捐献者的骨髓样本为对照,在进行miRNA表达水平分析时,将其在对照中的表达水平标准化为1。
1.3 统计学处理方法 采用SPSS12.0软件进行统计学分析,所有数据使用前均需要进行方差齐性检验,然后进行student’s t-test分析。P<0.05为差异有统计学意义。
2 结果
2.1 生物信息技术筛选在M5型AML细胞系中特异表达的miRNA 通过比较THP-1和K562细胞系的miRNA-seq测序数据,将miRNA在K562细胞系中的表达量标准化为1得到差异倍数,根据差异倍数>5.0的标准筛选出16个miRNA作为本实验进行研究的miRNA,见表2。这16个miRNA分别为:has-let-7b-5p、hsalet-7d-5p、hsa-miR-103b、hsa-miR-107、hsa-miR-128-3p、hsa-miR-140-3p、hsa-miR-155-5p、hsa-miR-181a-5p、hsa-miR-181b-5p、hsa-miR-221-3p、hsamiR-222-3p、hsa-miR-23a-3p、hsa-miR-29a-3p、hsamiR-29c-3p、hsa-miR-320a、hsa-miR-877-5p。
2.2 miRNA在细胞系中的筛选验证 检测到其中的8个miRNA在THP-1细胞中的表达量显著高于k562细胞(P<0.05)。这些miRNA是:hsa-let-7d-5p、hsamiR-103b、hsa-miR-155-5p、hsa-miR-181a-5p、hsamiR-221-3p、hsa-miR-222-3p、hsa-miR-23a-3p、hsamiR-320a,见图1。
2.3 miRNA在M5型AML临床病例骨髓样品中的筛选验证 8个miRNA在大多数患者样品中均存在高表达现象,见图2和表3。hsa-let-7d-5p在12个患者样品中均较正常对照样本至少高表达2倍,且其中10个(占83.33%)miRNAs的表达水平与对照样本比差异有统计学意义(P<0.05),见图2A;hsa-miR-222-3p和hsa-miR-221-3p则在11个患者样品中高表达至少2倍,且其中的10个miRNAs表达水平与对照样本差异有统计学意义(P<0.05),见图2B和2C。

图1 16个miRNA在THP-1和k562细胞中的相对表达量
3 讨论
自1993年首次发现miRNA以来[13],研究者一直致力于探寻miRNA的重大意义。研究表明miRNA所在基因座的缺失、扩增、突变、表观遗传修饰沉默等均可引起miRNA的异常表达从而进一步导致肿瘤的发生[14]。人类大约有50%的已注释miRNA位于与癌症相关的基因组区域中,这表明miRNA与多种肿瘤密切相关[15],miRNA也可调节造血干细胞的异常分化,从而促进白血病的发生[15-19]。Calin等[20]报道miRNA-15a与miRNA-16-1的表达水平与慢性淋巴细胞白血病(chronic lymphoblastic leukemia,CLL)中Bal2呈负相关,两者被认为是Bal2的反义作用因子。Mi等[3]在2007年筛选出27个在AML和急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)中具有差异表达的miRNA,6个在ALL中上调,21个在AML中上调,其中miR-128-a与miR-128-b在ALL中的表达明显升高,而let-7b与miR-223在ALL中明显降低,4个miRNA中的任意2条组合都可以区分ALL与AML,诊断精确率>95%。本实验通过高通量测序技术对K562、THP-1细胞系miRNA转录组进行了深入研究,不同miRNA在不同细胞系的差异表达可为急慢性白血病候选分子诊断物的鉴定提供新的重要信息资源[11]。利用高通量技术探寻AML miRNA表达谱的研究虽已有报道[3,21-26],但对于AML不同亚型的miRNA转录组学方面还缺乏较为系统、深入的研究,尤其是针对某一特定类型AML的miRNA的研究。本实验目的在于针对AML亚型中的急性单核细胞白血病(M5)进行研究,希望能够鉴定出一组可用于M5临床诊断的miRNA分子诊断标志物。

图2 8个miRNA分别在12例M5样本中的相对表达量分析
本实验最终筛选出3个在M5中特异高表达的miRNAs:hsa-miR-222-3p、hsa-let-7d-5p、hsa-miR-221-3p,可考虑作为M5的分子标志物。miR-222与miR-221高度同源,其基因位于X染色体区域,二者成簇分布,具有相同的种子序列,在人与小鼠等脊椎动物中高度保守。miR-221的作用靶点位于Kit mRNA的3’UTR区域,miR-221的表达升高,可在转录水平引起mRNA的翻译抑制,Kit蛋白表达降低,从而抑制红细胞的增殖分化;另外,miR-221可使内皮生物学发生改变,调控血管生成相关调控因子的表达。miR-222与肿瘤转移及细胞增殖相关,上调miR-222的表达,可促进体外细胞增殖,同时还能促进裸鼠荷瘤模型中肿瘤的生长[27-30];下调miR-222的表达,则可抑制体外肿瘤细胞增殖[31];miR-221抑制剂经胆固醇修饰后,也可抑制体内肿瘤的生长[32]。 以上研究表明,miR-222与miR-221有可能成为侵袭性肿瘤的一个重要治疗靶点。let-7d属let-7家族中成员之一,目前报道较多的是let-7与肺癌的关系,let-7在肺癌组织及细胞系中的表达均较低,同时与患者术后生存期的长短有关[33]。另有研究发现,let-7d在头颈部鳞癌细胞中表达降低,并且与低生存率有一定关系[34];let-7d在卵巢癌中缺失同时伴随HMGA2表达升高也可预示预后不佳[35],这些研究表明let-7d可能与疾病的预后相关。多项研究表明,let-7属抑癌基因,但并非所有研究支持这一论点。Bruecker等[36]发现let-7a分别在卵巢上皮癌和肺癌中表达上调;Lawrie等[37]发现滤泡性淋巴瘤向弥漫性大B细胞瘤转化与let-7b与let-7i的表达上调有关。本研究中let-7d在AML-M5型中表达上调,与其他研究报道的AML中miRNAlet-7d表达下调不一致,原因可能是本实验采用骨髓标本,且是针对其中某一特定类型进行研究,因此尚需进一步深入探讨。
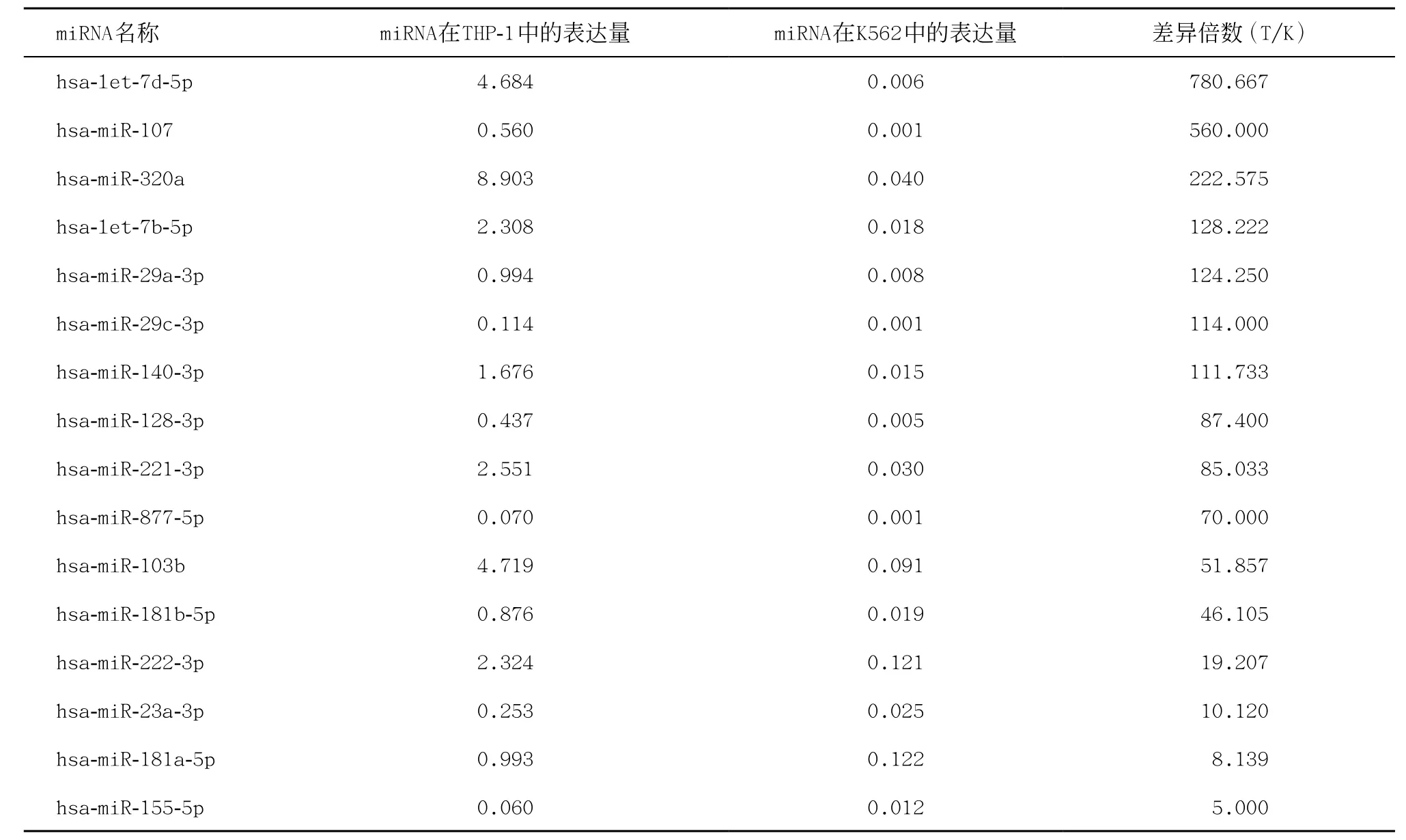
表2 从高通量测序数据中筛选出的16个miRNA

表3 miRNA在M5型临床病例骨髓样品中的验证筛选标准
[1] ESTEY E, D HNER H. Acute myeloid leukaemia[J]. Lancet, 2006, 368(9550): 1894-1907.
[2] LOWENBERG B, DOWNING J R, BURNETT A. Acute myeloid leukemia[J]. N Engl J Med, 1999, 341(14): 1051-1062.
[3] MI S, LU J, SUN M, et al. MicroRNA expression signatures accurately discriminate acute lymphoblastic leukemia from acute myeloid leukemia[J]. Proc Natl Acad Sci U S A, 2007, 104(50): 19971-19976.
[4] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[5] CHENG A M, BYROM M W, SHELTON J, et al. Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J]. Nucleic Acids Res, 2005, 33(4): 1290-1297.
[6] CALIN G A, CROCE C M. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6(11): 857-866.
[7] ESQUELA-KERSCHER A, SLACK F J. Oncomirs-microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4):259-269.
[8] MARTON S, GARCIA M, ROBELLO C, et al. Small RNAs analysis in CLL reveals a deregulation of miRNA expression and novel miRNA candidates of putative relevance in CLL pathogenesis[J]. Leukemia, 2008, 22(2): 330-338.
[9] TAKADA S, YAMASHITA Y, BEREZIKOV E, et al. MicroRNA expression profiles of human leukemias[J]. Leukemia, 2008, 22(6): 1274-1278.
[10] KUCHENBAUER F, MORIN R D, ARGIROPOULOS B, et al. In-depth characterization of the microRNA transcriptome in a leukemia progression model[J]. Genome Res, 2008, 18(11): 1787-1797.
[11] XIONG Q, YANG Y, WANG H, et al. Characterization of miRNomes in acute and chronic myeloid leukemia cell lines [J]. Genomics Proteomics Bioinformatics, 2014, 12(2): 79-91.
[12] WANG H, HU H, ZHANG Q, et al. Dynamic transcriptomes of human myeloid leukemia cells[J]. Genomics, 2013, 102(4): 250-256.
[13] LEE R C, FEINBAUM R L, AMBROS V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5): 843-854.
[14] CALIN G A, CROCE C M. MicroRNA-cancer connection:the beginning of a new tale[J]. Cancer Res, 2006, 66(15): 7390-7394.
[15] CALIN G A, SEVIGNANI C, DUMITRU C D, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci U S A, 2004, 101(9): 2999-3004.
[16] FABBRI M, GARZON R, ANDREEFF M, et al. MicroRNAs and noncoding RNAs in hematological malignancies:molecular, clinical and therapeutic implications[J]. Leukemia, 2008, 22(6): 1095-1105.
[17] GARZON R, CROCE C M. MicroRNAs in normal and malignant hematopoiesis[J]. Curr Opin Hematol, 2008, 15(4):352-358.
[18] VASILATOU D, PAPAGEORGIOU S, PAPPA V, et al. The role of microRNAs in normal and malignant hematopoiesis [J]. Eur J Haematol, 2010, 84(1): 1-16.
[19] YENDAMURI S, CALIN G. The role of microRNA in human leukemia: a review[J]. Leukemia, 2009, 23(7): 1257-1263.
[20] CALIN G A, DUMITRU C D, SHIMIZU M, et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J]. Proc Natl Acad Sci U S A, 2002, 99(24): 15524-15529.
[21] FAYYAD-KAZAN H, BITAR N, NAJAR M, et al. Circulating miR-150 and miR-342 in plasma are novel potential biomarkers for acute myeloid leukemia[J]. J Transl Med, 2013, 11(31): 1-10.
[22] MARCUCCI G, RADMACHER M D, MAHARRY K, et al. MicroRNA expression in cytogenetically normal acute myeloid leukemia[J]. N Engl J Med, 2008, 358(18): 1919-1928.
[23] ZHU Y D, WANG L, SUN C, et al. Distinctive microRNA signature is associated with the diagnosis and prognosis of acute leukemia[J]. Med Oncol, 2012, 29(4): 2323-2331.
[24] ZHI F, CAO X, XIE X, et al. Identification of circulating microRNAs as potential biomarkers for detecting acute myeloid leukemia[J]. PLoS One, 2013, 8(2): e56718.
[25] MARCUCCI G, MAHARRY K S, METZELER K H, et al. Clinical role of microRNAs in cytogenetically normal acute myeloid leukemia: miR-155 upregulation independently identifies high-risk patients[J]. J Clin Oncol, 2013, 31(17):2086-2093.
[26] CAMMARATA G, AUGUGLIARO L, SALEMI D, et al. Differential expression of specific microRNA and their targets in acute myeloid leukemia[J]. Am J Hematol, 2010, 85(5): 331-339.
[27] VEERLA S, LINDGREN D, KVIST A, et al. MiRNA expression in urothelial carcinomas: Important roles of miR-10a, miR-222, miR-125b, miR-7 and miR-452 for tumor stage and metastasis, and frequent homozygous losses of miR-31[J]. Int J Cancer, 2009, 124(9): 2236-2242.[28] GALARDI S, MERCATELLI N, GIORDA E, et al. miR-221 and miR-222 expression affects the proliferation potential of human prostate carcinoma cell lines by targeting p27Kip1[J]. J Biol Chem, 2007, 282(32): 23716-23724.
[29] LE SAGE C, NAGEL R, EGAN D A, et al. Regulation of the p27Kip1 tumor suppressor by miR-221 and miR-222 promotes cancer cell proliferation[J]. EMBO J, 2007, 26 (15): 3699-3708.
[30] MERCATELLI N, COPPOLA V, BONCI D, et al. The inhibition of the highly expressed miR-221 and miR-222 impairs the growth of prostate carcinoma xenografts in mice[J]. PLoS One, 2008, 3(12): e4029.
[31] ZHANG C, KANG C, YOU Y, et al. Co-suppression of miR-221/222 cluster suppresses human glioma cell growth by targeting p27kip1 in vitro and in vivo[J]. Int J Oncol, 2009, 34(6): 1653-1660.
[32] PARK J K, KOGURE T, NUOVO G J, et al. miR-221 silencing blocks hepatocellular carcinoma and promotes survival[J]. Cancer Res, 2011, 71(24): 7608-7616.
[33] TAKAMIZAWA J, KONISHI H, YANAGISAWA K, et al. Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival [J]. Cancer Res, 2004, 64(11): 3753-3756.
[34] PARK S M, SHELL S, RADJABI A R, et al. Let-7 prevents early cancer progression by suppressing expression of the embryonic gene HMGA2[J]. Cell Cycle, 2007, 6(21): 2585-2590.
[35] SHELL S, PARK S M, RADJABI A R, et al. Let-7 expression defines two differentiation stages of cancer[J]. Proc Natl Acad Sci USA, 2007, 104(27): 11400-11405.
[36] BRUECKNER B, STRESEMANN C, KUNER R, et al. The human let-7a-3 locus contains an epigenetically regulated microRNA gene with oncogenic function[J]. Cancer Res, 2007, 67(4): 1419-1423.
[37] LAWRIE C H, CHI J, TAYLOR S, et al. Expression of microRNAs in diffuse large B cell lymphoma is associated with immunophenotype, survival and transformation from follicular lymphoma[J]. J Cell Mol Med, 2009, 13(7): 1248-1260.
(本文编辑:吴彬)
Characterization of specific miRNAs in acute monocytic leukemia
LIU Jinli1, LIU Shuge2, XIONG Qian2,
HAN Li3, LI Wei1, WANG Wanheng3, ZHANG Zhaojun1,2,4, LI Quanzhen1. 1.School of Laboratory Medicine and Life Science, Wenzhou Medical University, Wenzhou, 325035; 2.CAS Key Laboratory of Genome Sciences and Information, Beijing Institute of Genomics, Chinese Academy of Sciences, Beijing, 100101; 3.Guoxinkaier Biotechnology of Shanxi, Taiyuan, 030006; 4.University of Chinese Academy of Sciences, Beijing, 100049
Objective: To characterize the molecular markers of microRNA (miRNA) with specifically high expression in acute monocytic leukemia. Methods: A batch of miRNAs was firstly screened out for their significantly higher expression in THP-1 (acute monocytic leukemia cell line) by analyzing high-throughput miRNA transcriptome sequencing data of THP-1 and K562 (chronic myeloid leukemia cell line). These miRNAs were further tested in the THP-1 and K562 cell line by quantitative real-time PCR (qRT-PCR) to obtain the specifically high expressed miRNAs in THP-1 cell line. Finally, these screened miNRAs were verified in bone marrow samples of acute monocytic leukemia patients by qRT-PCR. The finally verified miRNAs could serve the candidates for clinical diagnosis of this disease in the future. Results: Three miRNAs that are specifically highly expressed in acute monocytic leukemia including let-7d-5p, miR-221-3p and miR-222-3p were characteried. Conclusion: By integrating the bioinformatics analysis and verification in cell lines and patient bone marrow samples, we finally characterized 3 miRNAs as potential molecular diagnostic markers in acute monocytic leukemia.
acute monocytic leukemia; microRNA; quantitative real-time PCR; miRNA-Seq
R557
A
10.3969/j.issn.2095-9400.2016.10.001
2016-02-26
国家重大科学仪器设备开发专项(2011YQ03013404);国家高技术研究发展计划(863计划)(2015AA020108)。
刘金立(1988-),女,山东德州人,硕士生。
共同通信作 者:李全贞,教授,Email:Quan.Li@UTSouthwestern.edu;张昭军,教授,Email:Zhangzhaojun@big.ac.cn。

