猪流行性腹泻病毒RT-PCR方法的建立
孔德梦,关冬梅,孔令达,3*
(1.哈尔滨维科生物技术开发公司,黑龙江 哈尔滨 150069;2.沈阳市于洪区动物疫病预防疾控中心,辽宁 沈阳 110141;3.中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150001)
猪流行性腹泻病毒RT-PCR方法的建立
孔德梦1,关冬梅2,孔令达1,3*
(1.哈尔滨维科生物技术开发公司,黑龙江 哈尔滨 150069;2.沈阳市于洪区动物疫病预防疾控中心,辽宁 沈阳 110141;3.中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150001)
为了进行猪流行性腹泻病毒的快速诊断,本研究根据GenBank中登录PEDV E基因设计一对引物,建立了RT-PCR方法,敏感性结果显示,可以检测到8.50×104个拷贝。特异性试验采用该方法对猪伪狂犬病病毒,猪圆环病毒2型,猪瘟病毒,猪繁殖与呼吸综合征病毒,猪轮状病毒等进行,结果表明只有PEDV能扩增出目的条带;利用本方法对现有PEDV阳性病料进行了检测,结果野毒株9份,占64.2%(9/14)。本方法的建立,为PEDV疫情诊断及防控提供了新的技术支撑。
猪流行性腹泻;分子流行病学调查
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属冠状病毒科、冠状病毒属的成员,是引起仔猪腹泻的主要肠道病毒,感染猪以水样腹泻、呕吐、脱水,主要危害仔猪为特征。PED于70年代初首先发现于英国,随后许多国家均有该病的报道。
在我国,PEDV分布较广,灭活苗及弱毒苗在一定程度上控制了该病的发生及流行,但自2010年以来,我国多地暴发流行PEDV,临床上主要表现为哺乳仔猪的高发病率和高死亡率,由腹泻病引起的仔猪死率达高达80%~100%,给养猪业带来了很大的经济损失。随后开展的病原分离鉴定分析、流行病学调查等相关研究,认定PEDV变异毒株是引起本次疾病流行的主要原因。
目前PEDV野毒株与弱毒疫苗株的区别检测技术主要有病毒分离、反转率聚合酶链式反应(RT-PCR)等。本研究采用RT-PCR技术,建立一种快速诊断的方法。
1 材料
1.1 毒株与样品来源猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒、猪细小病毒、猪繁殖与呼吸综合症病毒、猪伪狂犬病毒、猪瘟病毒等均由本单位保存。
1.2 主要试剂Taq DNA聚合酶,DNA Marker购自宝生物工程(大连)有限公司;RNA提取试剂盒RNeasy Plus Mini Kit购自QⅠAGEN公司;单链cDNA合成试剂EasyScript First-Strand cDNA Synthesis SuperMix购自全式金生物技术有限公司。Gel Extraction Kit、Plasmid Mini Kit购自OMEGA公司;RNAiso Regent、RT(反转录)、2×Taq PCR Master Mix、DNA分子质量标准购自宝生物工程(大连)有限公司;其他常规试剂均为国产分析纯试剂。
2 方法
2.1 引物的设计与合成引物分别参文献设计合成,预期扩增目的片段长度分别为234bp,由宝生物工程(大连)有限公司合成,引物详情见表1。

表1 引物序列
2.2 病毒基因组RNA的提取取PEDV弱毒株(ZJ08)及野毒株(HEBEⅠ08)处理过的样品200μl,按照RNeasy Plus Mini Kit试剂盒说明书操作提取病毒RNA,取一定量提取的RNA产物依照EasyScript First-Strand cDNA Synthesis SuperMix试剂盒反转成cDNA,-20℃保存备用。
2.3 RT-PCR反应
2.3.1 反转录成cDNA按照RT(反转录)试剂盒说明,采用20 μL体系:RNA模板10μL,5×PrimeScript Buffer 4μL,PrimeScript RT Enzyme Mix 1μL,RT Prime Mix 1μL,RNase Free dH20 4μL,按以下程序进行反转录反应:37℃15min,85℃5s,4℃保存。
2.3.2 PCR反应反转录完成后,取新的PCR反应管,采用20μL反应体系进行扩增:加入10μL 2×Taq PCR Master Mix,6μL ddH20,3μL反转录产物,上、下游引物各0.5μL。按照下列条件进行扩增:95℃预变性5min,95℃循环变性30s,PEDV 46℃退火复性30s,72℃延伸30s,30个循环,72℃延伸10min,4℃保存备用。
2.3.3 RT-PCR扩增产物的检测及鉴定取扩增产物于10g/L琼脂糖凝胶中电泳,并观察结果。
2.3.4 体系及反应条件优化PCR反应体系预设定为:2× PCR Buffer 10μL,上下游引物各1μL(引物浓度为10μM),cDNA模板1μL,Taq DNA聚合酶0.5μL(5U/μL),加双蒸水至20μL。PCR反应条件预设为:94℃5min;94℃30 s,50℃30s,72℃30s,30个循环;72℃7min。
固定反应退火温度为50℃,将上、下游引物剂量范围设在0.2~1.6μL以每0.2μL递增,进行引物浓度加入条件的优化,反应结束后,PCR产物以2%琼脂糖凝胶电泳检测。
确定上、下游引物最佳加入量后,在PCR体系中加入各种成分,设置退火温度梯度48~56℃,反应结束后,PCR产物以2%琼脂糖凝胶电泳检测。
2.3.5 敏感性试验以鉴定正确的含有PEDV序列的重组DNA为模板,核酸蛋白仪测定DNA浓度,双蒸水进行10倍梯度稀释,取每个稀释度的1μL作为模板进行RT-PCR反应。
2.3.6 特异性实验猪传染性胃肠炎病毒、猪轮状病毒、伪狂犬病病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、猪圆环病毒2型为模板进行RT-PCR检测,同时设强弱毒株为阳性对照,验证RT-PCR的特异性。
2.4 临床样品的检验应用建立的RT-PCR检测方法,对现有的14份PEDV阳性样品进行检测。临床组织样品按常规方法处理后,试剂盒提取RNA并进行反转后得到cDNA。以cDNA为模板进行RT-PCR扩增。
3 结果
3.1 RT-PCR结果利用针对PEDV E基因设计的引物,进行RT-PCR扩增。结果显示,扩增得到与预期目的条带大小相符的特异性片段,约234 bp,如图1所示。对PCR产物克隆、测序分析表明,所得基因序列与GenBank中登录的相应目的基因核苷酸序列同源性均在95%以上,表明扩增产物特异性较高。
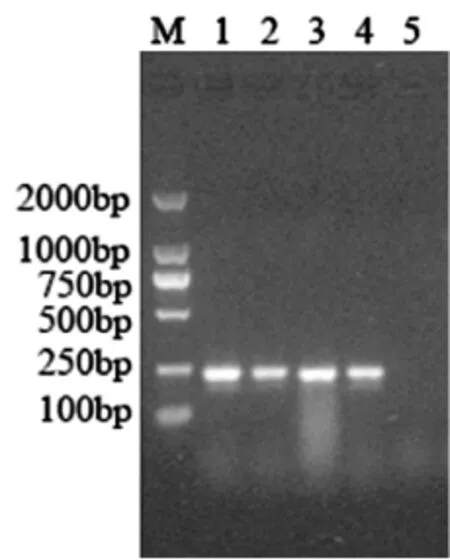
图1 部分PEDV的RT-PCR检测结果
M:DL2000 DNA分子量标准;1~3:部分样品PCR产物;4:阳性对照;5:阴性对照
3.2 反应体系优化结果PEDV最终RT-PCR检测体系为:PCR Buffer 10μL,上下游引物各0.8μL(引物浓度为10μM),cDNA模板1μL,TaqDNA聚合酶0.5μL(5U/μL),加双蒸水至20μL。
反应条件为:94℃5min;94℃30s,51℃30s,72℃30s,30个循环;72℃7min;4℃保存。
3.3 特异性及重复性试验采用设计的扩增PEDV的引物,分别对猪传染性胃肠炎病毒、猪轮状病毒、伪狂犬病病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、猪圆环病毒2型进行RT-PCR扩增,结果显示特异性良好其它病毒均未有目的条带出现,并重复2次实验。结果证实RT-PCR方法具有良好的特异性。
3.4 敏感性试验以初始浓度为8.50×1010拷贝/μL的PEDV重组质粒为模板,经过双蒸水10倍梯度稀释后,取每个稀释浓度的样品进行RT-PCR及普通PCR反应检测。敏感性实验结果表明RT-PCR最低能检出8.50×105拷贝/μL。本实验建立的RT-PCR方法灵敏。
3.5 临床样品检测结果对来自不同地区的14份PEDV阳性样品进行检测,结果显示,以野生强毒株感染为主,且发现了一例混合感染样品。表明当前可能存在免疫后感染的现象。
4 讨论
PEDV是危害养猪业的重要的传染病之一,腹泻二联灭活及弱毒疫苗的使用,对控制该病起到了一定的作用。但从2006年以来,PEDV在免疫后猪群出现流行,2010年下半年开始,PEDV在我国暴发流行,统计数据显示,PEDV的感染率明显高于另外两种猪腹泻病猪传染性胃肠炎(TGEV)及猪轮状病毒(PRoV)。报道称2010年开始在中国南方有多个省暴发PEDV且导致新生仔猪100%的死亡率,有超过100万头仔猪死亡。华中地区182家猪场表现严重腹泻的猪的粪便样本阳性检出率为60.44%,47个规模猪场共153份腹泻病料样品,阳性检出率为55.32%,表明近几年在我国PEDV是导致腹泻的主要原因。
猪病毒性腹泻疾病有爆发性流行、地方性流行两种形式。一般第一次感染均呈暴发性流行,一些猪传染性胃肠炎病毒污染比较严重的猪场,常呈地方性流行。冬春季节是病毒性腹泻疾病的多发季节,猪流行性腹泻和猪传染性胃肠炎的发生和流行具有明显的季节性,通常从11月到次年4月中旬,发病高峰为1~2月份,但现在夏季也可发病。病猪和带毒猪群是主要传染源,主要通过消化道和呼吸道传染给易感猪群,但在实验室平日检测时发现母猪乳汁中也能检测到PEDV和TGEV的存在,乳汁传播是否是其传播途径还有待进一步研究。2周龄以下仔猪发病率和死亡率较高,7日龄以内的产房仔猪腹泻最为严重,表现为迅速出现水样腹泻,严重脱水和死亡。断奶仔猪断奶猪和育肥猪表现持续性的水泻,大多数病猪康复,但生长发育受影响,成为僵猪。母猪表现精神萎顿,厌食,腹泻持续约1周。在临床上很难单凭腹泻这一多因子致病症状进行准确的诊断,因此进行相应的分子流行病学调查显得尤为重要。本方法的建立,为PEDV疫情诊断及防控提供了新的技术支撑。
[1]殷震,等.动物病毒学[M].北京∶科学出版社.1997.
[2]Debouck P,Pensaert M.Experimental infection of pigs with a new porcine enteric coronavirus,CV 777[J].American journal of veterinary research,1980,41(2)∶219-223.
[3]赵梦姣,等.山东省部分地区猪流行性腹泻流行病学调查及其M基因遗传变异分析[J].中国兽医学报.2013,33(010)∶1504-1508.
[4]孙振钊,等.猪腹泻病例中PEDV、TGEV及PRV的感染调查[J].动物医学进展,2014,35(5):132-135.
[5]刘孝珍,等.2011年猪流行性腹泻病毒的遗传变异分析[J].中国预防兽医学报,2012,34(3)∶180-183.
10.3969/J.ISSN.1671-6027.2016.04.016
★通讯作者

