广西巴马小型猪2型糖尿病模型骨骼肌糖代谢及能量代谢相关基因的表达差异
严雪瑜,蒋钦杨,吴延军,梁家充,郭亚芬,兰干球
(广西大学动物科学技术学院,南宁 530004)
广西巴马小型猪2型糖尿病模型骨骼肌糖代谢及能量代谢相关基因的表达差异
严雪瑜,蒋钦杨,吴延军,梁家充,郭亚芬,兰干球*
(广西大学动物科学技术学院,南宁 530004)
目的 探讨糖代谢及能量代谢过程中的关键调控基因(PGC-1α、Glut-4、ERRα、NRF-1、TFAM和线粒体基因)在2型糖尿病(type 2 diabetes mellitus,T2DM)发生中的作用。方法 以广西巴马小型猪T2DM模型建立的发病组和未发病组的背最长肌为实验材料,利用QRT-PCR实时荧光定量的方法对糖代谢及能量代谢相关基因mRNA和线粒体基因的表达情况进行检测。结果 在广西巴马小型猪背最长肌中,T2DM组PGC-1α、Glut-4、ERRα和NRF-1的相对表达量均显著高于非T2DM组,TFAM和线粒体基因的相对表达量则稍低于非T2DM组。结论 在T2DM巴马小型猪骨骼肌中,上调PGC-1α及其下游基因Glut-4、ERRα和NRF-1的表达水平,有利于改善葡萄糖代谢;而线粒体合成不足,致使ATP合成量不够,或引起胰岛素抵抗,进而导致2型糖尿病的发生。
广西巴马小型猪; 2型糖尿病; 骨骼肌; 胰岛素抵抗
全球成年人糖尿病患者数逐年增加,尤其以2型糖尿病(type 2 diabetes mellitus,T2DM)发病为主,成为严重危害人类健康的慢性非传染性疾病。而T2DM发病机制仍不十分清楚,骨骼肌胰岛素抵抗(insulin resistance,IR)是T2DM主要病因,研究参与调控骨骼肌IR的关键基因表达差异,对了解T2DM的发生有一定的作用。
肌肉组织是体内胰岛素刺激的葡萄糖摄取的主要场所。对T2DM患者进行高血糖-高血胰岛素试验表明,肌肉中的胰岛素抵抗是由葡萄糖转运缺陷所致[1]。在T2DM中,葡萄糖转运子4(Glut-4)表达下调或者由胰岛素刺激引起的Glut-4的转位的功能被减弱,终将导致血糖升高[2]。过氧化物酶体增殖激活受体辅激活因子1α(PGC-1α),对机体葡萄糖代谢、脂肪酸β-氧化以及线粒体生物合成等多种生理功能起到主要调节作用。研究发现,胰岛素抵抗个体线粒体代谢的标志物的表达发生改变、线粒体功能下降,导致肥胖和脂质堆积,在胰岛素抵抗和2型糖尿病发病机制中起重要作用[3]。线粒体功能紊乱是引发骨骼肌胰岛素抵抗主要因素之一,线粒体功能性障碍致使ATP合成减少,导致胰岛素分泌减少,或引起胰岛素抵抗,导致T2DM的发生[4]。
本实验通过QRT-PCR的方法测定两组小型猪(2型糖尿病猪、未发病猪)的糖代谢及能量代谢等关键调控基因(PGC-1α、Glut-4、ERRα、NRF-1、TFAM)和线粒体基因(12SrRNA和16SrRNA)数量,探讨上述关键调控基因在2型糖尿病发生中所起到的作用。
1 材料与方法
1.1 动物与分组
选用高脂高糖饲养的广西巴马小型猪10头,15月龄,分为T2DM组和非T2DM组,每组根据实验需求随机选取3头,性别不限。均来自广西大学巴马小型猪繁育场封闭群【SCXK(桂)2013-0003】,饲养于广西大学动物遗传育种实验室小型猪繁育场内,饲养期间给予高脂高糖饲料(60%全价饲料,30%蔗糖,10%猪油),自由饮水。其中,T2DM组为自然诱导的2型糖尿病小型猪,非T2DM组为未发病小型猪;以连续两个月空腹血糖值大于6.3 mmol/L,或只有一次空腹血糖值大于6.3 mmol/L,且静脉葡萄糖耐量试验(IVGTT)60 min血糖值大于6.3 mmol/L为2型糖尿病的判断标准[5, 6]。在建模结束后,采集小型猪第6、7肋骨之间的骨骼肌(背最长肌)样品,装入灭菌的冻存管中立即置于液氮中冷冻,而后迅速转入-80℃冰箱备用。
1.2 RNA提取及RT-PCR
采用Trizol法提取广西巴马小型猪的骨骼肌总RNA,并以其为模板,用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(TaKaRa,日本)反转录合成cDNA。
1.3 线粒体基因组(mtDNA)的提取
线粒体基因组DNA参照TIANamp基因组DNA提取试剂盒(Tiangen,中国)从骨骼肌中提取。
1.4 引物设计与合成
根据NCBI上GenBank公布的普通猪的基因序列,设计并合成猪的相关基因QRT-PCR引物设计[7-10](表1),温度为60℃。所需引物由TAKARA大连宝生物公司和上海生工生物工程技术服务有限公司合成。

表1 定量PCR引物
1.5 实时荧光定量PCR反应
采用SYBR Green I染料法,以18S rRNA为内参基因,目的基因相对表达量采用2-△△Ct法计算目的基因相对定量结果,在Roche Light Cycler 480实时荧光定量PCR仪上进行PCR扩增和数据分析。
实时荧光定量PCR体系(20.0 μL):SYBR Premix Ex Taq(Roche,美国)10.0 μL,Prime-F(10 μmol/L)0.5 μL,Prime-R(10 μmol/L)0.5 μL,模板5.0 μL,ddH2O 补足至20.0 μL。反应程序:95℃预变性5 min;95℃ 10 s、60℃ 10 s、72℃ 20 s,进行40个循环。
2 结果与分析
2.1 广西巴马小型猪T2DM模型糖代谢相关血清生化指标测定
对比分析T2DM猪与非T2DM猪糖代谢相关指标,结果如表2所示[5]。比较发现,T2DM组的空腹血糖高于非T2DM组,差异有显著性(P<0.05),胰岛素水平和胰岛素敏感指数(ISI)差异无显著性(P>0.05)。
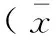
表2 两组小型猪糖代谢相关指标对比±s,n=3)
注:同列数值标“*”代表组内差异有显著性(P<0.05)。
Note. The mark “*” in the same column indicates a significant difference(P<0.05).
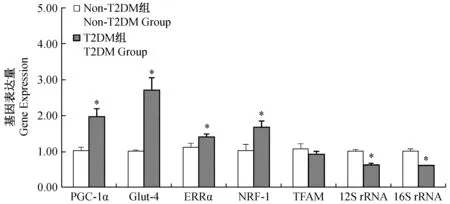
图1 广西巴马小型猪2型糖尿病模型相关调控基因表达情况Fig.1 T2 DM-related gene expression in the two groups of minipigs
2.2 两组小型猪骨骼肌IR关键调控基因表达差异
T2DM组和非T2DM组骨骼肌IR关键调控基因表达差异结果如图1所示。结果显示,在巴马小型猪骨骼肌中,T2DM组PGC-1α、Glut-4、ERRα及NRF-1的mRNA相对表达量均高于非T2DM组,差异有显著性(P<0.05),而TFAM相对表达量与非T2DM组差异无显著性(P>0.05)。在mtDNA基因数量的结果比较中发现, T2DM组12SrRNA以及16S rRNA的数量均低于非T2DM组,差异有显著性(P<0.05)。
2.3 关键调控基因表达差异与血清生化指标相关性分析
关键调控基因表达差异与血清生化指标相关性分析结果如表3所示。结果显示,血糖水平与PGC-1α、Glut-4和NRF-1基因呈正相关关系,差异有显著性(P<0.05),与12SrRNA和16SrRNA基因呈负相关关系,差异有显著性(P<0.05);胰岛素水平和ISI指数均与PGC-1α、Glut-4和NRF-1基因呈负相关关系,差异有显著性(P<0.05),与12SrRNA和16SrRNA基因呈正相关关系,差异有显著性(P<0.05);ERRα和TFAM基因与血糖、胰岛素和ISI指数相关关系差异无显著性(P>0.05)。
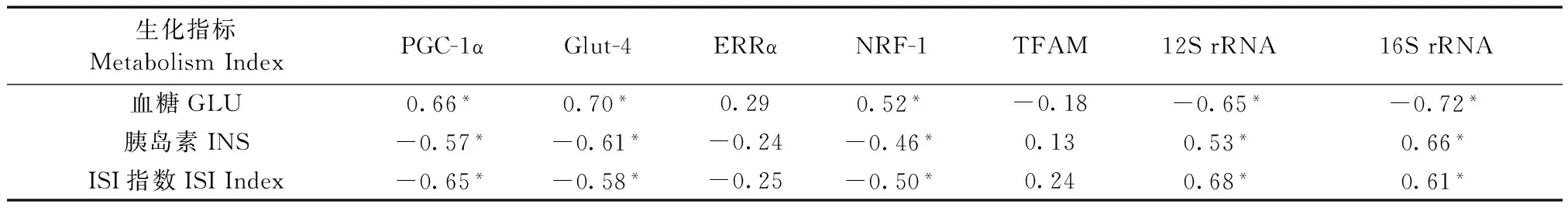
表3 关键调控基因表达差异与血清生化指标相关性分析
注:表中数值为相关系数(r)。
Note. Value in the table is the correlation coefficient (r).
3 讨论
肌肉葡萄糖的转运主要依赖于胰岛素敏感的Glut-4在质膜表面的聚集,Glut-4具有保持胰岛素敏感性,维持血糖平衡的作用,与2型糖尿病有着密切的关系。PGC-1α能通过协同激活MEF2C高效诱导Glut-4基因的表达,进而提高肌细胞转运葡萄糖的能力,降低血糖[11]。实验动物模型骨骼肌内PGC-1α的表达缺陷,能引起严重的胰岛素抵抗[12-16],从而导致T2DM的发生。雌激素受体相关受体α(ERRα)是PGC-1α的重要共转录因子,也是线粒体能量传递中脂肪酸氧化和氧化磷酸化的重要调节因子。PGC-1α通过辅激活ERRα基因,抑制葡萄糖的氧化,保持肌糖原储备[17]。PGC-1α或PGC-1α-ERRα复合体通过结合核呼吸因子(NRFs),调节线粒体氧化磷酸化作用(OXPHOS),刺激线粒体DNA复制和转录所必需的线粒体转录因子A(TFAM)的表达;TFAM表达上调可刺激ATP的合成[18],介导线粒体的生物发生,促进线粒体合成和数量增加[19, 20]。
本研究发现,小型猪的血糖水平、胰岛素水平和ISI等指标与所检测的基因相关关系明显,表明所检测的基因与T2DM的发展有着一定重要的联系。T2DM组骨骼肌中PGC-1α、Glut-4、ERRα及NRF-1的mRNA相对表达量均显著高于非T2DM组,推测T2DM小型猪骨骼肌需要PGC-1α的过量表达,从而诱导大量Glut-4来转运葡萄糖;高表达的PGC-1α又刺激下游基因ERRα和NRF-1的表达上调。而T2DM组mtDNA基因12SrRNA和16SrRNA的表达水平显著低于非T2DM组,前者的线粒体数量明显少于后者,能量代谢能力降低,对糖和脂肪酸的消化应用减少,过多的糖和脂肪酸沉积,引发骨骼肌胰岛素抵抗发生,进而诱发T2DM。该结果与Mootha等[21]的研究结果相似,他们发现部分T2DM患者的骨骼肌中线粒体OXPHOS相关靶基因的表达水平低于正常人。Patti等[22]的研究亦证实,在糖尿病及IR患者PGC-1α和NRFs的mRNA表达水平显著下调,并伴随着线粒体的形态异常。而在小鼠肌肉中超表达PGC-1α基因,可以成倍地增加肌肉线粒体的数量,ATP合成能力提高近60%,并增加脂肪酸转运相关基因的表达水平[23, 24]。
综上所述,推测机体骨骼肌中PGC-1α、Glut-4、ERRα、NRF-1和TFAM等调节能量代谢的基因表达增加,可以促进骨骼肌糖含量下降;而线粒体数量减少,则引起能量代谢水平下降,导致骨骼肌糖代谢异常,引发胰岛素抵抗,最终诱发T2DM。
[1] Watt MJ, Southgate RJ, Holmes AG, et al. Suppression of plasma free fatty acids upregulates peroxisome proliferator-activated receptor (PPAR) alpha and delta and PPAR coactivator 1alpha in human skeletal muscle, but not lipid regulatory genes [J]. J Mol Endocrinol, 2004, 33(2): 533-544.
[2] Maianu L, Keller SR, Garvey WT. Adipocytes exhibit abnormal subcellular distribution and translocation of vesicles containing glucose transporter 4 and insulin-regulated aminopeptidase in type 2 diabetes mellitus: implications regarding defects in vesicle trafficking [J]. J Clin Endocrinol Metab, 2001, 86(11): 5450-5456.
[3] Lowell BB, Shulman GI. Mitochondrial dysfunction and type 2 diabetes[J]. Science, 2005, 307(5708): 384-387.
[4] Petersen KF, Befroy D, Dufour S, et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance[J]. Science, 2003, 300(5622): 1140-1142.
[5] 梁家充.广西巴马小型猪2型糖尿病动物模型制作及相关基因多态性分析[D].广西大学,2011.
[6] 陈江伟.广西巴马小型猪2型糖尿病动物模制作及相关基因多态性分析[D].广西大学,2010.
[7] 姚国佳.PPARδ和Myoglobin基因表达对猪肉色的影响及机制研究 [D].浙江大学,2010.
[8] 单体中.Sirt1基因表达对猪脂肪分解的影响及其分子机制研究 [D].浙江大学,2008.
[9] 鞠大鹏.代谢性核受体ERRα在脂肪细胞甘油三酯积累过程中的作用研究[D].西北农林科技大学,2010.
[10] 严雪瑜,敖秋桅,严小东,等.广西巴马小型猪PGC-1α基因克隆与组织表达分析 [J].中国实验动物学报,2014,22(05): 27-31.
[11] Michael LF, Wu Z, Cheatham RB, et al. Restoration of insulin-sensitive glucose transporter (GLUT4) gene expression in muscle cells by the transcriptional coactivator PGC-1 [J]. Proc Natl Acad Sci U S A, 2001, 98(7): 3820-3825.
[12] Hara K, Tobe K, Okada T, et al. A genetic variation in the PGC-1 gene could confer insulin resistance and susceptibility to Type II diabetes [J]. Diabetologia, 2002, 45(5): 740-743.
[13] Kumashiro N, Tamura Y, Uchida T, et al. Impact of oxidative stress and peroxisome proliferator-activated receptor gamma coactivator-1alpha in hepatic insulin resistance [J]. Diabetes, 2008, 57(8): 2083-2091.
[14] De Filippis E, Alvarez G, Berria R, et al. Insulin-resistant muscle is exercise resistant: evidence for reduced response of nuclear-encoded mitochondrial genes to exercise [J]. Am J Physiol Endocrinol Metab, 2008, 294(3): E607-E614.
[15] Liu C, Lin JD. PGC-1 coactivators in the control of energy metabolism [J]. Acta Biochim Biophys Sin (Shanghai), 2011,43(4): 248-257.
[16] Holloway GP, Perry CG, Thrush AB, et al. PGC-1alpha’s relationship with skeletal muscle palmitate oxidation is not present with obesity despite maintained PGC-1alpha and PGC-1beta protein [J]. Am J Physiol Endocrinol Metab, 2008, 294(6): E1060-E1069.
[17] Wende AR, Huss JM, Schaeffer PJ, et al. PGC-1alpha coactivates PDK4 gene expression via the orphan nuclear receptor ERRalpha: a mechanism for transcriptional control of muscle glucose metabolism [J]. Mol Cell Biol, 2005, 25(24): 10684-10694.
[18] Finck BN, Kelly DP. Peroxisome proliferator-activated receptor gamma coactivator-1 (PGC-1) regulatory cascade in cardiac physiology and disease [J]. Circulation, 2007, 115(19): 2540-2548.
[19] Baar K. Involvement of PPAR gamma co-activator-1, nuclear respiratory factors 1 and 2, and PPAR alpha in the adaptive response to endurance exercise [J]. Proc Nutr Soc, 2004, 63(2): 269-273.
[20] Wu Z, Puigserver P, Andersson U, et al. Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1 [J]. Cell, 1999, 98(1): 115-124.
[21] Mootha VK, Lindgren CM, Eriksson KF, et al. PGC-1alpha-responsive genes involved in oxidative phosphorylation are coordinately downregulated in human diabetes [J]. Nat Genet, 2003, 34(3): 267-273.
[22] Patti ME, Butte AJ, Crunkhorn S, et al. Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes: Potential role of PGC1 and NRF1 [J]. Proc Natl Acad Sci U S A, 2003, 100(14): 8466-8471.
[23] Choi CS, Befroy DE, Codella R, et al. Paradoxical effects of increased expression of PGC-1alpha on muscle mitochondrial function and insulin-stimulated muscle glucose metabolism [J]. Proc Natl Acad Sci U S A, 2008, 105(50): 19926-19931.
[24] Tadaishi M, Miura S, Kai Y, et al. Skeletal muscle-specific expression of PGC-1alpha-b, an exercise-responsive isoform, increases exercise capacity and peak oxygen uptake [J]. PLoS One, 2011, 6(12): e28290.
Expression of skeletal muscle glucose and energy metabolism-related genes in Guangxi Bama minipigs with type 2 diabetes mellitus
YAN Xue-yu, JIANG Qin-yang, WU Yan-jun, LIANG Jia-chong, GUO Ya-fen, LAN Gan-qiu*
(College of Animal Science and Technology, Guangxi University,Nanning 530004,China)
Objective In this study, the glucose and energy metabolism-related genes (PGC-1α,Glut-4,ERRα,NRF-1,TFAMand mtDNA gene) were detected in type 2 diabetes mellitus (T2DM) and non-T2DM minipigs, and the gene function was explored for T2DM pathogenesis. Methods The longissimus muscle of T2DM and non-T2DM Guangxi Bama mini-pigs was used as experiment material. The expression of glucose and energy metabolism-related genes was detected by QRT-PCR. Results The expressions ofPGC-1α,Glut-4,ERRαandNRF-1 genes were significantly higher than that of non-T2DM group, the expressions of TFAM and mtDNA gene were lower than that of non-T2DM group. Conclusions The upregulated expression ofPGC-1αgene and its downstream genesGlut-4,ERRα,NRF-1 may improve the glucose metabolic functions in skeletal muscle in the Bama minipigs, whereas insufficient mitochondrial synthesis may induce decreasing ATP synthesis, and results in skeletal muscle insulin resistance, finally leading to the T2DM occurrence.
Guangxi Bama minipig; Diabetes mellitus, type 2, T2DM; Skeletal muscle; Insulin resistance
LAN Gan-qiu. E-mail: ganqiulan@gxu.edu.cn
国家自然科学基金项目(81360135);广西自然科学基金项目(2013GXNSFAA019187);国家现代农业产业技术体系广西生猪产业创新团队项目(NYCYTXGXCXTD-03-15)。
严雪瑜(1988-),女,博士,研究方向:动物遗传育种与动物疾病模型研究。E-mail: yanxueyu1122@qq.com
兰干球(1963-),博士,教授,博士生导师,主要从事动物分子遗传育种研究工作。E-mail: ganqiulan@gxu.edu.cn
研究报告
Q95-33
A
1005-4847(2016)05-0470-04
10.3969/j.issn.1005-4847.2016.05.006
2016-02-02

