基因沉默组织型转谷氨酰胺酶抑制SaOS-2细胞成骨分化
余慧镭,殷晓雪,陈仲强,冷慧杰,宋纯理,刘忠军
(北京大学第三医院骨科,北京 100191)
基因沉默组织型转谷氨酰胺酶抑制SaOS-2细胞成骨分化
余慧镭,殷晓雪*,陈仲强,冷慧杰,宋纯理,刘忠军
(北京大学第三医院骨科,北京 100191)
目的 研究组织型转谷氨酰胺酶(tissue transglutaminase, TG2)是否参与人SaOS-2细胞系成骨分化过程。 方法 使用携带短发夹RNA(short hairpin RNA, shRNA)的慢病毒转染SaOS-2细胞以敲减TG2表达,以SaOS-2细胞及转染了含阴性对照shRNA病毒的SaOS-2作为对照组,分别进行体外成骨诱导培养,并进行以下检测:诱导14 d后各组矿化情况(茜素红染色);诱导4、7 d后碱性磷酸酶活性及I型胶原、骨钙素、骨形态发生蛋白-2(BMP-2)的mRNA表达,并与诱导前的表达水平相比较。 结果 SaOS-2细胞组及转染阴性对照shRNA组在体外成骨诱导过程中I型胶原、骨钙素、BMP-2的mRNA表达和ALP活性逐渐增加,14 d时形成明显矿化结节,而TG2敲减后的SaOS-2细胞在诱导14 d时矿化水平显著低于对照组,诱导7 d时ALP活性及I型胶原、骨钙素、BMP-2的mRNA表达水平显著低于对照组。结论 组织型转谷氨酰胺酶参与SaOS-2细胞体外成骨分化及矿化。
组织型转谷氨酰胺酶;SaOS-2细胞;成骨分化
转谷氨酰胺酶是一组催化转酰胺反应的酶,由9个成员组成,其中组织型转谷氨酰胺酶(tissue transglutaminase, TG2)分布广泛,功能多样,近年来研究表明它可能在矿化与骨化过程中发挥重要作用[1]。TG2在肥大软骨细胞、成骨细胞、骨细胞和成牙质细胞中均有表达[2-3],与软骨细胞分化和基质矿化相关[4],参与软骨细胞向肥大前阶段的转化[5]。源于软骨细胞的TGs能促进前成骨细胞的矿化,而TG活性抑制剂能抑制体内外的成骨细胞分化及矿化[6-7]。目前已经在矿化组织基质中发现多种TG2蛋白交联活性的底物如I型胶原(collagen I, Col I)、纤连蛋白、骨桥蛋白等,它们可在TG2催化作用下进行蛋白交联反应,形成稳定的胶原网络,促进细胞外基质的形成与矿化[8]。另外,TG2在一些成骨相关的病理过程中起重要作用,比如血管钙化和胸椎黄韧带骨化[9-10]。在血管钙化发病过程中,TG2能诱导血管平滑肌细胞发生成骨细胞样转化[11],提示TG2具有促成骨的作用。
然而研究表明另外一种TG家族成员FXIIIA在骨和软骨细胞中也有表达并参与骨的矿化[12],其功能可能与TG2有重叠或代偿。为了进一步明确TG2在成骨分化和矿化过程中的作用,本课题使用基因沉默技术,特异性敲减成骨细胞系SaOS-2中TG2 mRNA的表达,观察是否会对细胞体外成骨分化产生影响。
1 材料与方法
1.1 细胞与培养
SaOS-2细胞由David R.Eyre教授(University of Washington Medical Center, Seattle, WA, USA)馈赠,使用含10%胎牛血清(Gibco)的DMEM高糖培养液(Hyclone)培养于5%CO2,37℃培养箱中,每2 d更换培养液。进行成骨诱导分化实验时,在细胞密度约为80%时将培养液更换为成骨诱导培养液,配方为DMEM高糖培养液中加入10%胎牛血清、10-8mol/L地塞米松、50 ng/mL抗坏血酸(Sigma)以及10 mmol/L β-甘油磷酸钠(Sigma)。
1.2 慢病毒转染
携带敲减TG2的shRNA的慢病毒(sc-37514-v)购于Santa Cruz公司,用不影响基因表达的阴性对照慢病毒(sc-108080)作为对照。在12孔板上以1×104/孔接种SaOS-2细胞,24 h后细胞密度达到约50%时,在各孔中分别加入相应病毒。6 d后,使用含嘌呤霉素的培养液筛选转染成功的细胞。在筛选10 d后检测TG2敲减效率。
1.3 半定量RT-PCR
细胞以5×104/皿接种培养于60 mm培养皿,到达干预时间时使用Trizol法提取RNA,取5 μg总RNA使用Goscript逆转录试剂盒(Promega)进行逆转录。然后通过半定量RT-PCR检测TG2、Col I、骨钙素(osteocalcin, OCN)、骨形态发生蛋白-2(bone morphogenetic protein-2, BMP-2)的mRNA表达,以β-肌动蛋白(β-actin)作为内参。引物使用Primer Premier软件设计并由奥科公司合成。引物序列及反应条件见表1。

表1 半定量RT-PCR使用引物列表
1.4 蛋白质印迹
细胞以5×104/皿接种培养于60 mm培养皿,到达干预时间时使用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度,制备用于蛋白印迹检测的蛋白样品。取30 μg蛋白上样,在10% SDS-PAGE凝胶中电泳,然后转移至硝酸纤维素膜,于含5%牛血清白蛋白的封闭缓冲液中室温封闭2 h后孵育TG2一抗(Santa Cruz)4℃过夜,然后孵育二抗常温30 min,于红外荧光扫描仪上进行条带显像。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)作为内参。对条件使用Image J软件进行灰度值分析。
1.5 碱性磷酸酶活性检测
细胞以1×104/孔接种于12孔板,到达干预时间时使用RIPA裂解液提取细胞总蛋白,以BCA法测定蛋白浓度。使用LabAssayTM ALP试剂盒(Wako)测定蛋白样品的碱性磷酸酶(alkaline phosphatase, ALP)活性。
1.6 矿化检测
细胞以5×104/皿接种培养于60 mm培养皿,到达干预时间时弃去皿中培养液并用PBS清洗两遍,使用4%中性甲醛4℃下固定20 min,随后使用pH 4.2的1%茜素红溶液室温下染色30 min,洗去浮色后分别在大体及镜下观察并采图。
1.7 转谷氨酰胺酶活性检测
细胞以1×104/孔接种于12孔板,到达干预时间时使用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度。取蛋白样品进行转谷氨酰胺酶活性检测,具体检测方法在前文中有详细介绍[13]。
1.8 数据分析
数据分析使用SPSS 14.0进行统计分析,各组数据均采用均值±标准差表示。组间资料分析采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 TG2 shRNA抑制了SaOS-2细胞中TG2的表达和TG酶活性
为了解转染TG2 shRNA的SaOS-2细胞(shTG2)中TG2表达敲减的效率,我们以转染scrambled shRNA的SaOS-2细胞(shScr)和野生型SaOS-2细胞(wide-type, wt)作为对照,在mRNA及蛋白水平检测TG2的表达水平以及TG酶活性,结果表明与wt组相比,shTG2组TG2的mRNA及蛋白表达水平均显著降低(图1a,1b),蛋白表达定量分析显示TG2蛋白表达降低约85%(图1c),TG活性相对于对照组降低60%(图1d),shScr组与wt组无明显差异。

注:细胞接种于12孔板,分别用携带TG2 shRNA和scrambled shRNA的慢病毒转染, A.半定量RT-PCR检测shTG2, shScr和wt SaOS-2中TG2的mRNA表达;B.蛋白印迹检测shTG2, shScr和wt SaOS-2中TG2的蛋白表达; C.三组细胞中TG2蛋白表达的半定量数据统计分析,数据均来源于3次重复实验,**P<0.01 vs wt; D. shTG2, shScr, wt, 0.25 μg TG标准品和0.5 μg TG标准品的TG活性检测,数据均来源于6次重复实验,*P<0.05 vs wt。图1 SaOS-2细胞TG2敲减效率Note. Cells were seeded in 12-well plate and infections of TG2 shRNA lentiviral particles and scrambled shRNA lentiviral particles were performed as described under “Methods and Materials”. A.Semiquantitative RT-PCR analysis on TG2 mRNA expression in shTG2,shScr and wild-type(wt) SaOS-2 cells. B.Western blotting analysis on TG2 expression in shTG2,shScr and wt SaOS-2 cells. C.Statistical analysis of TG2 protein expression. Data were combined from 3 duplicate experiments and reported as means ±SD. **P<0.01 vs wt(Dunnett test). D. TG activity analysis for shTG2, shScr, wt, 0.25 μg TG and 0.5 μg TG. Data were combined from 6 duplicate experiments and are reported as means ±SD. *P<0.05 vs wt(Dunnett test).Fig.1 Efficiency of TG2 knocking down in SaOS-2 cells by TG2 shRNA
2.2 TG2敲减抑制了SaOS-2细胞体外矿化
基质矿化是成骨分化的重要特征之一,为了探究TG2在SaOS-2细胞体外矿化中的作用,我们将shTG2、shScr和wt三组细胞分别培养于成骨诱导液及普通培养液,14 d后进行茜素红染色,在大体像及镜下观察,三组细胞在普通培养14 d后均为阴性染色,成骨诱导培养14 d后wt及shScr出现阳性染色,而shTG2染色明显较弱(图2)。

注:茜素红染色检测shTG2, shScr和wt SaOS-2在普通培养液或成骨诱导培养液中培养14 d后基质矿化,观察大体图及镜下图(×100),红色代表阳性染色,从三次重复实验中选取代表图像。(标尺=200 μm)图2 TG2敲减抑制SaOS-2细胞矿化Note. ShTG2,shScr and wt SaOS-2 cells were cultured in osteo-inductive medium or general medium for 14 days and the mineralization of the cultured cells was assessed using alizarin red staining. The bright red region represents positively stained region. All of the cultures were taken photos in both general view and microscopic view(×100), representative images from three separate experiments. Scale bar=200 μm.Fig.2 TG2 knockdown suppressed the mineral deposition in SaOS-2 cells
2.3 TG2敲减抑制SaOS-2细胞体外成骨分化
Col I、OCN及ALP参与成骨分化过程,并对胞外基质矿化有重要作用。在之前的研究中我们发现SaOS-2细胞以较低的水平表达Col I,OCN的mRNA并具有一定的ALP活性,而在诱导7 d后这些成骨指标水平显著提高[13]。本研究中结果显示shTG2组细胞在诱导培养7 d后ALP活性虽较诱导前升高,但显著低于相同处理的shScr和wt组(图3a),Col I和OCN的mRNA表达也在诱导培养7 d后显著低于shScr和wt组(图3b,3c),这表明TG2敲减抑制了成骨性分化。BMP-2是一种成骨分化因子并且参与细胞成骨分化的过程,与对照组相比,shTG2组细胞在诱导前及诱导4 d时BMP-2轻度降低,而在7 d时显著降低(图3b,3c),表明BMP-2可能参与TG2对成骨分化的调节。
3 讨论
SaOS-2细胞是一种成熟的用于研究人成骨分化的体外实验模型,它在培养于成骨诱导培养液时会进行成骨分化及矿化,表现为Col I、OCN、ALP活性等成骨指标水平增高及形成矿化基质[14]。在之前的研究中我们发现,SaOS-2细胞在诱导培养7 d后,TG2的表达和TG活性都显著增加,而且SaOS-2细胞的成骨分化过程会被TG活性抑制剂所阻滞[13],以小鼠前成骨细胞系MC3T3-E1为模型的实验也得到了类似结果[6],但是TG2是否在成骨分化中起作用仍不明确,由于TG家族的其他成员也能发挥出TG活性,所以在SaOS-2细胞的成骨分化过程中起作用的TG活性有可能是由其他成员提供。另外,TG2(-/-)小鼠并没有表现出异常的骨骼表型,提示TG2在骨骼系统的发育中可能并不重要[15]。然而,近期研究表明基因敲除实验的结果可能会受代偿网络的影响[16],所以TG2敲除小鼠的正常骨骼表型可能是由于FXIIIA、TGF-β或其他因子的代偿作用。由于转录水平的敲减不会引起这种代偿作用[16],那么本研究使用shRNA敲减TG2可能会为认识TG2在成骨中的作用提供进一步的证据,以阐明TG2是否参与SaOS-2细胞成骨分化及矿化。SaOS-2细胞在使用shRNA敲减TG2后,TG2的蛋白表达降低了约85%,TG活性降低60%,这表明TG2敲减模型成功建立并且TG2是SaOS-2细胞中TG酶活性的重要来源。
TG2敲减后,SaOS-2细胞矿化能力显著降低,说明TG2在其矿化中起重要作用。成骨诱导后SaOS-2细胞中Col I、OCN的表达以及ALP活性的升高也被TG2所抑制,说明TG2表达的减少抑制了SaOS-2细胞的成骨分化。
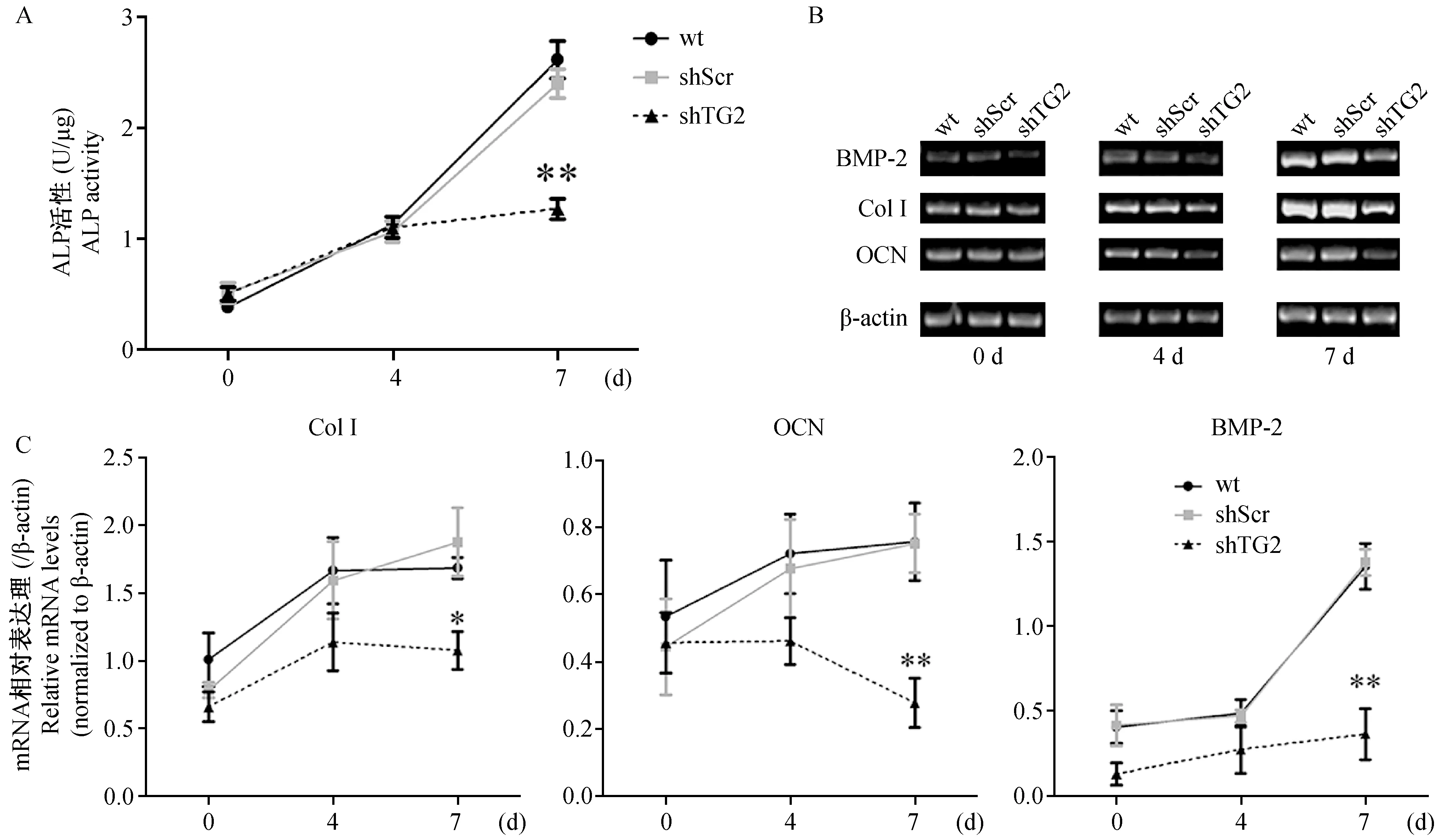
注:shTG2, shScr和wt SaOS-2分别在成骨诱导液中培养0、4、7 d。 A.碱性磷酸酶活性检测,数据均来源于6次重复实验,*P<0.05 vs wt; B.半定量RT-PCR检测Col I、OCN和BMP-2的mRNA表达; C. Col I、OCN和BMP-2的mRNA表达的灰度值统计分析,数据均来源于3次重复实验,*P<0.05 vs wt , **P<0.01 vs wt。图3 TG2敲减抑制SaOS-2细胞成骨分化Note. Cells were cultured in osteo-inductive medium for 0, 4 and 7 days. A. Alkaline phosphatase activity was measured as described in “Methods and Materials”. Data were combined from 6 duplicate experiments and reported as means±SD. **P<0.01 vs wt (Dunnett test). B. Semiquantitative RT-PCR analysis of BMP-2, Col I and OCN mRNA expression in the shTG2, shScr and wt cells. C. Statistical analysis of BMP-2, Col I and OCN mRNA expression. Data were collected from 3 duplicate experiments and reported as means±SD. *P<0.05 vs wt cells (Dunnett test), **P<0.01 vs wt cells (Dunnett test).Fig.3 TG2 knockdown suppressed the osteoblastic differentiation of SaOS-2 cells
TG活性参与矿化组织发育过程已经得到共识[4],并且其机制已经进行了一些研究。I型胶原-纤连蛋白交联产物是成骨分化过程中胞外基质形成所不可缺少的[17],而TG活性在I型胶原-纤连蛋白交联产物的组装及成熟过程中起重要作用[6]。本实验中发现TG2敲减后TG活性显著降低,Col I表达减少,细胞外基质矿化明显受抑,所以TG2可能通过TG活性参与调节成骨性分化。另外有研究表明,TG2对胶原的修饰能促进人成骨细胞的黏附、增殖、分化及矿化[18],这也为TG2通过蛋白交联活性参与人成骨分化过程提供了更多的证据。
BMP-2是TGF-β家庭的成员并且通过多种信号通路包括MAPK、Wnt等参与骨骼发育和骨折修复[19],本实验中我们发现SaOS-2细胞分化过程中BMP-2表达的增加被TG2敲减所抑制,那么BMP-2的表达降低可能参与了TG2敲减对成骨分化的抑制。总之,我们的结果直接证明了TG2在SaOS-2细胞的矿化和成骨性分化中起重要作用,并且其机制可能包括调节细胞外基质组装和BMP-2的表达。
TG2和FXIIIA是TG家族中表达于骨、软骨和牙齿等矿化组织的成员[1; 20],近期有研究表明在小鼠MC3T3-E1细胞成骨分化中起主要作用的是FXIIIA而不是TG2。然而我们在之前的实验中发现TG2的表达水平在SaOS-2细胞成骨分化过程中逐渐增加[13],本实验中我们发现特异性沉默TG2能抑制SaOS-2细胞的成骨性分化和矿化,所以TG2在SaOS-2细胞成骨分化中起重要作用。我们的结果与上述研究的差别可能是由于两种细胞的不同或者细胞种属的不同。本研究确定了TG2与SaOS-2细胞体外成骨分化和矿化之间的关系,在TG2基因沉默后,SaOS-2细胞的成骨分化和矿化部分受抑,说明TG2是人成骨分化过程中所必需的因子。另外,TG2对人成骨细胞的调节作用可能与胞外基质的装配和BMP-2的表达有关。我们的研究为认识TG2在人成骨分化和矿化中的作用提供了进一步的证据。
[1] Nurminskaya MV, Belkin AM. Cellular functions of tissue transglutaminase. In: Jeon Kw Ed.Int Rev Cell Mol Biol,2012,294:1-97.
[2] Kaartinen MT, El-maadawy S, Rasanen NH, et al. Tissue transglutaminase and its substrates in bone [J]. J Bone Mineral Res. 2002, 17(12):2161-2173.
[3] Kaartinen MT, Sun W, Kaipatur N, et al. Transglutaminase crosslinking of sibling proteins in teeth [J]. J Dental Res, 2005, 84(7):607-612.
[4] Nurminskaya M, Kaartinen MT. Transglutaminases in mineralized tissues [J]. Front Biosci, 2006, 11: 1591-1606.
[5] Nurminsky D, Shanmugasundaram S, Deasey S, et al. Transglutaminase 2 regulates early chondrogenesis and glycosaminoglycan synthesis [J]. Mech Dev, 2011, 128(3-4):234-245.
[6] Al-jallad HF, Nakano Y, Chen JL, et al. Transglutaminase activity regulates osteoblast differentiation and matrix mineralization in mc3t3-e1 osteoblast cultures [J]. Matrix Biol, 2006, 25(3):135-148.
[7] Deasey S, Grichenko O, Du S, et al. Characterization of the transglutaminase gene family in zebrafish and in vivo analysis of transglutaminase-dependent bone mineralization [j]. Amino Acids, 2012, 42(2-3):1065-1075.
[8] Watanabe K, Tsunoda K, Itoh M, et al. Transglutaminase 2 and factor XIII catalyze distinct substrates in differentiating osteoblastic cell line: utility of highly reactive substrate peptides [J]. Amino Acids, 2013, 44(1):209-214.
[9] Beazley KE, Deasey S, Lima F, et al. transglutaminase 2-mediated activation of beta-catenin signaling has a critical role in warfarin-induced vascular calcification [J]. Arteriosc Thromb Vasc Biol, 2012, 32(1):123-u302.
[10] Yin XX, Chen ZQ, Guo ZQ, et al. Tissue transglutaminase expression and activity in human ligamentum flavum cells derived from thoracic ossification of ligamentum flavum [J]. Spine, 2010, 35(20):e1018-e1024.
[11] Johnson KA, Polewski M, Terkeltaub RA. Transglutaminase 2 is central to induction of the arterial calcification program by smooth muscle cells [J]. Circ Res, 2008, 102(5):529-537.
[12] Al-jallad HF, Myneni VD, Piercy-kotb SA, et al. Plasma membrane factor XIIIA transglutaminase activity regulates osteoblast matrix secretion and deposition by affecting microtubule dynamics [J]. Plos One, 2011, 6(1): e1589.
[13] Yin XX, Chen ZQ, Liu ZJ, et al. Tissue transglutaminase (tg2) activity regulates osteoblast differentiation and mineralization in the SAOS-2 cell line [J]. Braz J Med Biol Res, 2012, 45(8):693-700.
[14] Prideaux M, Wijenayaka AR, Kumarasinghe DD, et al. SSOS2 osteosarcoma cells as an in vitro model for studying the transition of human osteoblasts to osteocytes [J]. Calc Tissue Int, 2014, 95(2):183-193.
[15] Cordell PA, Newell LM, Standeven KF, et al. Normal bone deposition occurs in mice deficient in factor XIII-a and transglutaminase 2 [J]. Matrix Biol, 2015, 43: 85-96.
[16] Rossi A, Kontarakis Z, Gerri C, et al. genetic compensation induced by deleterious mutations but not gene knockdowns [J]. Nature, 2015, 524(7564):230-233.
[17] Marsh ME, Munne AM, Vogel JJ, et al. Mineralization of bone-like extracellular-matrix in the absence of functional osteoblasts [J]. J Bone Mineral Res, 1995, 10(11):1635-1643.
[18] Fortunati D, Chau DY, Wang Z, et al. Cross-linking of collagen I by tissue transglutaminase provides a promising biomaterial for promoting bone healing [J]. Amino Acids, 2014, 46(7):1751-1761.
[19] Rahman MS, Akhtar N, Jamil HM, et al. Tgf-beta/bmp signaling and other molecular events: regulation of osteoblastogenesis and bone formation [J]. Bone Res, 2015, 3:15005.
[20] Lismaa SE, Mearns BM, Lorand I, et al. Transglutaminases and disease: lessons from genetically engineered mouse models and inherited disorders [J]. Physiol Rev, 2009, 89(3):991-1023.
Knockdown of tissue transglutaminase in SaOS-2 cell line inhibits its osteoblastic differentiation and mineralization
YU Hui-lei, YIN Xiao-xue*, CHEN Zhong-qiang, LENG Hui-jie,SONG Chun-li, LIU Zhong-jun
(Department of Orthopedics, Peking University Third Hospital, Beijing 100191, China)
Objective To investigate whether TG2 plays an important role in the osteoblast differentiation and mineralization. Methods TG2 mRNA of SaOS-2 cells was knocked down using a lentivirus stably expressing short-hairpin(sh) RNA targeting TG2.Then the cells were cultured in osteo-inductive medium for 14 d to measure mineralization and for 7 d to measure the levels of osteoblastic differentiation markers including ALP activity and mRNA of collagen I, osteocalcin(OCN) and BMP-2.The wild-type SaOS-2 cells and scrambled shRNA-transducted SaOS-2 cells served as the controls. Results The controls displayed an increasing trend of the level of ALP activity and mRNA of collagen I, osteocalcin and BMP-2,and notable mineralization at 14 d.When TG2 was knocked down, ALP activity, mRNA of collagen I, osteocalcin and BMP-2 at 7d,and mineralization at 14 d were all significantly lower in comparison with the corresponding values in the controls.Conclusion TG2 is involved in the differentiation and mineralization of osteoblasts in vitro.
Tissue transglutaminase;SaOS-2 cell line; Osteoblastic differerntiation
YIN Xiao-xue.E-mail: luckyemail2008@sina.com
国家自然科学基金(编号:81101334)。
余慧镭(1992 -),男,硕士,主要从事成骨细胞方面的研究,E-mail: yuhuileixs@126.com
殷晓雪(1972-),女,博士,副研究员,主要从事成骨细胞及细胞外基质研究。E-mail: luckyemail2008@sina.com
研究报告
Q95-33
A
1005-4847(2016)05-0448-06
10.3969/j.issn.1005-4847.2016.05.002
2016-03-08

