MRI引导放射治疗研究进展
邵雨卉 付 杰
MRI引导放射治疗研究进展
邵雨卉 付 杰
MRI 引导放射治疗可以实现最佳的影像诊断准确度和精准的治疗效果。放射治疗和MRI技术迅速发展使放射治疗精确化、个体化成为现实。MRI 引导放射治疗在靶区勾画、治疗计划制定、在线实时引导及其设备、MRI引导质子治疗等方面均得到广泛研究。
磁共振成像;放射治疗
近来MRI在放射治疗的靶区勾画、治疗计划制定、放疗的在线引导等方面均得到广泛研究、其目的是使放射治疗更加精确化、个体化。本文汇集近年来文献对MRI引导放射治疗研究进展综述如下。
MRI引导放射治疗靶区勾画
准确勾画靶区是精确放疗的基础和保证,肿瘤靶区勾画的准确性将直接影响肿瘤局部控制率和周围关键器官毒副反应。CT对电子密度差异小的相邻解剖结构分辨能力差(如肿瘤和软组织之间)。MRI可以明显改善软组织分辨能力,且MRI为多参数成像,具有更丰富的信息;MRI可以更早期、更细致地显示肿块与周围组织结构的解剖关系,从而清楚显示肿瘤侵犯范围,有利于靶区的确定及放射治疗计划的个体化。
MRI引导放射治疗计划计算
MRI/CT影像配准的系统误差将会贯穿整个治疗过程。MRI引导放射治疗计划计算的优势在于避免了该误差的产生,减少CT扫描、简化流程、降低费用,并减少辐射。由于MRI无法直接提供电子密度信息,需要从MRI数据中转换出等效电子密度数据。方法主要有手工赋值法(manual bulk density assignment),图谱赋值法(atlas methods)和像素转换法(voxelwise conversion)。
1.手工赋值法(manual bulk density assignment)
对于解剖结构复杂的部位,手动勾画不同解剖结构(骨、肺、软组织等),并相应赋予不同的电子密度值可增加剂量计算的精确性。利用这种方法颅内肿瘤的剂量误差大约为1%[1,2],前列腺癌的剂量误差大约在1%~2%之间[1,3]。对于胸部肿瘤,通过对软组织和肺的电子密度赋值,也可实现剂量计算的高精确性[1]。该方法未能临床广泛应用主要原因在于耗时、费力、效率低。手工赋值法适用于单一均匀组织的MRI引导放疗计划制定。
Chin Comput Med Imag,2016,22∶491-494
Department of Radiation Oncology, The 6th People’s Hospital of Shanghai Jiaotong University
Address: 600 Yishan Rd, Shanghai 200233, P.R.C.
Address Correspondence to FU Jie (E-mail: fujieqing@hotmail.com)
2.图谱赋值法
利用MRI图像集自动生成电子密度数据,采用变形配准方法赋予患者MRI电子密度信息,其剂量计算结果与手工赋值法相仿。该方法的优点是自动化完成、效率高。Dowling等人的研究表明图谱赋值法在剂量计算上的误差小于2%[4]。图谱赋值法依赖于图像配准方法,不适用于解剖结构分辨率低的解剖部位,配准还存在误差问题。
3.体素转换法(voxelwise conversion)
超短回波(ultrashort echotime,UTE)研究可以使MRI体素强度转换为电子密度值。使用不同的回波时间区分具有不同T2、T1弛豫时间的组织。利用自动影像分割、手工密度赋值、连续或近于连续的基于模型的转换来实现从UTE 图像生成电子密度数据。该方法在颅内病变的中心点剂量差异均在+/-0.5%以内[5]。然而T2、T1与场强无线性相关,增大了转换电子密度值的不确定性。另外成像范围小,仅局限于头部,仍需进一步研究。
MRI功能成像引导放射治疗
MRI功能定量成像可一次成像提供解剖和功能信息,是评估肿瘤放射治疗反应的重要工具。MRI功能定量成像可以用来量化放射治疗引起的放射靶区和危及器官的功能变化,疗前的功能变化数据可以用于检测肿瘤的放射敏感性、评价疗效,并进一步在放疗过程中优化放疗计划,如改变分割剂量,优化治疗靶区并提高靶区剂量[6],从而获得最佳的治疗结果。
1.弥散加权成像(diffusion weighted imaging,DWI )
可以从分子水平早期监测放疗疗效并评估预后。已有研究表明[7-10],在头颈部肿瘤、前列腺癌、妇科肿瘤中,DWI能非创伤性地早期敏感地评估放疗疗效和预后。
2.灌注成像(perfusion weighted imaging,PWI)
能够在活体上快速而几乎无创的量化反映肿瘤微血管生成及分布情况,从而达到评价恶性程度及放疗反应的目的。
3.磁共振波谱成像(magnetic resonance spectroscopy imaging, MRS)
由于代谢异常通常早于结构变化,可以在放疗计划的制定和实施过程中更科学地确定靶区的范围,在肿瘤放疗后的进展观察、反应评估以及预后的评价也有积极的意义。Rock等采用MRS来鉴别放射性坏死和肿瘤复发,并在MRS检查后48 h内行立体定向活检证实,Cho/Cr和Lip-Lac/Cho可以用于鉴别肿瘤和坏死组织[11]。Tarnawski等的研究证实对于恶性胶质瘤,Lac/NAA是重要的预后因子[12]。
4.其他
研究发现动态对比-增强MRI(dynamic contrast-enhanced MRI,DCE- MRI)可以用于检测宫颈癌的氧合水平及放射治疗后疗效的评估[13-15]。Hoskin等[16]发现,BOLD-MRI检测前列腺肿瘤内缺氧具有高灵敏度和低特异性。BOLD效应还受血流量、血红蛋白水平和脉管等因素的影响。
MRI功能定量成像应用在放射治疗的评估中还存在以下挑战,包括数据可复性、生物标记解读、图像质量和数据分析等。功能定量MRI引导放疗发展还需要全面的研究。
MRI在线引导放疗设备进展
MRI在线引导放疗(magnetic resonanceguided radiotherapy,MRgRT)设备研发的主要挑战是磁场与射线的相互作用,3个主要技术障碍是MRI磁场干扰、射频干扰和射线在磁场中的传输。2009年Raaymakers B W 等研究显示在放疗同时进行高品质的MRI是可行的[17]。
1.设备
迄今为止,已有5种MRgRT设备解决方案(表1,图1)[18]。
2.磁场和射线的相互影响
2.1场强的影响:高场强产生高信噪比(signal to noise ratio ,SNR),提高时间或空间分辨率,提高对比度,提供信息丰富的高质量图像。但也会增加伪影,引起几何失真。 Baldwin及Crijns等为MRgRT系统研发了专用于放射治疗的MRI几何校正算法[20,21]。
2.2磁场对剂量分布的影响:射线次生电子会受磁场影响,影响的大小决定于场强和入射射束的方向。垂直于射束的磁场,会导致建成距离缩短和不对称半影,主要发生在组织-空气界面。受磁场影响,次生电子将因受洛伦兹力而返回,导致界面局部剂量增加,即电子折返效应(electron return effect ,ERE)。ERE的程度取决于放射野的大小、磁场强度和表面方向。Raaymakers 等认为对穿野照射可以抵消电子折返效应的影响[22],当IMRT使用多个对穿野时可以补偿电子折返效应[23]。平行于射束的磁场,对组织-空气界面的影响较小,然而,来自辐射源和空气柱的污染电子,通过平行磁场被光子束捕获,可潜在增加入射时的剂量[24,25]。对于现实MRI杂散磁场,这种影响可能是有限的[26],有待进一步调查研究。
磁场会影响剂量探测器的准确性,特别是电离室。通过蒙特卡罗模拟的NE2571 Farmer-type电离室[27]实验显示,取决于1.5 T磁场的方向的不同,响应变化最大可达11%。
2.3辐射对磁共振RF线圈的影响:研究显示MRI接收线圈尺寸小,可忽略其对射野的影响[28]。Burke等研究表明低强度磁场中RF线圈受照射可产生辐射感应电流[29]。Hoogcarspel等研究显示在1.5T(64兆赫)时,照射RF线圈不会降低信噪比[28]。
MRI引导的质子放疗
Bragg峰带来的陡峭的剂量梯度变化导致质子比光子放疗更需要实时解剖定位,迫切要求高精度图像引导以发挥质子放疗的优势,减少正常组织受照射。质子本身为带电粒子,光束轨迹会受磁场影响发生偏移,这可以通过计算分析[30]。因为磁场中的次生电子在质子放疗中相对于光子放疗中的相对能量更低,其影响可以忽略不计[31]。目前MRI引导的质子放疗还处于早期研究阶段。
展 望
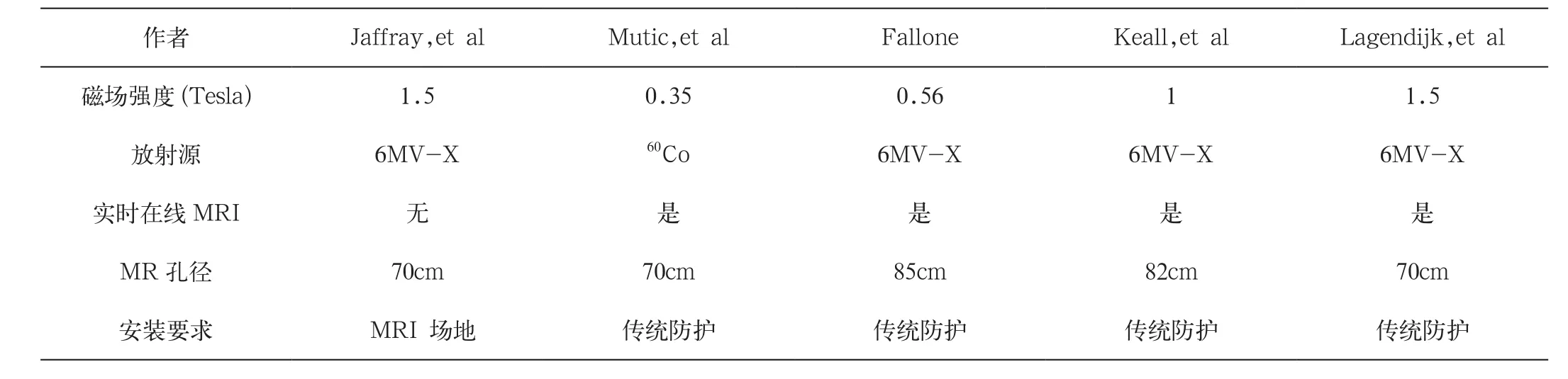
表1 MRgRT设备解决方案
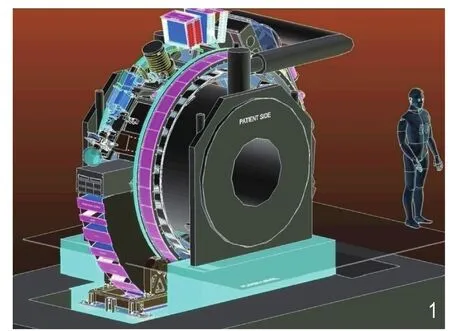
图1 荷兰的乌德勒支大学医学中心、医科达和飞利浦公司共同研发的MRgRT设备示意图[19]。
MRI在放疗计划制定和实施过程中更精准地确定靶区的范围;在肿瘤放疗过程中的监测肿瘤变化、评估治疗反应以及预后;MRI可减少近距离治疗过程操作者依赖,量化并增加治疗的精确性;MRI在线引导放射治疗将对目前放疗产生巨大的影响。虽然这些技术尚未常规应用于临床,但潜在地可能改变放射治疗方式,值得深入开展研究。
[ 1 ]Jonsson JH, Karlsson MG, Karlsson M, et al. Treatment planning using MRI data: An analysis of the dose calculation accuracy for different treatment regions. Radiat Oncol,2010,5:62.
[ 2 ]Stanescu T, Jans HS, Pervez N, et al. A study on the magnetic resonance imaging (MRI)-based radiation treatment planning of intracranial lesions. Phys Med Biol. 2008,53:3579-93.
[ 3 ]Kim J, Garbarino K, Schultz L, et al. Dosimetric evaluation of synthetic CT relative to bulk density assignment-based magnetic resonance-only approaches for prostate radiotherapy. Radiat Oncol,2015,10:239.
[ 4 ]Dowling JA, Lambert J, Parker J, et al. An atlas-based electron density mapping method for magnetic resonance imaging (MRI)-alone treatment planning and adaptive MRI-based prostate radiation therapy. Int J Radiat Oncol Biol Phys, 2012,83: e5-11.
[ 5 ]Jonsson JH, Johansson A, Söderström K, et al. Treatment planning of intracranial targets on MRI derived substitute CT data. Radiother Oncol, 2013,108:118-22.
[ 6 ]van der Heide UA, Houweling AC, Groenendaal G, et al. Functional MRI for radiotherapy dose painting. Magn Reson Imaging, 2012,30:1216-1223.
[ 7 ]Hamstra DA, Galbán CJ, Meyer CR, et al. Functional diffusion map as an early imaging biomarker for high-grade glioma: correlation with conventional radiologic response and overall survival. J Clin Oncol,2008,26:3387-3394.
[ 8 ]King AD, Chow KK, Yu KH, et al. Head and neck squamous cell carcinoma: diagnostic performance of diffusion-weighted MR imaging for the prediction of treatment response. Radiology,2013,266:531-538.
[ 9 ]Vargas HA, Akin O, Franiel T, et al. Diffusion-weighted endorectal MR imaging at 3 T for prostate cancer: tumor detection and assessment of aggressiveness. Radiology,2011,259:775-84.
[10]Mayr NA, Huang Z, Wang JZ, et al. Characterizing tumor heterogeneity with functional imaging and quantifying high-risk tumor volume for early prediction of treatment outcome: cervical cancer as a mode. Int J Radiat Oncol Biol Phys,2012,83:972-9.
[11]Rock JP, Hearshen D, Scarpace L, et al. Correlations between magnetic resonance spectroscopy and image-guided histopathology, with special attention to radiation necrosis. Neurosurgery,2002,51:912-919.
[12]Tarnawski R, Sokol M, Pieniazek P, et al. 1H-MRS in vivo predicts the early treatment outcome of postoperative radiotherapy for malignant gliomas. Int J Radiat Oncol Biol Phys,2002,52:1271-1276.
[13]Horsman MR, Mortensen LS, Petersen JB, et al. Imaging hypoxia to improve radiotherapy outcome. Nat Rev Clin Oncol,2012,9:674-687.
[14]Cooper RA, Carrington BM, Loncaster JA, et al. Tumour oxygenation levels correlate with dynamic contrast-enhanced magnetic resonance imaging parameters in carcinoma of the cervix. Radiother Oncol,2000,57:53-59.
[15]Halle C, Andersen E, Lando M, et al. Hypoxia-induced gene expression in chemoradioresistant cervical cancer revealed by dynamic contrastenhanced MRI. Cancer Res,2012,72:5285-5295.
[16]Hoskin PJ, Carnell DM, Taylor NJ, et al. Hypoxia in prostate cancer: correlation of BOLD-MRI with pimonidazole immunohistochemistryinitial observations . Int J Radiat Oncol Biol Phys,2007,68:1065-1071.
[17]Raaymakers BW, Lagendijk JJ, Overweg J, et al. Integrating a 1.5 T MRI scanner with a 6 MV accelerator: proof of concept.Phys Med Biol, 2009,54:N229-237.
[18]Ménard C, van der Heide U. Introduction: Systems for magnetic resonance image guided radiation therapy. Semin Radiat Oncol,2014,24:192.
[19]Lagendijk JJ, Raaymakers BW, van Vulpen M. The magnetic resonance imaging-linac system. Semin Radiat Oncol,2014,24:207-209.[20]Baldwin LN, Wachowicz K, Fallone BG.A two-step scheme for distortion rectification of magnetic resonance images. Med Phys, 2009,36:3917-3926.
[21]Crijns SP, Raaymakers BW, Lagendijk JJ.Proof of concept of MRI-guided tracked radiation delivery: tracking one-dimensional motion. Phys Med Biol,2012,57:7863-7872.
[22]Raaymakers BW, Raaijmakers AJ, Kotte AN, et al. Integrating a MRI scanner with a 6 MV radiotherapy accelerator: dose deposition in a transverse magnetic field. Phys Med Biol,2004,49:4109-4118.
[23]Raaijmakers AJ, Raaymakers BW, Lagendijk JJ. Magnetic-fieldinduced dose effects in MR-guided radiotherapy systems: dependence on the magnetic field strength. Phys Med Biol, 2008,53:909-923.
[24]St Aubin J, Santos DM, Steciw S, et al.Effect of longitudinal magnetic fields on a simulated in-line 6 MV linac . Med Phys,2010,37:4916-4923.
[25]Oborn BM, Metcalfe PE, Butson MJ, et al. Electron contamination modeling and skin dose in 6 MV longitudinal field MRIgRT: Impact of the MRI and MRI fringe field. Med Phys,2012,39:874-890.
[26]Keyvanloo A, Burke B, Warkentin B, et al. Skin dose in longitudinal and transverse linac-MRIs using Monte Carlo and realistic 3D MRI field models. Med Phys, 2012,39:6509-6521.
[27]Meijsing I, Raaymakers BW, Raaijmakers AJ, et al. Dosimetry for the MRI accelerator: the impact of a magnetic field on the response of a Farmer NE2571 ionization chamber. Phys Med Biol,2009,54:2993-3002.
[28]Hoogcarspel SJ, Crijns SP, Lagendijk JJ, et al. The feasibility of using a conventional flexible RF coil for an online MR-guided radiotherapy treatment. Phys Med Biol, 2013,58:1925-1932.
[29]Burke B, Wachowicz K, Fallone BG, et al. Effect of radiation induced current on the quality of MR images in an integrated linac-MR system. Med Phys, 2012,39:6139-6147.
[30]Wolf R, Bortfeld T. An analytical solution to proton Bragg peak deflection in a magnetic field. Phys Med Biol,2012,57:N329-337.
[31]Raaymakers BW, Raaijmakers AJ, Lagendijk JJ. Feasibility of MRI guided proton therapy: magnetic field dose effects. Phys Med Biol, 2008,53:5615-5622.
Progress of Magnetic Resonance Imagine Guided Radiotherapy
SHAO Yu-hui,FU Jie
MRI guided radiotherapy is capable of providing the most precise image diagnosis and outstanding performance of treatment. With the significant development of the technique nowadays, it is possible to apply accurate customized radiotherapy treatment with MRI. The potential applications of MRI in tumor contouring, treatment planning, online-IGRT, and proton therapy has been under active investigation.
MRI,Radiation therapy
R8144.42
B
1006-5741(2016)-05-0491-04
中国医学计算机成像杂志,2016,22∶491-494
∶上海交通大学附属第六人民医院肿瘤放疗科
通信地址:上海市徐汇区宜山路600号肿瘤放疗科 ,上海 200233
∶付杰(电子邮箱∶fujieqing@hotmail.com)
2016.08.31;修回时间:2016.09.02)

