经皮电刺激联合减重跑台训练对完全性脊髓损伤大鼠胶质源性神经营养因子及RhoA表达的影响
蔡洪梅,王维,马頔,王文娟,易添,周晓红
经皮电刺激联合减重跑台训练对完全性脊髓损伤大鼠胶质源性神经营养因子及RhoA表达的影响
蔡洪梅1,王维2,马頔1,王文娟2,易添1,周晓红2
(锦州医科大学 1.研究生院;2.附属第一医院康复科,辽宁 锦州 121000)
目的研究经皮电刺激联合减重跑台训练对完全性脊髓损伤大鼠胶质源性神经营养因子(GDNF)及RhoA表达的影响,探讨其存在的可能机制。方法将108只成年雌性SD大鼠随机均分为6组:正常组(A组)、假损伤组(B组)、损伤组(C组)、电刺激组(D组)、训练组(E组)、电刺激+训练组(F组)。术后第5天对D、E、F组进行相应的干预治疗,在治疗前后对所有大鼠进行BBB评分,并检测治疗1、3、7、14、21、28 d后损伤脊髓处的GDNF与RhoA的表达。结果从治疗第7天开始,与C组比较,D、E、F组的BBB评分、GDNF表达都增高(P<0.05),RhoA的表达降低(P<0.05),且F组BBB评分、GDNF、RhoA表达差异更为显著(P<0.01);正常组与假损伤组比较,BBB评分、GDNF、RhoA表达无统计学差异(P>0.05)。结论经皮电刺激与减重跑台训练能有效改善损伤脊髓的功能重建,其作用机制与GDNF、RhoA的表达变化有关;经皮电刺激与减重跑台训练联合应用对大鼠运动功能恢复的治疗作用更明显,并适合长时间使用。
经皮电刺激;减重跑台训练;完全性脊髓损伤;胶质源性神经营养因子;RhoA
网络出版地址
脊髓损伤(spinal cord injury,SCI)作为一种高致残性疾病,造成患者肢体感觉、运动功能障碍等生理损伤的同时还给心理带来严重压力,对其回归社会有很大的影响。大量研究[1]表明SCI危害巨大主要源于继发性损伤,即神经元继发性凋亡和脊髓损伤局部微环境的形成。经皮电刺激与减重跑台训练作为干预治疗措施已被证实对改善SCI后遗症、促进患者回归社会家庭有效[2]。但对两者的联合应用目前未见相关报道。
近年来,研究[3]发现胶质源性神经营养因子(glial cell line⁃derived neurotrophic factor,GDNF)可维持脊髓运动神经元存活,抗神经元凋亡,实现运动功能重建,RhoA在轴突再生抑制性因子诱导脊髓神经元细胞骨架塌陷的过程中起到关键作用[4],针对GDNF和RhoA相关药物与基因重组治疗脊髓损伤的研究成为了热点,但其给药途径和安全性问题也相继出现[5],因此,本实验将经皮电刺激与减重跑台训练联合应用于脊髓损伤大鼠模型,检测脊髓损伤大鼠GDNF、RhoA在脊髓中的表达,探讨经皮电刺激与减重跑台训练对脊髓损伤存在的可能机制,为临床研究开辟新思路提供相关的实验数据。
1 材料与方法
1.1材料
经皮电刺激仪,自制减重跑台训练器,Bio⁃rad蛋白电泳装置,Bio⁃rad半干转印仪,摇床,Anti⁃RhoA(北京博奥森生物技术有限公司),Anti⁃GDNF(生工生物工程有限公司),SABC⁃POD(兔lgG)试剂盒、DAB显色试剂盒、ECL试剂盒(博士德生物工程有限公司)。4.0%水合氯醛(0.4 g、10 mL生理盐水配制,过滤,现用现配),青霉素钠(80万U,10 mL生理盐水配制),PBS,肝素钠等。
1.2动物及分组
SPF级成年雌性SD大鼠108只,体质量200~220 g,购自辽宁省实验动物资源中心,由锦州医科大学动物实验中心喂养管理,室温保持在20~25℃。
将108只成年雌性SD大鼠按随机数字表法分为6组:正常组(A组)、假损伤组(B组)、损伤组(C组)、电刺激组(D组)、训练组(E组)、电刺激+训练组(F组),每组18只,干预治疗1、3、7、14、21、28 d 6个时间点各3只。
1.3大鼠模型的制作
将C、D、E、及F组大鼠用自配的4.0%水合氯醛(3 mL/kg)腹腔注射麻醉。麻醉成功后放于大鼠手术台上俯卧固定,以T10为中心,背部剃毛,常规消毒。纵行依次切开皮肤及皮下组织,剥离椎旁肌肉并暴露棘突与椎板,咬除T9~11椎板,暴露T10段脊髓,用尖锐刀片自背侧至腹侧快速横断脊髓,这时大鼠出现双后肢快速收缩痉挛,尾巴痉挛性左右摆动,造模成功,再检查脊髓两断端确认是否横断完全。压迫止血后,逐层缝合切口,手术全程严格按无菌操作。术后立即给予青霉素钠8万U、生理盐水2 mL 1次,皮下注射,稍按摩注射部位以助吸收。独笼饲养,每日早晚各1次按摩挤压膀胱助大鼠排尿,至排尿反射恢复;皮下注射青霉素钠8万U,1次/d,维持1周。注意观察手术切口愈合情况,下肢、尾巴有无溃烂、自噬。假损伤组大鼠不做脊髓横断,其余同上述操作,A组大鼠不做任何特殊处理。除A组外,所有大鼠在手术前后各禁食水12 h,预防手术并发症的产生。如有死亡或不适合继续实验的大鼠及时同条件补充。
1.4干预方法
1.4.1经皮电刺激:术后第5天对D组和F组大鼠进行电刺激,将大鼠放于固定器内,正极接T10位置的皮肤,负极接右下肢小腿位置的皮肤。刺激频率10 Hz,疏密波脉冲电流3~8 mA,强度以引起肌肉收缩为宜,电刺激1次/d,每次30 min[6]。C组与相同的电刺激仪相连,但不给予刺激。
1.4.2减重跑台训练:术后第5天对E组和F组大鼠进行减重跑台训练。训练设备是在大鼠跑步机的基础上自制减重装置,在跑步机上方置两根带有夹子的鱼线,一根夹于大鼠项背部,控制前肢负重,另一根(长度可调)夹于尾部,控制后肢负重并根据后肢恢复情况调节减重量[7]。跑步机平板的速度为8~12 m/min,减重为大鼠体质量的30%~70%,速度与减重根据各组大鼠具体运动情况做适当调整。训练时间为30 min/d,分3次进行,每次10 min,间隔5 min。在实验前所有大鼠做跑台适应性训练,以熟悉跑台环境,实验过程中用细木棍给予大鼠适当刺激以保证训练量。
1.5大鼠后肢运动功能评定量表(Bosso⁃Beattie⁃Bresnahan locomotor rating scale,BBB)
该评定法有21项,0~21分,分数越高表明下肢运动功能越好。本实验中各组大鼠于造模前后进行BBB评分,造模前各组大鼠均达到21分。0分作为横断脊髓造模成功的标准,>0分视为造模失败并同条件增补。取材前对各时间点大鼠进行BBB评分,以对比脊髓损伤后的运动功能恢复情况。所有评分都是由熟悉评定方法但不了解实验分组的3名成员进行,取平均值作为最终评定得分。
1.6蛋白检测
各组大鼠均于末次干预治疗24 h后(即术后6、8、12、19、26、33 d)进行取材,每组每个时间点3只大鼠,其中1只用于免疫组化检测,另外2只用于
Western blot检测。
1.6.1免疫组化检测GDNF蛋白表达:用过量的4.0%水合氯醛腹腔麻醉大鼠,依次剪开胸部的皮肤、肌肉、胸骨,暴露心脏,自心尖部插管直至主动脉后固定,剪开右心耳,灌注加入1 mL肝素钠的生理盐水(约200 mL)直到有澄清液从右心耳流出,肝脏、肠系膜变白,再改用经过滤的4℃4%多聚甲醛(约300 mL)灌注,直到肝脏、四肢变硬。拆除灌注装置,剪下T10上下各2 cm的胸段脊髓,用弯眼科剪小心剔除椎板取出脊髓,放入4%多聚甲醛4℃恒温固定,更换多聚甲醛液1次/d,连续3 d,于锦州医科大学附属第一医院病理科包埋成蜡块。按照试剂盒说明书行免疫组织化学染色:切片、烤片、脱蜡、3%H2O2灭活、抗原修复、封闭血清、一抗4℃孵育过夜、滴加二抗、DAB显色、苏木精染色、脱水封片。400倍放大,随机选4个视野,观察胞质内棕黄色纤维状的GDNF阳性表达,应用Image⁃Pro Plus 6.0彩色病理图文分析系统(Olympus公司),测定GDNF的阳性细胞数。
1.6.2Western blot检测RhoA蛋白表达:用过量的4.0%水合氯醛进行腹腔麻醉大鼠,剪下T10上下各1 cm的胸段脊髓,小心剔除椎板取出脊髓,经1次PBS清洗掉血液等后放入标记好的2 mL EP管内,置于-80℃保存备用,整个过程在冰上作业并在5 min内完成。然后蛋白定量制样、灌胶、加样、电泳、转膜、封闭、加一抗置于4℃过夜、加适当浓度的二抗、ECL显色曝光,经定影处理后扫描分析。
1.7统计学分析
2 结果
因麻醉意外死亡3只,膀胱破裂造成4只死亡,肠梗阻死亡6只,均于造模后5 d内死亡。以上大鼠均同条件及时补充。
2.1各组大鼠各时间点BBB评分及分析
与C组比较,D、E、及F组从治疗3 d开始(即术后第8天)BBB评分升高有统计学意义(P<0.05)。与D组和E组比较,治疗7 d开始(即术后第12天)F组的BBB评分升高(P<0.05)。说明电刺激与减重跑台训练均能改善脊髓损伤大鼠下肢的运动功能,并且联合运用对大鼠下肢功能重建的恢复更为显著;治疗7 d开始(即术后第12天),D组与E组BBB评分比较差异具有统计学意义(P<0.05),说明电刺激疗法比减重跑台训练对脊髓损伤大鼠运动功能的恢复作用更明显;而A组与B组比较,BBB评分无统计学差异(P>0.05),说明假损伤造模方法对该实验研究未造成影响。见表1。
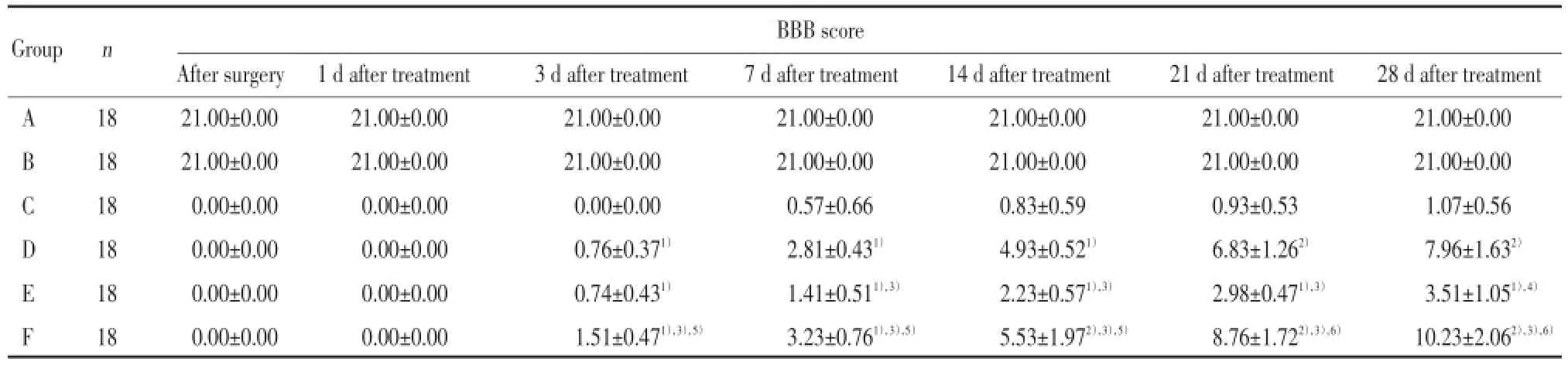
表1 各组大鼠各时间点BBB评分比较Tab.1 Comparison of BBB score in each rat group at each time point
2.2各组大鼠在各个时间点GDNF、RhoA蛋白表达
与B组比较,C组GDNF的阳性细胞数呈先升高后降低的趋势,在术后第19天达到高峰,术后第33天降低到正常水平,说明GDNF在脊髓损伤后短期内有反应性升高,但维持时间不长,并由此推测随着时间的延长,损伤组GDNF的阳性细胞数有可能会低于正常水平。与C组比较,D、E、F组GDNF的阳性细胞数升高有统计学意义(P<0.05);与D组和E组比较,F组升高差异有统计学意义(P<0.05),说明电刺激与减重跑台训练都能增加脊髓损伤大鼠脊髓处GDNF的分泌,联合运用更为显著。D组与E组比较阳性细胞数差异具有统计学意义(P<0.05),说明电刺激疗法比减重跑台训练对GDNF的表达影响更明显。见表2。
与C组比较,F组从治疗3 d开始(即术后第8天)RhoA的表达降低(P<0.05),并且随着治疗时间延长差异更显著(P<0.01);与D组和E组比较,F组RhoA的表达降低(P<0.01)。与C组比较,D、E组在治疗7 d(即术后第12天)开始RhoA表达差异有统计学意义(P<0.05),说明电刺激与减重跑台训练的联合运用,比两者中任何一种单一疗法对RhoA的表达影响都显著,并适合长时间坚持使用。从治疗7 d(即术后第12天)开始,D组与E组比较RhoA表达差异具有统计学意义(P<0.05),说明电刺激疗法对RhoA的表达影响更显著。D、E、F组RhoA的表达在治疗3~7 d迅速降低并达高峰,随后虽然其表达量在继续降低,但降低速度变缓,说明早期治疗对RhoA表达的影响较为明显。见表3。
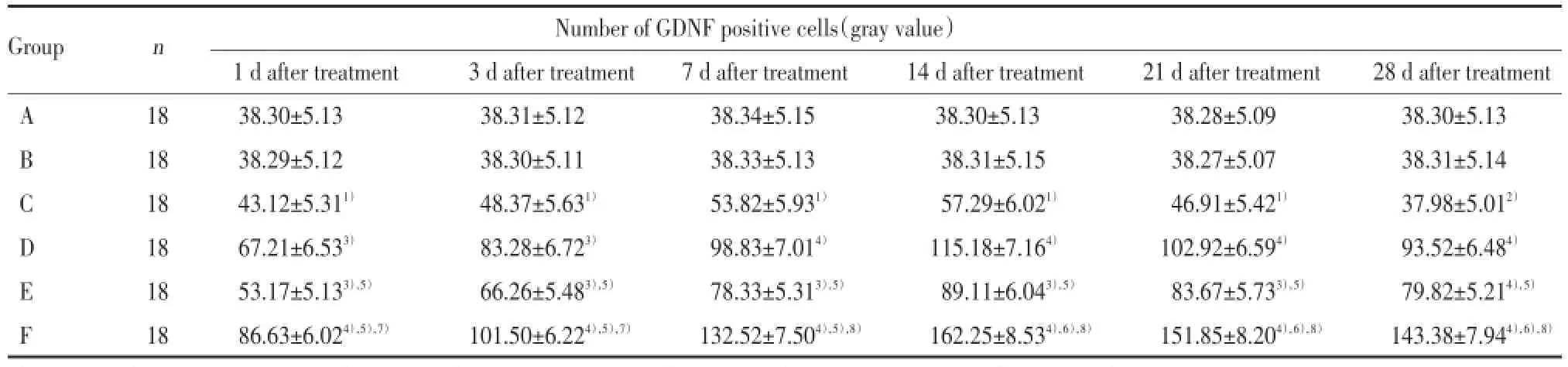
表2 各组大鼠免疫组化法检测GDNF的表达比较Tab.2 Comparison of GDNF expression in each group by immunohistochemistry
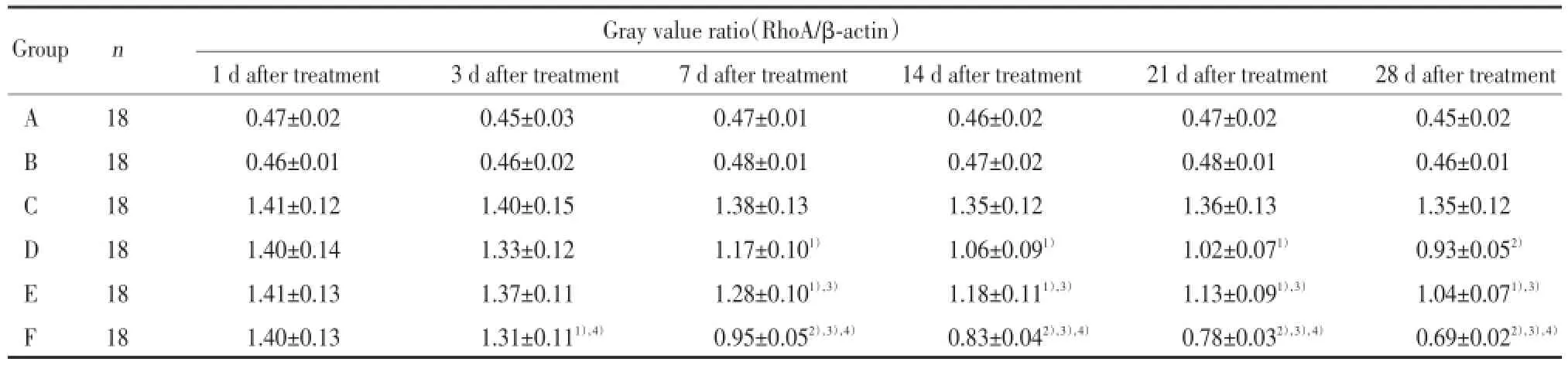
表3 各组大鼠Western blot检测RhoA表达比较Tab.3 Comparison of RhoA expression in each group by Western blot
3 讨论
随着医疗技术的不断发展,单一的治疗方法已不再适应临床需求。本实验将经皮电刺激与减重跑台训练联合作用于脊髓损伤大鼠,从而探讨联合疗法的作用效果。经皮电刺激可通过抑制炎性因子及瘢痕形成、促进营养因子分泌改善脊髓的继发性损伤;减重跑台训练是利用特殊的减重装置,将上肢悬吊以减轻双下肢负重,达到脊髓损伤后下肢的行走、肌力、感觉等功能逐渐恢复的一种康复训练方法[8]。目前,减重跑台训练多用于不完全脊髓损伤及脑卒中患者的康复,而用于完全性脊髓损伤的研究较少。其作用机制可能与通过感觉信息的传入,刺激损伤部位神经元轴突再生,从而促进神经环路的形成有关[9]。
本实验结果显示,D、E组大鼠BBB得分均高于C组,说明电刺激和减重跑台训练都可促进完全性SCI大鼠下肢运动功能的恢复;D、E组GDNF与RhoA的表达变化也表明电刺激和减重跑台训练对损伤脊髓的作用与GDNF和RhoA有关;F组的BBB得分、GDNF分泌和RhoA表达与C组比较都有明显的差异,而且优于D、E 2组,另外还发现F组BBB得分、GDNF分泌和RhoA表达早期的变化速度较快,之后趋于平稳但仍与C组差异显著。由此说明电刺激与减重跑台训练的联合疗法治疗效果更明显,且早期治疗作用显著并适合长期使用。
GDNF来源于神经胶质细胞,由134个氨基酸组成,分子量为(33~35)×103,是TGF⁃β超家族的亚家族,在脊髓中分布广泛,其在正常大鼠脊髓后角中的含量较高。GDNF是一个较新的神经营养因子,近些年引起研究者的广泛关注,大量在体和体外实验都已表明,GDNF可维持损伤脊髓神经元的存活,促进轴突再生,减轻神经元继发性凋亡,对脊髓损伤后运动功能的恢复发挥着至关重要的作用[10]。RhoA是小G蛋白超家族中Rho家族的Rho亚族中的成员,激活后的RhoA主要与下游的ROCK(即Rho激酶)结合影响肌动-球蛋白系统,最终导致生长锥的塌陷,抑制神经轴突再生[11⁃12]。而有研究[13]发现脊髓继发性损伤的重要抑制因子(MAG、Nogo⁃A、Omgp等)都会通过影响RhoA信号通路发挥抑制作用,因此抑制RhoA的表达成为了阻断脊髓继发性损伤的关键。
经皮电刺激与减重跑台训练作为物理治疗方法安全性较高,也已应用于临床,但未见其对GDNF、RhoA影响的报道。因此,本实验探讨了经皮电刺激和减重跑台训练对脊髓损伤后运动功能恢复的作用机制是否与促进损伤脊髓中GDNF的分泌和抑制RhoA的表达有关。实验研究结果显示,D、E组与C组的比较,差异具有统计学意义(P<0.05),说明经皮电刺激和减重跑台训练一方面可通过促进GDNF的分泌抵抗运动神经元的凋亡,刺激轴突再生,另一方面,通过抑制RhoA的表达,切断继发性SCI抑制因子发挥抑制作用的信号通路,最终达到改善运动功能恢复的目的。
本次实验通过对横断脊髓损伤大鼠模型进行经皮电刺激与减重跑台训练的不同干预设计,评定大鼠干预前后的BBB评分来反映脊髓损伤大鼠运动功能的恢复情况,同时检测干预后损伤脊髓组织中GDNF和RhoA的表达变化,结果说明经皮电刺激与减重跑台训练都能有效改善损伤脊髓的功能重建,其作用机制与GDNF、RhoA的表达有关;且两种方法的联合应用对大鼠运动功能恢复的治疗作用更明显,并适合长时间使用。但由于实验经费等原因,本实验未能监测更长时间的使用结果及停止干预治疗后的随访,故经皮电刺激及减重跑台训练对完全性脊髓损伤大鼠的长期效应还需要进一步研究。
[1]WHITE⁃SCHENK D,SHI RY,LEARY JF.Nanomedicine strategies for treatment of secondary spinal cord injury[J].Int J Nanomed,2015,10(1):923-938.DOI:https://dx.doi.org/10.2147/IJN.S7568 6.
[2]李华,李小萍,王玉龙,等.减重步行训练对不完全脊髓损伤患者步行能力的影响[J].临床和实验医学杂志,2008,7(7):69-73. DOI:10.3969/j.issn.1671⁃4695.2008.07.039.
[3]DENG LX,DENG P,RUAN YW,et al.A novel growth⁃promoting pathway formed by GDNF overexpressing schwann cells promotes propriospinal axonal regeneration,synapse formation,and partial re⁃covery of function after spinal cord injury[J].J Neurosci,2013,33(13):5655-5667.DOI:10.1523/JNEUROSCI.2973⁃12.2013.
[4]SCHOLLENBERGER L,GRONEMEYER T,HUBER CM,et al. RhoA regulates peroxisome association to microtubules and the ac⁃tin cytoskeleton[J].PLoS One,2010,5(11):e13886.DOI:10.1371/ journal.pone.0013886.
[5]PARGRIDGE WM,BOADO RJ.Pharmacokinetics and safety in rhe⁃sus monkeys of a monoclonal antibody⁃GDNF fusion protein for tar⁃geted blood⁃brain barrier delivery[J].Pharm Res,2009,26(10):2227-2236.DOI:10.1007/s11095⁃009⁃9939⁃6.
[6]DELEY G,DENUZILLER J,BABAULT N,et al.Effects of electri⁃cal stimulation pattern on quadriceps isometric force and fatigue in individuals with spinal cord injury[J].Muscle Nerve,2015,52(2):260-264.DOI:10.1002/mus.24530.
[7]马睿杰,孙连珠,张柳娟,等.电针结合减重步行训练对急性脊髓损伤大鼠巢蛋白和神经生长因子表达的影响[J].中国康复医学杂志,2015,30(6):532-537.DOI:10.3969/j.issn.1001⁃1242.2015. 06.003.
[8]赵俊,邹任玲,胡秀枋,等.大鼠跑台训练模型方法研究进展[J].动物医学进展,2014,35(9):101-105.DOI:10.3969/j.issn.1007⁃5038.2014.09.025.
[9]MEHRHOLZ J,POHL M,ELSNER B.Treadmill training and body weight support for walking after stroke[J].Cochrane Database Syst Rev,2014,1:CD002840.DOI:10.1002/14651858.CD002840.pub3.
[10]LEDDA F,PARATCHA G,SANDOVAL⁃GUZMAN T,et al.GDNF and GFRa1 promote formation of neuronal synapses by ligand⁃in⁃duced cell adhesion[J].Nature Neurosci,2007,10(3):293-300. DOI:10.1038/nn1855.
[11]CONRAD S,GENTH H,HPFMANN F,et al.Neogenin⁃RGMa sig⁃naling at the growth cone is bone morphogenetic protein⁃indepen⁃dent and involves RhoA,ROCK,and PKC[J].J Biolog Chem,2007,282(22):16423-16433.DOI:10.1074/jbcM610901200.
[12]COSTA P,SCALES TME,IVASKA J,et al.Integrin⁃specific con⁃trol of focal adhesion kinase and RhoA regulates membrane protru⁃sion and invasion[J].PLoS One,2014,8(9):e74659.DOI:10.1371/journal.pone.0074659.
[13]CAFFERTY WBJ,DUFFY P,HUEBNER E,et al.MAG and OMgp synergize with Nogo⁃A to restrict axonal growth and neuro⁃logical recovery after spinal cord trauma[J].J Neurosci,2010,30(20):6825-6837.DOI:10.1523/JNEUROSCI.6329⁃09.2010.
(编辑武玉欣)
Effects of Transcutaneous Electrical Stimulation and Combination Body Weight Supported Treadmill Training on Glial Cell Line⁃derived Neurotrophic Factor and RhoA in Transection Spinal Cord Rats
CAI Hongmei1,WANG Wei2,MA Di1,WANG Wenjuan2,YI Tian1,ZHOU Xiaohong2
(1.Graduate School,Jinzhou Medical University,Jinzhou 121000,China;2.Department of Rehabilitation,The First Affiliated Hospital,Jinzhou Medical University,Jinzhou 121000,China)
ObjectiveTo study the effects of transcutaneous electrical stimulation and combination body weight supported treadmill training on glial cell line⁃derived neurotrophic factor(GDNF)and RhoA in rats with spinal cord transection,and explore their possible mechanism.Methods A total of 108 adult female SD rats were randomly divided into 6 groups:normal group(A group),sham injured group(B group),injured group(C group),electrical stimulation group(D group),training group(E group)and electrical stimulation+training group(F group).After 5 days of sur⁃gery corresponding intervention treatment for the D,E,F groups,Bosso⁃Beattie⁃Bresnahan locomotor rating scale for open field(BBB scale)was assessed.The expression of GDNF and RhoA in spinal cord tissue were measured 1,3,7,14,21 and 28 d after treatment.ResultsCompare with C group,the scores of BBB and levels of GDNF were increased(P<0.05),and the levels of RhoA were reduced(P<0.05)in D,E,F groups since 7 d after treatment,and the BBB scales,levels of GDNF,RhoA in F group was more obviously(P<0.01).There were no statistical differenc⁃es of the BBB scales,levels of GDNF,and RhoA between normal group with sham injured group(P>0.05).ConclusionTranscutaneous electri⁃cal stimulation and body weight supported treadmill training can effectively improve the injured spinal cord function reconstruction,and their mech⁃anism may be associated with the expression of GDNF and RhoA in injured spinal cord.The combination therapy of electrical stimulation and body weight supported treadmill training is more apparent for motor function recovery of rats,which is suitable for long time use.
transcutaneous electrical stimulation;body weight support treadmill training;complete spinal cord injury;glial cell line⁃derived neurotrophic factor;RhoA
R493
A
0258-4646(2016)09-0838-05
10.12007/j.issn.0258⁃4646.2016.09.016
蔡洪梅(1987-),女,硕士研究生.
王维,E-mail:dubutianxia315@163.com
2015-11-28
网络出版时间:

