食管癌术后患者应用中药干预对生活质量及生存时间的影响研究
韩自力,孙建锋
·临床医学·
·论著·
食管癌术后患者应用中药干预对生活质量及生存时间的影响研究
韩自力,孙建锋
目的 观察中药干预对术后食管癌患者的生活质量及生存时间的影响。方法 选取180例经手术治疗的食管癌患者并依据知情同意的原则分为3个治疗组,分别是单纯化疗组、单纯中药组及中药+化疗组,每组各60例。采用生活质量核心问卷(QLQ-C30)和生存分析评估患者的生存质量和生存时间。结果 中药组、中药+化疗组和化疗组患者的临床症状及身体功能经干预均有一定改善,但总体而言,化疗+中药组的改善效果最佳,与另2组比较差异有统计学意义(P<0.05);化疗+中药组及单纯中药组患者经干预后,机体的免疫水平改善,而化疗组患者的免疫状况下降;化疗组患者的生存时间为(27.21±3.55)个月,中药组患者的生存时间为(28.56±4.19)个月,化疗+中药组患者的生存时间为(34.58±3.24)个月;经Log-Rank检验,3组差异有统计学意义(χ2=5.698,P=0.037)。结论 食管癌患者术后服用中药,其生活质量、免疫状况、生存时间均明显改善,可在临床推广中药+化疗的综合干预方案。
食管癌;中药;化疗;生活质量;生存时间
食管癌是世界范围内最常见的恶性肿瘤之一,占全部恶性肿瘤的2%,其病理基础是食管上皮组织的恶性病变[1]。流行病学资料显示:全世界每年约有20万人死于食管癌;在我国,食管癌的死亡人数仅次于胃癌,以>40岁的男性患者为主。食管癌的发病因素呈网络状,炎症、创伤、饮水、饮食及遗传因素等均与食管癌的发生有一定关联[2-4]。但其确切的发病原因仍有待进一步研究确证。临床上,食管癌的治疗仍然以外科手术切除为主,但是复发和转移是困扰食管癌外科手术治疗的2个瓶颈因素,如何有效降低复发率和转移率是研究热点之一[5]。我国的传统医学在多年的临床实践中积累了治疗食管癌的丰富经验,尤其是近年来在提高食管癌手术成功率方面发挥了越来越重要的作用。有研究报道,食管癌患者经手术治疗以后,单纯使用中医药或者与放化疗药物联合应用中医药,对患者术后的生活质量和生存时间均具有一定的改善效果[6-9]。为了进一步评估中药干预对于食管癌患者术后的生活质量和生存时间的影响,本研究采用随机对照的设计方案,观察评价不同的干预措施对食管癌患者术后生活质量和生存时间的影响,旨在为改善食管癌患者的预后和生活质量提供参考依据。
1 对象与方法
1.1 研究对象 选取2010年1月-2011年1月在怀来县中医医院肿瘤外科接受食管癌手术治疗的住院患者180例为研究对象,其中,男性106例,女性74例;平均年龄(56.58±12.09)岁。依据知情同意原则将研究对象分为化疗组、中药组、化疗+中药组,每组各60例。3组患者的年龄、性别、肿瘤类型、病例分期等基线特征及基本临床病理参数的比较差异均无统计学意义(P>0.05),见表1。

表1 3组患者的基本特征及主要临床参数比较
1.2 研究对象的纳入和排除标准 (1)纳入标准:①接受食管癌手术治疗;②术后2~4周;③术后未接受抗肿瘤及免疫治疗;④患者愿意参加本研究,并签署知情同意书。(2)排除标准:①心、肝、肾、肺、骨髓造血功能紊乱;②有远处转移、有感染或严重心血管疾病等;③合并有其他部位的恶性肿瘤。
1.3 治疗方法 3组的治疗均在术后2~4周开始,治疗方案如下:(1)化疗组:化疗前1~2 d开始服用甲地孕酮160 mg,1次/d,连续服用1周后休息2周,3周为1个周期。治疗采用统一化疗方案:亚叶酸钙100 mg/m2静脉滴注2 h+5-氟尿嘧啶300 mg/m2静脉滴注7 h+顺铂20 mg/m2静脉滴注1 h,共静脉滴注1~5 d。为了缓解化疗的不良作用,期间适当给与水化利尿和止吐治疗。(2)中药组:根据中医辨证施治原则视患者的体质用药。采用基本药物太子参、石见穿、白花蛇舌草、麦冬、夏枯草、红花、生地黄、蜈蚣、玉竹、天龙、当归、天花粉、山慈菇等,坚持辨证辨病相结合的原则酌情加减用量。中药煎服1剂/d,连续治疗1年。(3)中药加化疗组:化疗和中药治疗同时进行。
1.4 生活质量核心问卷(QLQ-C30) 采用欧洲癌症研究和治疗组织(EORTC)制定的修订版生活质量核心问卷(QLQ-C30)评估患者的生活质量。该量表共包含30个项目,包括5个功能量表、3个症状量表、6个单项测量项目、1个总体健康和生活质量量表。每个项目评定等级为4级(1:没有;4:经常有)或7级(1:很差;7:很好)。该量表是目前公认的能较准确反应癌症、化疗等对患者生活质量影响的量表。功能量表和总体量表得分越高提示功能状况越好;症状量表和单项量表得分越高提示症状越重。
1.5 免疫球蛋白检测 为了评估3组患者治疗前后体液免疫状况,本研究采用贝克曼库尔特Immage 800全自动特定蛋白分析仪速率散射比浊法检测血清IgG、IgA、IgM水平,选取同期在我院健康体检中心体检均正常的健康人组成对照组。
1.6 随访 本研究采用电话、复诊、上门拜访等方式在疗程结束后的第1、2、3年7月进行随访,最后一次随访的时间为2015年7月25日。本研究共有14人失访,按照截尾数据处理,其中化疗组5例、中药组4例、化疗+中药组5例。
1.7 统计学处理 计量资料采用均数±标准差(x±s)表示,计数资料采用百分率(%)表示;分别采用方差分析和χ2检验,方差分析若有统计学差异,则进一步采用LSD法进行两两比较;采用Kaplan-Meier法进行生存分析,生存率的比较采用Log-Rank检验;所有统计分析均借助SPSS20.0软件进行操作,检验水准α=0.05。P<0.05表示差异有统计学意义。
2 结果
表2 3组患者治疗前后QLQ-C30症状量表评分比较(分,x±s)

症状化疗组(n=60)中药组(n=60)化疗+中药组(n=60)治疗前治疗后治疗前治疗后治疗前治疗后恶心呕吐39.41±21.4229.21±18.24a39.81±20.7827.40±19.87ab40.41±22.1323.20±17.56abc疼痛 34.40±20.4725.40±19.42a33.41±19.8126.21±20.47a33.47±19.4723.45±19.84abc气促 50.12±28.1544.75±19.45a51.32±29.4143.85±20.15a52.41±30.2042.41±20.15abc失眠 41.78±30.4232.41±27.51a42.49±31.42a30.24±29.42ab43.55±32.4828.40±22.47abc食欲减退43.41±31.4241.01±29.3442.48±30.9434.35±28.34ab43.00±29.8840.32±27.41ac疲倦 48.75±20.1636.25±19.87a48.35±21.0935.26±20.15a48.12±20.4532.04±18.45abc便秘 42.72±32.1238.11±28.0343.07±31.8739.42±20.3443.00±30.8540.32±29.81a腹泻 22.11±28.3119.35±14.50a23.45±27.0918.20±14.09a21.86±24.2016.35±13.42abc
注:与治疗前比较aP<0.05,与化疗组治疗后比较bP<0.05;与中药组治疗后比较cP<0.05
表3 3组患者治疗前后QLQ-C30功能量表评分比较(分,x±s)

项目化疗组(n=60)中药组(n=60)化疗+中药组(n=60)治疗前治疗后治疗前治疗后治疗前治疗后躯体功能 69.82±20.3174.32±21.34a69.84±20.5373.45±22.45a68.91±20.1474.35±21.47abc角色功能 61.38±31.0475.31±30.19a61.79±30.5975.26±31.89a60.87±31.9781.32±31.79abc情绪功能 71.79±26.9181.42±27.81a69.48±23.0981.32±27.31a61.45±30.5288.79±26.49abc认知功能 75.26±21.3583.46±21.35a75.26±21.35a84.35±32.45a75.49±19.4790.52±23.49abc社会功能 49.36±31.8459.47±37.4950.23±34.6162.35±38.14ab51.46±36.7963.49±38.47ac总体健康状况51.46±23.4657.49±23.45a51.46±24.8959.46±24.56ab53.46±25.8967.23±26.35abc
注:与治疗前比较aP<0.05;与化疗组治疗后比较bP<0.05;与中药组治疗后比较cP<0.05
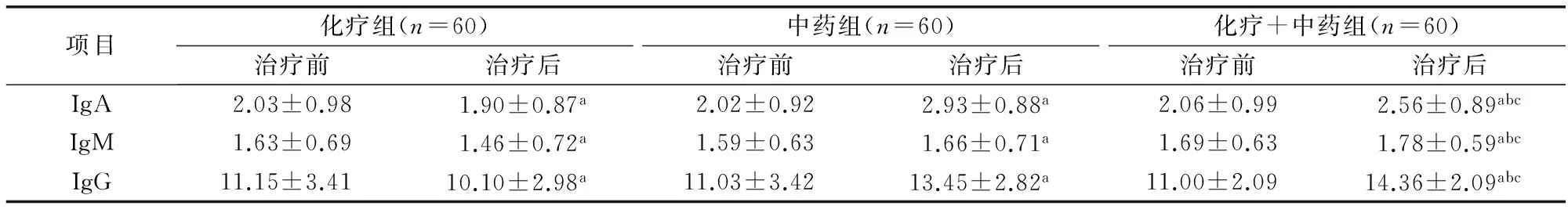
表4 3组患者治疗前后免疫球蛋白水平比较(mg/L,x±s)
注:与治疗前比较aP<0.05;与化疗组治疗后比较bP<0.05;与中药组治疗后比较cP<0.05
2.1 治疗前后QLQ-C30症状评分比较 治疗前,3组患者的QLQ-C30症状评分比较差异均无统计学意义;治疗后,3组患者的恶心呕吐、疼痛、气促、失眠、食欲减退、疲倦、腹泻等症状评分差异具有统计学意义,经LSD法两两比较,恶心呕吐、疼痛、气促、失眠、疲倦、腹泻等症状评分以化疗+中药组改善效果最佳,而食欲减退的改善最佳的是中药组,差异均具有统计学意义(P<0.05)。见表2。
2.2 治疗前后QLQ-C30功能评分比较 治疗前,3组患者的QLQ-C30功能评分比较差异均无统计学意义;治疗后,3组患者的躯体功能、角色功能、情绪功能、认知功能、社会功能、总体健康状况等评分差异均具有统计学意义,经LSD法两两比较,躯体功能、角色功能、情绪功能、认知功能等功能评分以化疗+中药组改善效果最佳,而社会功能、总体健康状况等的改善最佳的是化疗+中药组,其次是中药组,差异均具有统计学意义(P<0.05)。见表3。
2.3 免疫球蛋白水平比较 3组患者治疗前血清IgA、IgM、IgG水平相比差异无统计学意义(P>0.05);治疗后中药组和中药+化疗组患者的血清IgA、IgM、IgG水平均有不同程度提高,但化疗组患者的血清IgA、IgM、IgG水平均较治疗前明显下降(P<0.05)。见表4。
2.4 生存时间分析 3组患者的Kaplan-Meier生存曲线见图1,分析结果显示:化疗组患者的生存时间为(27.21±3.55)个月,中药组患者的生存时间为(28.56±4.19)个月,化疗+中药组患者的生存时间为(34.58±3.24)个月;经Log-Rank检验,3组差异有统计学意义(χ2=5.698,P=0.037)。

图1 3组患者的Kaplan-Meier生存曲线
3 讨论
食管癌是全世界范围内最常见的消化道恶性肿瘤之一,据统计:2002年,全世界食管癌发病率和死亡率分别位居恶性肿瘤的第8位和第6位,同时新发病例和死亡病例分别为46.2万例和38.6万例[5,10-12]。中国是一个人口大国,是食管癌的高发地区,据流行病学调查,我国每年食管癌新发病例占全世界的50%以上,发病人数位居世界第一[4,13]。近年来,食管癌的发病率呈上升趋势。食管癌预后较差,主要原因是早期诊断率不高,一半以上的患者在就诊时已是中晚期患者。
目前外科手术仍是食管癌治疗的首选方案,转移与复发是食管癌外科手术失败的主要原因之一。据报道:接受手术的食管癌患者有90%出现复发转移;即便是早期诊断的患者,仍有约一半在术后5年内复发或转移[14]。因此,提高食管癌患者的生存率,减少复发或转移是最大的挑战之一。国内外多项临床研究结果及多年的临床实践表明:手术配合辅助的化疗方案的综合性治疗可以在一定程度上提高生存率、降低复发率[15-18],但总体来看,其3~5年生存率改善并不明显,特别是对于II期以上的患者而言,更是如此。我国传统医学在治疗食管癌的实践中总结了宝贵的经验,特别是在食管癌的术后辅助治疗方面具有一定的优势。近年来,有学者提出:为进一步改善食管癌根治术后的生存率,可以考虑把化疗和中药干预方案有机地结合,建立最佳综合治疗方案。但是,该理论目前尚未得到临床实践证实[2-3]。
为进一步评估食管癌术后采用中药干预的临床效果,本研究采用随机临床试验的设计方案,评估了单纯化疗、单纯中药治疗、化疗+中药的综合性治疗方案对食管癌患者的生活质量及生存时间的影响,从患者生存时间的量和质等方面进行评估。分析结果显示:在改善食管癌患者的症状和功能方面,3种治疗方案均具有一定的疗效,但总体来看,化疗和中药的综合性方案效果最佳。本研究通过检测3组患者的体液免疫水平对上述现象的机制做了初步的探索,结果显示:食管癌患者术后使用中药可以明显改善患者的免疫水平,而化疗可以在一定程度上降低患者的免疫水平。从病理学角度而言,免疫水平是机体抵抗疾病的综合能力,免疫水平越高,越有利于患者健康水平的改善。生存分析结果提示:化疗+中药组患者的生存时间最长,3年生存率最高,究其原因,可能与治疗方案能明显改善患者的免疫状况,从而提高了机体的抗病能力,进而降低了复发和转移的危险[19-21]。上述研究结果提示:中药可以改善患者免疫功能状态及生活质量,还可以有效延长患者的生存时间。
综上所述,中药在食管癌的术后综合治疗中可发挥减毒增效作用,可延长生存时间,体现了其独特的治疗效果,中药结合化疗可及时调整用量,以求取得最理想的临床疗效。
[1] 蔡后富,郑小平,庄仁莲. 洞头县2012-2013年居民恶性肿瘤死亡原因分析[J]. 浙江预防医学, 2015, 27(1):73-75.
[2] 陈万青,张思维,陈志峰. 中国食管癌胃癌高发区贲门癌流行趋势分析[J]. 中国肿瘤, 2008, 17(12):998-1000.
[3] 陈万青,郑荣寿,陈志峰,等. 中国4个食管癌高发区上消化道癌的流行现状[J]. 中国肿瘤, 2011, 20(8):557-560.
[4] 谢梦,武爱文. 环境污染物与消化道肿瘤[J]. 世界复合医学, 2015(2):168-174. DOI:10.11966/j.issn.2095-994X.2015.01.02.15.
[5] 陈左霞,王凤英,陈培发,等. 2006-2012年浙江省金华市居民恶性肿瘤死亡分析[J]. 中国预防医学杂志, 2015, 16(3):209-212.
[6] Chang YL, Tsai YF, Chao YK, et al. Quality-of-life measures as predictors of post-esophagectomy survival of patients with esophageal cancer[J]. Qual Life Res, 2016, 25(2):465-475. DOI:10.1007/s11136-015-1094-4.
[7] Dellenmark-Blom M, Chaplin JE, Gatzinsky V, et al. Health-related quality of life among children, young people and adults with esophageal atresia: a review of the literature and recommendations for future research[J]. Qual Life Res, 2015, 24(10):2433-2445. DOI:10.1007/s11136-015-0975-x.
[8] Wen Y, Pan XF, Huang WZ, et al. Quality of life for patients with esophageal/gastric cardia precursor lesions or cancer: a one-year prospective study[J]. Asian Pac J Cancer Prev, 2015, 16(1):45-51.
[9] Shen H, Wang J, Li W, et al. Assessment of health-related quality of life of patients with esophageal squamous cell carcinoma following esophagectomy using EORTC quality of life questionnaires[J]. Mol Clin Oncol, 2015, 3(1):133-138. DOI:10.3892/mco.2014.434.[10] 丁贤彬,吕晓燕,冯连贵,等. 2009-2013年重庆市恶性肿瘤流行趋势分析[J]. 中国预防医学杂志, 2015, 16(3):196-199.
[11] 李辉章,毛伟敏,汪祥辉,等. 2000-2009年浙江省肿瘤登记地区癌症死亡情况分析[J]. 中国慢性病预防与控制, 2015, 23(3):168-171.
[12] 李莉,刘庆敏,刘冰. 杭州市居民2010~2012年恶性肿瘤疾病负担分析[J]. 中国肿瘤, 2015, 24(3):186-190. DOI:10.11735/j.issn.1004-0242.2015.03.A004.
[13] 张方雷. 2010-2013年宁波市江东区居民恶性肿瘤死亡分析[J]. 中国农村卫生事业管理, 2015, 35(3):308-310.
[14] 刘树,刘啸,孙萍,等. 食管癌三野淋巴清扫术后痰培养病原菌的分布及药敏分析[J]. 海峡药学, 2015, 27(1):104-105. DOI:10.3969/j.issn.1006-3765.2015.01.048.
[15] Hurmuzlu M, Aarstad HJ, Aarstad AK, et al. Health-related quality of life in long-term survivors after high-dose chemoradiotherapy followed by surgery in esophageal cancer[J]. Dis Esophagus, 2011, 24(1):39-47. DOI:10.1111/j.1442-2050.2010.01104.x.
[16] Jacobs M, Macefield RC, Elbers RG, et al. Meta-analysis shows clinically relevant and long-lasting deterioration in health-related quality of life after esophageal cancer surgery[J]. Qual Life Res, 2014, 23(4):1097-1115. DOI:10.1007/s11136-013-0545-z.
[17] Kachnic LA, Winter K, Wasserman T, et al. Longitudinal quality-of-life analysis of RTOG 94-05 (Int 0123): A phase III trial of definitive chemoradiotherapy for esophageal cancer[J]. Gastrointest Cancer Res, 2011, 4(2):45-52.
[18] Koivusalo A, Pakarinen MP, Turunen P, et al. Health-related quality of life in adult patients with esophageal atresia--a questionnaire study[J]. J Pediatr Surg, 2005, 40(2):307-312. DOI:10.1016/j.jpedsurg.2004.10.014.
[19] Leplège A, Mackenzie-Schliacowsky N, Eacute CE, et al. Quality of life scale and impact of a topical treatment on symptoms of gastro-esophageal reflux without severe esophagitis[J]. Gastroenterol Clin Biol, 2005, 29(6-7):676-681.
[20] Lin JY, Wang MS, Dong LP, et al. Influence of personal character on quality of life of patients with esophageal cancer in north Henan province and influencing factors[J]. Asian Pac J Cancer Prev, 2012, 13(11):5415-5420.
[21] Madhusudhan C, Saluja SS, Pal S, et al. Palliative stenting for relief of dysphagia in patients with inoperable esophageal cancer: impact on quality of life[J]. Dis Esophagus, 2009, 22(4):331-336. DOI:10.1111/j.1442-2050.2008.00906.x.
(本文编辑:彭润松)
Effect of herbal medicine on the life quality and survival time of the esophageal cancer patients after surgery
Han Zili, Sun Jianfeng
(Tradition Chinese Medicine Hospital, Huailai County, Huailai 075400, China)
Objective To observe the effect of herbal medicine on the life quality and survival time of the esophageal cancer patients after surgery.Methods With their knowledge and consent, 180 esophageal cancer patients after surgery were divided into 3 groups: the pure chemotherapy group, the pure traditional herbal medicine group and the chemotherapy + herbal medicine group, each consisting of 60 patients. The quality of life questionnaire (QLQ-C30) and survival analysis were used to assess the quality of life and survival time of the patients.Results The clinical symptoms and physical functions in all the patients of the 3 groups were improved to some extent after treatment. However, on the whole, symptom improvement of the chemotherapy + herbal medicine group was the most sufficient(P<0.05). After intervention, the immune function of both the chemotherapy + herbal medicine group and the pure herbal medicine group was improved, while that of the chemotherapy group was decreased. The survival time of the chemotherapy group was (27.21±3.55) months, while that of the herbal medicine group was (28.56±4.19) months, and that of the chemotherapy + herbal medicine group was (34.58±3.24) months. By Log-rank test, statistical significance could be noted in survival time of the 3 groups (χ2=5.698,P=0.037).Conclusion Taking traditional herbal medicine after surgery could significantly improve the life quality, immune function and survival rate of the esophageal cancer patients, and this comprehensive intervention profile could be extended in the clinical practice.
Esophageal cancer; Herbal medicine; Chemotherapy; Quality of life; Survival time
075400 河北 怀来,怀来县中医医院
R735
A [DOI] 10.3969/j.issn.1009-0754.2016.05.017
2015-10-23)

