不同方法提取草菇多糖体外抗氧化活性
凡军民+李静+贾君+谢春芹+谢正林


摘要:分别采用热水提取法、酶法、微波法、碱法4种不同方法提取草菇多糖,并对其抗氧化活性进行比较研究。结果表明:不同方法提取的草菇多糖对·OH、DPPH·都较强的清除作用;纤维素酶法、微波法是较佳的2种提取抗氧化草菇多糖的方法,其多糖均具有较强的抗氧化、还原能力。
关键词:草菇;多糖;提取方法;抗氧化性
中图分类号: S646.1+30.1;O629.12 文献标志码: A
文章编号:1002-1302(2016)09-0323-03
草菇(Volvariella volvacea)菇肉脆嫩,味道鲜美,营养价值高,是食用菌中栽培方法最简单、出菇最快、原料最丰富、最可口的食用菌之一。早在300年前,我国已经进行草菇的人工栽培,后由华侨传到世界各国成为第3大栽培食用菌。我国草菇年产量高于3万t,占全世界总产量的70%~80%,居世界之首,故国际上称其为“中国蘑菇”[1]。
草菇中抗氧化活性成分已有一些报道[2-4],主要有总酚类、多糖类、三萜类、黄酮类化合物等。Cheung等采用3种不同方法评价草菇的甲醇提取物和水提取物的抗氧化活性发现,水提取物的抗氧化活性高于甲醇提取物,其抗氧化活性与总酚含量有关[3]。赵俊霞等用不同有机溶剂对草菇培养液及菌丝体中的代谢成分进行分离提取,代谢提取物均有较高的 DPPH·清除率,即较高的抗氧化活性,其有效成分含有粗三萜、黄酮类物质[4]。
本研究通过热水提取法、酶法、微波法、碱法4种不同提取方法对草菇多糖进行提取,并测定其体外抗氧化活性,探讨不同提取方法对草菇多糖清除自由基能力的影响,旨在寻找最佳的提取方法,为草菇的精深加工提供理论基础。
1 材料与方法
1.1 材料
供试材料:草菇子实体,购于农贸市场。
试剂:95%乙醇、氢氧化钠、浓盐酸、维生素C、硫酸亚铁、双氧水、水杨酸、三羟甲基氨基甲烷盐酸盐(Tris-HCl)、邻苯三酚、无水乙醇、十二水磷酸氢二钠、二水磷酸二氢钠、铁氰化钾、三氯乙酸(trichloroacetic acid,简称TCA)、氯化铁、甲醇、氯化亚铁、乙二胺四乙酸(EDTA),均为国产分析纯;1-二苯基-2-三硝基苯肼(DPPH,美国Sigma公司),菲洛嗪(Ruibio进口分装)。
仪器:赛多利斯电子天平(上海精密科学仪器有限公司);HH-4数显恒温水浴锅(金坛市富华仪器有限公司);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);TDL-5A低速台式大容量离心机(湖南星科科学仪器有限公司);UV-2100紫外-可见分光光度计(北京中教金源科技有限公司);LGJ-12普通型冷冻干燥机(北京松源华兴科技发展有限公司)。
1.2 草菇多糖提取工艺流程
草菇→预处理→不同方法提取→减压浓缩→乙醇沉淀→透析→冷冻干燥→草菇多糖。
1.3 草菇多糖提取方法
1.3.1 草菇的预处理 新鲜草菇子实体洗净、去杂、切块,置于105 ℃烘箱灭活10 min;65 ℃烘干、粉碎,得到草菇碎屑;95%乙醇室温过夜,浸提3次,过滤,残渣放置于阴凉处风干待用。
1.3.2 热水提取法 取预处理的草菇干制品,按料液比1 g ∶20 mL 加入蒸馏水,沸水提取1 h,过滤。按照“1.3.1”节中的步骤共提取2次,合并提取液。
1.3.3 酶法提取法 取预处理的草菇干制品,按料液比1 g ∶20 mL 加入蒸馏水,纤维素酶、蜗牛酶加入量为0.35%(质量体积比),50 ℃提取90 min,升温至90 ℃灭活酶,过滤,得提取液。
1.3.4 微波提取法 取预处理的草菇干制品,按料液比1 g ∶20 mL 加入蒸馏水,乳化10 min,微波处理功率为490 W,提取8 min,过滤。按照“1.3.1”节中的步骤共提取2次,合并提取液。
1.3.5 碱法提取 取水提后草菇残渣,按照料液比1 g ∶10 mL 加入0.5 mol/L NaOH溶液,于4 ℃提取2次,每次4 h,过滤,滤液中加入3 mol/L HCl,调pH值至7.0。
1.3.6 提取多糖的浓缩干燥 将提取液于60 ℃减压浓缩至原体积的1/10,4 000 r/min离心10 min,去除沉淀;在浓缩液中缓缓加入95%乙醇,使浓缩液与乙醇体积比为1 ∶4;静置过夜,离心,沉淀物用蒸馏水溶解,溶解液透析(分子截留量为10 ku),冷冻干燥,分别得到水提多糖WPF75、蜗牛酶提多糖SAPF75、纤维素酶提多糖CAPF75、微波提多糖MPF75、碱提多糖APF75。
1.4 草菇多糖的含量测定
多糖的含量测定采用苯酚-硫酸法,参照2005年版《中华人民共和国药典》。
1.5 抗氧化活性的测定
1.5.1 · OH清除活性的测定[5]分别吸取1.0 mL各浓度样液,依次加入3.0 mL 2 mmol/L FeSO4溶液、3.0 mL1 mmol/L H2O2溶液,静置10 min。再加入3 mL 6 moL/L水杨酸溶液,37 ℃水浴30 min,在510 nm处测定吸光度D510 nm,以维生素C作阳性对照。清除率计算公式:
清除率=[1-(Di(510 nm)-Dj(510 nm))/D0(510 nm)]×100%。
式中:Di(510 nm)为不同多糖浓度下的吸收度;Dj(510 nm)为用蒸馏水代替水杨酸时测得的不同多糖浓度本底吸光度;D0(510 nm)为用水代替多糖样品时测得的空白对照吸光度。每个浓度平行测3次,求清除率的平均值。
1.5.2 清除活性测定[6]取4.5 mL50 mmol/L Tris-HCl缓冲溶液(pH值=8.2),加入1.0 mL各浓度样液,25 ℃水浴20 min,立即加入0.4 mL于25 ℃预热过的25 mmol/L邻苯三酚溶液,25 ℃水浴5 min。加入1 mL 8 mmol/L HCl 终止反应,在320 nm处测定吸光度D320 nm,以维生素C作阳性对照。清除率计算公式:
清除率=[1-Di(320 nm)/D0(320nm)]×100%。
式中:Di(320 nm)为不同多糖浓度下的吸光度;D0(320 nm)为用水代替多糖样品时测得的空白对照吸光度。每个浓度平行做3次,求清除率的平均值。
1.5.3 DPPH·清除活性测定[5]分别吸取4.0 mL各浓度样液与0.2 mmol/L DPPH溶液,加入具塞试管中摇匀,黑暗条件下于37 ℃放置30 min,3 000 r/min离心10 min,取上清液于517 nm处测吸光度D517 nm,以维生素C作阳性对照。清除率计算公式:
清除率=[1-(Di(517 nm)-Dj(517 nm))/D0(517 nm)]×100%。
式中:Di(517 nm)为不同多糖浓度下的吸光度;Dj(517 nm)为用无水乙醇代替DPPH溶液时测得的不同多糖浓度本底吸光度;D0(517 nm)为用水代替多糖样品时测得的空白对照吸光度。每个浓度平行测3次,求清除率的平均值。
1.5.4 还原力测定[7]取2.5 mL各浓度样液,各加入2.5 mL 0.2 moL/L磷酸盐缓冲液(pH值6.6)、1%K3Fe(CN)6 溶液,混匀后于50 ℃水浴20 min。加入2.5 mL 10% 三氯乙酸溶液终止反应,3 000 r/min离心10 min。取5.0 mL上清液,分别加入5.0 mL蒸馏水、1.0 mL 0.1% FeCl3,静置10 min,在700 nm处测定吸光度D700nm,每个浓度平行测3次,以维生素C作阳性对照。
1.5.5 对金属离子螯合活性测定[7]取1.0mL各浓度样液,分别加入3.7 mL甲醇、0.1 mL 2 mmol/L FeCl2、0.2 mL5 mmol/L 菲洛嗪,25 ℃反应10 min后,于562 nm处测定吸光度D562 nm,每个浓度平行测3次,以EDTA作为对照。金属离子螯合力计算公式:
螯合力=[1-Di(562 nm)/D0(562 nm)]×100%。
式中:Di(562 nm)为不同多糖浓度下的吸光度;D0(562 nm)为用水代替多糖样品时测得的空白对照吸光度。
1.5.6 半抑制质量浓度IC50的计算 以多糖浓度为横坐标、清除率为纵坐标,绘制不同方法提取草菇多糖的清除率曲线。以纵坐标的清除率50%作水平线,与清除率曲线相交点,即为半抑制质量浓度IC50。
2 结果与分析
2.1 不同方法提取草菇多糖及其含量测定
提取结果表明,水提多糖WPF75、微波提多糖MPF75、蜗牛酶提多糖SAPF75、纤维素酶提多糖CAPF75、碱提多糖APF75V得率分别为16.92%、15.56%、22.57%、21.38%、1.92%,可见蜗牛酶提多糖SAPF75得率最高,纤维素酶提多糖CAPF75次之,碱提多糖APF75最低。酶能最大限度地释放胞内外游离、部分结合的多糖成分,因此含量最高;由于水提法的时间长、次数多,含量也较高。
2.2 不同方法提取草菇多糖对·OH清除作用的比较
由图1可知,草菇多糖具有较强的清除·OH作用,在质量浓度0.1~5.0 mg/mL范围内,5种不同方法提取草菇多糖清除率随着质量浓度增加而提高;在质量浓度0.1~1.0 mg/mL 范围内,微波提多糖MPF75与纤维素酶提多糖CAPF75对·OH的清除率均大于阳性对照维生素C,且具有明显的量效关系;微波提多糖MPF75、纤维素酶提多糖CAPF75半抑制质量浓度IC50分别低于0.10、0.89 mg/mL,阳性对照维生素C的IC50为0.11 mg/mL;在质量浓度1.0~5.0 mg/mL 范围内,微波提多糖MPF75与纤维素酶提多糖CAPF75对·OH的清除率与阳性对照维生素C相当,对·OH 自由基的清除率为98.36%。
在质量浓度0.1~5.0 mg/mL范围内,碱提多糖APF75、水提多糖WPF75、蜗牛酶提多糖SAPF75半抑制质量浓度IC50分别为0.60、2.00、2.75 mg/mL,且具有明显的量效关系。在质量浓度1.0~5.0 mg/mL范围,草菇多糖对·OH的清除作用由大到小排序为阳性对照维生素C>碱提多糖APF75>水提多糖WPF75>蜗牛酶提多糖SAPF75。
结果表明,微波提多糖MPF75和纤维素酶提多糖CAPF75具有较强的清除·OH能力,其能力≥阳性对照维生素C。
2.3 不同方法提取草菇多糖对O-2· 清除活性的比较
由图2可知,在不同方法提取草菇多糖对O-2· 的清除作用的比较中,只有纤维素酶提多糖CAPF75对O-2· 具有清除作用。蜗牛酶提多糖SAPF75、微波提多糖MPF75、碱提多糖APF75、水提多糖WPF75的清除活性均为0;在质量浓度0.1~5.0 mg/mL范围内,纤维素酶提多糖CAPF75对O-2· 的清除活性逐渐增强,最大清除率为98.32%,且IC50为0.12 mg/mL。结果表明:仅纤维素酶提多糖CAPF75具有较强的清除O-2· 能力。
2.4 不同方法提取草菇多糖对DPPH·清除活性的比较
由图3可知,草菇多糖具有较强的清除DPPH·作用,在质量浓度0.1~5.0 mg/mL范围内,5种不同方法提取草菇多糖清除率随着质量浓度增加而提高,且具有明显的量效关系;在质量浓度0.1~1.0 mg/mL范围内,草菇多糖清除DPPH·作用由大到小排序为阳性对照维生素C>碱提多糖APF75>蜗牛酶提多糖SAPF75>纤维素酶提多糖CAPF75>水提多糖WPF75>微波提多糖MPF75;在质量浓度1.0~5.0 mg/mL范围内,草菇多糖对DPPH·的清除作用发生变化,其作用由大到小排序为阳性对照维生素C>蜗牛酶提多糖SAPF75>水提多糖WPF75>纤维素酶提多糖CAPF75>碱提多糖APF75>微波提多糖MPF75。蜗牛酶提多糖SAPF75、水提多糖WPF75、纤维素酶提多糖CAPF75、微波提多糖MPF75的半抑制质量浓度IC50分别为0.100、0.460、0.463、0.464 mg/mL。
结果表明,5种不同方法提取草菇多糖均有较强的清除DPPH·能力,且质量浓度越大,其清除率越高。
2.5 不同方法提取草菇多糖还原活性的比较
由图4可知,草菇多糖具有一定的还原力,在质量浓度0.1~1.0 mg/mL的范围内,5种不同方法提取草菇多糖清除率随着质量浓度增加而提高,且具有明显的量效关系,还原活性由大到小排序为阳性对照维生素C>纤维素酶提多糖CAPF75>微波提多糖MPF75>碱提多糖APF75>蜗牛酶提多糖SAPF75>水提多糖WPF75。在质量浓度为5.0 mg/mL时,碱提多糖APF75的还原活性也大于阳性对照维生素C。在质量浓1.5~2.5mg/mL范围内,5种不同方法提取草菇多糖还原力由强至弱排序为纤维素酶提多糖CAPF75>微波提多糖MPF75>阳性对照维生素C>碱提多糖APF75>蜗牛酶提多糖SAPF75>水提多糖WPF75。可见草菇多糖的还原能力与其抗氧化活性之间有着明显的相关性,还原能力的高低可以间接反映抗氧化能力的强弱。
结果表明,纤维素酶提多糖CAPF75和微波提多糖MPF75具有较强的还原能力,反映其抗氧化能力较强。
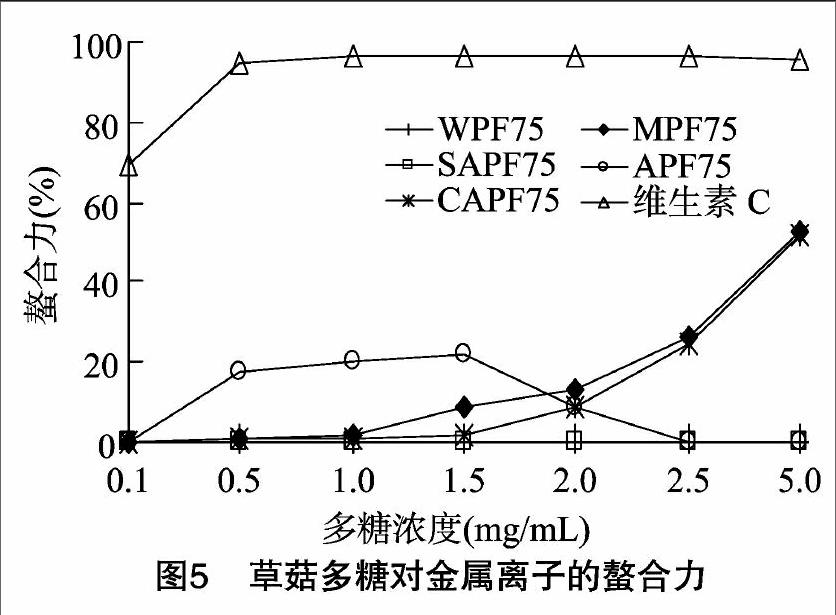
2.6 不同方法提取草菇多糖金属子螯合力的比较
由图5可知,在质量浓度为0.1~5.0 mg/mL范围内,纤维素酶提多糖CAPF75与微波提多糖MPF75随质量浓度增加对金属离子螯合力逐渐增加,最大螯合力分别为51.78%、52.77%;水提多糖WPF75与蜗牛酶提多糖SAPF75对金属离子几乎无螯合力。在质量浓度0.1~2.5 mg/mL时,碱提多糖APF75对金属子螯合力有1个平峰,最大螯合力为21.59%。活性物质的金属离子螯合作用一方面可避免重金属对生物体的危害,有利于人体的健康;另一方面又可螯合对人体重要的金属离子(铁、锌等),可能对人体健康产生负面影响[7]。
结果表明,通过控制纤维素酶提多糖CAPF75和微波提多糖MPF75浓度,能够达到较理想的金属离子螯合作用。
3 结论与讨论
由结果可知,5种不同方法提取的草菇多糖在体外对·OH、DPPH·都有较强的清除作用,其中纤维素酶法和微波法是2种最佳的提取抗氧化多糖的方法,其多糖得率分别为21.38%、15.56%,均具有较强抗氧化能力、还原能力。草菇多糖能够清除自由基,具有一定的抗氧化作用,有望被开发成为天然的抗氧化剂,极具开发潜力和市场前景。
参考文献:
[1]刘学铭,廖森泰,陈智毅. 草菇的化学特性与药理作用及保鲜与加工研究进展[J]. 食品科学,2011,32(1):260-264.
[2]孙延芳,刘艳凯,梁宗锁,等. 6种食用菌多酚及其抗氧化活性研究[J]. 广东农业科学,2011,38(16):76-78.
[3]Cheung L M,Cheung P C,Ooi V E. Antioxidant activity and total phenolics of edible mushroom extracts[J]. Food Chemistry,2003,81(2):249-255.
[4]赵俊霞,袁广峰,徐瑞雅,等. 草菇培养物中粗三萜和黄酮含量及抗氧化抗肿瘤活性研究[J]. 菌物学报,2007,26(3):426-432.
[5]张 强,张黎明. 阿魏酸茯苓多糖的抗氧化活性的研究[J]. 现代食品科技,2011,27(9):1078-1080.
[6]孟繁磊,陈瑞战,张 敏,等. 刺五加多糖的提取工艺及抗氧化活性研究[J]. 食品科学,2010,31(10):168-174.
[7]张 镜,廖富林,陈梓云,等. 阴香果实花色苷的体外抗氧化活性[J]. 食品科学,2011,32(17):128-132.

