水杨酸对紫外线胁迫下杉木组培苗的影响
吴华+苏倩+陈金慧+匡华林+施季森+成铁龙


摘要:水杨酸(SA)在植物的抗病、抗逆境胁迫中发挥着重要作用,为研究水杨酸对杉木抗紫外胁迫的影响,以杉木组培苗为试验材料,在培养基中添加不同浓度(0、50、100、150、200 mg/L)SA(以不添加SA作为对照组),用紫外灯模拟自然界UV-B辐射对其进行处理,测定紫外胁迫下杉木组培苗内源SA含量的变化,以及经SA预处理后杉木组培苗在紫外胁迫前后的生理状态及光合作用效率的变化。结果显示:不经SA预处理的杉木组培苗在紫外胁迫下内源SA含量随着照射时间的增加而增加,说明SA参与了紫外胁迫响应;经100、150 mg/L SA预处理后,有效降低杉木组培苗丙二醛含量,缓解紫外胁迫对杉木幼苗的伤害,POD活性、可溶性蛋白含量及叶绿素荧光参数(Fv/Fm值、YⅡ、qN、qP)均升高,显示SA能调节上述物质含量来增强杉木组培苗的抗紫外能力,从而有效保护杉木组培苗免受紫外胁迫的伤害。
关键词:杉木;组培苗;水杨酸;紫外胁迫;生理指标;POD活性;可溶性蛋白质含量;叶绿素荧光参数
中图分类号: S791.270.5 文献标志码: A
文章编号:1002-1302(2016)09-0207-04
杉木[Cunninghamia lanceolata (Lamb.) Hook]属杉科(Taxodiaceae)杉木属(Cunninghamia),是中国长江流域、秦岭以南地区栽培最广、生长快、经济价值高的用材树种。但是,杉木在生长过程中常受到各种逆境环境的胁迫。喻方圆等研究发现,杉木不同无性系间抵抗逆境胁迫的能力有所差异[1];吴华等发现,紫外线对杉木体胚苗有胁迫作用[2]。
水杨酸(salicylic acid,SA)是植物体内普遍存在的一种酚类化合物,是细胞内信号分子,又是一种内源性激素[3-4]。当植物受到病原物侵染后,产生过敏反应的部位内SA水平显著升高;当植物再次受到同种病原物或其他病原物侵染时,表现出抗性增强[5-7]。近年来,SA在植物抵抗非生物胁迫(紫外辐射[8-9]、低温[10-11]、高温[12-13]、干旱[14-15]、盐害[16]、重金属[17-18]等)方面作用的研究也开始受到广泛关注,但是目前有关SA在重要用材树种杉木逆境胁迫中的作用研究相对较少。本试验以杉木组培苗为对象,分析外源SA预处理对紫外胁迫的杉木组培苗生长发育的影响,从杉木组培苗生理指标的变化探讨外源添加SA是否可以缓解紫外胁迫对杉木组培苗的伤害,从而为揭示SA诱导植物抗紫外胁迫作用机制提供一定的理论基础。
1 材料与方法
选取株高7~8 cm、叶长2~3 cm、长势基本相同、生长状况良好的杉木组培苗,随机分成A、B 2组。
1.1 紫外胁迫处理下杉木组培苗内源SA含量变化
A组置于UV-B灯管(30 W,上海高硼紫外灯管)(280~320 nm)下方,用紫外辐射强度测试仪(北京师范大学光电仪器厂)测定紫外线辐射强度为18 kJ/(m2·d)。紫外辐射处理时间为每天10 h (8:00-18:00)。取辐射0、1、3、5、7、9 d 的杉木组培苗叶片(0 d为对照组),设3组重复,称质量后投入液氮,于-80 ℃冰箱保存,用于内源SA的测定。其中用甲醇浸提杉木组培苗体内的SA[19],用高效液相色谱仪(Waters e2695)测定内源SA含量。
1.2 添加SA对杉木组培苗的影响
将B组接种到含有不同浓度SA(0、50、100、150、200 mg/L)的培养基上,每个浓度4株苗,3个重复。接种3 d后将其置于紫外灯下,每天照射10 h(8:00-18:00);以接种在不加SA(0 mg/L)的培养基上的杉木为对照组(CK)。取照射0、3 d 植株相同部位的叶片,进行POD活性、丙二醛(MDA)含量、可溶性蛋白含量及叶绿素荧光参数的测定。
本研究用硫代巴比妥酸比色法进行丙二醛含量的测定[20];用考马斯亮蓝比色法进行可溶性蛋白含量的测定[21];用愈创木酚法进行过氧化物酶(POD)活性的测定[22],将1 min 内D值增加0.1计为1个过氧化物酶活力单位(U),酶活性单位为U/g。
在本研究中使用Dual-PAM-100叶绿素荧光仪进行活体叶绿素荧光的测定。测定前将植物于黑暗中适应30 min,利用24 μmol/(m2·s)测量光测初始荧光Fo,利用20 000 μmol/(m2·s)饱和脉冲测定最大荧光Fm,利用209 μmol/(m2·s)光化光测量光适应下的最大荧光(Fm′)。光系统Ⅱ的最大光合效率(Fv/Fm值)、光系统Ⅱ的实际光合效率(YⅡ)、光化学猝灭系数(qP)、非光化学猝灭系数(qN)由仪器自动给出。
2 结果与分析
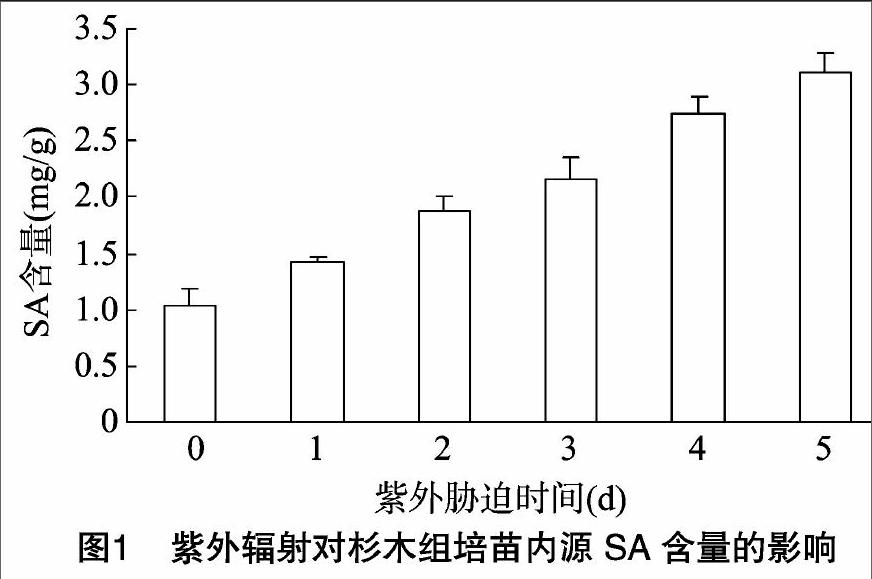
2.1 紫外胁迫处理对杉木组培苗内源SA浓度的影响
从图1可以看出,随着紫外照射时间的增加,杉木组培苗的内源SA含量呈上升趋势,与对照相比,其含量分别增加36.53%、81.73%、107.6%、162.5%、199.0%。说明在遭受紫外逆境胁迫时,杉木组培苗体内内源SA含量会升高。
2.2 SA处理对杉木组培苗抗紫外胁迫能力的影响
从图2可以看出,紫外照射0 d,经不同浓度SA处理,杉木组培苗叶绿素荧光参数(Fv/Fm值、YⅡ、qN、qP)与对照相比均降低;紫外照射3 d,与紫外照射0 d相比,杉木组培苗叶绿素荧光参数(Fv/Fm值、qN、qP)均降低。对照(0 mg/L SA)降低幅度最大,试验组杉木组培苗叶绿素荧光参数(Fv/Fm值、YⅡ、qN、qP)均高于对照组;当SA浓度为100 mg/L时,Fv/Fm值、YⅡ均达到最高值,与对照相比分别增加了10.6%、17.7%;当SA浓度为150 mg/L时,qN、qP达到最高值,与对照相比相比分别增加了81.7%、27.9%,说明适宜浓度的SA能够减弱紫外胁迫对植物的伤害。
从图3可以看出:紫外照射0 d,与对照相比经不同浓度SA处理杉木组培苗MDA含量增加,但差异不显著;紫外照射3 d,与紫外照射0 d相比,杉木组培苗MDA含量都有所上升,对照上升幅度最大,表明外源SA能缓解紫外照射引起的杉木幼苗体内MDA含量升高,MDA含量分别比对照减少了22%、29%、14%、3%,其中100 mg/L SA能显著降低由紫外胁迫产生的MDA含量。
如图4所示,在紫外照射前,与对照相比,经不同浓度水杨酸处理杉木组培苗POD活性显著提高,并随着水杨酸浓度的增加呈先上升后下降的趋势。紫外照射3 d后,不同浓度水杨酸处理POD活性升高幅度不同,与对照相比分别增加了8.1%、14.4%、34.7%、1.0%,表明紫外胁迫下外源SA可增强POD活性,其中100、150 mg/L SA可显著增强杉木体内POD的活性。
由图5可知,在紫外照射前,与对照相比,经不同浓度SA处理的杉木组培苗可溶性蛋白含量增加,差异显著,并随着
SA浓度的增加呈先上升后下降的趋势。紫外照射3 d后,经不同浓度SA处理,与对照相比杉木体内可溶性蛋白含量分别增加了121.9%、37.2%、16.9%、1.7%,说明外施SA能增加杉木体内可溶性蛋白含量,其中100、150 mg/L SA能显著增加可溶性蛋白含量。
3 结论与讨论
SA是植物体内一种与逆境防御系统密切相关的信号分子,参与植物抵抗生物与非生物胁迫的一系列细胞防御反应。研究表明,在植物中部分非生物胁迫可以导致植物内源SA水平的升高[23-25]。在本试验中,紫外辐射导致杉木组培苗叶片中内源SA积累,说明SA作为一种植物激素,参与杉木组培苗对紫外胁迫信号的响应。有研究表明,SA能激活植物过敏反应(hypersensitive response,HR)并诱导植物产生系统获得性抗性(systemic acquired resistance,SAR),HR使病原感染局部化,植物局部HR反应能引起整株植物获得抗性(即SAR)[26]。紫外照射前,外源添加SA使MDA含量增加不显著、叶绿素荧光参数数值降低,POD活性、可溶性蛋白含量升高,推测SA介导杉木产生HR、SAR,当杉木受到紫外线胁迫时,可提高杉木的抗性,保护杉木组培苗免受紫外胁迫的伤害。
叶绿素荧光参数是评价植物光合机构是否受损伤的重要参数,因此研究者常把它作为研究逆境胁迫对光合机构伤害内在响应的理想探针[27]。本试验结果表明,紫外胁迫后叶绿素荧光参数(Fv/Fm值、qN、qP)与紫外照射前相比都呈下降趋势,说明植株的光系统遭到了一定破坏;添加一定浓度SA后,Fv/Fm值、YⅡ、qN、qP下降幅度变小,SA浓度为100 mg/L时能有效增强植物光合作用,说明外源SA预处理诱导了杉木组培苗提高PSⅡ的潜在活性,提高了光能转化效率,减少了反应中心过剩光能的积累,保护光合机构免受破坏。
在正常生长条件下,植物体内自由基的产生和清除处于动态平衡状态;当植物受胁迫时,这种平衡被破坏,首先影响生物膜产生质膜过氧化作用,累积许多有害的过氧化物[28]。丙二醛是植物细胞膜不饱和脂肪酸发生过氧化作用的终产物,它可以结合交联质膜上的蛋白质,使其失活,导致膜孔隙度变大,通透性增加,从而破坏生物膜的结构和功能,引起细胞代谢紊乱[29]。在本试验中,紫外胁迫处理后,与对照相比,MDA含量减少,说明一定浓度的SA能缓解紫外胁迫对植物膜系统的破坏,缓解植物的膜脂过氧化。张林青在研究SA对盐胁迫下番茄幼苗生理指标影响时也发现,SA可降低膜脂过氧化物产物丙二醛含量和质膜透性,缓解盐胁迫对幼苗生长的抑制[30]。
植物在干旱、低温、盐害逆境胁迫下,叶绿体利用CO2的能力会受到限制,能耗降低,光合电子传递到O2的比例相对增加,可使体内活性氧如H2O2等含量大量增加。如果过量的活性氧不能被及时清除,植物将会受到严重的氧化伤害,因此植物形成酶促和非酶促的抗氧化防御系统以保护细胞免受伤[31-32]。植物体内的可溶性蛋白质大多数是参与代谢的酶类,其含量是了解植物体总代谢水平的一个重要指标[33]。在本试验中,与紫外照射前相比,紫外照射后杉木中的抗氧化酶(POD)活性及可溶性蛋白含量明显上升,杉木组培苗受到紫外胁迫后,SA可显著增强POD活性,来调节抗氧化系统代谢平衡,减轻对植物的伤害。李婧男等发现,SA对盐胁迫下沙冬青幼苗抗氧化酶活性有影响[34];可溶性蛋白含量的升高可能是与抗性蛋白质、防御酶系的合成有关[35-36]。但不同SA处理使得POD活性及可溶性蛋白含量增加量不同,100、150 mg/L SA可显著增加杉木体内POD的活性、可溶性蛋白含量,200 mg/L SA反而对杉木有害,说明SA能通过增加抗氧化酶(POD)活性、提高可溶性蛋白含量来提高杉木的适应性,从而减少紫外照射对于杉木的伤害。
综上所述,外施SA 100、150 mg/L能够有效提高杉木组培苗的生理机能,增强杉木组培苗抵抗紫外胁迫的能力,保护杉木组培苗免受紫外辐射的伤害,在今后杉木幼苗培育过程中可适当外施一定浓度SA以提高杉木幼苗的抗性。另外,SA及其功能类似物具有高效、低成本、无毒、无残留等特点,其在林业、农业的生产应用中将有广阔的前景。
参考文献:
[1]喻方圆,徐锡增,Robert D G. 水分和热胁迫对5种苗木生长及生物量的影响[J]. 南京林业大学学报:自然科学版,2003,27(4):10-14.
[2]吴 华,闫 姗,陈金慧,等. 紫外线对杉木体胚再生植株的影响[J]. 林业科学研究,2015,28(6):839-843.
[3]Liu X,Rockett K S,Krner C J,et al. Salicylic acid signalling:new insights and prospects at a quarter-century milestone[J]. Essays in Biochemistry,2015,58:101-113.
[4]Zhang Q,Xiao S.Lipids in salicylic acid-mediated defense in plants:focusing on the roles of phosphatidic acid and phosphatidylinositol 4-phosphate[J]. Frontiers in Plant Science,2015,6(2):387.
[5]Zheng X Y,Zhou M,Yoo H,et al. Spatial and temporal regulation of biosynthesis of the plant immune signal salicylic acid[J]. Proceedings of the National Academy of Sciences of the United States ofAmerica,2015,112(30):9166-9173.
[6]Zhang Y,Xu S,Yang S,et al. Salicylic acid alleviates cadmium-induced inhibition of growth and photosynthesis through upregulating antioxidant defense system in two melon cultivars (Cucumis melo L.)[J]. Protoplasma,2015,252(3):911-924.
[7]Khan M,Fatma M,Per T S,et al. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants[J]. Frontiers in Plant Science,2015,6:462.
[8]胡丽涛,吴能表,陈凤娟,等. 水杨酸对UV-B胁迫下黄瓜荧光特性和抗氧化力的影响[J]. 西南师范大学学报:自然科学版,2010,35(3):191-196.
[9]Singh V P,Kumar J,Singh S,et al. Dimethoate modifies enhanced UV-B effects on growth,photosynthesis and oxidative stress in mung bean (Vigna radiata L.) seedlings:Implication of salicylic acid[J]. Pesticide Biochemistry & Physiology,2014,116:13-23.
[10]刘晓静,郭凌飞,李 鸣,等. 水杨酸对低温胁迫下甘蔗苗期抗寒性的效应[J]. 中国农学通报,2011,27(5):265-268.
[11]辛慧慧,李防洲,侯振安,等. 低温胁迫下棉花幼苗对外源水杨酸的生理响应[J]. 植物生理学报,2014,50(5):660-664.
[12]孙军利,赵宝龙,郁松林. 外源水杨酸(SA)对高温胁迫下葡萄幼苗耐热性诱导研究[J]. 水土保持学报,2014,28(3):290-294,299.
[13]杨 岚,师 帅,王红娟,等. 水杨酸对高温胁迫下铁皮石斛幼苗耐热性的影响[J]. 西北植物学报,2013,33(3):534-540.
[14]郝敬虹,易 旸,尚庆茂,等. 水杨酸处理对干旱胁迫下黄瓜幼苗氮素同化及其关键酶活性的影响[J]. 园艺学报,2012,39(1):81-90.
[15]郝敬虹,易 旸,尚庆茂,等. 干旱胁迫下外源水杨酸对黄瓜幼苗膜脂过氧化和光合特性的影响[J]. 应用生态学报,2012,23(3):717-723.
[16]陈 颖,徐彩平,汪南阳,等. 盐胁迫下水杨酸对南林895杨组培苗抗氧化系统的影响[J]. 南京林业大学学报:自然科学版,2012,36(6):17-22.
[17]陈 珍,朱 诚. 水杨酸在植物抗重金属元素胁迫中的作用[J]. 植物生理学报,2009,45(5):497-502.
[18]王俊霖,严晓茹,沈晓云,等. 不同水杨酸处理方式对喜树幼苗铝胁迫的缓解效应[J]. 林业科技开发,2014,28(6):54-58.
[19]张 卫,孙国新,徐玉新,等. 植物体内水杨酸分析方法的探讨及其应用[J]. 生态毒理学报,2009,4(6):889-897.
[20]路文静,李弈松. 植物生理学实验指导[M]. 北京:中国林业出版社,2012:169-233.
[21]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:211-221.
[22]李合生. 植物生理生化实验理论与技术[M]. 北京:高等教育出版社,2001:216-220.
[23]Yuan S,Lin H H.Role of salicylic acid in plant abiotic stress[J]. Zeitschrift Für Naturforschung C,2008,63(5/6):313-320.
[24]Horváth E,Szalai G,Janda T.Induction of abiotic stress tolerance by salicylic acid signaling[J]. Journal of Plant Growth Regulation,2007,26(3):290-300.
[25]Miura K,Tada Y.Regulation of water,salinity,and cold stress responses by salicylic acid[J]. Frontiers in Plant Science,2014,5(2):4.
[26]丁秀英,苏宝林,张 军,等. 水杨酸在植物抗病中的作用[J]. 植物学通报,2001,18(2):163-168.
[27]裴 斌,张光灿,张淑勇,等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报,2013,33(5):1386-1396.
[28]赵天宏,孙加伟,付 宇. 逆境胁迫下植物活性氧代谢及外源调控机理的研究进展[J]. 作物杂志,2008(3):10-13.
[29]郑世英,商学芳,王景平.可见分光光度法测定盐胁迫下玉米幼苗抗氧化酶活性及丙二醛含量[J]. 生物技术通报,2010(7):106-109.
[30]张林青. 水杨酸对盐胁迫下番茄幼苗生理指标的影响[J]. 北方园艺,2011(21):36-38.
[31]鹿 宁,臧晓南,张学成,等. 逆境胁迫对藻类抗氧化酶系统的影响[J]. 武汉大学学报:理学版,2012,58(2):119-124.
[32]刘义玲,李天来,孙周平,等. 根际低氧胁迫对网纹甜瓜生长、根呼吸代谢及抗氧化酶活性的影响[J]. 应用生态学报,2010,21(6):1439-1445.
[33]梁 剑. 重金属镉胁迫对油橄榄幼苗生长的影响[J]. 江苏农业科学,2015,43(11):110-112.
[34]李婧男,刘 强,李 升. 水杨酸对盐胁迫下沙冬青幼苗抗氧化酶活性及PSⅡ光化学效率的影响[J]. 华南农业大学学报,2010,31(1):42-46.
[35]张怀山,赵桂琴,栗孟飞,等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答[J]. 草业学报,2014,23(2):180-188.
[36]朱 政,蒋家月,江昌俊,等. 低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响[J]. 安徽农业大学学报,2011,38(1):24-26.

