二氧六环/水溶液处理对棉花纤维结构形态及木质素的影响
谢丽霞,胡文冉,范玲
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆农业科学院核技术生物技术研究所/新疆农作物生物技术重点实验室/新疆农业科学院棉花分子机理与分子育种实验室,乌鲁木齐 830091)
二氧六环/水溶液处理对棉花纤维结构形态及木质素的影响
谢丽霞1,2,胡文冉2,范玲2
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆农业科学院核技术生物技术研究所/新疆农作物生物技术重点实验室/新疆农业科学院棉花分子机理与分子育种实验室,乌鲁木齐 830091)
【目的】针对棉花纤维中纤维素含量较高、难以研磨,而致使其它成分提取困难的特性,采用不同二氧六环/水溶液在不同温度和有无盐酸作为催化剂的条件下,直接处理完整棉花纤维,选出适合提取棉花纤维中木质素所需的实验条件,为进一步分析棉花纤维中木质素结构提供合适的实验方法。【方法】设置3种二氧六环与水的不同配比处理,在两种不同温度,以及有无盐酸催化条件下共12种处理,分别清洗去可溶物质的棉花纤维,提取出棉花纤维中的木质素。以标样木质素为参照,在紫外光谱条件下,分析对比不同处理所得木质素在280 nm处的吸光度值和200~500 nm区间的扫描曲线图;将其在合适的处理条件下处理得到的纤维残渣和剪碎的棉纤维分别利用扫描电镜拍照,观察二氧六环/水溶液处理对棉花纤维结构形态的影响。【结果】12种处理条件中,添加盐酸处理条件下,提取的木质素的吸光度值总体高于非盐酸条件下处理提取所得。在盐酸作用下处理棉花纤维提取的木质素中,当二氧六环/水溶液的体积比为85/15,反应温度在86℃时,提取的木质素的紫外扫描曲线与标样木质素曲线相似;扫描电镜观察结果显示,该处理能够打破棉花纤维细胞壁结构,使纤维次生壁充分暴露,有利于棉花纤维中结构物质的析出。【结论】利用二氧六环/水溶液(V/V,85/15)在86℃、盐酸作为催化剂的反应条件下处理完整棉花纤维16 h,可提取出棉花纤维中木质素。
二氧六环/水;棉花纤维;结构形态;木质素
0 引 言
【研究意义】木质素是一种由苯丙烷结构单元构成,具有三维立体网状结构的天然高分子杂聚物,在自然界中是含量仅次于纤维素的第二大丰富的可再生有机资源。木质素在维管植物(蕨类植物、裸子植物和被子植物等)中分布广泛,是植物细胞壁的重要组成成分,主要沉积在植物次生壁中,与细胞壁中的结构多糖以化学键连接形式形成交联结构[1]。在植物体中,木质素为植物细胞壁提供机械强度与疏水性,同时允许水和营养物质的运输,保护植物免受物理、化学和微生物的侵害[2]。研究发现木质素也存在于棉花纤维中,并且影响棉花纤维品质的形成,尤其是对纤维强度有着重要作用[3-5]。棉花纤维是棉花特有的一种表皮毛细胞,由棉花胚珠外珠被单个细胞分化发育而来,经历分化、伸长、次生壁加厚和脱水成熟四个时期,棉花纤维在持续时间较长的次生壁加厚时期合成大量的纤维素,是在高等植物中纤维素含量最多的单细胞结构[6]。棉纤维纤细、柔软,次生壁结构紧实致密难以使用研磨成粉状,导致结构多糖以外的结构物质难以提取,针对这种特性,找到合适的棉纤维木质素的提取方法为进一步分析其结构具有十分重要的意义。【前人研究进展】木质素在植物细胞壁中分布不均一,结构复杂且不稳定,与纤维素和半纤维通过化学键紧密连接,分子量也因生物种类及分离方法等大小存在差异,如何在不改变木质素结构的前提下将其从细胞壁中完全分离出来仍然是木质素研究的难点。植物体中的木质素的分离方法大体可分为两类:一类是将植物体中木质素以外的成分溶解除去,木质素作为不溶性成分被过滤分离出来,另一类是木质素作为可溶性成分,将植物体中的木质素溶解而纤维素等其他成分不溶解进行的分离[7]。目前分离提取木质素方法众多,但不同的分离提取方法致使提取的木质素种类也有所不同。天然木质素因含有多糖聚砜等杂质不能代表其原本结构;磨木木质素得率低而且含有少量糖,球磨时间长致使木质素组分改变;酶解木质素产量虽高,但是含有糖类物质,影响对木质素结构的分析[7];二氧六环木质素兼具产量和纯度,广泛用于分析木质素的结构特性[8]。二氧六环木质素是把木质素作为可溶物质溶解再分离提取的一种方法,该方法在处理提取过程中样品化学结构变化比较少,所以被用来分析研究物质结构。二氧六环提取木质素在香蕉植物的叶鞘[10]、桉树[11]和麻类[12]等生物质中已有相关研究报道和部分理论基础。【本研究切入点】迄今为止,采用二氧六环/水溶液提取棉花纤维中的木质素的相关研究还未见报道,同时也未发现选用二氧六环/水溶液的不同配比分析比较对提取的木质素的影响的相关研究。实验结合紫外光谱分析与扫描电镜技术以选择和验证相对最佳的样品处理方法。【拟解决的关键问题】研究将完整棉花纤维采用二氧六环/水溶液在不同的实验条件下进行处理,通过对比在不同实验条件下不同二氧六环/水溶液的配比,在紫外光谱下选出二氧六环/水溶液提取棉花纤维中木质素合适的实验条件,并结合扫描电镜观察二氧六环/水溶液处理后纤维的形态变化,为研究棉纤维中木质素的结构提供适宜的实验方法。
1 材料与方法
1.1 材 料
1.1.1 棉花
供试材料为TM-1,2015年种植于新疆农科院玛纳斯试验站,自然成熟后,收获脱绒备用。
1.1.2 主要试剂及仪器
1,4-二氧六环,丙酮,二氯甲烷,乙醇,二甲基亚砜(DMSO),盐酸(HCl),NaHCO3,Tris-HCl,NaCl,Triton X-100,均为分析纯;蒸馏水;标样木质素;均一化缓冲液(H-buffer:50 mmol/L Tris-HCl、10 g/L Triton X-100、1 mol/L NaCl,pH 8.3);天平;电热恒温震荡水槽(上海一恒,DKZ-2型);定性滤纸;磁力搅拌器;旋转蒸发仪(N-1100);烘箱(EYELA,NDO-700);扫描电镜(蔡司,SUPRA 55VP),GBC紫外分光光度计。
1.2 方 法
1.2.1 棉花纤维的获得与清洗
将自然成熟的棉铃使用轧花机脱籽留取纤维,用镊子拣去除纤维以外的杂质;使用均一化缓冲液清洗两次,80%的丙酮清洗两次,纯丙酮清洗一次,每次清洗后使用夹蒜器挤干溶液;将清洗好的棉花纤维自然晾干备用。取少量清洗干燥后的棉花纤维,剪碎,备用(标记为CK)。
1.2.2 二氧六环/水溶液(V/V)处理棉花纤维
准确称取12份0.5 g的棉花纤维分别置于50 mL的浓缩瓶内,每份3个重复。参照Allison Tolbert[13]、M. SARWAR JAHAN[14]以及S.WU[15]等的方法,其中略有改变。在12个浓缩瓶中分别加入不同比例的二氧六环溶液30 mL,在不同温度以及有无盐酸做催化剂的条件下(0.405 mL HCl),加热回流冷凝反应16 h后取出,室温下冷却,定性滤纸过滤。棉纤维残渣用相同配比的二氧六环/水溶液清洗2~3次,过滤,合并滤液。纤维残渣再用蒸馏水清洗三次后烘干备用。滤液用NaHCO3调节pH值至中性,随后使用旋转蒸发仪将滤液蒸干,加入30 mL冷水,置于磁力搅拌器上搅拌使之均一化。12 000 r/min离心5 min,得到黄褐色沉淀物,即为粗制木质素。表1
1.2.3 木质素的纯化
参照Angela Ziebell[16]方法分别将不同实验条件下获得的粗制木质素溶于90/10(V/V)的二氧六环/水的溶液中,分别加入10 mL冷水使之沉淀析出,4℃,12 000 r/min,5 min离心,将得到的沉淀物过夜室温下干燥。在已干燥的沉淀物中加入10 mL二氯甲烷/乙醇(V/V,2/1)使其溶解,用乙醚沉淀木质素,12 000 r/min,室温离心5 min,获得的木质素再用乙醚清洗3次,干燥。

表1 反应体系的温度条件、浓度配比和酸性条件Table 1 The temperature of the reaction system conditions, concentration ratio and the acidic conditions
1.2.4 不同比例二氧六环/水处理棉纤维所得木质素的紫外光谱图
将干燥后的二氧六环木质素分别溶解于5 mL二甲基亚砜(DMSO)中;同时称取5 mg木质素标样,用5 mL的二甲基亚砜溶解,使用GBC紫外分光光度计,以二甲基亚砜作为参照对比溶液,测定280 nm处的吸光度值,并在200~500 nm区间扫描标样木质素和所提取木质素的吸收光谱图。
1.2.5 扫描电镜制片
将剪碎的棉花纤维(CK)与二氧六环处理并用蒸馏水清洗干燥后的纤维残渣,用导电性好的导电双面胶分别粘在金属样品台面上,放在真空蒸发器中喷镀一层100~200埃厚的金属膜,在2 000′的放大倍数时选取CK与二氧六环溶液处理后的纤维残渣利用扫描电镜拍照观察。
2 结果与分析
2.1 盐酸对不同比例二氧六环/水处理棉纤维的影响
实验设置1~12号处理棉花纤维的反应条件,其中,单号为添加盐酸的反应体系,双号为未添加盐酸的反应体系。研究表明,1~12号处理棉花纤维提取的木质素的吸光度值,T1、T3、T5、T7、T9、T11号处理提取的木质素吸光度值总体高于T2、T4、T6、T8、T10、T12号处理提取的木质素吸光度值,总体表现为T5>T3>T1>T11>T9>T7>T4>T8>T2>T12>T10>T6号处理。即反应混合物中添加盐酸时的提取高于未添加盐酸时提取的木质素的吸光度值。表明盐酸在反应体系中作为催化剂,有助于二氧六环/水溶液提取棉花纤维中的木质素。图1
2.2 温度对不同浓度二氧六环处理棉纤维的影响
研究表明,相同条件下,木质素的吸光度值表现为T7
2.3 紫外吸收光谱
研究表明,在12种处理棉花纤维的反应条件中,当混合体系中没有添加盐酸作为反应催化剂时,所得木质素的吸光度值较低,其扫描曲线趋势趋于平滑,所以仅对特征性较强的混合体系中添加盐酸作为催化剂时提取的木质素进行紫外吸收光谱分析(奇数号)。图1
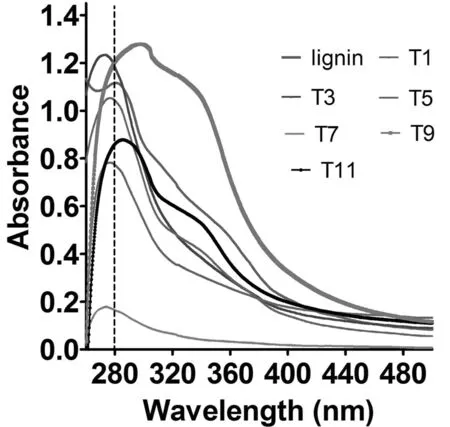
研究表明,T1、T3、T5、T7、T9、T11在270~350 nm处有明显的吸收信号。木质素所含的芳环结构在紫外光区域有较为强烈的吸收光谱,一般在200~208和268~287 nm处有强烈吸收,在230 nm附近也有吸收峰,但相对较弱,310~350 nm附近也有较弱的吸收峰。T1的扫描曲线与标样木质素扫描曲线相似,说明当反应体系在以盐酸为催化剂、温度86℃、二氧六环/水的配比为85/15(V/V)时,提取的木质素更为贴近结构变化小的木质素。图2

注:86℃:T1(85/15)、T2(85/15)、T3(90/10)、T4(90/10)、T5(96/4)、T6(96/4);90℃:T7(85/15)、T8(85/15)、T9(90/10)、T10(90/10)、T11(96/4)、T12(96/4);二氧六环/水(V/V);T1、T3、T5、T7、T9、T11处理添加盐酸;T2、T4、T6、T8、T10、T12处理未添加盐酸
Note: 86℃: T1(85/15)、T2(85/15)、T3(90/10)、T4(90/10)、T5(96/4)、T6(96/4); 90℃: T7(85/15)、T8(85/15)、T9(90/10)、T10(90/10)、T11(96/4)、T12(96/4); dioxane/water (V/V); T1、T3、T5、T7、T9、T11 treatment with hydrochloric acid; T2、T4、T6、T8、T10、T12 treatment without hydrochloric acid
图1 不同处理条件下提取的木质素吸光度值
Fig.1 Extraction of lignin absorbance value under different processing conditions
2.4 二氧六环处理方法对棉花纤维表面结构形态的影响
研究表明,剪碎的棉纤维(CK,图3A)结构完整,纤维细胞壁表面趋于光滑,切面断裂面痕迹平整;而二氧六环/水(V/V,85/15)溶液处理后的棉纤维(图3B)多处断裂,纤维细胞壁表面被剥离成片状,表层剥离破损明显,结构变化显著,切断面与未处理时相比较,破坏效果尤为明显。比较表明,棉花纤维经二氧六环/水(V/V,85/15)溶液处理后有利于木质素的分离提取,以此验证了在该实验条件下处理棉花纤维分析其木质素方法的合理性。图3
注: 86℃:T1(85/15)、T3(90/10)、T5(96/4);90℃:T7(85/15)、T9(90/10)、T11(96/4);二氧六环/水(V/V),以盐酸为催化剂处理
Note: 86℃: T1(85/15), T3(90/10), T5(96/4); 90℃: T7(85/15),T9(90/10), T11(96/4); dioxane/water (V/V),Treatment with hydrochloric acid as a catalyst
图2 木质素吸收曲线
Fig.2 Lignin absorption curve

注:图A为剪碎的棉纤维(CK),图B为86℃时以盐酸作为催化剂、二氧六环/水(V/V,85/15)处理后的棉花纤维;放大倍数为2 000′
Note: Figure A is chopped cotton fiber (CK), Figure B for cotton fibers were treated by the ratio of 85/15(V/V) dioxane/water solution at 86℃ with hydrochloric acid as a catalyst; Magnification of 2,000′
图3 未处理与二氧六环处理后棉纤维的SEM
Fig.3 SEM image of untreated and treated after p-dioxane cotton fiber
3 讨 论
目前,关于分离提取生物质中的木质素,一般是将材料经研磨处理之后采用二氧六环抽提,二氧六环溶剂提取所得木质素纯度高,碳水化合物含量较少,不含硫成分,结构破坏小,已被认为是提取木质素首选的标准溶剂[17-19]。木材、竹材等生物质材料木质化程度高,质地坚硬,一般在分离木质素之前都采用球磨粉碎处理的方式,在后续的提取中以提高木质素得率。但是由于棉花纤维中纤维素含量较高和难以研磨而致使其它成分提取困难的特性,不能沿用其它材料在处理时所采用的研磨等类似的方法,实验尝试二氧六环/水溶液的三种配比12种不同处理条件提取棉花纤维中的木质素。实验结果表明,温度相同、二氧六环/水溶液配比相同时,当在反应体系中添加盐酸作为催化剂时,相对于未添加盐酸时的处理效果较为明显,这与Gellerstedt G.[9]的实验结果一致。盐酸作为反应催化剂,主要作用是破坏木质素和半纤维素间α-芳基醚键,混合溶液在酸性条件时选择性断裂木质素中的芳基甘油-β-醚键和其他一些不稳定的醚键连接,使分离木质素的过程更易于进行[8]。虽然毛健贞[20]在处理乌拉草过程中,发现在稀酸处理后的生物质表面有微球状的假木质素存在,假木质素是由糖类-木质素聚合物和糖类水解重聚组成,但与实验结果不同,实验中二氧六环/水溶液处理棉花纤维得到的木质素参照Angela Ziebell的方法对其纯化后,除去了大部分糖类物质,有效阻碍了假木质素的形成。实验中反应温度在86℃时从棉纤维中分离提取出的木质素的吸光度值明显高于90℃时木质素的吸光度值,推测在二氧六环/水溶液中由于温度偏高反而可能会影响木质素的分离。实验中,紫外扫描结果显示,86和90℃时90/10(V/V)处理棉花纤维提取的木质素分别在273和298 nm处有最大吸收值,最高吸收波峰偏离标准样品。前人测试紫丁香基丙烷结构单元的特征吸收在274~276 nm处,愈创木基丙烷结构单元在281~285 nm处有较大的吸收[21],推测该处理可能含有其它成分致使波峰偏离。90℃时96/4(V/V)处理的吸光度值偏低,与90/10(V/V)处理所得木质素的吸收峰均在320 nm之后有明显的吸收峰,推测可能是对香豆酸和阿魏酸的结构吸收峰,这与孙永昌在怪柳和史正军在甜龙竹中提取的木质素结构类似[22-23]。86℃时96/4(V/V)和90℃时85/15(V/V)处理的吸光度值最低,相对而言,可能该处理致使木质素提取不够完全。总之,前述这些处理可能含有其它成分干扰吸收而导致峰形不够理想;比较而言,当配比为85/15(V/V)时,在280 nm附近有非常明显的非共轭酚型基团吸收,显示出了木质素紫外吸收的基本特征,吸收光谱特征与标准样品很相似,并与M. SARWAR JAHAN[14]分离提取的木质素紫外扫描曲线结果一致。根据提取的木质素在280 nm处的吸光度值和200~500 nm的紫外吸收图谱,结合扫描电镜观察,显示棉纤维经二氧六环/水的配比为85/15(V/V)处理后,细胞壁破碎,次生壁充分暴露,有利于沉积在次生壁当中的木质素被分离出来。
4 结 论
二氧六环/水溶液处理棉纤维可以打破木质素与纤维素半纤维素彼此间的交联状态,达到破坏纤维组织结构使纤维次生壁裸露,有利于提取沉积在纤维次生壁中的木质素的目的。清洗去可溶物质的棉花纤维,利用酸性二氧六环/水(V/V,85/15)溶液在86℃条件下处理棉花纤维16 h,可提取出棉花纤维中的粗制木质素,将粗制木质素纯化后得到棉花纤维中的木质素。
References)
[1] 曹双瑜, 胡文冉, 范玲. 发育中棉纤维硫酸木质素含量的动态变化[J]. 新疆农业科学, 2012, 49(7):1 184-1 189.
CAO Shuang-yu, HU Wen-ran, FAN Ling. (2012).The Dynamic Changes of Klason Lignin Contents during Cotton Fiber Development [J].XinjiangAgriculturalSciences, 49(7):1,184-1,189. (in Chinese)
[2] Dima, O., Morreel, K., Vanholme, B., Kim, H., Ralph, J., & Boerjan, W. (2015). Small glycosylated lignin oligomers are stored in Arabidopsis leaf vacuoles.PlantCell, 27(3):695-710.
[3] Ling, F., Shi, W. J., Hu, W. R., Hao, X. Y., Wang, D. M., & Hui, Y., et al. (2009). Molecular and biochemical evidence for phenylpropanoid synthesis and presence of wall-linked phenolics in cotton fibers.JournalofIntegrativePlantBiology, 51(7):626-637.
[4] 闫洪颖. 棉花纤维发育过程超微结构观察和次生壁木质素含量的分析[D]. 乌鲁木齐:新疆农业大学硕士论文,2009.
YAN Hong-ying. (2009).Ultra-structural Observation on Fiber Cell and Lignin Content Analysis of Secondary Wall during Cotton Fiber Development [D]. Master Dissertation. Xinjiang Agricultural University, Urumqi.(in Chinese)
[5] Han, L. B., Li, Y. B., Wang, H. Y., Wu, X. M., Li, C. L., & Luo, M., et al. (2013). The dual functions of wlim1a in cell elongation and secondary wall formation in developing cotton fibers.PlantCell, 25(11):4,421-4,438.
[6] Kim, H. J., & Triplett, B. A. (2001). Cotton fiber growth in planta and in vitro. models for plant cell elongation and cell wall biogenesis.PlantPhysiology, 127(4):1,361-1,366.
[7] 蒋挺大.木质素[M].第二版.北京: 化学工业出版社,2008:88-89.
JIANG Ting-da. (2008).Lignin[M]. 2nd Ed. Beijing: Chemical Industry Press:88-89.(in Chinese)
[8] 岳凤霞. 木质素新型模型物的合成及其在木质素结构研究中的应用[D]. 广州:华南理工大学博士论文,2012.
YUE Feng-xia. (2012).Synthesesofnewlignin-relatedmodelcompoundsandtheirusesforstructuralcharacterizationoflignin[D]. PhD Dissertation. South China University of Technology, Guanzhou. (in Chinese)
[9] Gellerstedt, G., Pranda, J., & Lindfors, E. L. (1994). Structural and molecular properties of residual birch kraft lignins.JournalofWoodChemistry&Technology, 14(4):467-482.
[10] Oliveira, L., Evtuguin, D. V., Cordeiro, N., Silvestre, A. J., Silva, A. M., & Torres, I. C. (2006). Structural characterization of lignin from leaf sheaths of "dwarf cavendish" banana plant.JournalofAgricultural&FoodChemistry, 54(7):2,598-2,605.
[11] Evtuguin, D, V,, Neto, C. P., Silva, A. M., et al.(2001). Comprehensive study on the chemical structure of dioxane lignin from plantation eucalyptus globulus wood.JournalofAgricultural&FoodChemistry, 49(9):4,252-4,261.
[12] 颜婷婷,吴东辉,严雪峰,等. 黄麻和红麻纤维磨木木质素的红外光谱特征[J]. 中国麻业科学,2008,30(6):316-320.
YAN Ting-ting, WU Dong-hui, YAN Xue-feng, et al.(2008). The FTIR Characteristics of the Milled Wood Lignin of Jute and Kenaf Fibers [J].PlantFiberSciencesinChina, 30(6):316-320. (in Chinese)
[13] Tolbert, A., Akinosho, H., Khunsupat, R., Naskar, A. K., & Ragauskas, A. J. (2014). Characterization and analysis of the molecular weight of lignin for biorefining studies.BiofuelsBioproducts&Biorefining, 8(6):836-856.
[14] Jahan, M. S., Liu, Z., Wang, H., Saeed, A., & Ni, Y. (2012). Isolation and characterization of lignin from prehydrolysis liquor of kraft-based dissolving pulp production.CelluloseChemistry&Technology, 46(3):261-267.
[15] Wu, S., & Argyropoulos, D. S. (2003). An improved method for isolating lignin in high yield and purity.JournalofPulp&PaperScience, 29(7):235-240.
[16] Ziebell, A., Gracom, K., Rui, K., Chen, F., Pu, Y., & Ragauskas, A., et al. (2010). Increase in 4-coumaryl alcohol units during lignification in alfalfa (medicago sativa) alters the extractability and molecular weight of lignin.JournalofBiologicalChemistry, 285(50):38,961-38,968.
[17] J skelinen, A. S., Sun, Y., Argyropoulos, D. S., Tamminen, T., & Hortling, B. (2003). The effect of isolation method on the chemical structure of residual lignin.WoodScience&Technology, 37(2):91-102.
[18] Bai, Y. Y., Xiao, L. P., Shi, Z. J., & Sun, R. C. (2013). Structural variation of bamboo lignin before and after ethanol organosolv pretreatment.InternationalJournalofMolecularSciences, 14(11):21,394-21,413.
[19] 张爱萍,刘传富,孙润仓,等. 光谱技术在木素结构分析中的应用[J]. 中国造纸学报,2007,22(3):97-101.
ZHANG Ai-ping, LIU Chuan-fu, SUN Run-cang, et al. (2007). The Application of Spectroscopy Technologies in Lignin Structural Characterization [J].TransactionsofChinaPulpandPaper, 23(3):97-101.(in Chinese)
[20] 毛健贞. 乌拉草木质素结构解析及预处理过程中的木质素结构变化[D]. 北京: 北京林业大学博士论文,2014.
MAO Jian-zhen.(2014). Structural characterization of lignin in Carex meyeriana Kunth, and their changes during pretreatment [D]. PhD Dissertation. Beijing Forestry University, Beijing. (in Chinese)
[21] 王键,王燕. 棉秆木质素的光谱分析[J]. 林产化学与工业, 2009,29(1):115-119.
WANG Jian, WANG Yan.(2009). Spectroscopic Analysis of Cotton Stalk Lignin [J].ChemistryandIndustryofForestProducts, 29(1):115-119. n Chinese)
[22] 孙永昌. 木质素高效分离、结构表征及基于离子液体的降解机理研究[D]. 北京: 北京林业大学博士论文,2014.
SUN Yong-chang.(2014).EfficientSeparationandStructuralCharacterizationofLignin,andLigninDegradationinIonicLiquid-basedSystems[D]. PhD Dissertation. Beijing Forestry University, Beijing. (in Chinese)
[23] 史正军. 甜龙竹及巨龙竹半纤维素、木质素结构诠释及相互间化学键合机制解析[D]. 北京: 北京林业大学博士论文,2013.
SHI Zheng-jun.(2013).Structuralcharacterizationofhemicellulosesandlignin,andtheirinter-linkagesinDendrocalamusbrandisiiandDendrocalamussinicus[D]. PhD Dissertation. Beijing Forestry University, Beijing. (in Chinese)
Fund project:The Talents Engaging in Scientific and Technological Innovations of Xinjiang, China "Comparison of cell wall ultrastructure and phenylpropanoid compounds in developing fiber of upland cotton and sea- island cotton"(No.2014721025)
Dioxane/Aqueous Solution Treatment on Cotton Fiber Structure Form and the Influence of Lignin
XIE Li-xia1,2,HU Wen-ran2,FAN Ling2
(1. College of Agronomy, Xinjiang Agricultural University, Urumqi 830052, China; 2. Research InstituteofNuclearandBiotechnologies/XinjiangKeyLaboratoryofCropBiotechnology/LaboratoryofMolecularMechanismandMolecularBreedinginCotton,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China)
【Objective】 In view of the high cellulose content in cotton fiber and the difficulty to grind it, which causes it hard to extract other chemical compositions in it, the project aims to treat cotton fiber with different dioxane / water ratio solution at different temperatures and with no hydrochloric acid as catalyst in order to choose sui
Table experimental conditions, which might be an appropriate experimental method for further lignin structure study of cotton fiber.【Method】Soluble substances in cotton fiber were cleaned and were treated by the 12 different treatment conditions that included 3 different ratios of dioxane/water, 2 different temperature conditions, and catalysis with or without hydrochloric acid. The lignin absorbance at 280 nm and scanning curves on range of 200-500 nm of the lignin from different treatment was analyzed based on the UV with the standard sample lignin as reference. Then the fiber residue, which was obtained from an appropriate treatment, was compared with chopped fiber using scanning electron microscopy (SEM) to observe the influence of the fiber morphology during treatment in dioxane/water.【Result】In the 12 treatments, the conditions with the hydrochloric acid catalysis had higher lignin absorbance. When the volume ratio of dioxane/water was 85/15 and the heat-treatment temperature was 86℃, the UV scanning curve of the extracted fiber lignin was similar to that of standard sample lignin. SEM observation results showed that the cotton fiber cell wall structure, in the crosslinking structure of cellulose, hemicellulose and lignin, was destroyed and made the secondary wall exposed sufficiently, which benefit the release of structural material of cotton fiber.【Conclusion】When complete cotton fibers were treated by the ratio of 85/15 (V/V) dioxane / water solution at 86℃ for 16 h, hydrochloric acid as a catalyst, the lignin in the cotton fibers can be extracted, which will provide a new approach to study the lignin in cotton fiber.
dioxane;cotton fiber;structure form;lignin
10.6048/j.issn.1001-4330.2016.08.002
2016-03-21
自治区创新人才项目“陆地棉和海岛棉纤维不同发育阶段细胞壁超微结构和苯丙烷类化合物的比较”(2014721025)
谢丽霞(1988-),女,陕西人,硕士研究生,研究方向为生物化学与分子生物学,(E-mail)muyuewangxie@126.com
范玲(1958-),女,山西人,研究员,博士,研究方向为棉花纤维品质改良机理,(E-mail)fanling@xaas.ac.cn
S562
A
1001-4330(2016)08-1383-07

