加工番茄下胚轴再生体系的建立
唐亚萍,王柏柯,杨生保,李 宁,杨 涛,帕提古丽,王 强,余庆辉
(新疆农业科学院园艺作物研究所,乌鲁木齐 830091)
加工番茄下胚轴再生体系的建立
唐亚萍,王柏柯,杨生保,李 宁,杨 涛,帕提古丽,王 强,余庆辉
(新疆农业科学院园艺作物研究所,乌鲁木齐 830091)
【目的】建立加工番茄模式品种M82的再生体系,为加工番茄M82的遗传转化奠定基础。【方法】研究不同灭菌剂对加工番茄表皮灭菌效果,及运用正交组合设计不同浓度的激素配比,研究不同浓度的激素对加工番茄愈伤组织诱导和不定芽诱导的影响。【结果】加工番茄种皮灭菌,以15%次氯酸钠(NaClO)+吐温-20 30 min对加工番茄M82种皮的灭菌效果最佳;愈伤组织诱导,以MS B5+3 mg/L 6-BA+0.25 mg/L NAA诱导出的愈伤组织平均直径最大;不定芽诱导,以MS B5+0.5 mg/L ZT+0.2 mg/L IAA中诱导的愈伤组织平均出芽数最多。【结论】获得了加工番茄M82的再生体系,并得出细胞分裂素ZT对于加工番茄不定芽的诱导具有较好的效果。
加工番茄;下胚轴;再生体系
0 引 言
【研究意义】番茄(SolanumLycopersicon)是全球广泛栽培的重要蔬菜作物,并已完成基因组测序[1],加工番茄作为番茄的一个栽培种是新疆主要的经济作物之一。加工番茄主要的特点是自封顶,植株矮化,多分枝,花期集中,果实多为椭圆,与鲜食番茄相比果皮较厚,更耐储运[2]。栽培番茄M82具有加工番茄的多项特点,并作为加工番茄的模式品种被广泛应用于研究中。加工番茄的组织培养是进行加工番茄杂种优势固定、优良品种快繁、突变体保存利用及转基因等生物技术领域研究的基础。【前人研究进展】通常组织培养的外植体包括:原生质体、子叶、下胚轴和真叶,其中研究最多的是子叶[3]。不同品种和不同外植体的再生频率各不相同。在番茄的组织再生培养中用的最多的植物生长调节物质分别是玉米素(ZT)、6-苄基腺嘌呤(6-BA)、萘乙酸(NAA)和3-吲哚乙酸(IAA)。El-Bakry[4]利用不同浓度的6-BA和IAA研究了10个不同品种的番茄,其中5个品种的诱导率高达100%。马杰等[5]认为2.0 mg/L 6-BA+0.2 mg/L NAA对浙杂‘905’、‘圣亚’和‘富丹’再生效果最佳。李景富等[6]在研究中指出2.0 mg/L 6-BA+0.2 mg/L IAA是宇番一号和0949-46下胚轴最佳的出芽培养基,并且这两个品种子叶的芽分化率均高于下胚轴。李倩等[7]研究结果表明,对于番茄品种‘09-22’来说1.0 mg/L 6-BA+0.5 mg/L IAA是最佳的芽分化培养基,并且子叶的分化率略高于下胚轴。刘炜炜等[8]以加工番茄‘亚心98-1’和里格尔子叶为外植体认为ZT和IAA的组合对不定芽的诱导效果最好。【本研究切入点】由于番茄的离体再生具有明显的基因型依赖性[9],加之加工番茄M82的再生体系研究是进行加工番茄功能基因组学和分子生物学研究的基础,而目前关于加工番茄下胚轴组织培养再生体系的研究鲜有报道。因此,以具有较高分生组织特性的下胚轴为外植体,研究加工番茄的高效再生体系对加工番茄基因功能鉴定具有重要意义。【拟解决的关键问题】研究以加工番茄M82为研究材料,以下胚轴为外植体进行不同浓度激素的配比筛选出最优的加工番茄M82的再生体系,为加工番茄基因功能研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 品种
供试的加工番茄品种为M82(引自Tomato Genetics Resource Center)。
1.1.2 培养基
种子发芽的培养基:1/2 MS(文中MS培养基为30 g/L蔗糖,70 g/L琼脂,pH=5.8)。
愈伤组织诱导培养基:在MS+B5的基本培养基中,添加不同浓度的6-BA (2.0、3.0和4.0 mg/L)及NAA(0.25和0.5 mg/L)的组合。
不定芽诱导培养基:在MS+B5的基本培养基中,添加不同浓度的ZT (0.5和1.0 mg/L)及IAA(0.1和0.2 mg/L)的组合。
根诱导培养基:MS+0.5 mg/L IBA[2,10]。
1.2 方 法
1.2.1 无菌苗
挑选籽粒饱满的种子50粒,分别用不同的方法进行种皮表面灭菌,加工番茄种皮表面灭菌的方法分别采用:15%次氯酸钠(NaClO)+吐温-20 30 min、70%乙醇1 min+15% NaClO 20 min、和0.1%升汞(HgCl2)3 min +15% NaClO 20 min。在操净工作台内用无菌水冲洗3~5次,将加工番茄种子接入1/2 MS培养基内,放置于(25±1 ℃)光照培养箱内,待种子发芽7 d后使用。
1.2.2 外植体
将发芽后的无菌苗取下胚轴0.5 cm接种于含有不同浓度6-BA和NAA的MS+B5培养基内进行愈伤组织出愈情况观察,并移植到含有不同浓度的ZT和IAA中进行不定芽诱导的观察。
在张录霞等[2]的研究结果基础上,设计不同激素浓度配比,利用正交分析法将不同浓度的激素进行配比,列出加工番茄下胚轴愈伤组织诱导和不定芽诱导培养基,不定根采用MS+0.5 mg/L IBA进行诱导。表1,表2
1.2.3 测定项目
待下胚轴接种于不同愈伤组织诱导培养基内25 d后,观察愈伤组织的生长情况,并统计愈伤组织平均直径、诱导率和出芽率。
1.3 数据统计
数据采用SPSS软件进行变量分析(Avova),0.05水平为显著性差异(Duncan)。
表1 M82愈伤组织诱导培养基中不同浓度6-BA和NAA组合
Table 1 The medium of callus differentiation with different concentrations of 6-BA and NAA in M82

编号NoB1B2B3B4B5B66-BA(mg/L)202030304040NAA(mg/L)025050250502505
表2 M82不定芽诱导培养基中不同浓度ZT和IAA组合
Table 2 The medium of buds differentiation with different concentrations of ZT and IAA in M82
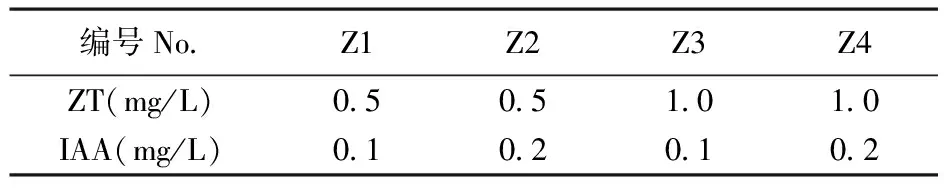
编号NoZ1Z2Z3Z4ZT(mg/L)05051010IAA(mg/L)01020102
2 结果与分析
2.1 不同灭菌剂对种子消毒效果的影响
研究表明,不同灭菌剂对加工番茄M82种子的灭菌效果和萌发均有影响。15%次氯酸钠、吐温-20和70%乙醇对种子的萌发影响不大,均有90%以上的萌发率。但在灭菌效果上,先用70%乙醇进行种皮表面灭菌效果较好。用升汞进行种皮表面灭菌的效果最好,没有污染的种子,但是升汞却极大的影响了种子的萌发,用升汞处理后的种子萌发率仅为8%。因此,采用70%乙醇1 min+15%次氯酸钠 20 min进行加工番茄种皮表面灭菌处理。在该种皮灭菌条件下,经过12 d后无菌苗子叶全出,成长势良好。表3,图1
表3 不同灭菌剂加工番茄M82种子污染率和发芽率
Table 3 Effects of different sterilizing agents on the rate of contamination and germination of M82 seeds

灭菌剂种类Typesofsterilizingagent污染率Pollutionrate(%)发芽率Germinationrate(%)15%NaClO+吐温(Tween)-2030min49501%HgCl23min+15%NaClO20min0870%乙醇(Ethanol)1min+15%NaClO20min192

图1 不同灭菌剂种类M82发芽变化
Fig.1 Effects of different sterilizing agents on the germination of M82 seeds
2.2 不同浓度的6-BA和NAA对加工番茄愈伤组织诱导率的影响
根据张录霞等[2]的研究结果,同时由于ZT较6-BA的成本较高,因此在加工番茄愈伤组织诱导阶段采用细胞分裂素6-BA进行愈伤组织的诱导(图2A)。不同浓度的6-BA和NAA的组合对加工番茄愈伤组织的诱导率差异不明显,各激素配比的培养基内愈伤组织的诱导率均在98%以上。从加工番茄愈伤组织的平均直径可以看出,愈伤组织平均直径最大的培养基中激素浓度是3 mg/L 6-BA+0.25 mg/L NAA。随着6-BA的浓度增加,愈伤组织的平均直径也增加。但是当6-BA浓度升高到4 mg/L时,影响愈伤组织的生长,愈伤组织的平均直径明显减小。NAA的浓度对加工番茄愈伤组织的诱导和平均直径的大小没有明显的影响。然而6-BA对加工番茄不定芽的诱导率却很低,最高的不定芽诱导率仅有31.58%,同时可以看出较高浓度的NAA会影响不定芽的诱导。表4,图2
表4 不同浓度的6-BA和NAA下加工番茄愈伤组织诱导变化
Table 4 Effects of different concentrations of 6-BA and NAA on callus induction of processing tomato
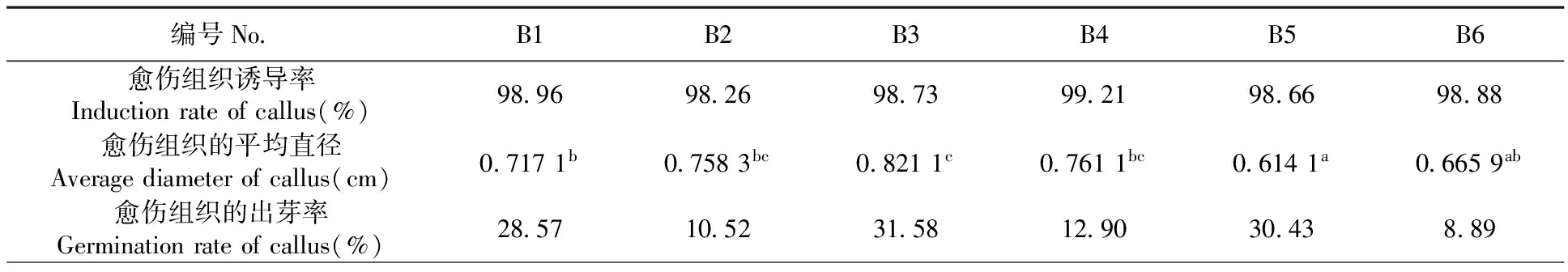
编号NoB1B2B3B4B5B6愈伤组织诱导率Inductionrateofcallus(%)989698269873992198669888愈伤组织的平均直径Averagediameterofcallus(cm)07171b07583bc08211c07611bc06141a06659ab愈伤组织的出芽率Germinationrateofcallus(%)28571052315812903043889
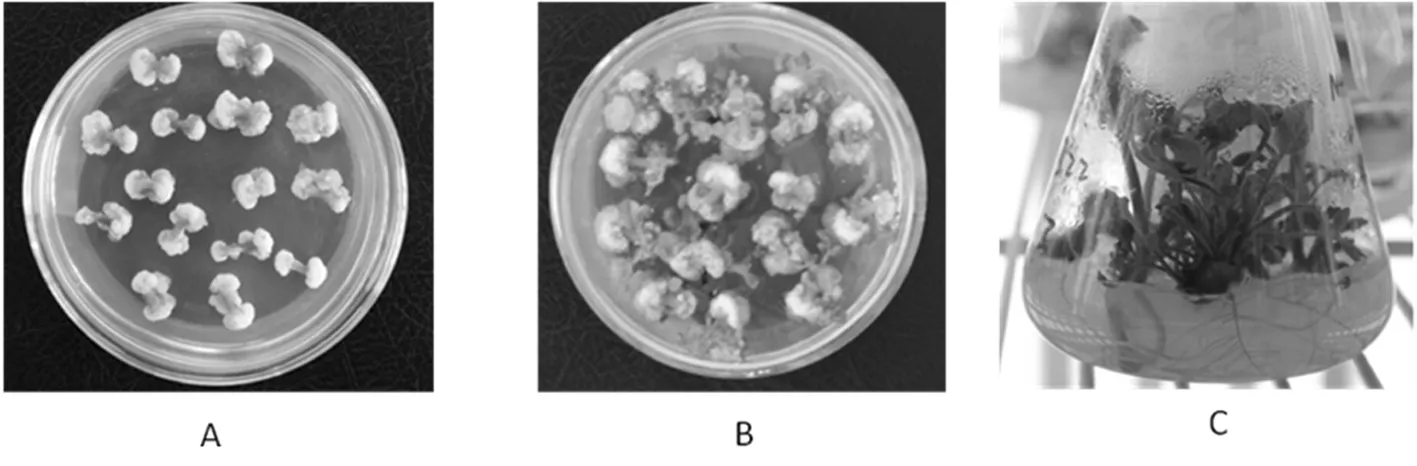
注:A:愈伤组织诱导;B:不定芽的再生;C:根诱导
Note:A: callus induction; B: regeneration of buds; C: roots induction
图2 加工番茄的再生体系
Fig. 2 The regeneration system of processing tomato
2.3 不同浓度ZT和IAA对加工番茄出芽率的影响
由于6-BA对加工番茄的不定芽的诱导率极低,所以采用ZT进行加工番茄不定芽的诱导(图2B)。研究表明,平均每块愈伤组织的平均出芽数与愈伤组织的平均直径没有明显的关系。在含有细胞分裂素ZT的培养基中,M82的不定芽诱导率与6-BA相比高3~4倍,均在97%以上。在0.5 mg/L ZT+0.2 mg/L IAA培养基中愈伤组织的出芽数最多平均为6个,其次是0.5 mg/L ZT+0.1 mg/L IAA,说明在较低浓度(0.5 mg/L)的ZT培养基内愈伤组织的平均出芽数较高。但愈伤组织的平均直径在1.0 mg/L ZT培养基内的较大,可见愈伤组织的平均直径与愈伤组织的平均出芽数不相关。表5,图2
表5 不同浓度ZT和IAA下加工番茄不定芽的诱导变化
Table 5 Effects of different concentrations of ZT and IAA on buds induction of processing tomato
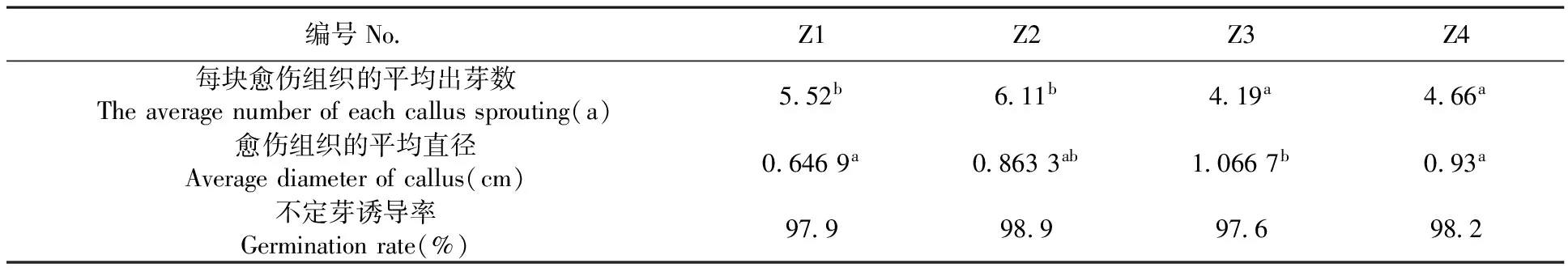
编号NoZ1Z2Z3Z4每块愈伤组织的平均出芽数Theaveragenumberofeachcallussprouting(a)552b611b419a466a愈伤组织的平均直径Averagediameterofcallus(cm)06469a08633ab10667b093a不定芽诱导率Germinationrate(%)979989976982
2.4 加工番茄生根的诱导
总结张录霞等[2]、刘炜炜等[8]对于不同品种加工番茄生根的诱导,采用MS+0.5 mg/L IBA对M82进行生根诱导(图2C)。在生根培养基中,加工番茄根诱导情况良好,须根数量多,根系较发达。图2
3 讨 论
种皮消毒灭菌是建立无菌苗的关键环节,无菌苗体系的建立是番茄再生体系建立的重要基础。种皮灭菌研究结果同张录霞等[2]的研究结果相似,升汞严重影响加工番茄种子的发芽率,加工番茄种皮灭菌主要采用次氯酸钠,只是在不同的文献中[11]采用的次氯酸钠的浓度和消毒时间与研究存在差异。
番茄作为模式植物之一,其组织培养和再生体系的研究已趋于成熟,但是加工番茄再生体系的研究还较为薄弱。加工番茄组织培养具有很强的基因特异性,因此选择合适的培养基和激素配比是进行组培的重要环节[12,13]。在加工番茄再生体系建立的实验中,多以子叶为外植体进行再生体系的研究,而研究以下胚轴为外植体通过不同激素配比研究分别获得了最佳的愈伤组织诱导培养基和不定芽再生培养基。寇晓虹等[14]以加工番茄子叶为研究对象,表明芽诱导培养基中MS+2 mg/L ZT+0.2 mg/L IAA不定芽诱导效果最好;研究结果同刘炜炜等[8]建立的加工番茄“亚心98-1”和里格儿子叶再生体系中不定芽的诱导研究结果相似,均采用ZT和IAA的激素配比作为不定芽的诱导,并且最佳的不定芽诱导的激素浓度也相同。陈丽萍等[12]以加工番茄‘B04’下胚轴为外植体的研究中,认为2.0 mg/L ZT对不定芽的诱导效果最好,而在研究中0.5 mg/L ZT对加工番茄M82不定芽的诱导效果最好,并不是越高浓度的细胞分裂素对不定芽的诱导效果越好。然而产生这些差异的原因可能在于不同基因型在不同浓度的激素配比中的差异。
4 结 论
以加工番茄M82为研究对象,以下胚轴为外植体进行了加工番茄M82再生体系的研究,通过对不同浓度的激素配比研究得出了加工番茄M82的最佳愈伤组织诱导和不定芽诱导培养基。在愈伤组织诱导阶段采用6-BA和NAA的组合,能够以较高的愈伤组织诱导率诱导出颜色嫩绿,紧密结构的愈伤组织。但由于6-BA和NAA的激素组合对M82不定芽的诱导率极低。因此,在不定芽诱导中采用ZT和IAA,且以较低浓度的ZT筛选出最多的平均愈伤组织诱导芽数。
References)
[1]杨涛, 杨生保, 李宁, 等. 番茄ILs果实耐压力测定及与其他果实性状相关性分析[J].新疆农业科学, 2015, 52(8): 1 373-1 381.
YANG Tao, YANG Sheng-bao, LI Ning, et al. (2015). Fruit's compression resistance testing of ILs in tomato and correlation analysis with other fruit trait [J].XinjiangAgriculturalSciences, 52(8):1,373-1,381.(in Chinese)
[2]张录霞, 郝青南, 马超, 等. 加工番茄遗传转化再生体系的建立[J].西北农业学报, 2008, 17(3) :236-241.
ZHANG Lu-xia, HAO Qing-nan, MA Chao, et al. (2008). Processing tomato plant regeneration in genetic transformation [J].ActaAgriculturaeBoreali-occidentalisSinica, 17(3): 236-241. (in Chinese)
[3]曹慧颖, 张立军, 夏润玺, 等. 番茄组织培养研究进展[J]. 中国蔬菜, 2012, (16) : 10-14.
CAO Hui-ying, ZHANG Li-jun, XIA Run-xi, et al. (2012). Research progress on tomato tissue culture [J].ChinaVegetables, (16) : 10-14. (in Chinese)
[4] El-Bakry, A. A. (2002). Effect of genotype, growth regulators, carbon source, and pH on shoot induction and plant regeneration in tomoto.InVitroCellular&DevelopmentalBiology-Plant, 38(5):501-507.
[5] 马杰, 邱栋梁. 番茄组培再生体系优化研究 [J]. 中国农学通报, 2011,27(8):185-189.
MA Jie, QIU Dong-liang. (2011). Study on tissue culture and regenerative system of tomato [J].ChineseAgriculturalScienceBulletin, 27(8):185-189. (in Chinese)
[6] 王傲雪, 赵越, 陈秀玲, 等. 不同激素组合对番茄芽分化率的影响[J]. 东北农业大学学报, 2013, 44(7): 85-90.
WANG Ao-xue, ZHAO Yue, CHEN Xiu-ling, et al. (2013). Effect of different plant hormone combinations on bud differentiation of tomato [J].JournalofNortheastAgriculturalUniversity, 44(7): 85-90. (in Chinese)
[7] 李倩, 王滨, 李培环, 等. 番茄子叶和下胚轴离体再生体系的建立[J].北方园艺, 2015, (1): 106-110.
LI Qian, WANG Bin, LI Pei-huan, et al. (2015). Establishment of regeneration system of cotyledon and hypocotyl in vitro of tomato [J].NorthernHorticulture, (1): 106-110.(in Chinese)
[8] 刘炜炜, 秦荣, 张伟, 等. 加工番茄离体再生体系的建立[J]. 中国农学通报, 2012, 28(16): 155-160.
LIU Wei-wei, QIN Rong, ZHANG Wei, et al. (2012). Establishment of in vitro regeneration system for processing tomato [J].ChineseAgriculturalScienceBulletin, 28(16): 155-160. (in Chinese)
[9] Ellul, P., Garcia-Sogo, B., Pineda, B., Rios, G., Roig, L., & Moreno, V. (2003). The ploidy level of transgenic plants in Agrobacterium-mediated transformation of tomato cotyledons (LycopersiconesculentumL. Mill.) is genotype and procedure dependent.TheoreticalandAppliedGenetics, 106(2):231-238.
[10] Sivankalyani, V., Takumi, S., Thangasamy, S., Ashakiran, K., & Girija, S. (2014). Punctured-hypocotyl method for high-efficient transformation and adventitious shoot regeneration of tomato.ScientiaHorticulturae, 165(3):357-364.
[11] 吴志刚, 宋明, 王志敏, 等. 番茄组织培养中无菌苗培养条件的优化[J].中国农学通报, 2006, 22(4): 335-337.
WU Zhi-gang, SONG Ming, WANG Zhi-min, et al. (2006). Condition optimization for culturing sterile tomato plants in tissue culture [J].ChineseAgriculturalScienceBulletin, 22(4): 335-337. (in Chinese)
[12] 陈丽萍, 张丽华, 程智慧. 加工番茄离体再生体系的建立[J]. 西北农业学报, 2007, 16(1): 162-167.
CHEN Li-ping, ZHANG Li-hua, CHEN Zhi-hui. (2007). Establishment of in vitro regeneration system for processing tomato [J].ActaAgriculturaeBoreali-occidentalisSinica, 16(1): 162-167. (in Chinese)
[13] 王理. 番茄高效离体再生体系的建立及遗传转化初探[D].成都:四川农业大学硕士学位论文, 2012.
WANG Li. (2012)Establishmentofhighefficientplantregenerationsystemandresearchongenetictransformationoftomato[D]. Master Dissertation. Sichuan Agricultural University, Chengdou. (in Chinese)
[14] 寇晓虹, 罗云波, 田慧琴, 等.多聚半乳糖醛酸酶(PG)反义基因转化加工番茄[J].食品科学, 2007, 28(3):187-191.
KOU Xiao-hong, LUO Yun-bo, TIAN Hui-qin, et al. (2007). Genetic transformation processing of tomato with anti-PG gene [J].FoodScience, 28(3):187-191. (in Chinese)
Fund project:Research projects of the Ministry of Agriculture in public welfare sector (201303115), "twelfth five-year plan" special major projects of Xinjiang (201230116-3) and youth science and technology innovation talents cultivation project of Xinjiang (2014721023)
Establishment of Hypocotyls Regeneration System for Processing Tomatoes
TANG Ya-ping, WANG Bai-ke, YANG Sheng-bao, LI Ning, YANG Tao, Patiguli,WANG Qiang, YU Qing-hui
(Research Institute of Horticultural Crops, Xinjiang Academy of Agriculture Science, Urumqi 830091, China)
【Objective】 In order to establish the regeneration and genetic transformati- on system of processing tomato, the hypocotyls of processing tomato model cultivar M82 which was introduced from Tomato Genetics Resource Center were used as explants.【Method】The sterilization effects of using different sterilizing agent and orthogonal design with different concentrations of hormones which for inducting of callus and adventitious buds were studied on processing tomato.【Result】 The sterilization with 15% sodium hypochlorite (NaClO) sterilization and Twain-20 for 30 min has the best result of surface sterilize on processing tomato. The medium with 3 mg/L 6-BA and 0.25 mg/L NAA has the biggest average diameters of process- sing tomato callus induction. The optimum medium for buds differentiation was MSB5+ 0.5 mg/L ZT+0.2 mg/L IAA.【Conclusion】The regeneration system of processsing tomato cultivar M82 was established through the above research and this study has drew a conclusion that the ZT of cytokinin has the best effect for inducting the buds in processing tomato.
processing tomato; hypocotyl; regeneration system
10.6048/j.issn.1001-4330.2016.05.001
2015-12-29
农业部公益性行业科研专项(201303115);自治区"十二五"重大专项 (201230116-3);自治区青年科技创新人才培养工程(2014721023)
唐亚萍(1986-), 女, 四川人, 助理研究员, 研究方向为加工番茄育种, (E-mail)tangyaping624@sina.com
余庆辉(1970-), 男, 广东人, 研究员, 研究方向为加工番茄新品种选育和栽培, (E-mail)tomato-yu@xaas.ac.cn
S641.2
A
1001-4330(2016)05-0785-06

