食管鳞癌细胞中ESCCAL_1对蛋白激酶磷酸化的调节作用
曹新广 崔渊博 陈小兵 曹巍
(1.郑州大学附属肿瘤医院 普外科 河南 郑州 450000; 2.郑州市中心医院 转化医学中心 河南 郑州 450000)
食管鳞癌细胞中ESCCAL_1对蛋白激酶磷酸化的调节作用
曹新广1崔渊博2陈小兵1曹巍2
(1.郑州大学附属肿瘤医院 普外科 河南 郑州 450000; 2.郑州市中心医院 转化医学中心 河南 郑州 450000)
目的 探讨ESCCAL_1在食管鳞癌中发挥功能的可能机制。方法 使用人磷酸化激酶阵列试剂盒检测ESCCAL_1敲减前后EC9706细胞中相关蛋白激酶磷酸化水平,对各蛋白条带进行灰度值定量分析。结果 KD组与NC组中FAK、JNK1、Src、AMPKα1等蛋白激酶的相对磷酸化水平比值分别为2.76∶1、2.20∶1、2.15∶1、2.01∶1,表达量明显降低(P<0.05)。结论 ESCCAL_1可能通过调节相关蛋白激酶的磷酸化水平调控EC9706细胞生长。
食管鳞状细胞癌;ESCCAL_1;蛋白激酶磷酸化
长链非编码RNA(long non-coding RNA,LncRNA)是一类转录本长度超过200 nt的RNA,基因组中80%的转录本为LncRNA[1]。目前越来越多的研究发现,LncRNA参与了生命进程中一系列重要的生命活动,包括发育、造血、器官形成、凋亡、细胞增殖及肿瘤形成等[2]。前期研究中我们采用高通量筛查技术在食管鳞癌(esophageal squmaous cancer,ESCC)中发现表达差异最大的一种LncRNA位于8号染色体(Chr8:76121095~76189420),其在ESCC组织中的表达显著增高,约为癌旁组织的30倍。由于文献中没有关于该LncRNA的表达及功能的研究报道,我们将其命名为食管鳞状细胞癌特异相关长片段非编码RNA_1(esophageal squmaous cancer associated LncRNA,ESCCAL_1),初步研究表明其可能参与了ESCC的发生发展过程,是潜在的诊断和预后标志物[3]。为了探讨ESCCAL_1在ESCC中发挥功能的机制,本实验采用人蛋白激酶磷酸化水平芯片阵列检测ESCCAL_1敲减前后EC9706细胞系蛋白激酶磷酸化水平表达变化。
1 材料与方法
1.1 实验材料 ESCC EC-9706细胞株购自中国科学院上海细胞库。慢病毒载体系统由pGC-LV载体、pHelper 1.0载体和 pHelper 2.0载体三质粒组成,购自上海吉凯公司。蛋白质组分析阵列-人磷酸化激酶阵列试剂盒购自R&D公司(美国)。
靶向ESCCAL_1基因的慢病毒载体的构建与生产:含干扰片段及无关序列的慢病毒载体委托上海吉凯公司合成。实验分为敲减组(ESCCAL_1-shNRA-EC9706转染组,KD 组)、阴性对照组(即转染无关系列,NC- ESCCAL_1-shNRA-EC9706,NC组)和空白对照组(不做任何处理,Con组)。
1.2 检测方法 采用人蛋白激酶磷酸化芯片阵列检测抑制ESCCAL_1表达后EC9706细胞蛋白激酶磷酸化相对水平,按说明书进行,并在伯乐成像系统中进行扫描分析。用伯乐成像分析软件对各蛋白膜进行灰度值分析,计算各蛋白激酶磷酸化相对水平。
1.3 统计学处理 采用SPSS 17.0统计软件进行分析。表达水平差异的比较采用χ2检验;多组数据间比较采用方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
KD组与NC组中FAK、JNK1、Src、AMPKα1等蛋白激酶的相对磷酸化水平比值分别为2.76∶1、2.20∶1、2.15∶1、2.01∶1,表达量明显降低(P<0.05)。见表1及图1、图2。
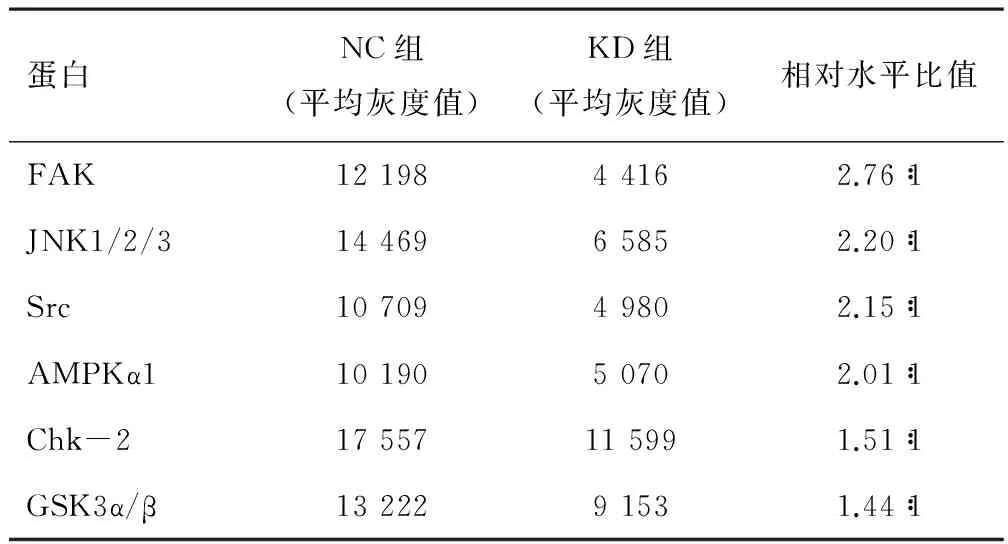
表1 人磷酸化激酶灰度值分析
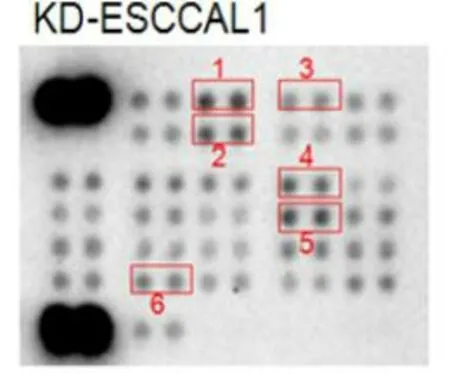
图1 芯片阵列检测ESCCAL_1敲减前后EC9706中
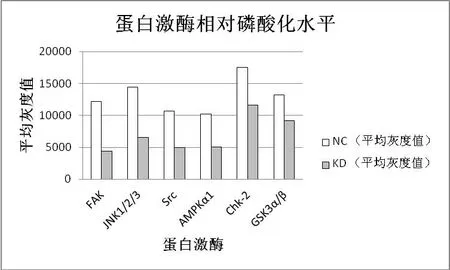
图2 芯片检测蛋白激磷酸化相对水平
3 讨论
LncRNA的作用机制非常复杂,至今人们知之甚少。近年来研究表明,LncRNA作为细胞功能调控网络中必需的生物分子,在染色体折叠组装与稳定、核小体形成、基因表达、信使RNA的选择性剪辑以及蛋白质形成等过程中发挥重要作用。目前研究显示,LncRNA位于增强子区域时,可调节蛋白-蛋白、蛋白-DNA的相互作用,也可以直接结合蛋白或miRNAs,可从复制、转录、翻译等多种层面对细胞功能进行调控,调控的主要方式是充当信号分子、分子诱饵、蛋白复合体骨架等[4],可以积累体细胞基因拷贝数变异(copy-number variations,CNAs),导致基因组不稳定,一部分CNAs会引起肿瘤发生。有的LncRNA可以从多个层面,充当多个角色,发挥极其复杂精确的调控功能。
Hu等[5]使用RNA pull down、Western blotting及RIP-qPCR确认FAL1 RNA的结合蛋白为BMI1。BMI1是PRC1(polycomb repressive complex 1)复合体的一个亚基,PRC1是染色体修饰复合物,可抑制多种基因表达。shRNA沉默FAL1或BMI1,发现表达量增加最多的是CDKN1A基因,该基因与癌症发生有关,说明FAL1可能通过调控BMI1在CDKN1A启动子的结合率而控制CDKN1A的转录,提高CDKN1A的表达。另有研究采用LncRNA芯片发现MEG3在肝癌中的特异性表达下调。对MEG3表达调控机制的研究认为,MEG3的表达下调可能是因为MEG3启动子发生了超甲基化,即LncRNA的表达同样可能受到表观遗传调控;MEG3启动子的超甲基化可能是与microRNA-29a 调控通路相互作用的结果,从而认为miRNA和LncRNA可以相互作用而参与基因表达调控[6]。MALAT1也称为NEAT2(nuclear-enriched abundant transcript 2),目前研究较多。Wang等[7]研究表明,在ESCC细胞系中miRNA-101和miRNA-217通过转录后调节机制使MALAT1表达沉默,阻滞细胞周期进程,进而抑制癌细胞的增殖、迁移和侵袭。MALAT1的5’端可以与SR剪切蛋白家族中的多种因子结合,改变SR蛋白的磷酸化与去磷酸化,影响其活性;通过影响SR蛋白的空间,调控其对pre-mRNA的剪接作用[8]。
蛋白激酶(protein Kinases,PK)是一类催化蛋白质磷酸化反应的酶,是一个非常庞大的功能性蛋白家族。它能把腺苷三磷酸(ATP)上末位的磷酸基团转移到蛋白质的特定氨基酸残基上。根据被磷酸化底物蛋白的氨基酸残基种类,蛋白激酶共分为5类,即丝氨酸/苏氨酸、酪氨酸、组氨酸、色氨酸和天冬氨酰基/谷氨酰基蛋白激酶。蛋白激酶的调控功能非常强大,涉及面广,在细胞信号传导、代谢、细胞凋亡、细胞周期调控、免疫和炎症反应等复杂生命活动中均起着非常重要的作用。近年来科研人员发现,蛋白激酶还和肿瘤细胞的增殖、分化以及肿瘤发生发展有密切关系,如局部黏着斑激酶(focal adhesion kinase,FAK)在肺癌、乳腺癌等多种肿瘤中表达上调[9]。随后发现,FAK可通过调控多条信号通路参与肿瘤生长、发生、发展过程,并与肿瘤的浸润转移有关[10-11]。近年来,研究人员已开发多种靶向药物并应用于临床,抑制PK活性以杀死或控制癌细胞。如在 ER(+)乳腺癌中,三苯氧胺可通过调节PKC活性抑制癌细胞生长[12];吉非替尼和厄洛替尼作为酪氨酸激酶抑制剂用于治疗肺癌等。本研究中使用人磷酸化激酶阵列试剂盒检测抑制ESCCAL_1表达后EC9706中磷酸蛋白激酶的表达,用软件对各蛋白条带进行灰度值定量分析。结果显示, NC组与敲减组相比,FAK、JNK1、Src、AMPKα1、Chk2和GSK3α/β相对水平比值分别为2.76∶1、2.20∶1、2.15∶1、2.01∶1,1.51∶1、1.44∶1,敲减组表达量明显降低(P<0.05)。这提示在体外食管癌细胞系中,ESCCAL_1能与多种蛋白激酶作用,引起这些蛋白激酶磷酸化,参与食管癌的发生发展。当然,进一步的研究需验证这些蛋白激酶磷酸化在食管癌中的作用,ESCCAL_1与蛋白激酶的作用机制,并明确这些激酶之间复杂的网络对话,对食管鳞癌发生发展的分子机制有进一步认识。
[1] Kapranov P, Cheng J, Dike S, et al. RNA maps reveal new RNA classes and a possible function for pervasive transcription[J]. Science, 2007, 316(5830): 1484-1488.
[2] Ponting C P, Oliver P L, Reik W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136(4): 629-641.
[3] Cao W, Wu W, Shi F, et al. Integrated analysis of long noncoding RNA and coding RNA expression in esophageal squamous cell carcinoma[J]. Int J Genomics, 2013, 2013: 480534.
[4] Rinn J L, Kertesz M, Wang J K, et al. Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J]. Cell, 2007, 129(7): 1311-1323.
[5] Hu X, Feng Y, Zhang D, et al. A functional genomic approach identifies FAL1 as an oncogenic long noncoding RNA that associates with BMI1 and represses p21 expression in cancer[J]. Cancer Cell, 2014, 26(3): 10.
[6] Braconi C, Kogure T, Valeri N, et al. microRNA-29 can regulate expression of the long non-coding RNA gene MEG3 in hepatocellular cancer [J]. Oncogene, 2011, 30(47): 7.
[7] Wang X, Li M, Wang Z, et al. Silencing of long noncoding RNA MALAT1 by miR-101 and miR-217 inhibits proliferation, migration, and invasion of esophageal squamous cell carcinoma cells[J]. J Biol Chem, 2015, 290(7): 3925-3935.
[8] Lin R, Roychowdhury-Saha M, Black C, et al. Control of RNA processing by a large non-coding RNA over-expressed in carcinomas[J]. FEBS Lett, 2011, 585(4): 671-676.
[9] Luo M, Guan J L. Focal adhesion kinase: a prominent determinant in breast cancer initiation, progression and metastasis[J]. Cancer Lett, 2010, 289(2): 127-139.
[10]Ou J, Pan F, Geng P, et al. Silencing fibronectin extra domain A enhances radiosensitivity in nasopharyngeal carcinomas involving an FAK/Akt/JNK pathway[J]. Int J Radiat Oncol Biol Phys, 2012, 82(4): e685-e691.
[11]Zhao X, Guan J L. Focal adhesion kinase and its signaling pathways in cell migration and angiogenesis[J]. Adv Drug Deliv Rev, 2011, 63(8): 610-615.
[12]Gundimeda U, Chen Z H, Gopalakrishna R. Tamoxifen modulates protein kinase C via oxidative stress in estrogen receptor-negative breast cancer cells[J]. J Biol Chem, 1996, 271(23): 13504-13514.
Regulatory effects of ESCCAL_1 on protein kinase phosphorylation in esophageal squamous cell carcinoma
Cao Xinguang1, Cui Yuanbo2, Chen Xiaobing1, Cao Wei2
(1.DepartmentofGeneralSurgery,theAffiliatedCancerHospitalofZhengzhouUniversity,Zhengzhou450003,China;2.DepartmentofTranslationalMedicineCenter,ZhengzhouCenterHospital,Zhengzhou450007,China)
Objective To explore the possible mechanism of ESCCAL_1 in esophageal squamous cell carcinoma. Methods Human phospho-kinase array kit was used to detect the phosphorylation of protein kinase in EC9706 cells transfected with ESCCAL_1-shRNA or control. Each gray value of protein band was quantitatively analyzed.Results The relative gray value ratios of FAK、pJNK1、pSrc、pAMPKα1 between KD group and NC group were 2.76∶1, 2.20∶1, 2.15∶1, 2.01∶1 respectively, and the phosphorylation of these protein kinases in KD group was significantly down-regulated (P<0.05).Conclusion ESCCAL_1 may regulate the EC9706 cell proliferation and metastasis through protein kinase phosphorylation.
esophageal squamous cancer; ESCCAL_1; protein kinase phosphorylation
曹巍,E-mail:xinguangcao@126.com。
R 735.1
10.3969/j.issn.1004-437X.2016.10.002
2016-03-17)

