小鼠睾丸生精小管内残余体颗粒形成及转归的观察
肖长义, 王雅琴, 黎家华, 汤桂成, 魏 霞
三峡大学医学院组织胚胎学教研室,宜昌 443002
小鼠睾丸生精小管内残余体颗粒形成及转归的观察
肖长义, 王雅琴, 黎家华, 汤桂成, 魏 霞
三峡大学医学院组织胚胎学教研室,宜昌 443002
目的 通过对小鼠睾丸生精小管内残余体物质的形成与转归的观察,了解机体器官是如何处置结构废弃物的。方法 取体重18~20 g成年BALB/c小鼠的睾丸,石蜡切片后进行残余体特异性染色和观察,超薄切片后进行透射电镜染色和观察。结果 残余体特异性染色显示,部分生精小管内有染成深蓝色、大小不等的圆形或不规则形的颗粒。这些颗粒最早可见于生精周期Ⅳ~Ⅴ期,在精子细胞朝向管腔一侧的胞质之内出现细粒状的细小蓝色颗粒。伴随着生精时相的向后推移,精子细胞的胞质逐渐减少,颗粒逐渐变大,颗粒数量相应减少,至精子排放时,即生精周期的Ⅶ~Ⅷ期,颗粒的总量达到高峰,颗粒全部聚集于生精上皮的表面。当精子释放完成后,颗粒即迅速向小管周边移动。在颗粒向基部迁移时,伴随着数量的逐渐减少。这些颗粒就是残余体。电镜观察,可见这些颗粒的动态分布特征与光镜观察的一致。这些颗粒大小差异大,内部结构形态多样,电子密度差异明显。在精子释放完成后,颗粒迅速向管周移动,内部结构与电子密度也不断发生变化,最终转化成为脂质样颗粒。这些脂质样颗粒在接近基膜处,可能最终被排入到睾丸间质之中。结论 小鼠生精小管在生精过程中产生的残余体颗粒,在向上皮基底部转移的过程中,逐渐转化成为脂质样颗粒,这些脂质样颗粒可能最终被排泄于生精小管之外。观察提示睾丸可以通过将睾丸自身生产的结构废弃物排出而保持自洁。
小鼠; 睾丸; 生精小管; 残余体; 形成; 转归
观察生精小管内结构废弃物——残余体的形成及处置,主要目的是关注组织、器官对生命过程中所产生的垃圾——脂褐质的处理,为衰老研究提供支持。睾丸是研究结构废弃物处置很具代表性的器官,因为每一生精周期都有大量残余体形成,并需要处置。既往有不少人对这些残余体物质的形成、转化进行过观察,但因观察上的困难,一直难以完整描述,甚至中断研究几十年[1-4]。本文作者前期报道了大鼠睾丸生精小管内残余体转移、转化及转归的情况,显示残余体转化形成脂质样颗粒——一种特殊形式的脂褐质之后,可能最终被排出生精小管,进入睾丸间质之内[5]。为进一步求证这种现象的普遍性,我们以小鼠睾丸为对象再次进行了观察。
1 材料和方法
取成年雄性BALB/c小鼠,体重18~20 g,脱颈处死后取睾丸,分别固定于Bouin液中或1.5%戊二醛中。固定于Bouin液中的组织进行石蜡包埋,5 μm切片,脱蜡后,进行残余体染色。染色方法参考文献[6]略做改动。染色液的配制:将伊红1 g,美蓝0.25 g,天青B号0.75 g,依次溶于200 mL蒸馏水中,充分摇动混匀后,敞口静置7 d熟化,再加50 mL双蒸水,充分摇匀,过滤,过滤后的液体即可用于染色。将脱蜡后的切片置于染色液中染色4~12 h,视染色效果中止染色。染色后的切片用蒸馏水洗,烤干,透明,中性树胶封片,切片置光镜下观察。戊二醛固定的组织用1%四氧化锇后固定,常规脱水,环氧树脂包埋,MICROM HM340E超薄切片机切片,置于铜网,分别再用硝酸铅和醋酸铀复染。最后,标本用Hitachi 7500透射电子显微镜进行观察。
2 结果
2.1 光镜观察
睾丸组织经以上染色在光镜下观察,可见睾丸内所有的细胞核均被染成蓝色,细胞质被染成淡红色。少数生精小管内可见被染成深蓝色且大小不等的圆形或不规则形颗粒,这些颗粒边界清楚,在生精小管内清晰可见。根据是否含有此种颗粒,生精小管可分含颗粒的和不含颗粒的两种。根据Oakberg[7-8]对小鼠生精小管的生精周期分期:含染色颗粒的生精小管,生精周期为Ⅳ期至Ⅷ期;不含此种颗粒或未见明显颗粒的生精小管,生精周期为Ⅸ期至Ⅲ期。
从Ⅰ期开始,位于生精上皮表层的精子细胞,其呈扇形伸向管腔的胞质,染色逐渐变深(图1)。随着精子成熟,扇形胞质蓝色逐渐加深,至Ⅳ期,胞质内开始显现出细微的蓝色颗粒(图2)。以后,这种颗粒越来越清晰,数量逐渐增多,体积也明显增大。至Ⅶ~Ⅷ期的时候,染色颗粒数量、体积达到最高峰(图3)。颗粒的位置也由精子头部上方,转移到了精子头部的下方。在Ⅷ期后期,成熟精子由上皮释入管腔之后,这些颗粒非常明显地排列于上皮的表层(图4)。其后,染色颗粒迅速向管周移动,同时,数量迅速减少,至Ⅸ期时,颗粒完全消失。
在纵断面上的生精小管,从生精上皮排出精子到染色颗粒全部消失,其占居生精小管的长度一般为200~300 μm。颗粒消失后的小管上皮可见仍属Ⅷ期的小管。
在一个完整的睾丸切面上,Ⅷ期小管的数量约有2~3个,约占总小管断面数的1/20~1/30。
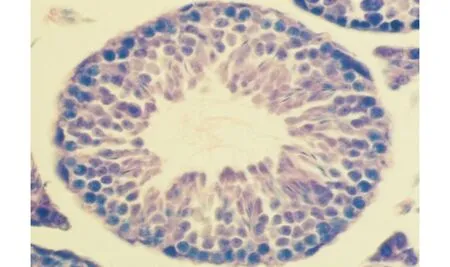
生精小管内生精上皮表层有大量呈扇形伸出的精子胞质,胞质染色由淡红至深紫,未见有明显的颗粒性物质存在图1 小鼠睾丸Ⅱ~Ⅲ期生精小管(残余体特殊染色,×400)Fig.1 Seminiferous tubule at stage Ⅱ-Ⅲ of spermatogenic cycle in mouse testis (Staining for residual bodies, ×400)
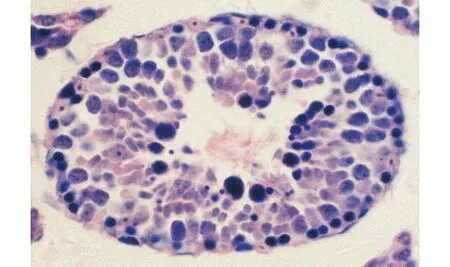
生精小管内生精上皮表层有众多细密的染色颗粒,这些颗粒均位于精子尾部周围的胞质之内图2 小鼠睾丸Ⅳ~Ⅴ期生精小管(残余体特殊染色,×400)Fig.2 Seminiferous tubule at stage Ⅳ-Ⅴ of spermatogenic cycle in mouse testis (Staining for residual bodies, ×400)
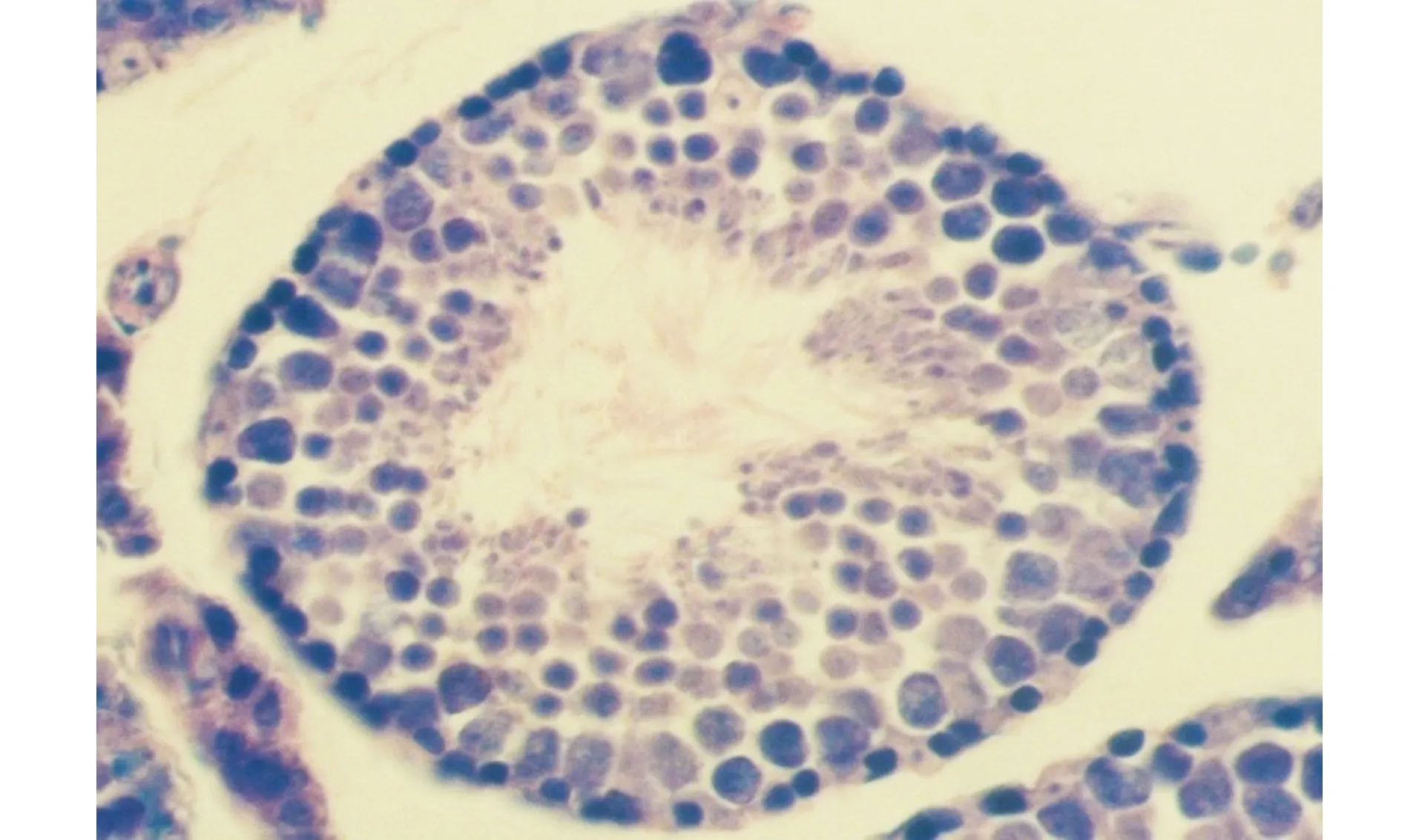
生精小管的生精上皮表层,排列着一层即将被释放的精子,精子头粘附于上皮,尾部游离于管腔;大小不等的染色颗粒已经由精子头部的上方转移到了下方,部分区域的精子已经被释放,上皮表层只留下了颗粒图3 小鼠睾丸Ⅶ~Ⅷ期生精小管(残余体特殊染色,×400)Fig.3 Seminiferous tubule at stage Ⅶ-Ⅷ of spermatogenic cycle in mouse testis (Staining for residual bodies, ×400)
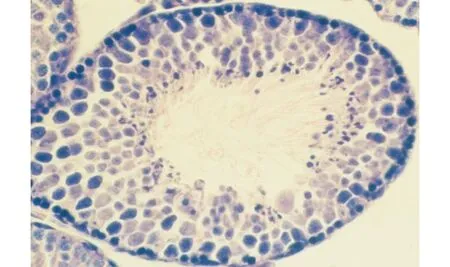
精子由生精上皮释放入管腔后,数量众多的染色颗粒留在上皮的表层,颗粒大小不等,并可见染色颗粒迅速向上皮深部移动的现象图4 小鼠睾丸Ⅷ期生精小管(残余体特殊染色,×400)Fig.4 Seminiferous tubule at stage Ⅷ of spermatogenic cycle in mouse testis (Staining for residual bodies, ×400)
2.2 电镜观察
生精周期Ⅰ期时,在精子细胞朝向管腔伸出的胞质内,可见丰富的膜性结构,有些膜性结构呈花枝状或纺锤状。胞质内的线粒体,除了参与线粒体鞘形成的线粒体外,还有部分线粒体散在分布于胞质之中,其体积明显大于参与线粒体鞘形成的线粒体。至生精周期的Ⅲ期时,精子细胞的胞质内开始有散在或单个高电子密度的脂质样颗粒出现。这种颗粒大小均一,直径约0.3~0.4 μm,无膜包被,电子密度均匀,呈均质状。随着精子成熟度的增加,这种高电子密度的脂质颗粒数量会有增加。这一时期,胞质内的膜性结构明显减少,空泡和囊泡数量明显增多。同时,胞质内还会出现一种片状分布的均匀细密的沙粒状物质,这种物质电子密度中等,初时与周边胞质界限不清,后期与周边结构有明显界限,但无膜包被。这种细沙状物质的量会随着精子的成熟而逐渐增加。这一时期,线粒体鞘外的线粒体体积进一步变大,电子密度进一步增高,膜的厚度增加,结构模糊,并开始发生聚集(图5)。
在生精周期Ⅴ以后,变性的线粒体开始出现固缩,电子密度达到中高状态,呈腊肠样,并常发生聚集。这一时期,数量众多的囊泡几乎消失不见,空泡的数量也大为减少。精子胞质内的大片区域为细密的沙粒状物质所占据,这些物质电子密度中等,与周边的结构界限清晰。高电子密度的脂质样颗粒数量略有增加,散在分布于胞质之中(图6)。
至生精周期Ⅷ期,精子释放、残余体形成时,在这些遗留在生精上皮表面的残余体内,除了少量低电子密度的无定形物质和少量膜被空泡外,主要成分是3种高电子密度物质。这3种高电子密度物质,其电子密度和结构差异明显,由高至低的顺序是:高电子密度的脂质样颗粒,变性线粒体聚集斑块,沙粒状物质团块。膜被空泡在残余体内的数量不等,大小差异大(图7)。
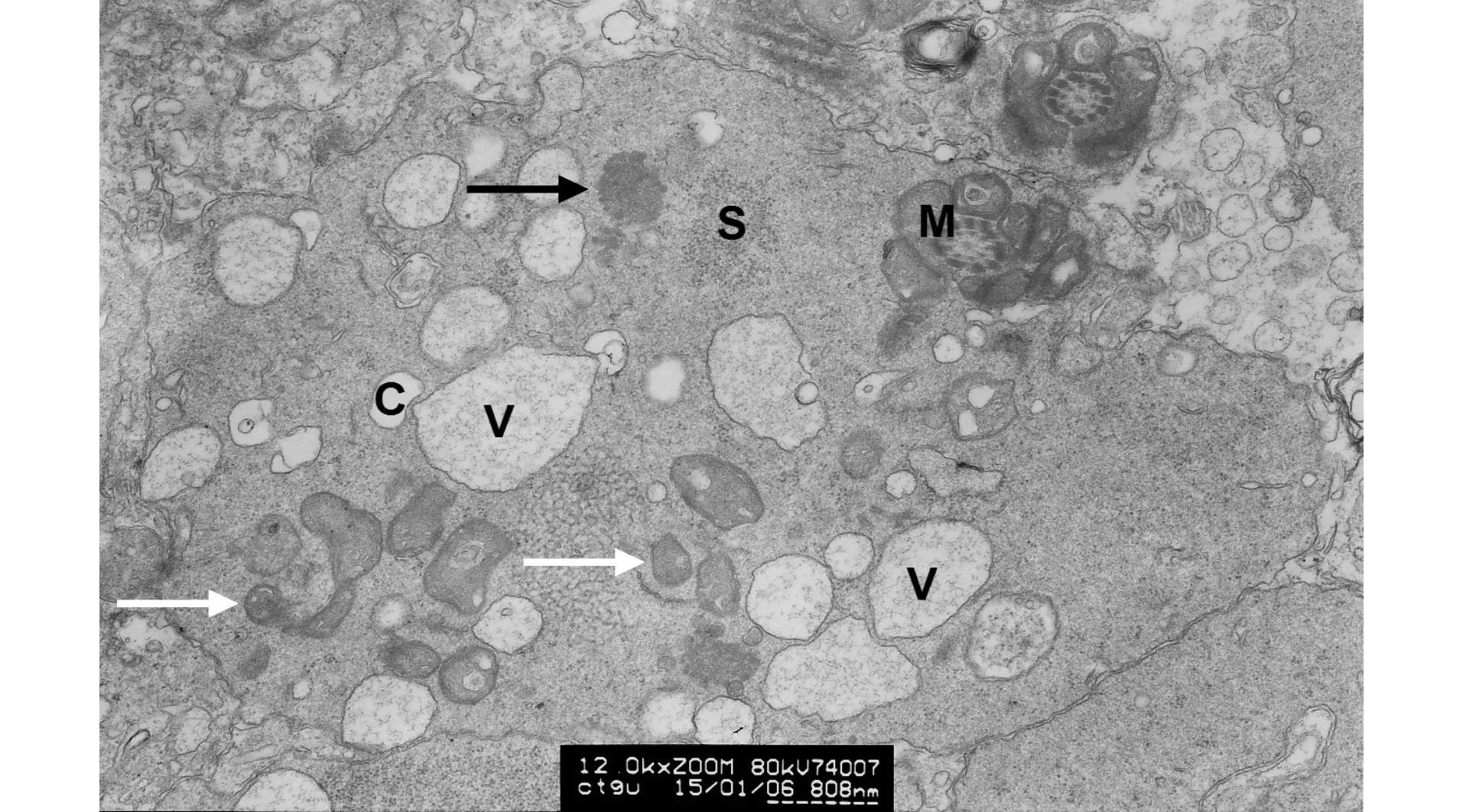
在尾部中段(M)左侧可见1个中等电子密度球形脂质样颗粒,无膜包被(黑箭头示),可能为高电子密度脂质颗粒的前身;在胞质的上方及右侧区域,有小片中等电子密度的沙粒状物质(S);在尾部胞质的左下区域,可见两簇聚集的变性、固缩的线粒体(白箭头示);胞质内还可见广泛分布的囊泡(V)及空泡(C)图5 处于生精周期Ⅱ~Ⅲ期的、位于生精上皮表面的、精子尾部中段周围的胞质(×12 000,标尺808 nm)Fig.5 Cytoplasm around the middle piece of the sperm tail on the surface of seminiferous tubule at Ⅱ-Ⅲ of spermatogenic cycle (×12 000, scalebar=808 nm)
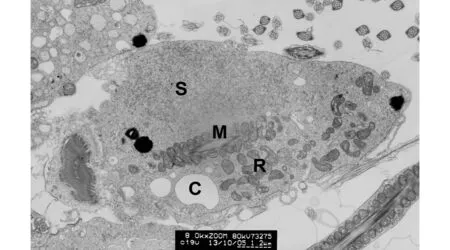
精子尾部中段胞质内可见3个散在的高电子密度球形颗粒;在中段线粒体鞘(M)的上方,有成片中等电子密度的沙粒状物质(S);在胞质断面的下方及右方,可见成簇聚集的由线粒体固缩形成的中等电子密度的膜性腊肠样结构(R);胞质内还可见到数个空泡(C)图6 生精周期Ⅴ期生精上皮表面、精子尾部中段周围胞质(×8 000,标尺1.2 μm)Fig.6 Cytoplasm in the middle piece of sperm tail on the surface of seminiferous tubule at stage Ⅴ of spermatogenic cycle (×8 000, scalebar=1.2 μm)
残余体形成后,即迅速向生精小管的周边——生精上皮的基部移动。残余体在向上皮基底部转移时,其体积逐渐变小,内部结构不断变化。低电子密度物质和空泡迅速消失。中等电子密度的细密沙粒状物质的颗粒逐渐变得粗大、电子密度逐渐增高,演变成较高电子密度的粗大颗粒状物质或无定形物质。变性线粒体的内部基质和膜性结构的电子密度逐步增高,逐渐演化成具有板层样结构的高电子密度脂质样结构。残余体内原有的高电子密度脂质样颗粒不断融合变大,聚集形成更大的脂质颗粒。此时,这种含有脂质颗粒的残余体,即转化形成所谓的脂质包涵体(lipid inclusion)。当这种脂质包涵体转移至支持细胞的基底部时,其残余体原有的结构消失殆尽,内部结构全部为高电子密度脂质样物质所替代,此时的脂质包涵体即转化为脂质样颗粒(lipid-like particle)或脂滴(lipid droplet)。在残余体本身转化的同时,在Sertoli细胞胞质内,残余体周边常常可见多个大小不等的含脂质成分的球形颗粒出现,这种颗粒内部结构均匀,电子密度高,也是属于脂质颗粒。这些颗粒内部有时可见板层状结构(图8)。
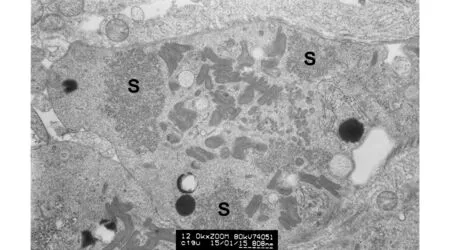
残余体内可见4个散在的高电子密度球形颗粒,并有成片中等电子密度的沙粒状物质(S);在中部区域,可见成簇聚集的由线粒体固缩形成的中等电子密度的膜性腊肠样结构,偶然可见几个囊泡图7 生精周期Ⅷ期精子排放后、位于生精上皮表面的残余体(×12 000,标尺808 nm)Fig.7 Residual body on the surface of seminiferous epithelium after spermiation at stage Ⅷ of spermatogenic cycle (×12 000, scalebar=808 nm)
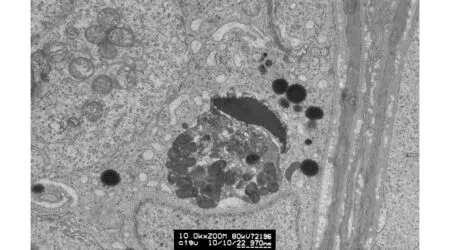
可见一个大的电子密度不均的团块状颗粒,颗粒有断续的膜包被;这个大的非均质的团块含多种结构成份,团块的下半部由很多小的非均匀结构的球团块构成,似为线粒体变性后形成的结构,电子密度较高;团块的右上呈新月状的部分,为电子密度高、结构相对均匀的脂质样结构;在这个团块周边有数个大小不等、电子密度甚高的圆球形脂质颗粒,这些颗粒无膜包被图8 小鼠生精小管生精上皮基底部(×10 000,标尺970 nm)Fig.8 Seminiferous epithelium base in the mouse seminiferous tubule (×10 000,scalebar=970 nm)
在支持细胞基底部,接近生精上皮的基膜处,能够清晰可辩的残余体已经很少,取而代之的是数量众多、大小不一、电子密度很高的脂质包涵体或脂质样颗粒。这些颗粒均无膜包被。经常可见脂质样颗粒紧贴支持细胞基底部的细胞膜,或紧贴支持细胞和生精细胞相对的侧面细胞膜。在脂质样颗粒紧贴支持细胞基底部细胞膜的地方,支持细胞的细胞膜常有结构不清,甚至出现断续的状态(图9)。在支持细胞基底部的侧面,常有上皮基底部间隙存在,间隙内有时可以见到有板层结构的高电子密度脂质颗粒(图10)。

一个高电子密度脂质颗粒紧贴支持细胞基底部的细胞膜上,颗粒没有膜包裹;在颗粒紧贴的部位,细胞膜的界限模糊不清,结构不完整;颗粒的高电子密度物质呈毛絮状或丝状伸出,与细胞膜相融合;细胞膜小管的基膜完整;在与这个颗粒相对应的管周基质细胞内,可见有一个高电子密度的圆团,具有明显的板层样脂质颗粒的结构特征图9 小鼠生精小管生精上皮基底部及小管周边(×40 000,标尺243 nm)Fig.9 Seminiferous epithelial base in the mouse seminiferous tubule and tubule periphery (×40 000, scalebar=243 nm)
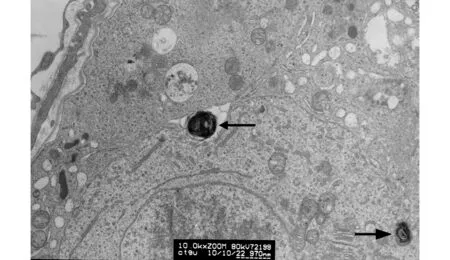
中部黑箭头所示为位于支持细胞和初级精母细胞之间间隙中的脂质颗粒,该颗粒显示为高电子密度的板层状结构。右下黑箭头所示为位于初级精母细胞上方的脂质颗粒,该颗粒较小,具有明显的高电子密度的层状结构特征,该颗粒也位于支持细胞和初级精母细胞之间的间隙之中图10 生精小管靠近生精上皮基底部(×10 000,标尺970 nm)Fig.10 Seminiferous epithelial base closed to edge of the mouse seminiferous tubule (×10 000, scalebar=970 nm)
在与支持细胞基底部有大量脂质样颗粒聚集区域相对应的管周基质内,也即在生精周期第Ⅷ~Ⅸ期,生精小管的周边基质及附近间质内,常常可见有类似于生精小管内脂质样颗粒的高电子密度颗粒出现。这些管外的高电子密度颗粒可出现于生精小管基膜之外的组织间隙内,也可出现在管周基质细胞或间质淋巴管内皮细胞之内,或间质淋巴管内皮细胞与睾丸间质细胞之间(图11,12)。而在其它生精时相的小管周围的基质内,或睾丸间质内,极少见到类似的颗粒出现。
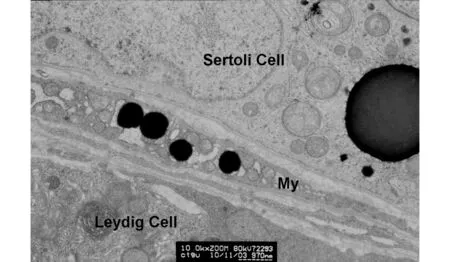
在支持细胞基底部可见一个大的和数个小的高电子密度颗粒,颗粒无膜包被,颗粒边界呈毛刺样;在管周基质细胞内可见有4个小的高电子密度颗粒,颗粒的结构特征看起来与支持细胞内的颗粒相类似;My为管周基质细胞图11 生精小管生精上皮基部及管周组织(×10 000,标尺970 nm)Fig.11 Seminiferous epithelial base and tissue around the seminiferous tubule (×10 000, scalebar=970 nm)

在睾丸间质内的淋巴管内皮细胞(E)胞质内可见数个高电子密度球形颗粒,颗粒的形态学特征与出现于Sertoli细胞内的脂质颗粒十分相近,而与睾丸间质细胞内的脂滴(箭头示)完全不同;My为管周基质细胞图12 生精小管管周及睾丸间质(×12 000,标尺808 nm)Fig.12 Tissue around the seminiferous tubule and interstitial tissue of the testis (×12 000, scalebar=808 nm).
3 讨论
本研究的目的是希望借助对生精小管内残余体形成和转归的观察,从一个器官的侧面来了解机体是如何处理体内的生物垃圾——脂褐质的,以期为衰老的理论研究提供一些基本素材。
精子排出后,残余体转化为脂褐质在上皮内存在的时间甚短,在大、小鼠均只占Ⅷ期的后半程,约占一个生精周期长的4%~5%(大鼠)或3%~4%(小鼠)[9-10]。找到这一时相的小管,一直是电镜观察的难点,而能恰好看到脂褐质接触支持细胞基底部细胞膜的现象,实属一件非常困难的事情,这也许是让许多研究者放弃观察的重要原因。因此国内外关于残余体及其转化的研究自上个世纪七十年代起完全绝迹。而在此之前的不多研究中,关于残余体转归转化为脂褐质的结局,也仅有推论,没有直接证据[1-4,11]。我们在长期大量的观察积累下,取得一些图像观察结果。
对残余体物质的消化和处理,一直被认为是支持细胞的重要功能之一。支持细胞对精子释放后遗留在生精上皮表层的残余体的处理目前比较一致的观点认为,其全部转化为脂质样的脂褐质,既往的研究者根据其不同转化阶段的形态表现分别给予不同的称谓:脂质包涵体(lipid inclusion)[1-3],脂滴(lipid droplet)[4,11-12],或脂色素(lipochrome pigment)[4]。但是关于这些脂褐质物质的转归,虽然有多种推论,但始终是一个谜[1-4,11]。由于这一时相持续时间非常短,电镜标本恰好切到这一时相的生精小管十分不易,这也是关于残余体转归的电镜研究文献很少的重要原因。为了弄清残余体的转归,前期我们对大鼠睾丸的生精小管进行了观察[5]。通过观察,我们得到的结论是:残余体经过一系列的形态学转变、形成脂质样颗粒之后,最终被支持细胞排出小管之外[5]。为了求证这个结论是否具有普遍性的意义,我们对小鼠睾丸的生精小管进行了观察。此外,既往国内外关于残余体的观察研究几乎仅限于大鼠[1-4,13],本研究首次对小鼠生精小管内残余体的形成、转归进行了报道。
在光镜水平上,本研究使用残余体特殊染色方法,能够在整体水平上呈现残余体的形成和转归过程。我们可以看到,小鼠残余体染色特征的形成早在精子成熟、释放之前就开始显现。在Ⅲ期开始,位于生精上皮表层的精子细胞,其呈扇形伸向管腔的胞质,逐渐蓝染,但没有明显的颗粒。至Ⅴ期,随着精子的成熟,扇形胞质被整体深染。这种被蓝染的胞质呈团块状,在Ⅷ期成熟精子由上皮释入管腔的时刻,数量和体积达到最高峰。当精子释放完毕,染色团块在向管周移动的同时,数量迅速减少,并消失。这一染色特性的变化与电镜下的残余体的形成和转化是高度一致的。
电镜下,残余体在支持细胞内的转移过程,也是一个转化的过程,即:由变性的线粒体、沙粒样物质、高电子密度脂质样颗粒这3种不同物质,逐渐转化为高电子密度的、无膜包被的、均质或呈层状结构的球形脂质样颗粒。这种转化十分迅速,在残余体由上皮表层向上皮基底部转移的过程中,短时间内就可以完成。
这种残余体转化形成的高电子密度球形脂质颗粒——一种特殊形态的脂褐质,其成分看起来似由磷脂构成,具有可溶解、可分散的性质。支持细胞基底部细胞膜有脂质样颗粒紧贴的部位,细胞膜结构模糊、缺损、或有与颗粒结构融合的现象。此外,在支持细胞内有脂褐质存在的部位,管周基质细胞内、间质淋巴管内皮细胞内和组织间隙内出现具有相同电子密度和结构特点的球形结构。这些现象与我们在大鼠睾丸内观察到的结果完全类似,同样支持我们前期建立的假设,即:由残余体转化形成类脂质的脂褐质成分可以通过扩散的形式离开生精小管,进入包括淋巴间隙在内的睾丸间质之中[5]。
与我们在大鼠生精小管观察到的结果一致,小鼠生精小管中并没有观察到支持细胞的溶酶体与残余体融合的现象。而且,精子形成晚期,精子尾部周围胞质的形态学转化在残余体形成之前就已经开始了。上述现象说明,残余体内部物质的转化,是以自身的作用为主,可能与支持细胞的消化体系无关。这与Fawcett和Clegg等[4,13]的观点一致。
综上所述,残余体形成后迅速向管周移动,在很短的时间内完成转化,并到达支持细胞的基底部。对这一现象最合理的解释就是:支持细胞要将残余体转化形成的脂褐质排出生精小管,并借助管周丰富的淋巴系统,将这些物质带离睾丸,使睾丸保持“清洁”状态。根据这一推论,给我们带来的启示是:睾丸处理自身器官内脂褐质的方式是否在体内具有代表性的意义呢?其它组织器官是否也存在类似的处置机制呢?
[1] Kerr J B,De Kretser D M.Cyclic variations in Sertoli cell lipid content throughout the spermatogenic cycle in the rat[J].J Reprod Fertil,1975,43(1):1-8.
[2] Kerr J B,Mayberry R A,Irby D C.Morphometric studies on lipid inclusions in Sertoli cells during the spermatogenic cycle in the rat[J].Cell Tissue Res,1984,236(3):699-709.
[3] Clermont Y,Morales C,Hermo L.Endocytic activities of Sertoli cells in the rat[J].Ann N Y Acad Sci,1987,513(1):1-15.
[4] Fawcett D W.Ultrastructure and function of the Sertoli cell[J].Handbook of physiology,1975,2(6133):1581-1583.
[5] 肖长义,王亚琴,黎家华,等.大鼠睾丸生精小管内残余体类物质形成及排出[J].解剖学杂志,2014,37(4):443-447,563.
[6] 肖长义.一种可用于支持细胞功能判定的染色法[J].解剖学杂志,1993,16(5):470-471.
[7] Oakberg E F.Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium[J].Am J Anat,1956,99(3):507-516.
[8] Oakberg E F.A description of spermiogenesis in the mouse and its use in analysis of the cycle of the seminiferous epithelium and germ cell renewal[J].Am J Anat,1956,99(3):391-413.
[9] Clermont Y.Kinetics of spermatogenesis in mammals:seminiferous epithelium cycle and spermatogonial renewal[J].Physiol Rev,1972,52(1):198-236.
[10] Clermont Y,Trott M.Duration of the seminiferous epithelium in mouse and hamster determined by means of 3H-thymidind and radioautography[J].Fertil Steril,1969,20(5):805-817.
[11] Breucker H,Schafer E,Holstein A F.Morphogenesis and fate of the residual body in human spermiogenesis[J].Cell Tissue Res,1985,240(2):303-309.
[12] Dym M.The fine structure of the monkey(Macaca)Sertoli cell and its role in maintaining the blood-testis barrier[J].Anat Rec,1973,175(4):639-656.
[13] Clegg E J,MacMillan E W.The uptake of vital dyes and particulate matter by the Sertoli cells of the rat testis[J].J Anat,1965,99(2):219-29.
(2016-03-23 收稿)
Formation and Outcome of Residual Bodies in Seminiferous Tubules of the Mouse Testis
Xiao Changyi,Wang Yaqing,Li Jiahua et al
Department of Histology & Embryology,Medical College,China Three Gorges University,Yichang 443002,China
Objective To understand the waste dealing processinvivoby observing the formation and discharge of residual bodies in seminiferous tubules of the mouse testes.Methods Testes were obtained from adult BALB/c mice weighing 18-20 g.One part of the testis was made for paraffin sections to observe residual bodies by specific staining,and another part for ultrathin sections to observe residual bodies under the transmission electron microscope.Results Specific staining for residual bodies showed dark blue particles with different sizes in round or irregular shape in some seminiferous tubules.These particles initially appeared at stage Ⅳ-Ⅴ of the spermatogenic cycle.The fine-grain small blue particles appeared in the cytoplasm of spermatids towards the tubule lumen.With the extension of the spermatogenic cycle,the cytoplasm of the spermatid was gradually reduced,and the particles became large in volume and less in quantity.By the time of spermiation(Ⅶ-Ⅷ stage of the spermatogenic cycle),the particles all gathered on the surface of the seminiferous epithelium and the total number of particles reached the peak.After spermiation,the particles moved quickly to the edge area of the tube.There particles moved to the base with their quantity gradually reducing.These particles were known as the residual bodies.The transmission electron microscopy showed that the dynamic features of these particles were the same as those under the light microscope.These particles varied a lot in size and had different internal structures and electron densities.After the spermiation,the particles moved rapidly towards the edge area of the tubule in very short time.Their internal structures and electron densities changed continually and eventually transformed into lipid-like particles.These lipid-like particles near the basement membrane would be discharged out into interstitial tissue.Conclusion In seminiferous tubules of the mouse,the residual bodies produced in the spermatogenic cycle transform into lipid-like particles as they move to the base of the epithelium.These lipid-like particles are finally excreted outside the seminiferous tubule.It was suggested that the testis can keep self-cleaning by discharging out structural waste produced in the testis.
mouse; testis; seminiferous tubule; residual body; formation; outcome
R329.4
10.3870/j.issn.1672-0741.2016.05.011
肖长义,男,1958年生,教授,E-mail:xiaochy@ctgu.edu.cn

