MGMT不同表达水平的恶性胶质瘤患者术后采用不同化疗方案的疗效分析*
袁江伟,杨 洁,宋玉芝,王玉祥
(河北医科大学第四医院:1.神经外科;2.放疗科,石家庄 050000)
论著·临床研究 doi:10.3969/j.issn.1671-8348.2016.30.024
MGMT不同表达水平的恶性胶质瘤患者术后采用不同化疗方案的疗效分析*
袁江伟1,杨 洁2,宋玉芝2,王玉祥2
(河北医科大学第四医院:1.神经外科;2.放疗科,石家庄 050000)
目的 探讨不同六氧甲基鸟嘌呤-DNA甲基转移酶(MGMT)表达水平恶性胶质瘤患者术后采用不同化疗方案的临床疗效及不良反应的差异,为临床更有效地进行化疗提供参考。方法 选取该院肿瘤科2011年1月至2013年1月收治的90例恶性胶质瘤术后患者,将其中64例MGMT表达阴性的患者分为A组和B组(各32例),26例MGMT表达阳性患者纳入C组。A组采用放疗加替尼泊苷加尼莫司汀的治疗方案,B组采用放疗加替莫唑胺的治疗方案,C组采用放疗加替尼泊苷加尼莫司汀的治疗方案。比较3组患者的不良反应发生情况,并随访观察1年后生存率的差异。结果 3组患者的血红蛋白、白细胞、粒细胞、血小板、出血、丙氨酸氨基转移酶、肌酐、尿素氮、周围神经炎不良反应比较,差异均无统计学意义(P>0.05);3组患者恶心呕吐、腹泻、便秘的发生率比较,差异均有统计学意义(P<0.05),且C组明显高于A、B组(P<0.05)。随访观察1年,仅C组有1例患者失访。A、B、C组的中位生存时间分别为10、10、7个月,C组中位生存期明显低于A、B组(χ2=7.673,P=0.006;χ2=6.395,P=0.011),A、B组比较差异无统计学意义(χ2=0.063,P=0.802)。结论 MGMT表达阳性的胶质瘤患者长期预后效果明显较MGMT表达阴性者差。
六氧甲基鸟嘌呤-DNA甲基转移酶;胶质瘤;化疗;不良反应
恶性胶质瘤是临床上常见的一种原发性颅内肿瘤,具有较强的侵袭性,病死率极高。目前,临床上主要采用经验性化疗方法治疗该肿瘤,但大部分胶质瘤患者的预后较差。替莫唑胺(TMZ)和烷化剂是临床上治疗恶性胶质瘤的常用化疗药物[1]。近年来临床研究显示,六氧甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA-methyltransferase,MGMT)能较好地修复化疗造成的DNA损伤[1]。本研究主要以2011年1月至2013年1月于本院肿瘤科治疗的90例恶性胶质瘤术后患者为研究对象,分析了不同MGMT表达水平的恶性胶质瘤患者采用不同术后化疗方案的临床疗效及其不良反应表现的差异,具体报道如下。
1 资料与方法
1.1 一般资料 选取2011年1月至2013年1月本院肿瘤科治疗的恶性胶质瘤术后患者,纳入标准:所有患者均经肉眼全切或次全切除,病理诊断为脑胶质瘤Ⅲ、Ⅳ级,均签署知情同意书接受放化疗,无其他恶性肿瘤病史,Karnofsky功能状态评分(KPS评分)60分以上,无明显放化疗禁忌证;排除标准:预计生存时间小于3个月的患者,不能够耐受化疗药物的患者。本研究共纳入90例患者,将其分为3组:A组32例,男19例、女13例,年龄20~67岁,平均(39.1±5.9)岁,其中星形细胞瘤Ⅲ级14例、多形性胶质母细胞瘤16例、间变少枝胶质细胞瘤Ⅲ级2例,KPS评分(75.1±5.8)分;B组32例,男18例、女14例,年龄19~68岁,平均(41.6±6.1)岁,其中星形细胞瘤Ⅲ级17例、多形性胶质母细胞瘤14例、间变少枝胶质细胞瘤Ⅲ级1例,KPS评分(75.8±6.4)分;C组26例,男15例、女11例,年龄22~64岁,平均(39.4±5.6)岁,其中星形细胞瘤Ⅲ级12例、多形性胶质母细胞瘤12例、间变少枝胶质细胞瘤Ⅲ级2例,KPS评分(73.4±5.9)分。3组患者的年龄、性别等一般资料比较差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 MGMT的检测 取患者脑胶质瘤组织做成切片,石蜡包埋备用,将组织切片进行常规脱水,并放置在浓度为3%的过氧化氢溶液中持续孵育10 min,使内源性过氧化物的活性阻断,取出切片,进行梯度乙醇脱水,采用二甲苯透明,最后用中性树胶封片,选择甲基转移酶诊断试剂盒(由四川宇康生物技术有限公司生产)对肿瘤组织中的 MGMT 蛋白表达进行测定,操作步骤严格按照试剂盒说明书进行。于镜检下分析,细胞质内或肿瘤细胞内有棕褐色着色颗粒判为阳性,着色程度较弱的判为弱阳性,无色的判为阴性。
1.2.2 治疗方法 A组采用“放疗+替尼泊苷(由北京双鹤现代医药技术有限责任公司生产,国药准字H19990044 )+尼莫司汀(由扬子江药业集团有限公司生产,国药准字H20044292)”方案,选用60 mg/m2替尼泊苷加500 mL生理盐水对患者进行静脉滴注30 min,每日1次,连续5 d,同时静脉滴注3 mg/kg尼莫司汀,之后根据血常规检查结果停药3~4周,再次给药,剂量时间同前。B组采用“放疗+替莫唑胺(由浙江杭康药业有限公司生产,国药准字H20010509 )”方案,放疗同步口服替莫唑胺75 mg/m2,共42 d,放疗结束后4周辅助替莫唑胺治疗,第1周剂量为150 mg/m2,连续5 d,28 d为1个疗程;从第2周期开始增至每日200 mg/m2,连续5 d,28 d为1个疗程。化疗6个疗程。C组采用“放疗+替尼泊苷+尼莫司汀”方案,具体用药方法同A组。放疗方案均为全脑照射DT36~40 Gy,连续照射4周,后缩野补量至每2.0~2.5周DT20~24 Gy,每周5次。上述患者均为4周1个疗程。
1.2.3 随访及不良反应发生的监测 化疗期间对两组患者进行随访观察,随访时间4~12个月,平均(7.1±2.2)个月,随访方式主要为电话、门诊复查、登门检查等方式。不良反应的监测:询问患者用药的不适症状,每个用药疗程中进行2次血常规及肝肾功能检查,以每次检查指标或症状最为严重的一次作为标准不良反应,判定标准参见世界卫生组织5级国际标准,见表1。为方便统计,本研究将统计标准分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ度。
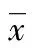
2 结 果
2.1 3组不良反应的发生情况 对3组患者的血红蛋白、白细胞、粒细胞、血小板、出血、丙氨酸氨基转移酶、肌酐、尿素氮、周围神经炎不良反应进行比较,差异均无统计学意义(P>0.05);3组恶心呕吐、腹泻、便秘的发生率比较,差异均有统计学意义(P<0.05),且C组患者明显高于A、B组(P<0.05),见表2。
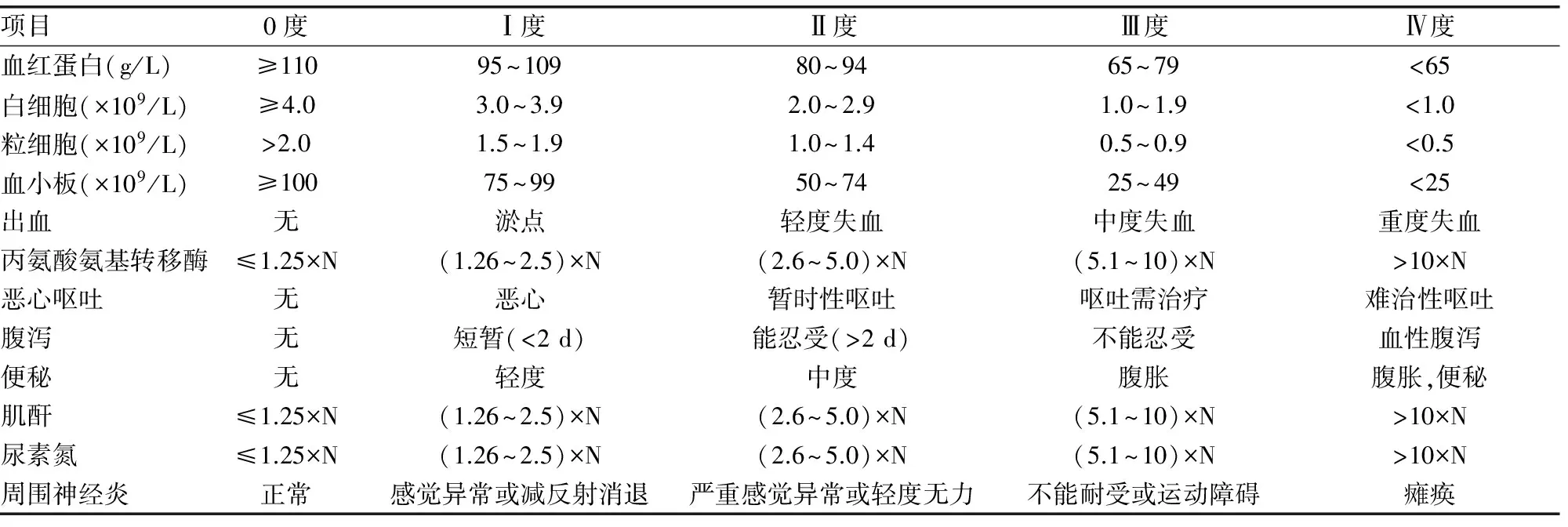
表1 不良反应分级标准
N:正常值上限。
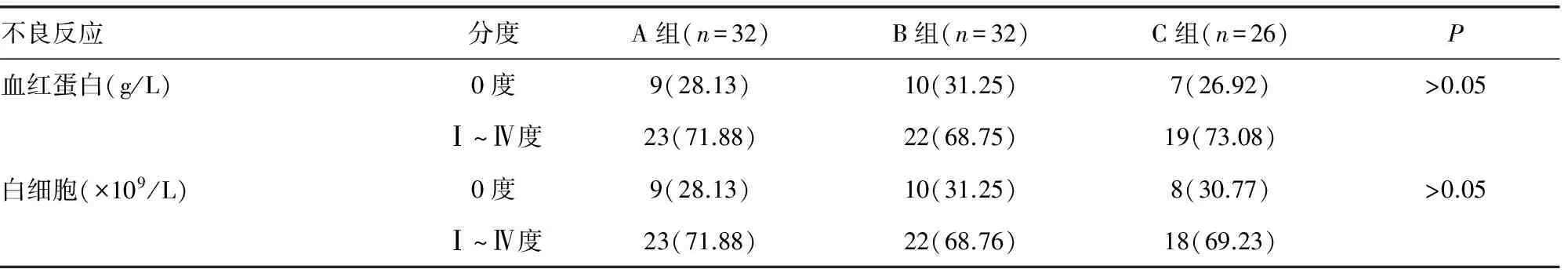
表2 3组化疗不良反应比较[n(%)]
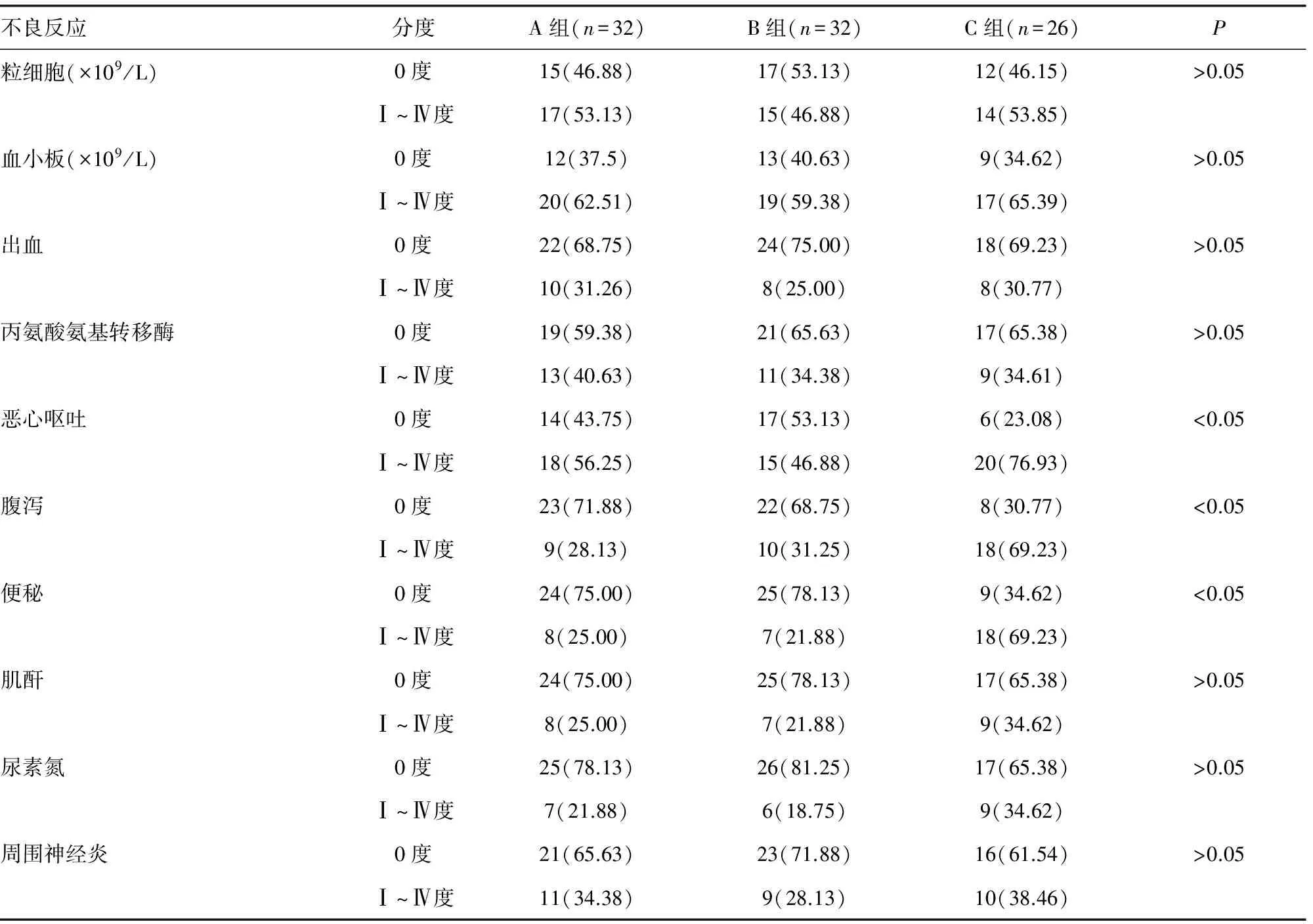
续表2 3组化疗不良反应比较[n(%)]
2.2 3组患者1年生存情况分析 对3组患者随访观察1年,仅C组有1例患者失访。A组中位生存时间为10个月,B组为10个月,C组为7个月,C组中位生存时间明显低于A、B组(χ2=7.673,P=0.006;χ2=6.395,P=0.011),A、B两组患者的生存时间比较差异无统计学意义(χ2=0.063,P=0.802)。3组生存曲线见图1。
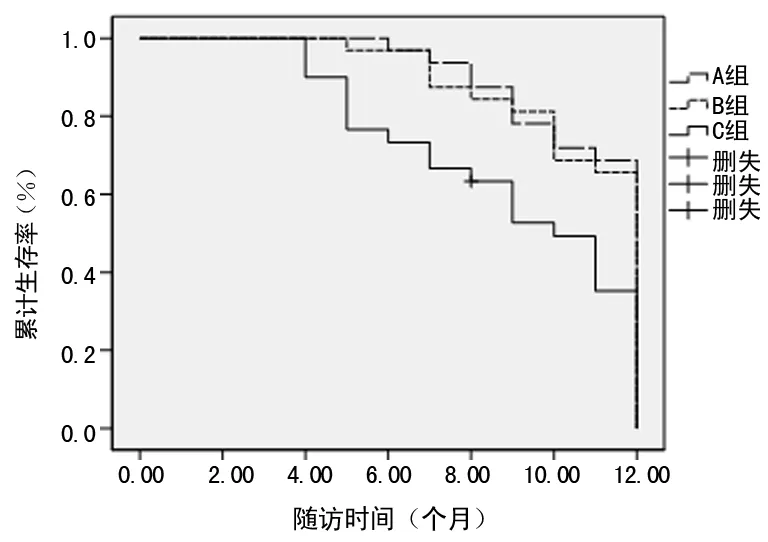
图1 3组患者生存率估计图
3 讨 论
目前,临床上主要通过化疗方法治疗胶质瘤,而肿瘤对化疗药物的耐受性可直接影响化疗效果[2]。其中,烷化剂具有较强的脂溶性,对血脑屏障具有较强的通透性,在脑胶质瘤的临床治疗中被广泛应用。TMZ属于咪唑并四嗪类新型烷化剂,具有较强的抗肿瘤活性,应用于胶质瘤的治疗中,可以有效提高患者的平均存活时间,减轻水肿症状,减少肿瘤体积,且不会发生明显的不良反应[3]。但随着TMZ的广泛应用,其抗药性的产生极大程度上限制了烷化剂的临床治疗效果,成为胶质瘤化疗失败的重要因素。MGMT是肿瘤细胞产生烷化剂抗药性的主要影响物质。临床研究表明,MGMT对烷化剂所造成的DNA损伤具有较好的修复作用[4-6]。因此,检测胶质瘤患者MGMT的活性高低可以对烷化剂治疗肿瘤的效果进行预见性判断。
MGMT的相对分子质量为22×103,是一种普遍存在的DNA修复酶,能有效保护染色体免受化疗药物的损伤[7-8]。其主要作用机制是通过不可逆地将烷化基团转移到MGMT蛋白第145位半胱氨酸残基上,使细胞免受烷化剂的损伤。MGMT的合成速率和含量直接决定了细胞修复DNA鸟嘌呤第6位氧原子上烷化基团的能力,脑组织中MGMT处于低水平状态,而在脑胶质瘤细胞当中,MGMT水平在星形胶质瘤中最高。TMZ是脑胶质瘤化疗中的常用药,作用于机体,可释放活性的氯乙基氮离子,使DNA上六氧鸟嘌呤烷基化,从而影响DNA的复制,消灭胶质瘤细胞[9-11]。而MGMT可以修复化疗药物烷基化的鸟嘌呤,阻止DNA形成交链,降低此类药物的细胞毒作用。因此,对于有MGMT高表达的胶质瘤患者应当避免选用TMZ等烷化剂化疗药物,以减少耐药性的产生,从而提高临床疗效[12]。
本研究结果显示,3组患者的血红蛋白、白细胞、粒细胞、血小板、出血、丙氨酸氨基转移酶、肌酐、尿素氮、周围神经炎等不良反应比较,差异均无统计学意义(P>0.05),3组患者随访观察1年,仅C组有1例患者失访。A组的中位生存时间为10个月,B组为10个月,C组为7个月,C组中位生存期明显低于A、B组,表明MGMT表达阳性的胶质瘤患者长期化疗效果明显较MGMT阴性表达者差,且不同表达的患者化疗不良反应无明显差异,这一结果和相关文献报道相吻合[13]。因此,笔者认为不同MGMT表达水平的恶性胶质瘤患者采用不同术后化疗方案的临床疗效差异明显。
[1]季列,周范民.6-氧-甲基鸟平嘌呤-DNA甲基转移酶和P53在人脑胶质瘤中的表达和预后关系的研究[J].中国临床神经科学,2011,19(6):588-593.
[2]曹秀娟,郝俊芳.高分级脑胶质瘤术后放射治疗[J].国际肿瘤学杂志,2011,38(1):27-29.
[3]Stupp R,Hegi ME,Mason WP,et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomized phase Ⅲ study:5-year analysis of the EORTC-NCIC trial[J].Lancet Oncol,2009,10(5):459-466.
[4]戴宜武,王振光,秦家振.脑胶质瘤治疗进展[J/CD].中华临床医师杂志(电子版),2013,7(14):675-677.
[5]Singh SK,Hawkins C,Terasaki M,et al.Identification of a cancer stem cell in human brain tumors[J].Cancer Res,2012,72(54):1853-1864.
[6]邵建永,陈忠平.胶质瘤1p/19q联合缺失特征分析[J].中国神经精神疾病杂志,2011,37(8):54-57.
[7]张哲,林松.间变星形细胞少枝胶质细胞肿瘤分子病理亚型分类研究[J].中华外科杂志,2013,51(12):54-55.
[8]张磊,袁江伟.HIF-1、MGMT、CD133在人胶质母细胞瘤中表达的相关性研究[J].中国神经精神疾病杂志,2013,39(9):33-36.
[9]张鹏.脑恶性胶质瘤术后单纯放疗与放化疗联合疗效比较[J].中国实用医药,2014,9(23):556-558.
[10]陈晓,田晓娇,涂汉军.恶性胶质瘤术后放疗联合化疗预后分析[J].浙江临床医学,2013,10(22):67-69.
[11]孙健,杨学军,杨树源.替莫唑胺与司莫司汀治疗复发性恶性胶质瘤的随机、对照、多中心研究[J].中华医学杂志,2013,93(3):55-57.
[12]冯富强,冀培刚,高国栋.贝伐单抗联合化疗治疗复发性恶性胶质瘤:附12例经验[J].中国神经肿瘤杂志,2012,10(3):23-26.
[13]黄洁棱,颜晓慧.恶性胶质瘤耐药细胞通过Beclin1上调自噬抵抗替莫唑胺化疗[J].中华神经医学杂志,2013,12(8):52-54.
Efficacy of different chemotherapy regimens for patients with malignant glioma on different expression levels of MGMT*
Yuan Jiangwei1,Yang Jie2,Song Yuzhi2,Wang Yuxiang2
(1.DepartmentofNeurosurgery;2.DepartmentofRadiotherapy,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang,Hebei050000,China)
Objective To investigate the differences of clinical efficacy and untoward reaction of different chemotherapy regimens for patients with malignant glioma on different expression levels of O6-methylguanine-DNA-methyltransferase(MGMT),in order to provide
for clinical treatment.Methods Totally 90 cases of patients with malignant glioma in our hospital from January 2011 to January 2013 were selected,among them,64 cases of MGMT negative expressing patients were divided into group A and group B with 32 cases in each group,and 26 cases of MGMT positive expressing patients were enrolled into the group C.Group A was treated with combination of radiotherapy,teniposide and nimustine,group B was treated with radiotherapy-temozolomide combination regimen,group C was treated with combination of radiotherapy,teniposide and nimustine.The untoward reactions of the three groups were compared,and the survival rate was observed after one year follow-up.Results The hemoglobin,leukocyte,granulocyte,platelet,bleeding,alanine aminotransferase,creatinine,urea nitrogen,peripheral neuritis,untoward reactions among the three groups had no statistically significant differences (P>0.05);the incidence rates of nausea and vomiting,diarrhea,constipation among the three groups had statistically significant differences(P<0.05),in which group C was significantly higher than that of group A and group B(P<0.05).Only one case in the group C was lost in the one year follow-up.The median survival time was 10 months in group A and group B,and was 7 months in group C.The median survival time in group C was significantly lower when compared with that in group A and group B(χ2=7.673,P=0.006;χ2=6.395,P=0.011),while there was no significant difference of median survival time between group A and group B(χ2=0.063.P=0.802).Conclusion The long-term prognosis of patients with negative MGMT expression might be significantly worse than that of patients with negative MGMT expression in glioma.
O6-methylguanine-DNA-methyltransferase;glioma;chemotherapy;untoward reaction
河北省卫生厅青年科技项目(20130245)。 作者简介:袁江伟(1981-),主治医师,硕士,主要从事胶质瘤的临床与基础研究。
R739.4
A
1671-8348(2016)30-4252-03
2016-03-20
2016-06-29)

