甘草酸苷通过NF-κB通路影响小鼠急性肝损伤机制的研究*
邱惠萍,李小六,饶和平
(1.衢州职业技术学院医学院内科教研室,浙江衢州 324000;2.蚌埠医学院第一附属医院药剂科,安徽蚌埠 236000)
论著·基础研究 doi:10.3969/j.issn.1671-8348.2016.30.011
甘草酸苷通过NF-κB通路影响小鼠急性肝损伤机制的研究*
邱惠萍1,李小六2,饶和平1
(1.衢州职业技术学院医学院内科教研室,浙江衢州 324000;2.蚌埠医学院第一附属医院药剂科,安徽蚌埠 236000)
目的 探讨甘草酸苷是否可通过调控核因子-κB(NF-κB)通路影响小鼠急性肝损伤。方法 选取200只体质量29~30 g昆明小鼠,分为4组,每组50只。第1组为对照组;第2组由四氯化碳(CCl4)诱导急性肝损伤;第3组在第2组的基础上注射复方甘草酸苷(SNMC)注射液;第4组在第3组的基础上加用NF-κB抑制剂(proDTC)。处理1、3、5 d后,检测小鼠血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素、清蛋白水平及凝血酶原时间(PT),计算Child-Pugh评分并进行病理学观察。结果 相较于第1组,CCL4处理后,AST、ALT、总胆红素、清蛋白表达水平,以及PT和Child-Pugh肝功评分均明显升高(P<0.05),表明已成功建立CCL4诱导急性肝损伤模型。同时给予小鼠SNMT后(CCL4+SNMT),各指标表达虽未回至正常水平,但随着处理时间的延长,表达水平逐渐降低(P<0.05)。同时此效应可被NF-κB抑制剂proDTC逆转。结论 SNMT可通过调节NF-κB通路降低小鼠急性肝损伤的严重程度。
复方甘草酸苷;核因子-κB;急性肝损伤
急性肝损伤是临床上常见的一类重症肝损伤,其可由酒精、化学药物、有机化合物及病毒感染等多种因素导致[1]。临床上常表现为肝脏短期内出现大片坏死及肝功能急剧衰竭,是导致患者死亡的重要原因之一[2-3]。因此,深入探究急性肝损伤的发生机制,靶向扼制损伤发展及寻找合理逆转急性肝损伤的药物具有重要的社会医学价值。甘草酸苷是从中药甘草中提炼出的,一种具有降低肝损伤、丙氨酸氨基转移酶(ALT)、肝细胞脂肪变形及肝纤维化等一系列保肝功效的药物,是糖尿病及肝病患者的常用护肝药之一[4-5]。近年来研究,复方甘草酸苷(SNMC)合并舒肝宁治疗急性肝损伤具有显著的疗效[6],提示甘草酸苷可影响机体急性肝损伤的修复[5]。然而其具体机制还不明了。目前,大量研究显示,核因子-κB(NF-κB)通路在各种因素导致的急性肝损伤过程中扮演了重要的角色[7]。并且高表达NF-κB,可显明显降低小鼠急性肝损伤的程度[8-9]。因此,本文聚焦于甘草酸苷促进肝损伤修复的临床现象及NF-κB通路在急性肝损伤过程中扮演的重要角色,以探究甘草酸苷影响小鼠急性肝损伤的具体机制。
1 材料与方法
1.1 材料 实验中选取的200只昆明小鼠(体质量为29~30 g),均购自广州医科大学动物实验中心。SNMC注射液购自华北制药股份有限公司、四氯化碳(CCl4)及NF-κB抑制剂(proDTC)均购自碧云天公司。
1.2 方法
1.2.1 实验动物处理 选取200只体质量为29~30 g的昆明小鼠,分为4组,各50只。第1组为对照组,腹腔注射生理盐水20 μL/10 g;第2组腹腔注射0.5%的CCl420 μL/10 g诱导急性肝损伤;第3组在第2组的基础上注射临床SNMC注射液(最大剂量3.3 μL/10 g);第4组在第3组的基础上加用NF-κB抑制剂(proDTC)150 μL/10 g。均连续注射5 d。
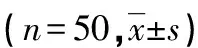
表1 各组不同指标水平比较
1.2.2 实验指标检测 分别在1、3、5 d于小鼠尾静脉抽取外周血,采用小鼠血清标本试剂盒(碧云天)检测天门冬氨酸氨基转移酶(AST)、ALT、总胆红素、清蛋白的表达水平及凝血酶原时间(PT)。同时按Child-Pugh评分量表对小鼠肝功进行评分[10]。5 d后,取小鼠肝脏组织切片,光镜下观察肝脏病理变化。
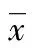
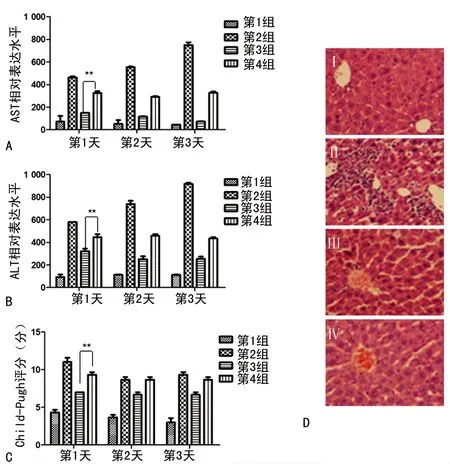
A:各组AST表达水平变化;B:各组ALT表达水平变化;C:各组Child-Pugh评分变化;D:光镜下观察处理5 d后小鼠肝脏病理切片(苏木精-伊红染色,×200;Ⅰ:第1组;Ⅱ:第2组;Ⅲ:第3组;Ⅳ:第4组):n=5;*:P<0.05;**:P<0.01。
图1 各组不同指标表达水平及病理变化
2 结 果
通过比较4组经不同试剂处理小鼠外周血AST与ALT的表达水平,结果显示,相较于第1组(对照组),第2组CCL4处理后,ALT与AST表达水平明显升高,差异均有统计学意义(P<0.05),表明已成功建立CCL4诱导急性肝损伤模型。同时给予小鼠SNMC后(CCL4+SNMC),AST及ALT表达虽未恢复至正常水平,但随着处理时间的延长,表达水平逐渐降低,见表1。同时,给予NF-κB抑制剂proDTC(CCL4+SNMC+proDTC)后可逆转该效应(图1A、B)。此外,根据最新指南Child-Pugh肝功评分量表,结果显示在4组实验中,Child-Pugh评分变化趋势与ALT(AST)变化趋势一致(图1C);并且光镜下观察病理切片结果显示,CCL4处理后,肝细胞发生明显坏死、细胞空泡变性及脂肪变性;而加入SNMC后,坏死比例明显下降,同时细胞空泡变性及脂肪变性也明显减少。同样此效应可被proDTC逆转(图1D)。
3 讨 论
急性肝损伤是临床上消化科的一类常见急症[1]。其发展迅速,在很短时间导致患者大片肝坏死,肝功能急剧下降,继而引起一系列全身多系统并发症,最后导致患者死亡[11]。虽然,目前免疫抑制剂的广泛应用极大地降低了患者急性肝损伤的严重程度,但其效果还并不理想[12-13]。因此,通过探究患者急性肝损伤的发病机制,有针对性地阻断对肝细胞的毒害作用,并促进自体肝细胞的再生与修复,非常有助于临床急性肝损伤的治疗,具有重要的医学价值。目前研究认为,无论是在何种因素所致急性肝损伤的环节中,NF-κB信号通路均扮演了重要的角色。重症肝炎及肝衰竭中NF-κB信号的表达明显低于正常或轻度肝损伤患者[14]。特异性增强肝细胞内NF-κB信号的表达可提高肝细胞耐受缺氧等多种应激的能力,并促进肝细胞的再生与修复[9]。以上研究提示,深入探究NF-κB信号在肝损伤过程中扮演的重要角色,有助于更好地阻断并逆转肝损伤。
因此,本研究以CCL4诱导肝损伤构建急性肝损伤模型,采用NF-κB信号通路抑制剂proDTC,观察加入proDTC前后SNMC对小鼠急性肝损伤的影响。结果显示,SNMC可明显降低CCL4诱导的急性肝损伤的严重程度;而proDTC的加入可抑制SNMC的作用,促进小鼠急性肝损伤的发生。因此,以上研究提示,SNMC可通过调节NF-κB信号通路降低急性肝损伤的严重程度。本研究通过检测不同肝功指标,观察加入proDTC前后SNMC对小鼠急性肝损伤的影响。然而,由于SNMC对肝细胞的影响是多方面的,不仅仅可降低肝损伤程度,同时与肝纤维化、细胞凋亡坏死、脂肪肝及水样变性等密切相关[4,15]。提示一方面NF-κB信号通路不仅参与了SNMC的抗损伤作用;同时NF-κB通路可能只是SNMC抗肝损伤机制的一小部分,很可能还存在其他的机制。本研究以SNMC抗肝损伤为媒介,深入探讨急性肝损伤的发生、发展机制,从而更好地控制急性肝损伤,为临床用药提供更多的理论指导。
[1]Taylor SA,Whitington PF.Neonatal acute liver failure[J].Liver Transpl,2016,22(5):677-685.
[2]Licata A.Adverse drug reactions and organ damage:the liver[J].Eur J Intern Med,2016(28):9-16.
[3]Agrawal S,Dhiman RK,Limdi JK.Evaluation of abnormal liver function tests[J].Postgrad Medical J,2016,92(1086):223-234.
[4]Matsuzaki Y,Ikegami T,Saito Y.Alternative therapies for hepatitis C:UDCA and SNMC[J].Nihon Rinsho,2011,69(Suppl 4):256-261.
[5]陈立艳,杨宝山,马英骥,等.复方甘草酸苷对小鼠暴发性肝功能衰竭的保护作用[J].中华肝脏病杂志,2005,13(3):209-212.
[6]何水清,卢瑞廷.舒肝宁联合复方甘草酸苷治疗急性肝损伤120例[J].中国实用医药,2014,9(20):182-183.
[7]Bak J,Je Nam K,Chung HY,et al.Oligonol ameliorates CCl 4 -induced liver injury in rats via the NF-Kappa B and MAPK signaling pathways[J].Oxid Med Cell Longev,2016(2016):3935841.
[8]Luedde T,Trautwein C.Intracellular survival pathways in the liver[J].Liver Int,2006,26(10):1163-1174.
[9]Wu J,Zern MA.NF-kappa B,liposomes and pathogenesis of hepatic injury and fibrosis[J].Front Biosci,1999(4):D520-527.
[10]Jacob KA,Hjortnaes J,Kranenburg G,et al.Mortality after cardiac surgery in patients with liver cirrhosis classified by the Child-Pugh score[J].Interact Cardiovasc Thorac Surg,2015,20 (4):520-530.
[11]Chughlay MF,Kramer N,Spearman CW,et al.N-acetylcysteine for non-paracetamol drug-induced liver injury:a systematic review[J].Br J Clin Pharmacol,2016,81(6):1021-1029.
[12]Juan J,Feld JJ.Hepatitis B virus and hepatitis C virus treatment and management in patients receiving immune-modifying agents[J].Curr Opin Rheumatol,2014,26(4):395-403.
[13]Arii S,Teramoto K,Kawamura T.Current progress in the understanding of and therapeutic strategies for ischemia and reperfusion injury of the liver[J].J Hepatobiliary Pancreat Surg,2003,10(3):189-194.
[14]Shin T,Kuboki S,Lentsch AB.Roles of nuclear factor-kappaB in postischemic liver[J].Hepatol Res,2008,38 (5):429-440.
[15]王岩,马英骥,杨宝山,等.复方甘草酸苷减轻HepG2细胞凋亡的机制[J].中华肝脏病志,2005,13(2):132-135.
Study on the mechanism of SNMT on acute liver injury in mice by NF-κB signaling pathway﹡
Qiu Huiping1,Li Xiaoliu2,Rao Heping1
(1.DepartmentofInternalMedicine,MedicalSchoolofQuzhouCollegeofTechnology,Quzhou,Zhejiang324000,China;2.DepartmentofPharmacy,theFirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu,Anhui236000,China)
Objective To explore whether glycyrrhizin has protective effect on acute liver injury in mice by NF-κB signaling pathway.Methods Totally 200 Kunming mice which the body weight were about 29-30 g were chose and divided into 4 groups randomly,50 cases in each group.The first group was the control group;the second group was acute liver injury group induced by CCl4;the third group was injected with Stronger Neo-Minophagen C(SNMC) injection on the basis of second groups;the fourth group was treated with NF-κB inhibitor (proDTC) on the basis of the third group.After 1,3,5 d treatment,the serum expressing levels of ALT,AST,total bilirubin,albumin of mice and prothrombin time were detected,the Child-Pugh score was calculated,and the pathological observation was performed.Results The results showed that,compared to the first group,after CCl4treatment,the expressing levels of AST,ALT,total bilirubin and albumin,the PT and Child Pugh score all were significantly increased(P<0.05),which indicated that the acute liver injury model induced by CCl4was successfully established.After the treatment of SNMT(CCl4+SNMT) in mice,although the level of each index did not return to normal level,with the extension of treatment time,the level of each index was also significantly reduced (P<0.05).At the same time,this effect could be reversed by NF-κB inhibitor proDTC.Conclusion SNMT plays a significantly protective role in acute liver injury via regulating NF-κB signaling pathway.
SNMT;nuclear factor-κB;acute liver injury
浙江省公益技术应用研究项目(2014C33252)。 作者简介:邱惠萍(1971-),副教授,本科,主要从事感染病学教学与研究。
R285.5
A
1671-8348(2016)30-4211-03
2016-03-23
2016-07-11)

