间歇性低氧致树突状细胞迁徙能力改变及其通路机制探讨*
胡 柯,王光伟△,杨 宇,徐国耀,李玉娴
(1.湖南医药学院临床医学院,湖南怀化 418000;2.中南大学湘雅二医院老年病科,长沙 410013)
论著·基础研究 doi:10.3969/j.issn.1671-8348.2016.30.008
间歇性低氧致树突状细胞迁徙能力改变及其通路机制探讨*
胡 柯1,王光伟1△,杨 宇2,徐国耀1,李玉娴1
(1.湖南医药学院临床医学院,湖南怀化 418000;2.中南大学湘雅二医院老年病科,长沙 410013)
目的 通过模拟人阻塞性睡眠呼吸暂停综合征(OSAS)间歇性低氧(IH)环境,观察其对人外周血来源树突状细胞(DCs)迁徙能力的影响,并通过干预RelB、p38的表达探讨IH致DCs迁徙能力改变的可能通路机制。方法 培养前将DCs分为RelB、p38干扰及非干扰质粒组。利用间歇低氧舱设置低氧环境,其中,给氧浓度为0.5%、1.5%、5.0%、10.0%,低氧/再氧合时间比为1∶1、1∶3、1∶5、1∶9,常氧对照组予以持续21.0%氧浓度供应。体外培养结束后蛋白质印迹法检测RelB、p38的表达,侵袭小室检测DCs的迁徙能力。结果 相对于常氧,体外IH下DCs整体迁徙能力下降,且DCs迁徙能力与IH环境下平均氧分压水平呈正相关(r=0.867,P<0.05),IH可促进DCs胞内RelB、p38表达,而干预二者表达均未逆转IH下迁徙能力的改变。结论 体外IH可导致DCs迁徙能力下降,且可能与RelB、p38激活无关。
间歇性低氧;树突状细胞;迁徙能力;RelB;p38
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)的间歇性低氧(intermittent hypoxia,IH)往往刺激体内炎症及氧化应激,造成动脉粥样硬化(atherosclerosis,AS)等血管并发症的发生、发展。树突状细胞(dendritic cells,DCs)作为体内最重要的抗原提呈细胞,很可能参与了OSAS致AS的过程。近来有研究报道,较之常氧,IH下DCs成熟表型及白细胞介素(IL)-12分泌增加,刺激T淋巴细胞反应(MLR)增强,并可能与细胞内活性氧(ROS)/Toll样受体4(TLR4)/ RelB,p38通路激活关联密切[1-2]。也有研究推断,DCs致AS的发生、发展除了需要分化成熟及具备免疫调节功能,还必须具备一定的迁徙能力,这样才能定植于血管内皮或归巢淋巴结,激活淋巴单核巨噬系统,促进泡沫细胞及粥样斑块形成。而国内有研究报道,持续低氧下DCs的迁徙能力明显下降[3],提示有必要明确IH对DCs迁徙能力的影响规律及其通路机制,以进一步阐明DCs在OSAS血管并发症中可能起到的作用。
1 材料与方法
1.1 主要材料 胎牛血清,重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF),重组人白细胞介素-4(rhlL-4),淋巴细胞分离液,RPMI-1640,重组人RANTES(rhRANTES),基质胶(matrigel),考马斯亮蓝G-250,牛血清清蛋白(BSA)等均为国产;p38及RelB一抗,电化学发光(ECL)显色试剂盒,免疫磁珠,过滤柱及Boy-den小室均购自美国Millipore公司;RelB-Snail及p38-pGenesil干扰质粒为武汉晶赛生物工程技术有限公司构建。
1.2 方法
1.2.1 IH环境设置 由湖南省老年病学研究室提供整套设备,包括气源与程控系统,分别决定低氧程度及不同时间比的低氧/再氧合循环。低氧→再氧合→低氧→再氧合模式循环,设置给氧浓度为0.5%、1.5%、5.0%、10.0%,低氧/再氧合(IH/ROX)时间比为1∶1、1∶3、1∶5、1∶9,共计400个循环,计时240 min后,继续在常氧(5% CO2,21% O2)条件下培养240 min。常氧培养组(持续21.0%给氧浓度)作对照,常氧下维持培养480 min。
1.2.2 人外周血来源的DCs的获取 健康志愿者抗凝外周血来自长沙市血液中心,采用梯度密度离心(Ficoll)获得单个核细胞。免疫磁珠阴性筛选法去除CD3、CD14、CD19和CD56细胞,再阳性筛选CD34细胞,含有rhGM-CSF及rhIL-4 的RPMI-1640培养基继续培养,显微镜和电镜下继续观察,出现类似DCs形态的细胞时予CD1a纯度检测,比例大于90%可认定为初始DCs。
1.2.3 细胞分组与干预 DCs分为RelB、p38 siRNA及非干扰质粒(Snail及pGenesil-1)组。培养前30 min分别转染RelB-Snail(干扰序列:5′-ATT CGT CGA TGA TTT CCA A-3′)、p38-pGenesil-1(干扰序列:5′-CGG ACT GGA TGG CCG TAC C-3′) SiRNA,Snail或pGenesil-1质粒,均为武汉晶赛生物工程技术有限公司构建,转染液(100 μL)为含1.6 μg DNA与4 μL脂质体的培养基,根据分子克隆实验指南完成转染步骤。
1.2.4 DCs相关检测
1.2.4.1 DCs胞内RelB、p38含量检测 蛋白质印迹法(Western blotting)检测DCs胞内RelB与p38含量,按照蛋白提取、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、抗原抗体反应、显影等步骤进行,AlphaEaseFC Version 4 软件分析目的条带的吸光度值。
1.2.4.2 DCs迁徙能力检测 在侵袭小室下室加入l mL rhRANTES,上下室之间放置直径12 mm的聚碳酸酯微孔膜,其上加入无血清的RPMI-1640稀释的matrigel。取DCs(约1×105)加入侵袭小室的上室中,普通环境孵育6 h,取出聚碳酸酯微孔膜,擦去未穿膜细胞及matrigel,甲醇中固定30 min,Gimsa染色后光镜下计数膜内细胞数并计算占总细胞数百分比,代表迁徙能力。每张随机选取5个视野,取平均值。
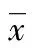
2 结 果
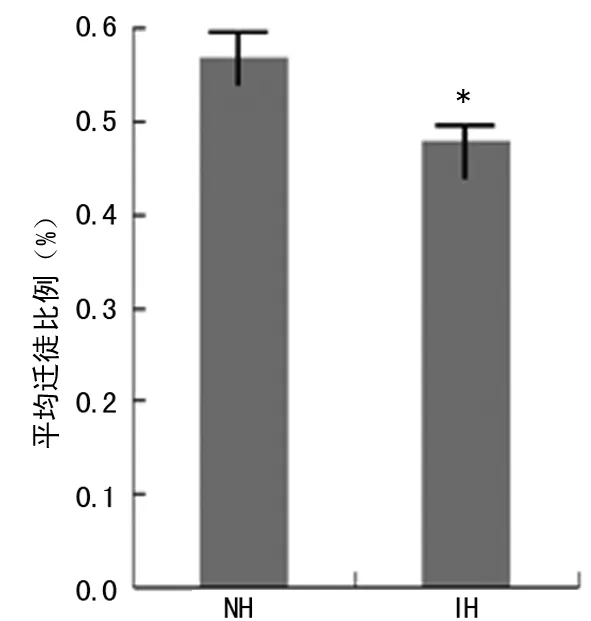
2.1 不同给氧浓度IH/ROX时间比培养后DCs的迁徙能力 表1显示不同低氧程度,IH/ROX时间比的IH环境下聚碳酸酯微孔膜中的细胞/总细胞数比例,代表DCs迁徙能力。16种IH条件下的平均迁徙比例为(0.48±0.06)%,正常对照下的比例为(0.57±0.05)%,二者相比差异有统计学意义(P<0.05),见图1。图2为各种IH条件的平均氧分压(APO2)与DCs迁徙能力的相关性分析情况,以APO2(单位:mm Hg)为自变量X,迁徙DCs比例为应变量Y,可得出回归方程Y=0.009X-0.043(r=0.867,P<0.05)。
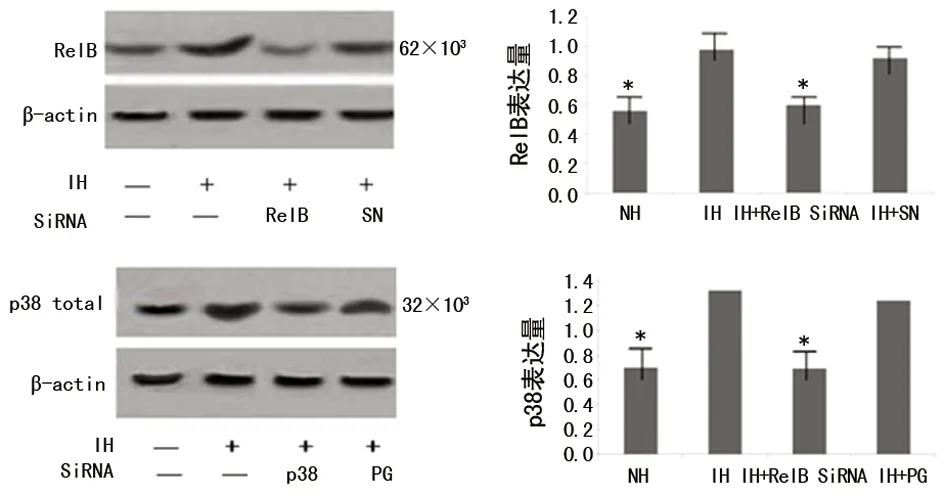
2.2 各组DCs RelB、p38的表达检测 Western blotting检测DCs胞内RelB、p38蛋白表达结果分别见图3a、b,与正常对照比较,IH(给氧浓度1.5%,HO/ROX 1∶5)可诱导RelB、p38合成(P<0.05);预先使用RelB-Snail及p38-pGenesil SiRNA可有效干扰IH下RelB、p38的合成(P<0.05)。
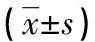
表1 不同低氧程度IH/ROX时间比条件下DCs的迁徙比例
*:P<0.05,与NH比较。
图1 IH与NH环境下DCs的平均迁徙能力

图2 IH条件下APO2与DCs迁徙能力的相关性分析
﹡,#:P<0.05,与IH环境比较。
图3 Western blotting检测各组RelB、p38的表达
2.3 DCs的迁徙能力 图4中细胞质淡染,细胞核染色较深的细胞即为聚碳酸酯微孔膜中DCs。各组DCs的迁徙比例见图5,显示较常氧培养,IH可抑制DCs迁徙 (0.45%vs.0.62%,P<0.05),RelB干扰(0.44%)或p38干扰(0.47%)对IH下DCs迁徙能力未造成明显影响。
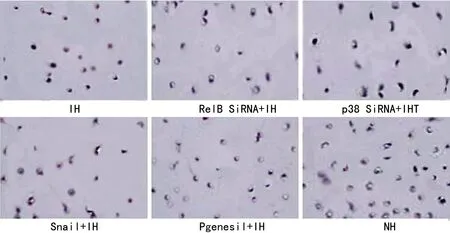
图4 微孔膜中DCs的Gimsa染色(×100)

#:P<0.05,与NH比较。
图5 DCs迁徙能力
3 讨 论
OSAS目前并不鲜见,其最重要的致病机制为IH,可导致氧化应激及炎症泛滥,是造成血管并发症的重要原因。近来有研究报道,较之常氧,体外IH环境可导致DCs成熟表型及IL-12产生增加,刺激MLR增强,提示DCs很可能是异常炎性反应的介导者;且DCs参与冠状动脉病变进展的设想亦得到了临床研究的证实[4]。最近亦有研究报道,作为DCs的活性表现形式,高脂饮食大鼠的外周血成熟树突状细胞(mDCs)分布下降,而其主动脉管壁上的mDCs比例上升,外周血mDCs可能加速迁徙入动脉壁,提示作为AS发生过程中最重要的始动因素,AS模型外周血DCs比例下降可能并非其生成减少,而是其分布异常,迁徙到血管壁的DCs数量增加[5]。从上述研究结果可以推断DCs致AS过程除了需要分化成熟及具备适当的免疫调节功能,迁徙能力同样很重要,这样DCs才能定植于血管内皮或归巢淋巴结,带来靶器官的损伤。因此,探讨IH下DCs迁徙能力的改变特征及通路机制可以更全面地揭示DCs在OSAS血管并发症中可能的作用,为干预OSAS并发症提供新的防治策略。
有关体外持续低氧情况对DCs的迁徙能力的研究已有报道,如有研究者发现持续低氧下DCs的迁徙能力明显下降,可能与低氧所导致的DCs表面基质金属蛋白酶及其组织抑制剂(MMPs/TIMPs)家族的表达失衡有关[3,6-7]。而OSAS造成的缺氧为典型的IH,与持续低氧存在本质差别,所以本研究采用IH环境模拟人类OSAS气相环境,并探讨体外该环境对DCs迁徙能力的影像特征,这在国内外还鲜有报道,是本研究的新意之处。结果提示与常氧条件比较,体外IH可导致DCs迁徙能力下降,且迁徙能力与培养环境APO2呈正相关。结合以往的报道,IH环境虽可刺激DCs的成熟并增强MLR,但下降的迁徙能力可能影响DCs致损伤能力的发挥,提示IH可能存在靶器官损伤的保护机制,以上使笔者对DCs在OSAS致血管内皮损伤中的的真实地位产生怀疑。但仔细推敲,本实验采用的是体外IH环境,与OSAS体内IH仍然存在差别。根据实验结果,IH虽可能导致DCs迁徙能力下降,但IH同时造成的炎症激活及AS病灶形成,可能又有利于趋化DCs[8-9],故有必要开展进一步研究揭示DCs在OSAS人群体内真实的迁徙能力。
前期本研究人员利用基因芯片,IH下DCs胞内明显表达上调的基因家族为核因子-κB(NF-κB)和丝裂原活化蛋白激酶(MAPK),其中,最为显著的分别为RelB和p38。本实验采用RNA干扰特异性干预IH环境下DCs RelB、p38的表达,结果示对其迁徙能力的改变无明显影响,提示IH可能通过其他通路(如MMPs/TIMPs家族)的表达来调节DCs的迁徙。但也有研究支持在特定刺激下,细胞内Toll样受体(TLRs)、NF-κBs及MAPKs的激活亦可能参与了MMPs表达的调节过程,从而影响迁徙[10-12]。本研究只选取了1种IH环境及1个观察时间点,加之使用体外环境,故对OSAS人群体内DCs迁徙能力的改变情况及具体机制还未能完全揭示。研究结果虽未能系统阐述体外IH下DCs迁徙能力的改变与OSAS血管并发症的关系,但这些遗留的问题值得在今后进一步挖掘探讨,为预防OSAS血管并发症提供全新的视角。
[1]Hu K,Yang Y,Tu Q,et al.The alteration on phenotype,function of human dendritic cells caused by intermittent hypoxia[J].Exp Ther Med,2016,121(3):96-102.
[2]胡柯,涂秋云,杨宇,等.ROS/TLR4/RelB,P38通路激活在间歇低氧致树突状细胞表型以及功能改变中的作用[J].免疫学杂志,2016,32(6):468-473.
[3]Song HB,Qu X,Yang MX,et al.Hypoxia inhibits the migratory capacity of human monocyte-derived dendrirtirc cells[J].Immunol Cell Biol,2005,83(6):668-673.
[4]李传昶,刘薇,易军,等.树突状细胞与冠状动脉严重狭窄的关系及辛伐他汀的干预作用[J].中国动脉硬化杂志,2010,18(1):57-62.
[5]傅强,李志梁,雷霄,等.急性冠状动脉综合征患者外周血树突状细胞亚群数量及比例的变化[J].中华心血管病杂志,2008,25(3):209-211.
[6]Osman M,Tortorella M,Londeri M,et al.Expressioin of matrix metalloproteinases and tissue inhibitor of metalloproteinases define the migratory characteristics of human monocyte-derived cells[J].Immunol,2002(105):73-82.
[7]Koropatnick T,Goodson MS,Heath-Heckman EA,et al.Identifying the cellular mechanisms of symbiont-induced epithelial morphogenesis in the squid-vibrio association[J].Biol Bull,2013,226(1):56-68.
[8]Sozzani S,Allavena P,Vecchi A,et al.The role of chemokines in the regulation of dendritic cell trafficking[J].J Leukoc Biol,1999(66):1-9.
[9]Schekman R.Discovery of the cellular and molecular basis of cholesterol control[J].Proc Natl Acad sci U S A 2013,110(37):14833-4836.[10]Osborne JK,Larsen JE,Shields MD,et al.NeuroD1 regulates survival and migration of neuroendocrine lung carcinomas via signaling molecules TrkB and NCAM[J].Proc Natl Acad Sci U S A,2013,110(16):6524-6529.
[11]Lee Y,Kim H,Kim KH,et al.Activation of toll-like receptor 2,3 or 5 induces matrixmetalloproteinase-1 and 9 expression with involvement of MAPKs and NF-κBs in human epidermal keratinocytes[J].Exp Dermatol,2010,19(8):e44-49.
[12]Morrell NW,Archer SL,Albert D,et al.Anticipated classes of new medications and molecular targets for pulmonary arterial hypertension[J].Pulm Circ,2013,3(1):226-244.
Study on the change of migration ability of dendritic cells induced by intermittent hypoxia and the mechanism of its pathway*
Hu Ke1,Wang Guangwei1△,Yang Yu2,Xu Guoyao1,LiYuxian1
(1.CollegeofClinicalMedicine,HunanUniversityofMedicine,Huaihua,Hunan418000,China;2.DepartmentofGeratology,theSecondXiangyaHospital,CentralSouthUniversity,Changsha,Hunan410013,China)
Objective By simulating the intermittent hypoxia(IH) environment of human obstructive sleep apnea syndrome(OSAS),to reveal the effect of IH on migratory ability of human peripheral blood derived dendritic cells(DCs),and through the intervention of RelB,p38 expression in order to explore the possible mechanism of the change of DCs migration ability induced by IH.Methods DCs were divided into RelB,p38 siRNA interfering and non interfering plasmid group before cultivation.The environment of hypoxia was created by a intermittent hypoxia cabin,among them,oxygen concentration was 0.5%,1.5%,5.0%,10.0%,hypoxia/reoxygenation time ratio was set as 1∶1,1∶3,1∶5 and 1∶9,while sustained oxygen was supplied to the contrast at a normal concentration of 21.0%.The content of RelB and p38 was tested by Western blotting after culture in vitro,migration ability of DCs was detected by invasion chamber.Results Compared with normoxia,DCs under IH tended to have declined migratory ability,which was confirmed to be correlated with the average oxygen partial pressure level under IH.IH could promote the expression of RelB and p38 in DCs,while the migratory ability of DCs was not reversed after intervening the expression of RelB and p38.Conclusion IH in vitro could cause a decline in migratory ability of DCs,which may not be induced by activation of RelB or p38 in DCs.
intermittent hypoxia;dendritic cells;migratory ability;RelB;p38
湖南省自然科学基金资助项目(SK201222032)。 作者简介:胡柯(1984-),讲师,博士,主要从事缺血性心脑血管病的临床及基础研究。△
R392.12
A
1671-8348(2016)30-4200-03
2016-04-02
2016-07-10)

