雌激素受体α、β亚型在血管瘤血管内皮细胞的表达分析*
宋晓峰,王 宁,李亚莎,周德凯,金先庆,王 佚,李晓庆
(重庆医科大学附属儿童医院胃肠外科及新生儿外科/儿童发育疾病研究教育部重点实验室/重庆儿童发育重大疾病诊治与预防国际科技合作基地/儿科学重庆市重点实验室,重庆 400014)
·论 著· doi:10.3969/j.issn.1671-8348.2016.30.007
雌激素受体α、β亚型在血管瘤血管内皮细胞的表达分析*
宋晓峰,王 宁,李亚莎,周德凯,金先庆,王 佚,李晓庆
(重庆医科大学附属儿童医院胃肠外科及新生儿外科/儿童发育疾病研究教育部重点实验室/重庆儿童发育重大疾病诊治与预防国际科技合作基地/儿科学重庆市重点实验室,重庆 400014)
目的 探讨雌激素受体亚型α(ERα)和β(ERβ)在鼠源性血管瘤内皮细胞(EOMA)上的表达及其意义。方法 通过免疫组织化学法检测ERα和ERβ在EOMA上的表达与分布,通过免疫组织化学法及实时荧光定量聚合酶链式反应(RT-PCR)研究ERα和ERβ的表达水平。结果 免疫组织化学法显示ERα、ERβ均表达在EOMA细胞的细胞质。免疫组织化学法及RT-PCR均提示ERα表达水平明显高于ERβ,差异有统计学意义(P<0.05)。结论 ERα、ERβ均表达在EOMA细胞的细胞质,ERα表达水平明显高于ERβ。
雌激素受体亚型α;雌激素受体亚型β;鼠源性血管瘤内皮细胞;体外培养;血管瘤
血管瘤是婴幼儿最常见的肿瘤,其病因及发病机制目前仍不清楚。研究发现,血管瘤的发生及生长与雌激素及其受体密切相关[1-2]。学者推测血管瘤的生长存在雌激素依赖性[3]。雌激素通过雌激素受体(estrogen receptor,ER)发挥生理效应。ER有两种亚型,即α和β亚型,两种亚型在结构上高度同源,功能却存在很大的差异,推测两者在血管瘤的发生、发展中可能发挥不同的作用。本研究拟通过免疫组织化学法及实时荧光定量聚合酶链式反应(RT-PCR)检测ER α、β亚型在血管瘤内皮细胞(EOMA)上的表达特征及分布规律。
1 材料与方法
1.1 材料 细胞株及主要试剂,细胞:EOMA细胞,购自美国典型菌种保藏中心(American Type Culture Collection,ATCC)。Dulbecco氏改良Eagle培养基/F-12(DMEM/F-12)细胞培养液购自美国Hyclone公司;胎牛血清(FBS)购自美国Invitrogen公司;兔抗小鼠ERα抗体、兔抗小鼠ERβ抗体购自北京博奥森生物技术有限公司;兔SP检测试剂盒购自北京中杉金桥生物技术公司;逆转录试剂盒购自宝生物工程(大连)有限公司;引物序列由北京六合华大科技股份有限公司合成。
1.2 方法
1.2.1 EOMA细胞培养和传代 EOMA细胞接种在含10%FBS的DMEM/F-12高糖培养基中,置于5%二氧化碳(CO2)、37 ℃、饱和湿度的培养箱中培养。常规传代培养,取对数生长期的细胞进行实验。
1.2.2 免疫组织化学检测ERα、β的表达 将用0.01%多聚赖氨酸处理的无菌盖玻片放人6孔板中,每孔加入2 mL对数生长期的EOMA单细胞悬液,细胞密度1×106/mL。细胞贴壁后换液继续培养48 h后取出细胞爬片。采用SP免疫组织化学试剂盒,卵白素-生物素-辣根过氧化物酶复合物法(ABC法)分别测定细胞α、β受体亚型表达(按照试剂盒说明书流程进行)。用二氨基联苯胺(DAB)显色,以磷酸盐缓冲液(PBS)代替一抗为阴性对照。以棕黄色着色为阳性,通过观察棕褐色染色的分布反映ERα、β的表达部位。通过图像分析系统观察各10张爬片20个视野下阳性表达的面积及平均光密度值,比较二者的表达强度。
1.2.3 RT-PCR检测ERα、β mRNA的表达 收集培养瓶对数生长期生长良好的EOMA细胞,采用Trizol提取总RNA,并溶于二乙基焦磷酸胺溶液。采用紫外分光光度仪于260、280 nm处测定RNA的浓度及纯度。扩增ERα上游引物为:5′-CAT TAT GGG GTC TGG TCC TGC G-3′,下游引物为:5′- GCC CAC TTC GTA ACA CTT GC-3′,PCR扩增片段长度为162 bp;扩增ER β上游引物为:5′-CCG ACT TCG CAA GTG TTA CG-3′,下游引物为:5′- CCC ACT GGT TCT CTT GGC TTT G-3′,PCR 扩增片段长度为139 bp;扩增β-actin上游引物为:5′-AAG ATG ACC CAG ATC ATG TTT GAG ACC-3′,下游产物为:5′-GCC AGG TCC AGA CGC AGG AT-3′,PCR 扩增产物长301 bp。根据逆转录试剂盒提供的流程合成cDNA。实时定量PCR反应为两步法,反应条件: 95 ℃预变性30 s;95 ℃变性5 s,54~60 ℃延伸/退火30 s,39个循环;65~95 ℃溶解曲线分析。
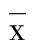
2 结 果
2.1 ERα、ERβ在EOMA细胞上的分布 见图1。
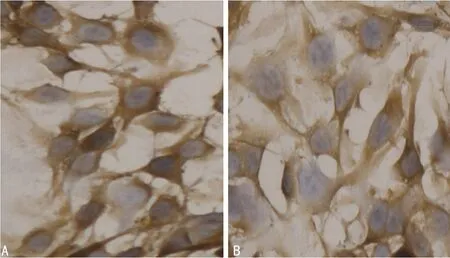
A:ERα;B: ERβ。
图1 ERα、ERβ在EOMA细胞上的表达(DAB染色,苏木精复染,×400)
2.2 免疫组织化学法检测ERα、ERβ在EOMA细胞上的表达 ERα的表达面积与表达强度均高于ERβ,差异均有统计学意义(P值分别为0.013、0.006)。见表1。
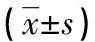
表1 ERα、ERβ在EOMA细胞上的表达面积及表达强度比较
2.3 实时荧光定量PCR检测ERα、ERβ在EOMA细胞上的表达分析 ERα的循环阈值(cycle threshold,Ct值)为(27.46±0.09),ERβ的Ct值为(33.84±0.07),ERα与ERβ的Ct值比较,差异有统计学意义(P=0.026),提示ERα起始模板拷贝数明显高于ERβ在EOMA上的表达,见图2~3。
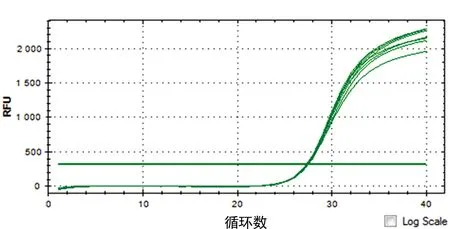
图2 ERα扩增曲线
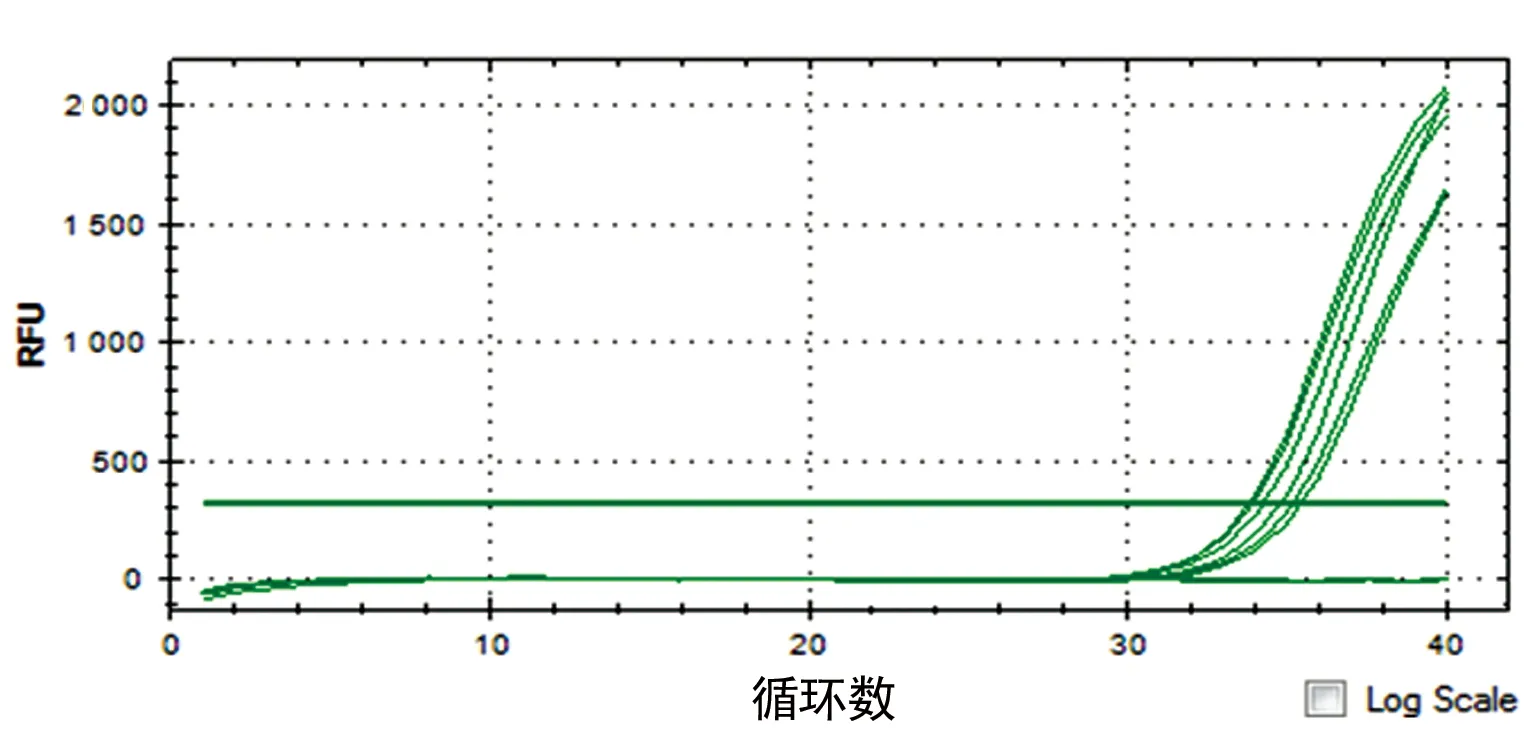
图3 ERβ扩增曲线
3 讨 论
血管瘤是婴幼儿常见疾病,部分血管瘤可出现严重的并发症,给患儿带来痛苦,并造成患儿机体功能及容貌严重毁损。血管瘤的发病原因及影响血管瘤生长的因素目前仍不清楚。学者对血管瘤进行了大量研究,发现血管瘤的发生及生长与雌激素密切相关[1-2]。临床观察发现血管瘤瘤体增生与高水平雌激素有着密切联系:妇女妊娠时发生的血管瘤,分娩后可自行缩小或消退;肝硬化患儿由于肝功能减退,灭活雌激素的能力降低而出现肝掌、蜘蛛痣;月经期增大并伴疼痛的巨大皮肤血管瘤患者行子宫卵巢切除术后肿瘤生长抑制,疼痛缓解;血管瘤患儿女性明显多于男性。本课题组前期研究也发现,血管瘤患儿血清雌二醇(E2)水平明显高于对照组[4-5]。
经典理论认为雌激素通过与其受体结合而发挥生理作用,雌激素对靶组织具有显著的促丝裂效应,当其到达靶细胞后,与细胞质内的受体结合形成复合物后再进入细胞核内,在胞核内雌激素再与核受体结合,引起ER构象变化,暴露DNA结合区,激活顺式作用元件使转录增强,蛋白质合成增多,进而影响靶细胞的代谢与功能。ER是一类由配体激活的转录因子,是核受体超家族的成员。雌激素的生理作用主要由ER的α、β两种亚型介导[6-7]。
ERα与ERβ同属核受体家族,在DNA结合区同源性达96%,在配体结合区则为53%,二者可形成同源或异源二聚体,进而形成转录复合物与雌激素反应元件结合启动转录[8]。但研究显示二者的功能并不相同,其由不同的基因编码,具有不同的cDNA和蛋白质分子结构,可导致差异性的转录应答,芯片分析揭示两种ER不但调控着不同的基因表达,而且由于它们以不同的亲和力结合相同的配基,差异性地调控同一基因的表达,从而引发不同的应答及受体信号瀑布的回应,因此通过不同的信号通路对雌激素靶器官和组织的生理、病理产生不同的影响,ERβ甚至可以抑制ERα的转录活性,二者在不同的性别、年龄及身体部位的表达都显示出明显差异[9-12]。
E2作用的靶组织分为经典和非经典两大类。经典的靶组织有子宫、乳腺、胎盘、肝脏、中枢神经系统、心血管系统、骨骼等,它们含有大量的ERα,与E2相互作用后可增强其下游基因的转录水平。非经典的靶组织包括前列腺、睾丸、卵巢、甲状腺、甲状旁腺、肾上腺、胰腺、胆囊、泌尿道、淋巴细胞和红细胞等,ERα在这些组织细胞中低表达或不表达,ERβ在这些组织中高表达。除了在组织分布方面的不同外,ERα和ERβ的转录活性及其与协同因子的相互作用也往往不同。
学者推测血管瘤发生及生长存在雌激素依赖性,但ERα和ERβ在血管瘤组织中各自的表达情况及雌激素对二者的作用机制目前尚未见文献报道。本研究通过免疫组织化学法及RT-PCR检测ERα和ERβ在EOMA细胞上的表达特征及分布规律,分析血管瘤组织中以何种亚型为优势受体亚型,在介导雌激素对血管瘤血管内皮细胞增殖中发挥主导生物学作用。通过免疫组织化学发现,ERα和ERβ均主要在细胞质表达。通过图像分析系统发现在同等数量的细胞爬片上各个视野的表达面积有明显差异,ERα阳性表达面积比ERβ明显增多(P<0.05);ERα表达强度明显高于ERβ(P<0.001)。
通过RT-PCR技术,观察ERα、ERβ的Ct值的差异。Ct值是每个反应管内的荧光信号到达设定的域值时所经历的循环数,也是荧光信号开始由本底进入指数增长阶段的拐点所对应的循环次数。模板DNA量越多,荧光达到阈值的循环数越少,即Ct值越小。Ct值与模板DNA的起始拷贝数成反比。实验发现:ERα的Ct值为(27.46±0.09),ERβ的Ct值为(33.84±0.07),ERα、ERβ间比较在Ct值上差异有统计学意义(P=0.026),ERα起始模板拷贝数明显高于ERβ在EOMA上的表达,即ERα相对高表达,ERβ相对低表达。
由此可以看出:ERα、ERβ在EOMA细胞上均有表达,ERα的表达明显高于ERβ,可能是血管瘤上皮细胞的优势ER,可能属于经典靶组织。雌激素对血管瘤血管内皮细胞的生长的调节可能通过ERα、ERβ两条路线,但雌激素信号在什么条件下激活α受体,在哪种条件下影响β受体尚未了解;由于α和β受体介导雌激素信号的路线可能不一样,具有不同的生物学作用,二者是共同介导雌激素对血管瘤上皮细胞的生长,还是相互拮抗发挥生物学效应仍需要后续的实验进一步研究。
本研究结果显示,ERα、ERβ在EOMA细胞的细胞质上均有表达,二者表达有明显差异。它们在血管瘤上皮细胞增殖中的作用机制尚待进一步研究。本研究拟进一步探索雌激素亚型在血管瘤上皮细胞增殖中的作用机制和信号通路,为血管瘤的基因或内分泌治疗提供新的靶点,为诊断及指导治疗提供依据;为这两种亚型在血管瘤生长中的不同生理作用提供新的基础资料。
[1]Oettinger-Barak O,Machtei EE,Ofer BI,et al.Pregnancy tumor occurring twice in the same individual:report of a case and hormone receptors study[J].Quintessence Int,2006,37(3):213-218.
[2]Sun ZY,Yang L,Yi CG,et al.Possibilities and potential roles of estrogen in the pathogenesis of proliferation hemangiomas formation[J].Med Hypotheses,2008,71(2):286-292.
[3]徐伟立,董春锋,牛爱国,等.血管瘤患儿雌激素升高因素及其与瘤体增生的关系[J].中华实用儿科临床杂志,2007,22(18):1430-1431.
[4]周德凯,王赞尧.婴幼儿血管瘤血清雌二醇水平的研究[J].中华小儿外科杂志,1991,12(2):71-72.
[5]周德凯,王赞尧,雷培芸.糖皮质激素治疗婴幼儿血管瘤的机理探讨[J].重庆医学,1996,25(4):198-199.
[6] 张智,王庭槐.雌激素作用分子机制研究进展[J].中国病理生理杂志,2003,19(10):1422-1426.
[7]Beato M,Klug J.Steroid hormone receptors:an update[J].Hum Reprod Update,2000,6(3):225-236.
[8]Muramatsu M,Inoue S.Estrogen receptor:how do they control reproductive and nonreproductive functions[J].Biochem Biophys Res Commun,2000,270(1):1-10.
[9]Hartman J,Edvardsson K,Lindberg K,et al.Tumor repressive functions of estrogen receptor beta in SW480 colon cancer cells[J].Cancer Res,2009,69(15):6100-6106.
[10]Lin CY,Ström A,Li Kong S,et al.Inhibitory effects of estrogen receptor beta on specific hormone-responsive gene expression and association with disease outcome in primary breast cancer[J].Breast Cancer Res,2007,9(2):R25.
[11]Li XF,Wang SJ,Jiang LS,et al.Gender-and region-specific variations of estrogen receptor α and β expression in the growth plate of spine and limb during development and adulthood[J].Histochem Cell Biol,2012,137(1):79-95.
[12]Lee YR,Park J,Yu HN,et al.Up-regulation of PI3K/Akt signaling by 17beta-estradiol through activation of estrogen receptor-alpha,but not estrogen receptor-beta,and stimalates cell growth in breast cancer cells [J].Biochem Biophys Res commun,2005,336(4):1221-1226.
The expression and distribution of estrogen receptor subtypes α and β in hemangioma endothelial cells﹡
Song Xiaofeng,Wang Ning,Li Yasha,Zhou Dekai,Jin Xianqing,Wang Yi,Li Xiaoqing
(DepartmentofGastrointestinalandNeonatalSurgery,theChildren′sHospitalAffiliatedtoChongqingMedicalUniversity/MinistryofEducationKeyLaboratoryofChildDevelopmentandDisorders/ChongqingInternationalScienceandTechnologyCooperationCenterforChildDevelopmentandDisorders/KeyLaboratoryofPediatricsinChongqing,Chongqing400014,China)
Objective To investigate the expression and distribution of estrogen receptor(ER) subtypes α,β in murine endothelial (EOMA) cells and to assess the significance of ERα,β in EOMA cells.Methods Expression and distribution of ERα,β in EOMA cells in vitro were detected by using immunohistochemistry.The expression level of ERα,β in EOMA cells were quantitatively evaluated by immunohistochemistry and real-time fluorescence quantitative (RT-PCR).Results Immunohistochemistry showed that ERα and ERβ were expressed in the cytoplasm of EOMA cells.The expression levels of ERα detected by using immunohistochemistry and RT-PCR method both were significantly higher than those of ERβ(P<0.05).Conclusion ERα and ERβ are expressed in the cytoplasm of EOMA cells,and expression level of ERα is significantly higher than that of ERβ.
estrogen receptor α;estrogen receptor β;murine endothelial cells;in vitro culture;hemangioma
国家临床重点专科建设项目(国卫办医函[2013]544);重庆市自然科学基金资助项目(cstc2011jjA10087);重庆市卫生局基金资助项目(2011-2-252);重庆市教委科学技术研究资助项目(KJ120308)。 作者简介:宋晓峰(1970-),副主任医师,博士,主要从事血管瘤发病机制及治疗研究。
R726.5
A
1671-8348(2016)30-4197-03
2016-03-20
2016-06-28)

