浅谈国外“Suzuki-Miyaura金属偶联反应”的教学设计思路
李 田 马锴果 高 珍 李维红
(北京大学化学与分子工程学院,基础实验教学中心,北京100871)
·国外化学教育·
浅谈国外“Suzuki-Miyaura金属偶联反应”的教学设计思路
李田马锴果高珍李维红*
(北京大学化学与分子工程学院,基础实验教学中心,北京100871)
Suzuki-Miyaura金属偶联反应是在零价钯配合物的催化下,芳基硼酸或硼酸酯与卤代芳烃发生交叉偶联的过程。该反应具有很强的底物适应性和官能团容忍性,广泛应用于众多天然产物与有机材料的合成。鉴于反应的重要性,近年来国外高校逐渐尝试将Suzuki-Miyaura反应引入到本科生的有机实验教学中。本文针对2000年后Journal of Chemical Education期刊中涉及的Suzuki-Miyaura反应,分别从反应条件、后处理和表征方法、实验拓展等多个方面进行了比较和归纳,并对其设计理念和教学特色进行了综述。
Suzuki-Miyaura金属偶联反应;教学实验设计
www.dxhx.pku.edu.cn
1 Suzuki-Miyaura金属偶联反应的背景介绍
有机化学的魅力在于科学家可以扮演“上帝之手”,独具匠心地创造分子世界。有机大分子由于其复杂的结构和独特的功能,一直是有机合成领域的热点和难点。大分子的合成依赖于大量C―C键的构筑,然而碳键的稳定性为此带来很大的困难,如何有效地激活碳原子是重构C―C键的关键。1912年格氏反应的发现是该领域的第一个里程碑,金属的插入为研究者提供了全新的思路。然而此反应条件剧烈、需要等物质的量的金属试剂,同时官能团容忍性较差。随后出现的钯催化的交叉偶联反应解决了这一问题。通过极少量的钯催化剂的使用形成碳钯键,使原本惰性的碳原子变得活泼,使反应更容易发生,并且反应条件更温和、底物官能团容忍性更好,甚至可以将原本合成中的多步反应简化为一步反应。该研究为化学家们提供了一款精巧的工具来合成复杂的有机分子,并广泛应用于制药、电子工业和先进材料等领域[1-3]。2010年10月6日,瑞典皇家科学院宣布将2010年诺贝尔化学奖授予美国科学家Richard F.Heck,以及日本科学家Ei-ichi Negishi和Akira Suzuki,以表彰三位科学家在钯催化交叉偶联反应方面的卓越研究[4-6]。图1是获奖的三位科学家。

图1 2010年诺贝尔化学奖获奖者
在一系列钯催化的偶联反应中,以Suzuki-Miyaura反应条件最温和,反应最低毒,且应用最广泛。Suzuki-Miyaura反应最初于1979年由日本北海道大学的Suzuki教授[7]发现并提出。反应是在零价钯配合物的催化下,芳基(烯基)硼试剂与卤代芳烃(烯烃)发生交叉偶联反应,从而实现C(sp2)―C(sp2)单键的连接。反应依次经历氧化加成、转移金属化、还原消除三个过程。首先Pd(0)插入到卤代芳烃中生成Pd(II)络合物,使原本碳卤键中较为亲电的碳原子通过碳钯键的形成而具有亲核性,从而大大提高反应活性;随后在碱的作用下,氧化加成得到的碳钯键与另一分子中的碳硼键进行转金属反应,将硼上的基团转移到金属钯上;最后通过还原消除的方式形成新的碳碳键,获得的Pd(0)催化剂可继续启动下一次循环。图2为反应的示例图和机理图。
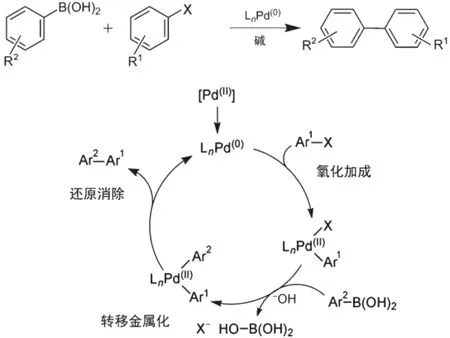
图2 Suzuki-Miyaura反应的示意图和机理图
鉴于金属催化偶联反应在科研中日益发挥重要的作用,把相关内容引入本科生的有机实验教学,将有助于丰富学生的知识体系,帮助其了解最前沿的科学研究,并为学生后续开展科研工作打下扎实的基础。目前实验教学中金属参与的实验通常只涉及传统的格氏反应,如何将最新的钯催化的金属偶联反应,尤其是适合为本科生开设的Suzuki-Miyaura反应引入实验教学,值得我们认真思考。本文对2000年后发表在美国化学会Journal of Chemical Education杂志上的9篇相关文献进行了综述,以期抛砖引玉,对今后的实验设计有所指导。
2 国外Suzuki-Miyaura金属偶联反应的教学设计思路
观察9篇文献的发表年份我们发现,2000年后,关于Suzuki-Miyaura反应的教学设计逐年增多,已引起大家的足够重视。实验内容在设计上体现出以下特点:(1)注重知识的整合和传递。实验不仅着眼于训练学生在金属催化偶联反应方面的操作技能,更着力于拓宽学生的知识视野,授课中以点带面,让学生对金属有机化学形成较为全面的认识和体会。(2)紧随科研进展,加强教学与科研的衔接。自1979年Suzuki-Miyaura反应被发现以来,研究者已从多个方面对反应进行了优化,包括尝试以氯代芳烃作为反应底物[8];开发含氮配体或无配体类催化剂[9];开发金属镍催化剂[10];采用水或离子液体作为反应介质[11];采用现代的微波法提供热源[12]等。文献表明,教学设计已不断地将以上进展融入其中,实现了该领域教学实验与科学研究的与时俱进。(3)强调环保理念,重视绿色化学。以下我们将从反应条件、后处理和表征方法、实验拓展三个方面对9篇教学实验进行更加详细的分析和总结,相关的条件与数据列于表1中(为便于说明,我们采用字母对文献进行了编号)。
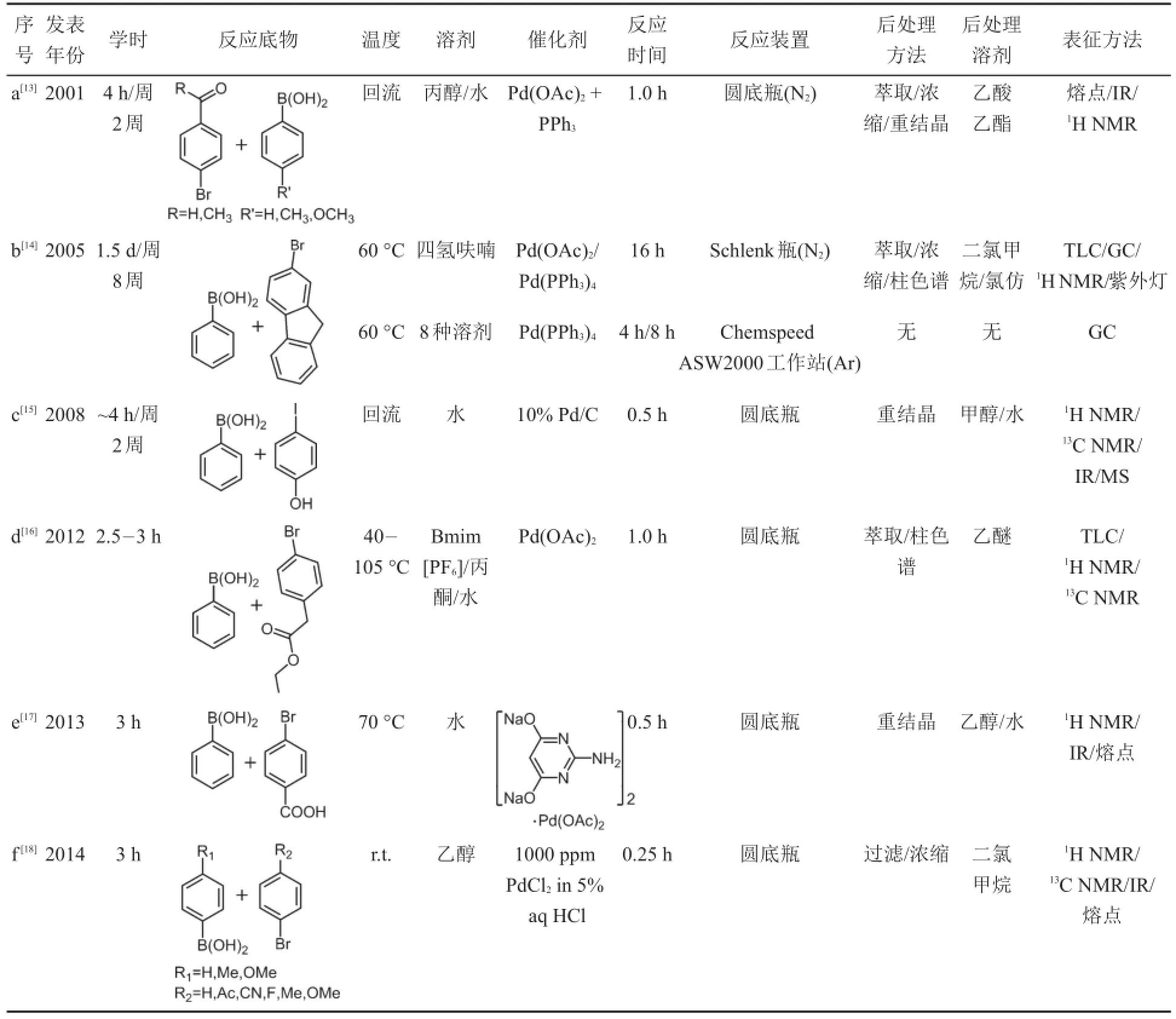
表1 Suzuki-Miyaura金属偶联反应在实验教学中的应用举例
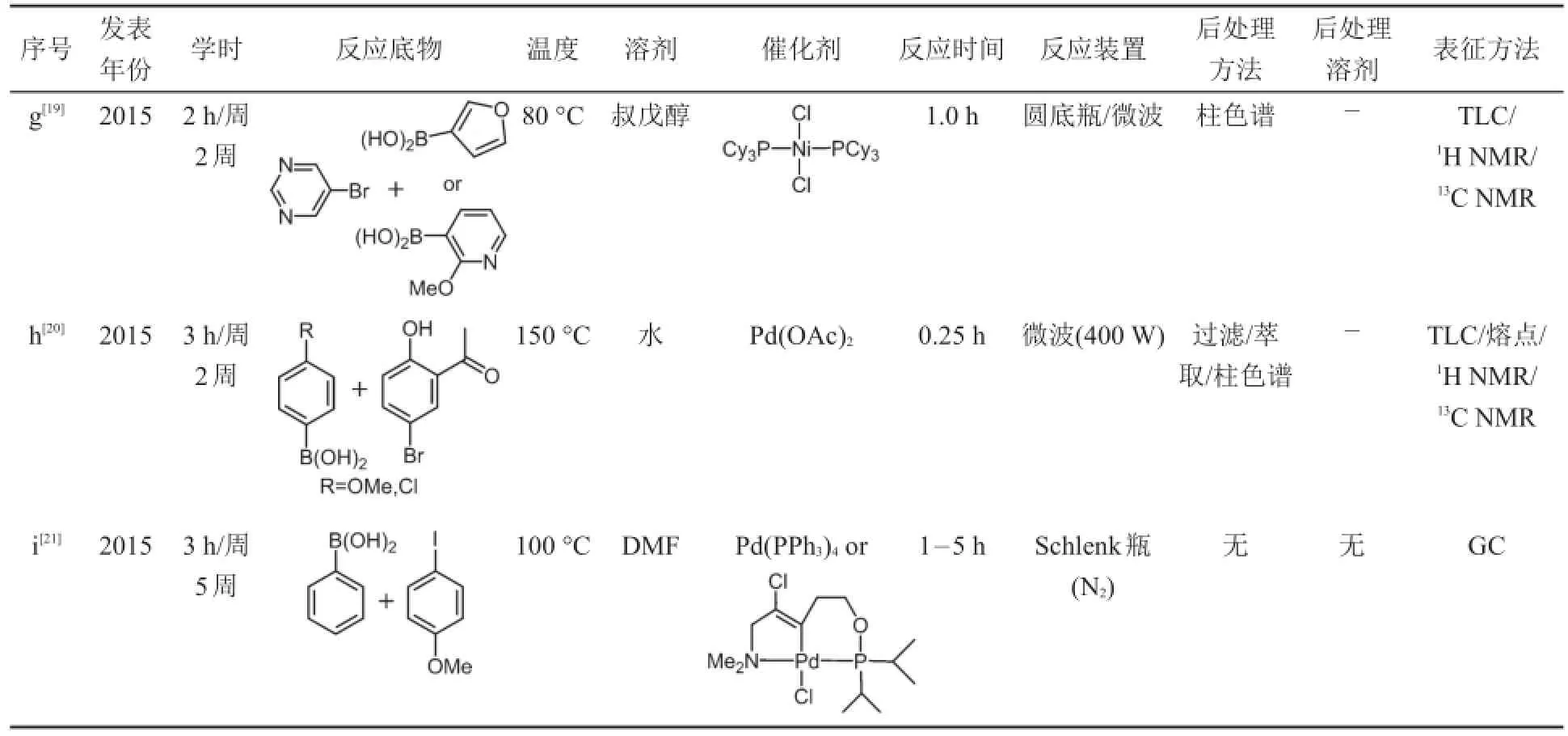
表1 Suzuki-Miyaura金属偶联反应在实验教学中的应用举例(续)
2.1反应条件的选择
反应条件包括底物、溶剂、催化剂、温度、反应时间和实验装置几个方面。教学实验需要确保安全低毒,并在限定的学时内完成。因此,实验中底物通常选取结构典型、活性较高的化合物,以此保证实验在较低的温度和较短的时间内完成。观察表1的实验数据我们发现,教学学时基本都控制在3 h/周,反应温度除文献c、h和i外,其余均不高于80°C。此外,为了突出教学重点,实验中尽量选择结构简单、取代较少的反应物,以避免后处理和讨论中出现过度复杂、难以分析的情况。9篇文献中,碘苯、溴苯和苯硼酸作为高频出现的反应底物,仅取代少量稳定的甲基和甲氧基官能团即是例证。在反应溶剂的选取上,一方面传统的Suzuki-Miyaura反应通常以THF/DMF等极性有机溶剂作为反应介质,因其对底物具有很好的溶解度和一定的活化度,对提高反应产率有所裨益。而另一方面,有机溶剂的高毒、高污染性也促使大家以水和离子液体作为反应介质,从而使反应迈向绿色化和清洁化。纵观表1的溶剂类型,两种思路均有体现。文献b和i选用传统的THF和DMF作溶剂,而文献c、d、e和h中,作者则选择了水和离子液体,其余文献则多数选择介于二者之间的醇为溶剂,兼顾反应活性和绿色特性。
催化剂的选择结合最新的科研进展,从经典的含膦配体,到最新的含氮配体、无配体类钯催化剂,以及镍催化剂均有涉及。文献a和b选择科研中最为常用的Pd(PPh3)4,或Pd(OAc)2外加PPh3配体,有利于学生学习经典的反应条件。文献c、d、f和h选择无配体类催化剂,目的在于避免膦配体有毒且对空气不稳定的缺点,并简化反应装置。文献e和i采用含氮配体,在降低配体毒性的同时,可提高催化剂的溶解度和催化活性;文献g则从结构稳定、价格低廉的角度出发,以金属镍催化剂代替金属钯催化剂。
基于不同的催化剂类型,相应有不同的反应装置。对于无配体、含氮配体类钯催化剂和镍催化剂,其在空气中较稳定,因此反应装置较常规,通常在圆底瓶中进行即可;而对于含膦配体的钯催化剂,由于膦配体对空气敏感,因此对反应装置有一定要求。文献a采用圆底瓶外加氮气球的方法将体系与空气隔离,该方法实验装置简单,常规的教学实验室均可满足条件,但仅适用于高活性高产率的快速反应。文献b则引入了科研中通用的Schleck技术,采用Schleck瓶,并配合双排管、油泵和氮气钢瓶,可以严格地创造体系的惰性气氛。该方法虽然操作流程较为复杂,但对于严格的无氧反应十分适用。比Schleck瓶更为高级和昂贵的装置,文献b也予以采用,文献中,主讲教师引入了先进的全自动工作站,该工作站可以同步进行16个对照实验,反应结果直接进入工作站自备的气相色谱(GC)进行分析,在确保无氧条件的同时,可以短时间实现对最优实验条件的筛选。具体的装置如图3所示。与其他教师希望简化装置、尽量适应于基础实验室的资源配置不同,文献b中,作者希望将学术界和工业界中最先进的仪器予以介绍,以帮助学生更好地融入今后的科研工作。与上述传统的加热方式不同,文献h另辟蹊径,将近年来新兴的微波法引入实验教学,以帮助学生了解区别于传统的电热套和电磁搅拌器的全新能量供给来源。

图3 Suzuki-Miyaura教学实验的反应装置[14]
2.2后处理和表征方法的选择
区别于9篇文献在反应条件方面的各具特色,后处理过程基本大同小异,均采用了基础有机实验中的常规方法。例如文献a、d和f配合以常规的有机溶剂,以萃取、浓缩和柱色谱的方法对产物进行了分离。文献c和e在经典操作的基础上,引入绿色化学的理念,以重结晶作为纯化手段,并以无毒或低毒的水和醇代替有机溶剂,为学生提供更加安全的实验环境。文献b和i相对较为特殊,没有经过后处理过程而直接将产物的粗品进行GC分析,直接对反应产率进行了核算。
产物的结构表征同样采用基础有机实验中的常用方法。以薄层色谱法对反应进程和产物纯度进行监测,配合熔点仪、红外光谱、核磁氢谱和碳谱对产物的结构和纯度做进一步分析。个别反应以GC作为表征手段。采用常规方法进行表征的优势在于方便在兄弟高校中推广和应用。
2.3实验内容的拓展
在学时允许的条件下,教师也尽可能地丰富实验内容,以帮助学生串联更多的知识点,对相关领域有更加全面深入的理解。本文中,有4篇文献将“有机方法学”引入了实验教学,例如文献b选用了8种不同的溶剂和不同的反应时间,并比较了它们的产率;文献d中,作者通过改变溶剂体系,让学生比较水、丙酮和离子液体对产率的影响;文献i则对催化剂和反应时间进行了变化,引导学生分析dupont′s配体相较于膦配体的优势,并了解反应时间对产率的影响,具体条件如图4所示。类似的设计有助于引导学生理解反应的发展历程,对于培养学生的科研思维大有裨益。需要指出的是,考虑到教学学时的限制,在实际教学中,每位学生只负责其中一组实验条件的摸索,实验结束后学生将所有结果和数据汇总,并在讨论环节集体分析。该设计思路不仅保证了学生实验的独立性和探索性,而且提高了整体的实验效率,值得借鉴和推广。
在结构表征的环节,区别于其他文献仅采用薄层色谱和核磁共振等传统方法,文献b增加了荧光表征技术(图5(1))。底物设计上,作者引入了稠环芳香化合物溴代芴,随着反应的进行,体系中逐渐生成芳香大π共轭产物,当用紫外灯对反应瓶进行照射时,即可观察到蓝色荧光从无到有,且亮度不断增强。该设计不仅增加了实验的丰富性和趣味性,而且可以在后续的讨论中延伸出光谱的相关知识,有利于完善学生的知识体系。
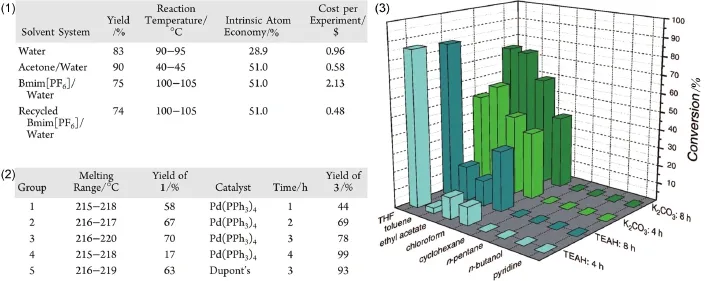
图4 Suzuki-Miyaura反应教学实验中的条件优化[14,16,21]

图5 Suzuki-Miyaura反应的荧光表征和理论计算[14,18]
如果说大部分文献着重于实验设计和开展的阶段,那么文献f则走得更远。作者将Gaussian计算引入到实验教学(图5(2)),理论计算与实验论证巧妙结合,在拓展学生技能的同时,加深了学生对于实验现象的理解,并对理论化学的进展有所了解。教师指导学生采用密度泛函理论(DFT)对不同卤素取代的碳卤键的键能进行了计算,并引导学生分析了Suzuki-Miyaura反应中卤素取代基反应活性差别的根源所在;而对于学生“联苯是平的”这一错误的思维定势,教师同样引导学生进行了理论计算,通过结构优化得到了联苯的扭曲构象,给予了学生强烈直观的认知冲击。实验结果与理论计算相互结合,是目前科研中常用的研究思路,然而在教学实验中并不多见。文献f进行的设计是很好的尝试,值得我们借鉴。
3 总结与展望
Suzuki-Miyaura反应作为构筑C(sp2)―C(sp2)单键的精巧手段,自1979年发现以来,以其良好的底物兼容性、温和的反应条件和高效的反应性能,在药物和材料合成等领域发挥着重要的作用。为了更好地衔接实验教学与学生今后的科研工作,在基础有机实验室引入Suzuki-Miyaura反应具有一定的现实意义。本文综述了2000年后发表在Journal of Chemical Education杂志上的9篇相关文献,从反应条件、后处理和表征方法、实验拓展三个方面对其实验内容和设计思路进行了详细的讨论和总结。实验设计以经典的Suzuki-Miyaura反应为核心,以点带面,使学生紧随科学研究的前沿,形成了完整的知识脉络,深入理解了过渡金属催化的交叉偶联反应的背景、机理和应用,掌握了无氧反应的一系列操作流程,并具备了一定的绿色化学的理念和科学研究的思路。以上经验和思路对于我们今后的实验设计具有一定的参考和指导意义。
[1]Nicolaou,K.C.;Ramanjulu,J.M.;Natarajan,S.;Bräse,S.;Rübsam,F.Chem.Commun.1997,No.20,1899.
[2]Huo,L.;Hou,J.;Zhang,S.;Chen,H.;Yang,Y.Angew.Chem.Int.Edit.2010,49,1542.
[3]黄春辉,李富友,黄维.有机电致发光材料与器件导论.上海:复旦大学出版社,2005.
[4]陈垚,赖文勇,解令海,黄维.科学通报,2011,56(13),995.
[5]张韶光,张文雄.大学化学,2010,25(6),1.
[6]肖唐鑫,刘立,强琚莉,王乐勇.自然杂志,2010,32(6),332.
[7]Miyaura,N.;Yamada,K.;Suzuki,A.Tetrahedron Lett.1979,20(36),3437.
[8]Saito,S.;Sakai,M.;Miyaura,N.Tetrahedron Lett.1996,37(17),2993.
[9]Littke,A.F.;Fu,G.C.Angew.Chem.Int.Edit.2002,41,4176.
[10]杨柳波,王利民,刘炼,潘笑娟.化工进展,2007,26(5),615.
[11]刘宁,刘春,金子林.有机化学,2012,32,860.
[12]Larhed,M.;Hallberg,A.J.J.Org.Chem.1996,61,9582.
[13]Callam,C.S.;Lowary,T.L.J.Chem.Educ.2001,78,947.
[14]Hoogenboom,R.;Meier,M.A.;Schubert,U.S.J.Chem.Educ.2005,82,1693.
[15]Aktoudianakis,E.;Chan,E.;Edward,A.R.;Jarosz,I.;Lee,V.;Mui,L.;Thatipamala,S.;Dicks,A.P.J.Chem.Educ.2008,85,555.
[16]Costa,N.E.;Pelotte,A.L.;Simard,J.M.;Syvinski,C.A.;Deveau,A.M.J.Chem.Educ.2012,89,1064.
[17]Hamilton,A.E.;Buxton,A.M.;Peeples,C.J.;Chalker,J.M.J.Chem.Educ.2013,90,1509.
[18]Hill,N.J.;Bowman,M.D.;Esselman,B.J.;Byron,S.D.;Kreitinger,J.;Leadbeater,N.E.J.Chem.Educ.2014,91,1054.
[19]Hie,L.;Chang,J.J.;Garg,N.K.J.Chem.Educ.2015,92,571.
[20]Soares,P.;Fernandes,C.;Chavarria,D.;Borges,F.J.Chem.Educ.2015,92,575.
[21]Oliveira,D.G.M.;Rosa,C.H.;Vargas,B.P.;Rosa,D.S.;Silveira,M.V.;Moura,N.F.D.;Rosa,G.R.J.Chem.Educ.2015,92,1217.
A Brief lntroduction to Suzuki-Miyaura Coupling Reaction in Organic Lab Abroad
LI TianMAKai-GuoGAO ZhenLI Wei-Hong*
(Experimental Chemistry Center,College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P.R.China)
Suzuki-Miyaura reaction is a coupling process of aryl boric acid(boron ester)and aryl halide that catalyzed by palladium(0).The reaction shows well tolerance for various functional groups and is wildly applied in syntheses of natural products and organic materials.Recently,colleges abroad tried to introduce this reaction into the undergraduate organic lab.This paper collected the literatures in Journal of Chemical Education about the Suzuki-Miyaura reaction since 2000 and gave an overview.
Suzuki-Miyaura coupling reaction;Experimental design
G64;O6-3
10.3866/PKU.DXHX201602011
,Email:litian@pku.edu.cn

