基本化学反应形式的系统分类
黄华奇 陈福盛 黄荣彬,*
(1厦门大学化学化工学院,福建厦门361005;2龙海第五中学,福建漳州363000)
·师生笔谈·
基本化学反应形式的系统分类
黄华奇1陈福盛2黄荣彬1,*
(1厦门大学化学化工学院,福建厦门361005;2龙海第五中学,福建漳州363000)
现行教材的化学反应分类以繁多的化学反应事实为对象,缺乏系统性。本文以基本化学反应形式为对象对反应进行系统分类,并且用多置换反应取代现行中文教材所称的复分解反应,而把复分解反应一词用于指称新增的一类基本反应形式,即复杂分解反应。对基本化学反应形式进行系统分类有助于发现新的反应。
化学反应;系统分类;多置换反应;复杂分解反应
www.dxhx.pku.edu.cn
1 引言
化学是在分子层次上研究物质的组成、性质、结构与变化规律的科学;在分子层次进行的物质变化涉及化学反应。认识化学反应是化学教育的基本内容。分子由原子组成,原子不灭、质量守恒。化学反应是反应物分子中原子的结合与分离、反应物成分交换的过程,这个过程还涉及有无伴随电子转移等特征。所有的化学反应构成化学反应概念的外延,根据化学反应的特征进行系统分类,是明确化学反应概念的重要思维方法。
长期以来,国内化学教学方面对化学反应的介绍,先是初中阶段介绍了化合反应、分解反应、置换反应和复分解反应,然后到高中阶段,增加了氧化还原反应。然而,氧化还原反应不能与上述4种反应并列。
现行化学教材对化学反应的分类,以繁杂的化学反应事实(内容)为对象,缺乏系统性。例如,没有对化合反应进一步细分;用复分解反应指称double replacement reaction(双置换反应);认为双置换反应都是非氧化还原反应,忽略了氧化还原的双置换反应;缺了由多种反应物参与的一类复杂分解反应。本文根据概念划分的原则,对基本化学反应形式进行系统的分类,用“二分法”把所有反应划分为氧化还原反应和非氧化还原反应,再把化合反应、分解反应、置换反应进行二分,增设多置换反应一词,不仅仅限于双置换反应,把复杂分解反应一词用于指称新增的一类基本反应形式。正确的、合乎规则的系统分类有助于全面认识化学反应,防止出现盲点又有助于找出空白点,有利于明晰概念;概念明晰则有利于发现新的反应,促进创新。
2 现行化学教材化学反应的分类及其不足
目前国内通行的基础化学教材[1,2]以化学反应事实为对象进行分类,把化学反应分为:
①化合反应:两种或两种以上的物质生成另一种物质的反应。
A+B+…=C
②分解反应:一种物质生成两种或两种以上其他物质的反应。
A=B+C+…
③置换反应:一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。
A+BC=AC+B
④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。
AB+CD=AD+CB
复分解反应前后各元素和原子团的化合价都保持不变。
⑤氧化还原反应。
这样的分类存在一些不足。
首先,前两个定义使用了“物质”一词,而后两个定义使用的是“单质”和“化合物”,这就易于造成混淆。虽然这里的物质容易理解为化学物质,但化学物质除了纯净物还有混合物。单质和化合物是纯净物的全部,化学反应应该明确是在纯净物之间进行,也就是,单质与单质,单质与化合物,化合物与化合物之间进行。
其次,前两个定义没有对反应物和生成物进行必要的特征限制,例如,对化合反应的特征应该限定从小到大,或者从简单到复杂;对分解反应应该限定从大到小,或者从复杂到简单。
再次,这里定义的分解反应,实际上只是简单的分解反应,没有考虑到复杂的分解反应,即多个反应物之间发生的分解反应。在此情形下,多个反应物参与是发生分解反应的必要条件,如果没有多个反应物参与,那么这个分解反应不会发生,所以这是一类反应,属于分解反应。而化合反应也可以存在生成多个生成物的复杂化合反应情形。
最后,关于置换反应,顾名思义,就是反应物之间交换成分的反应,这里的成分指的是单质原子,或者构成反应物和产物的原子团、离子等。这里定义的置换反应仅限定在单质和化合物之间进行,是不够全面的,只概括了单置换反应。实际上,置换反应可以发生在两种或多种化合物之间的多成分交换,是为多置换反应。可是,这类反应被不恰当地用复分解反应来指称,复分解反应是分解反应,不是置换反应。如果把双置换反应称为复分解反应,而由于其中也存在化合反应,是不是也可以称为复化合反应?现有分类也忽略了氧化还原的多置换反应。
需要特别指出的是,氧化还原反应与前4类反应并不是并列关系,而是包含或包含于的关系,氧化还原反应和非氧化还原反应都包含这4类反应,或者这4类反应都可以相应地分为氧化还原的和非氧化还原的反应,把“复分解反应”限定于非氧化还原反应缺乏理论支撑,会形成全面认识的盲点。
国外的基础化学教材[3-5]也没有对化学反应进行系统的分类。有的教材[4]把化学反应分为5类,即:燃烧反应、化合反应、分解反应、单置换反应和双置换反应。虽然用双置换反应取代了复分解反应,但是单置换反应和双置换反应不是矛盾关系,不能包括所有的置换反应。把燃烧反应独立出来与化合反应并列并不恰当,因为有的燃烧反应是化合反应,它们不是相异关系不能并列,教材也没有处理氧化还原反应与这些反应的关系,缺乏系统性。国外教材不再延用“double decomposition reaction”(译为“复分解反应”),而用“double replacement reaction”即双置换反应,“metathesis reaction”则指称非氧化还原的双置换反应[3]。
3 化学反应形式的分类
3.1分类的原则
化学以分子为研究层次,分子由原子组成。化学变化过程原子不灭、质量守恒。化学反应是相关反应物分子中原子的结合与分离以及成分交换的变化过程,而且,化学反应还有电子转移(元素原子化合价或氧化数变化)和没有电子转移(元素原子化合价或氧化数不变)之分,这是化学反应的基本属性。根据这些属性,我们对化学反应形式进行系统的分类。首先以反应是否伴随电子转移为特征用“二分法”把所有化学反应划分为氧化还原反应和非氧化还原反应。而后,把所有以原子之间的结合为主由小变大或由简单变复杂的反应划分为化合反应并进一步细分为简单和复杂;以原子之间的分离为主由大变小或由复杂变简单的划分为分解反应并进一步细分为简单和复杂;以成分交换为特征的划分为置换反应并进一步细分为单置换和多置换。还可以根据其他特征继续进行划分。所有的化学反应都可以分解为基本化学反应的组合。
概念外延的划分是明确概念外延的思维方法。化学反应的分类属于概念外延的划分。进行划分需要遵守逻辑学关于划分的规则[6],这些规则是:
①各子项外延之和必须等于母项的外延。
②每次划分必须使用同一划分标准。
③每次划分各子项外延应互不相容。
④划分应该逐级进行。
化学反应划分以后形成的基本化学反应类型要互为并列关系(相异关系),例如,分解反应不是化合反应,复分解反应是分解反应(子类的成员是大类的成员,这是公理),不是置换反应。
3.2基本化学反应形式的系统分类和示例
这里所说的化学反应形式指以单质或化合物为参与单位且以其书写的化学反应方程式所表达的反应形式,化学事实上相同但书写不同的反应方程式可以被归入不同的反应形式,例如:
NaHCO3+HCl=NaCl+CO2+H2O
是一种反应形式,如果写成如下形式:
NaHCO3+HCl=NaCl+H2CO3
则可以被归入不同的反应形式。
而基本化学反应形式指所书写的反应方程式不包含其他的反应方程式,也就是说,它不可以被分解为两个或两个以上其他反应式的相加。
本文以基本化学反应形式为对象,以反应物和生成物的形式特征为标准进行系统分类,遵守化学理论规则,例如认为H2CO3分子式符合化学规则,是一种化合物,不断定它不存在。努力把繁多的实验事实纳入系统分类体系。根据系统分类,理论上可以预测一些新反应的例子,促进新发现,化学教学要克服“举不出例子的就是不存在的”思维模式。
①化合反应:两种或两种以上单质或化合物生成一种或多种复杂化合物的反应。可分为简单化合反应和复杂化合反应。
(a)简单化合反应:两种或两种以上单质或化合物生成一种复杂化合物的反应。反应形式表示如下:
A+B+…=C
这里的反应物A和B是小的或者简单的纯净物,生成物C是大的或者复杂的化合物。化合反应的基本特征是从小变大、从简单变复杂。例如:
H2+Cl2=2HCl
虽然上例的反应物和生成物都是双原子分子,但是单质是小的、简单的,化合物是复杂的,符合由简单变复杂的特征,归为化合反应,但只生成一种复杂的化合物,是简单化合反应。
(b)复杂化合反应:两种或两种以上单质或化合物生成一种或以上复杂化合物的反应。用反应形式表示如下:
A+B+…=C+D+…
这里的反应物A和B至少有一种是小的或者简单的纯净物,生成物中至少有一种是大的或者复杂的化合物。化合反应的基本特征是从小变大、从简单变复杂。例如:
CH4+2O2=CO2+2H2O
反应物和生成物在大小和复杂差异程度不显著的情况下,以有单质反应物作为判断化合反应的标准。化合反应也有氧化还原的和非氧化还原的反应之分。
②分解反应:由大的或复杂的化合物生成小的或简单的纯净物的反应。按照参与分解反应的反应物种数量划分为简单分解反应和复杂分解反应。
(a)简单分解反应:由一种大的或复杂的化合物生成小的或者简单的纯净物的反应,用反应形式表示如下:
A=B+C+…
这里的A代表大的或者复杂的化合物,B和C代表小的或简单的纯净物,之所以说是纯净物,是因为产物可能是单质,也可能是化合物。例如:
CaCO3=CaO+CO2
2KClO3=2KCl+3O2
前者属于非氧化还原反应,后者属于氧化还原反应。
(b)复杂分解反应:即多种化合物之间发生的分解反应。在此情形下,多个化合物参与是发生分解反应的必要条件,所以,它是一类反应。用反应形式表示如下:
A+B+…=C+D+…
这里的A和B代表大的或者复杂的化合物,C和D代表小的或简单的纯净物。例如:
NaHCO3+HCl=NaCl+CO2+H2O
2KMnO4+3H2C2O4=2MnO2+K2CO3+3H2O+5CO2
前者是非氧化还原的复杂分解反应例子,后者是氧化还原的复杂分解反应。如果这类反应中有一个是大的或者复杂的生成物,显示出化合的特征,则以化合为划分标准,把它归为复杂化合反应。
前面提到的燃烧反应[5]是一个比较笼统的说法,是有单质氧参与的伴随发光发热的剧烈氧化反应,在大类上属于氧化还原反应。但是,有氧参与的氧化反应还有不伴随发光发热的、缓和的非燃烧反应。即使是燃烧反应还有燃烧物是小的、简单的物种参与的化合反应,也有燃烧物是大的、复杂的物种参与的分解反应。化学反应的系统划分能够清晰全面地认识化学反应。本文不可能对所有的化学反应进行完整的分类阐述,只是介绍系统划分的方法和规则。
③置换反应:反应物之间通过交换成分生成产物的化学反应。置换反应的特征是交换成分,这里的成分是原子、原子团、离子,下文的英语字母有的用于表示成分。根据交换成分的数目,可将置换反应划分为单置换反应和多置换反应。
(a)单置换反应:一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,用反应形式表示如下:
A+B-C=A-C+B
金属与金属盐的反应,金属与酸的反应,金属与碱的反应等是其典型例子。所有单置换反应涉及单质变成化合物,一定有电子转移发生,都是氧化还原反应。例如:
Zn+2HCl=ZnCl2+H2
但是,也存在单质参与反应但不发生电子转移的单置换反应,属于非氧化还原反应,例如:
5Ni+4Fe(CO)5=5Ni(CO)4+4Fe
(b)多置换反应:多种化合物相互交换成分,生成另外多种化合物的反应,用反应形式表示如下:
A-B+C-D+…=A-D+C-B+…
尽管反应式包含有反应物的分解,但也包含有化合反应,化合和分解不是它的主要特征,它的主要特征是交换成分,属于置换反应,不宜用复分解反应来指称。多置换反应前后各元素的化合价并不要求保持不变,可以是氧化还原反应,也可以不是,这与现行教材的阐述不同。例如:
NaHCO3+HCl=NaCl+H2CO3
AgCl+HBr=AgBr+HCl
2FeCl3+SnCl2=2FeCl2+SnCl4
前两者是非氧化还原的多置换反应,后者是氧化还原的多置换反应。
以上所列基本化学反应形式的系统分类可用图1表示,它符合划分的规则。这个系统划分也可以用欧拉图[6](图2)来表示。
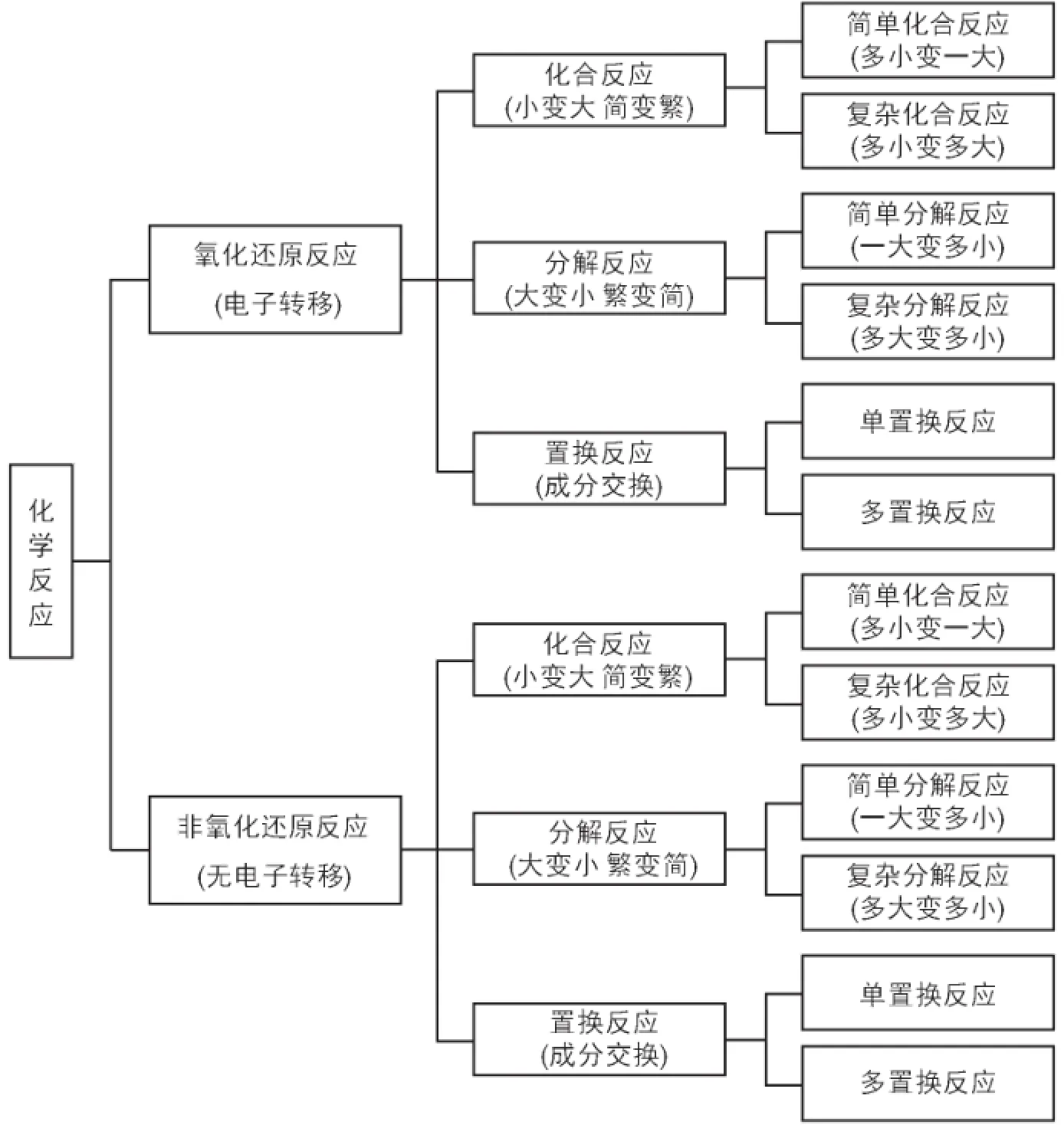
图1 基本化学反应形式分类树状图

图2 基本化学反应形式分类欧拉图
逻辑学用欧拉图表示概念的外延。图2中用一个圆圈表示所有的基本化学反应形式,圈外的面积表示非基本化学反应形式(不是基本化学反应形式的事物)。以有无电子转移为特征,把所有的化学反应形式用“二分法”划分为氧化还原反应和非氧化还原反应。它们又可以各自划分为化合反应、分解反应和置换反应,还可继续进行多级划分,每级划分以一个标准为主。本文进行的基本化学反应形式分类还可继续进行下去。用欧拉图表示划分能做到符合划分规则。
4 结语
本文从思维规则出发,指出了现行化学教材对化学反应的分类缺乏系统性,应用概念外延划分的方法和规则,初步尝试了一个基本化学反应形式的系统分类,并用树状分类图和欧拉图来表示。化学反应形式的系统划分能防止形成盲点又有助于找出空白之处,能促进新发现。划分是明确概念的方法之一,概念明确就是对事物本质特征的正确认识,而明确的概念是有效推理的基础,对促进创新有重要意义。
[1]王晶,郑长龙.义务教育教科书——化学(上册).北京:人民教育出版社,2012:35-39.
[2]王晶,郑长龙.义务教育教科书——化学(下册).北京:人民教育出版社,2012:11-75.
[3]Bodner,G.M.;Pardue,H.L.Chemistry,an Experimental Science,2nd ed.;John Wiley&Sons,Inc.:New York,1995;pp 312-313.
[4]Brown,T.L.;LeMay,H.E.;Bursten,B.E.Chemistry the Central Science,10th ed.;北京:机械工业出版社,2009:128-129.
[5]Burns,R.A.Fundamentals of Chemistry,4th ed.;北京:Higher Education Press,2004:286-300.
[6]华东师范大学哲学系逻辑学教研室.形式逻辑.上海:华东师范大学出版社,2009:39-43.
A Systematic Classification of Basic Chemical Reactions
HUANG Hua-Qi1CHEN Fu-Sheng2HUANG Rong-Bin1,*
(1College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,Fujian Province,P.R.China;2Longhai Fifth Middle School,Zhangzhou 363000,Fujian Province,P.R.China)
The old classification of basic chemical reactions was evaluated and a new systematic classification of basic reactions was proposed.In the new classification,all the chemical reactions were divided into oxidation-reduction reactions and non-oxidation-reduction reactions,and both can be divided into combination reaction,decomposition reaction and replacement reaction,respectively.In addition,a new class of basic reactions,the complicated decomposition reaction,was appended to reaction system.
Chemical reaction;Classification;Multi-replacement reaction;Complicated decomposition reaction
G64;O61
10.3866/PKU.DXHX201512021
,Email:rbhuang@xmu.edu.cn

