碳氧化反应速率常数与温度特殊关系的理论解释
孔令然 张树永
(山东大学化学与化工学院,济南250100)
·师生笔谈·
碳氧化反应速率常数与温度特殊关系的理论解释
孔令然张树永*
(山东大学化学与化工学院,济南250100)
对于碳氧化反应,在不同温度范围内,温度对反应速率常数的影响呈现不同规律的现象进行了讨论。指出第一阶段主要由氧气在碳表面化学吸附平衡受温度的影响决定。第二阶段则由碳在二氧化碳中发生气化反应,特别是其中的酮基脱附步骤决定。对已有的反应机理进行了比较,提出了新的简化机理,并采用速率控制步骤近似和平衡近似对机理进行了近似处理,得出的第二阶段动力学方程可以较好地解释相关实验规律。
碳氧化反应;多相反应;吸附平衡;二氧化碳;反应机理
www.dxhx.pku.edu.cn
1 前言
温度对化学反应速率的影响十分显著。到19世纪末人们已经发现,其影响可以归为5种类型[1](图1)。在5种类型中,人们对(I)、(II)、(III)3种类型的了解已经比较深入,能够较好地解释相关实验现象[2];对第(V)种类型的解释虽然存在争论,但已有了比较系统的讨论[3];而第(IV)种类型比较特殊,只在碳氧化反应中可以观察到[1,2],现行的物理化学教材只是简单地说明该现象可能与第(II)、(III)两种类型的反应有关[2],并将其特殊变化归因于可能存在副反应,但并未给出具体解释。
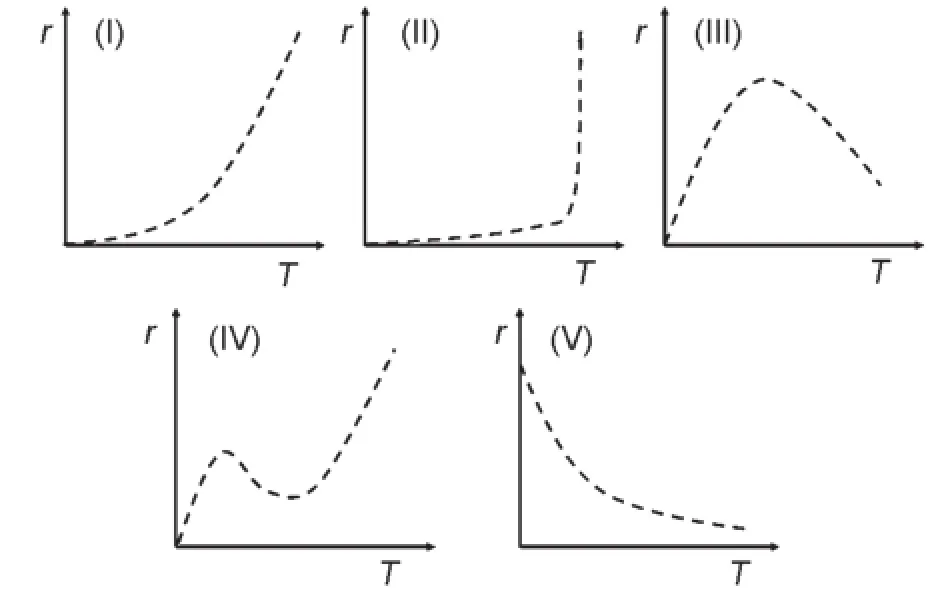
图1 温度对化学反应速率影响的5种类型
本文将类型(IV)的曲线分为2段分别加以讨论,并从反应机理和动力学近似处理的角度,对该现象的成因进行解释。
2 讨论与分析
2.1曲线的第一段
对于碳氧化反应:

在温度不是特别高的情况下可以观察到,该反应的速率常数随着温度的升高先上升后下降,这一现象与第(III)种类型十分相似,但导致这一现象的原因却不是催化剂的活性随温度的变化,而是界面反应中吸附作用的强度随温度的变化。
研究表明,碳的氧化只有在温度超过400°C时才会发生,而400°C恰恰是O2在碳表面由物理吸附转变为化学吸附的转变温度。研究进一步证明,氧在碳表面形成的活性表面含氧配合物对反应过程存在显著影响[4,5]。因此,该反应的第一阶段实际上是表面吸附-反应的过程:首先O2在碳表面发生化学吸附并转化为吸附的C=O,而后进一步形成CO2离开表面。由于化学吸附需要活化能,故温度升高会导致O2的化学吸附增强,从而使化学反应速率增加。但当化学吸附达到最大值之后进一步升高温度,则会导致O2的化学吸附减弱,不利于反应的进行[6]。这就很好地解释了第一阶段中,反应速率呈现随温度的升高先升高再下降的现象。
碳燃烧的第一个阶段通常发生在温度500-700°C的范围内,此时碳处于红热状态。
2.2曲线第二阶段的动力学特征
2.2.1反应的基本情况
当温度进一步升高时,碳氧化反应的速率常数随温度的升高而迅速增大,且曲线对温度的二阶导数为正值,与第一阶段的上升段不同。此时反应与多孔焦炭的行为类似,发生的反应主要是焦炭与二氧化碳的气化反应(反应(2))以及产生气体的进一步燃烧(反应(3)):

其中反应(2)是一个界面反应,吸热;反应(3)为气相的均相反应,放热。碳与二氧化碳的气化反应(2)是工业上的一个重要反应,在高温高压环境下,焦炭与二氧化碳反应得到的CO是冶金工业上最重要的还原剂之一。
反应(2)、反应(3)的总反应与反应(1)相同。其中,反应(2)为气-固多相反应,必须以二氧化碳的吸附为前提。因此,在考虑反应热力学的同时必须综合考虑CO2吸附动力学的影响。文献显示[4],该反应可分为缓慢气化和快速气化两个阶段。对于缓慢气化阶段,由于反应速度慢、吸热少,CO2在碳表面的吸附所放出的热量要大于反应(2)吸收的热量,此时反应(2)表现为放热反应,但放出的热量较少,对应于反应从第一阶段向第二阶段的过渡。对于快速气化阶段,由于反应(2)速度很快,吸热较多,此时CO2吸附放出的热量不足以抵消反应吸收的热量,故反应(2)表现为吸热。实验证明,该反应在600-700°C开始进行,在1200°C时焦炭的气化反应达到最大值,使反应(2)成为总反应的速率控制步骤,反应速率的变化趋势会再次发生改变。但因为碳燃烧温度很难超过1200°C,故这种变化实际上很难观察到。此时碳表面的颜色为黄色到浅黄色并伴有淡蓝色火焰,与CO的燃烧有关。
2.2.2反应的机理研究进展
由于反应(2)是多相反应而且焦炭表面具有多孔结构,吸附能力强,导致反应(2)的机理比较复杂。文献中有较多讨论[5,7,8]。
早在1955年[7],von Fredersdorff就提出碳和CO2的反应由CO2在碳表面的吸附、界面反应、产物脱附等步骤组成。具体的反应机理为:

其中,括号中表示被吸附的物种。von Fredersdorff虽然从吸附和界面反应的角度综合考虑了这一反应,但没有指出气体被吸附之后形成的具体产物,也没有讨论活化位置的作用。
1956年,Ergun[8]基于同位素示踪法研究,提出了如下机理:

其中,Cf表示焦炭表面的活化位置。Ergun指出,n可以为0、1、2,即反应完成后释放出的活化位置可能不是1。该机理利用经典的活化位置模型,能够较好地解释CO2在焦炭表面的吸附及其反应,但他没有说明吸附后形成的CO的具体组成。
1993年,Chen等[5]提出该反应由4个步骤组成:
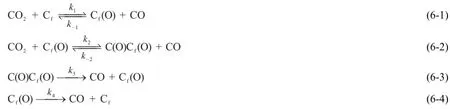
其中,Cf是焦炭表面的活化位置,Cf(O)是酮基,而C(O)Cf(O)是烯酮基。在温度不太高的情况下,烯酮基先分解为一氧化碳和酮基,在温度进一步升高时,酮基再分解释放出CO。该机理综合了吸附平衡和界面反应,并且指明了吸附产生的物质种类。但由于该机理比较复杂,作者并没有依据该机理推导出反应的速率方程并进而说明反应的动力学特征。
2.2.3反应动力学特征讨论
综合之前的相关研究进展,为了便于进行近似处理,我们提出了一个简化的反应机理:
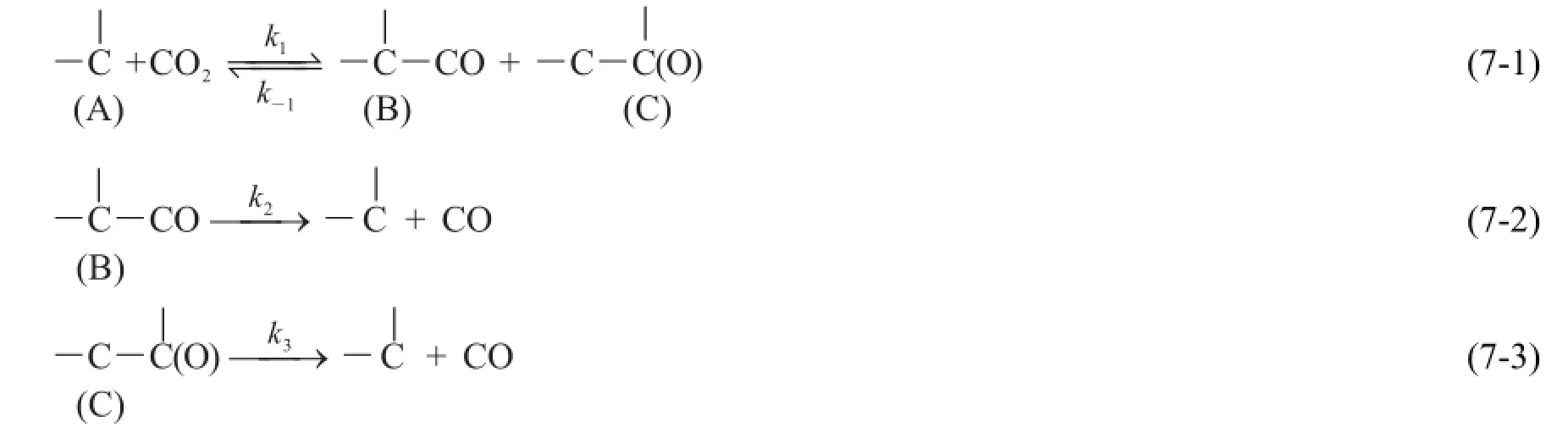
式中,(A)表示石墨中与其他碳原子相连的表面碳原子,每个(A)表示一个活性位置;k1、k-1分别表示吸附和脱附的速率常数。反应(7-1)是吸附平衡,对应于CO2在碳表面活性位置上的吸附,形成活化吸附配合物(C)(酮基)和(B)(烯酮基)。实际上,(B)可能有两种结构,即―C―CO和―C―OC,但文献中未区别加以讨论。(C)也可能有O与1个或者2个碳原子结合的情况[8],但出于简化处理的需要,此处也不做区分。
根据反应(2)是放热反应且放热不多可以推知,反应(7-1)正逆向反应的活化能相差不大。(C)可以通过断裂与C相连的1个C―C键而形成C=C=O的结构,再在氧的作用下通过断裂C=C形成CO。从键能角度考虑,(B)更容易脱附,而(C)脱附比较困难。实验表明,烯酮基可在700°C时脱附[4]而酮基只有在1200°C以上才能脱附[5]。因此,实验结果与我们的推测一致。这表明反应(7-2)相对容易进行,而反应(7-3)才是决定整个反应速率的速率决定步骤(rate-determining step,r.d.s.)。
如果采用r.d.s.近似和平衡近似对上述机理进行处理,可得如下结果:

所以,

式中[(A)]是碳表面活性位置的浓度,可视为常数;反应达到稳态时,[CO2]不随时间改变。故反应的速率主要由[(C)]和[(B)],即酮基和烯酮基在碳表面吸附的浓度决定。因为(7-2)反应容易发生,故[(B)]相对于[(C)]要小些,这有利于提高反应速率。而对于表观速率常数而言,根据上面的讨论可知k1≈k-1,故总反应的速率常数主要由k3决定。由于反应(7-3)的活化能很高,超过100 kJ·mol-1[4],故其反应速率常数随温度的变化率较大,而反应(2)又是高温碳氧化反应的速率决定步骤,所以第二段的斜率大于第一段就不足为奇了。
3 结论
碳氧化反应的速率常数与温度的关系可以分为两个阶段。其中,第一阶段为碳直接氧化为二氧化碳,其反应受氧气在碳表面吸附的影响。随着温度的升高,氧气在碳表面的化学吸附先增强后减弱,导致反应速率出现类似变化;第二阶段,当温度高于700°C时,首先发生碳与二氧化碳的气化反应,在反应温度达到1200°C之前,反应速率随着温度的升高而增大。由于在碳与二氧化碳的气化反应中,酮基脱附是速率控制步骤且活化能较高,导致反应速率的温度系数较大,而且该反应的活化能随着温度的升高而下降[4],导致反应速率常数随温度升高的趋势更大,故呈现速率快速增长的现象。
[1]印永嘉,奚正楷,张树永.物理化学简明教程.第4版.北京:高等教育出版社,2007:350.
[2]傅献彩,沈文霞,姚天扬.物理化学(下册).第5版.北京:高等教育出版社,2006:195.
[3]王家成,张树永.大学化学,2014,29(6),55.
[4]李金莲,汪琦,李艳茹.化学工程与装备,2009,12,21.
[5]Chen,S.G.;Yang,R.T.;Kapteijn,F.;Moulijn,J.A.Ind.Eng.Chem.Res.1993,32(11),2835.
[6]印永嘉,奚正楷,张树永.物理化学简明教程.第4版.北京:高等教育出版社,2007:294.
[7]von Fredersdorff,C.G.Ins.Gas Techn.Res.Bull.1955,19,75.
[8]Ergun,S.J.Phys.Chem.1956,60(4),480.
Theoretical Explanation of the Special Temperature Dependence of Rate Constant for Oxidation of Carbon
KONG Ling-RanZHANG Shu-Yong*
(School of Chemistry and Chemical Engineering,Shandong University,Jinan 250100,P.R.China)
For oxidation of carbon in different temperature ranges,there is different temperature dependence of rate constant.The temperature dependence can be divided into two sections.The first section is mainly determined by the chemical adsorption of oxygen on the carbon surface,forming oxygencontaining surface complexes.The effect of temperature on adsorption equilibrium of oxygen results in the first increase and then decrease of rate constant with increasing temperature.For the second section,it is mainly influenced by gasification of carbon in carbon dioxide,in which desorption of the carboxyl group is the rate-determining step(r.d.s.).In this paper,a comparison among the formerly established mechanisms for carbon oxidation at high temperature was made and a simplified mechanism was put forward.The rate equation for the second section was deduced based on this new mechanism using r.d.s.approximation and pre-equilibrium approximation treatments.The deduced rate equation is in good accordance with the main experimental facts.Therefore,a satisfactory explanation is given for the unusual behavior of carbon oxidation.
Carbon oxidation;Heterogeneous reaction;Adsorption equilibrium;Carbon dioxide;Reaction mechanism
G64;O643.1
10.3866/PKU.DXHX201603015
,Email:syzhang@sdu.edu.cn

