均相催化的醇和胺借氢反应
王 超
(陕西师范大学化学化工学院,西安710062)
均相催化的醇和胺借氢反应
王超*
(陕西师范大学化学化工学院,西安710062)
醇和胺的借氢反应是一种制备胺类化合物的绿色途径。本文介绍了借氢反应的概念,并重点介绍了均相催化的醇和胺之间借氢反应的起源、重要进展以及未来的发展趋势。
醇;胺;脱氢;金属有机;不对称催化
www.dxhx.pku.edu.cn
1 背景介绍
借氢反应是指利用金属催化剂从相对惰性的有机分子中脱氢形成金属氢化物,同时使有机分子活化并参与后续反应,之后金属氢化物再还原反应过程中生成的中间体而生成新的偶联产物(图1)[1-4]。通过借氢反应可以扩展活性较低的有机化合物的反应类型。同时借氢反应一般具有非常高的原子经济性,是一种绿色的化学反应类型。

图1 借氢反应过程示意图
醇类物质是一类广泛存在的基本化工原料,但醇类化合物在有机反应中的活性相对比较低。将醇脱氢氧化成醛能扩展其反应性。使用金属催化剂将醇脱氢生成高活性的醛,然后醛参与后续反应生成一个不饱和中间体,最后催化剂利用脱除的氢将该中间体还原而得到一个新的产物[3,5,6],以上反应过程即醇参与的借氢反应。该反应不仅扩展了醇的反应类型,同时也具有较高的原子经济性。醇参与的借氢反应可以分为醇和胺之间的借氢反应[7,8],以及醇和各种碳亲核试剂之间的借氢反应[4]。
醇和胺通过借氢反应来制备新的胺类化合物具有非常重要的意义。胺类物质是一类重要的有机化合物,其高效绿色的合成是有机化学的重要研究方向之一[9,10]。常用胺的制备方法包括卤代烃的亲核取代,或者醛酮和胺之间的还原胺化。卤代烃的使用会产生大量对环境不友好的卤化物,而还原胺化反应需要使用当量还原剂。醇和胺的借氢反应不需额外添加剂,反应的副产物为水,是一种绿色的制备胺类化合物的方法。本文主要介绍了均相催化的醇和胺之间的借氢反应及其重要进展,并对醇和胺借氢反应的发展方向做出展望。
2 醇和胺的借氢反应研究
2.1概念及起源
醇和胺反应生成新的胺并释放出水是热力学上有利的过程[7]。然而醇和胺借氢反应的第一步涉及醇羟基邻位碳上的碳氢键活化。该碳氢键的键能(414 kJ·mol-1)一般较高,因此在一般条件下醇和胺之间很难发生反应。加入合适的金属催化剂能降低碳氢键活化的键能,使得借氢反应得以在较温和的条件下进行[6]。在金属催化剂作用下将醇脱氢变成羰基化合物,羰基化合物即可和胺反应生成亚胺;金属催化剂再利用从醇上脱除的氢还原亚胺中间体可得到新的胺类物质,这一过程即醇和胺之间的借氢反应。整个反应的副产物为水,是一个绿色化学转化反应(图2)。
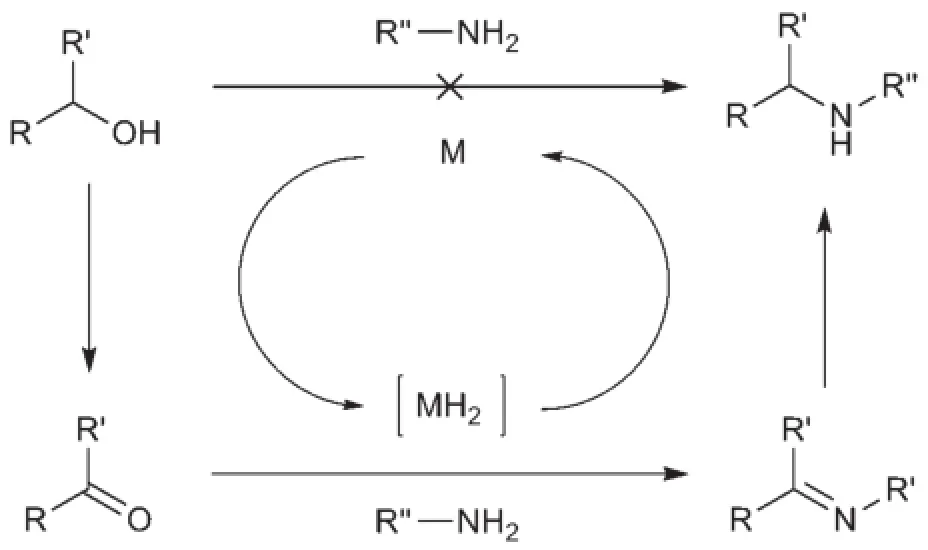
图2 醇和胺之间的借氢反应历程
早在1901年,人们即发现钠氧化物能促进醇和胺间脱水成胺的反应[11]。随后人们发现许多金属氧化物能通过酸催化脱水的机理实现醇对胺的烷基化反应,但反应的条件一般比较剧烈,反应温度通常在300-500°C之间。深入研究发现,某些金属氧化物催化的反应可能通过氢转移的过程进行。之后镍、铜和铂等多相催化剂被发现并应用于醇和胺间的借氢反应[7]。多相催化剂虽然具有易于回收、能重复使用的优点,但其催化的醇和胺的借氢反应一般来说反应温度较高,产物选择性难于控制[7]。相对于多相催化,使用结构确定的分子催化剂的均相催化具有活性和选择性易于调控的优点。特别是,如引入手性配体,均相催化将有可能实现不对称的借氢反应,从而为高附加值的胺类物质制备提供绿色的方法。均相催化的醇和胺之间的借氢反应直到1981年才被发现。Grigg等[12]和Watanabe等[13]几乎同时报道了贵金属催化的醇和胺之间的借氢反应。Grigg等[12]发现,带三苯基膦配体的钌、铑、铱络合物能催化醇和胺间的借氢反应(图3),其中RhH(PPh3)4络合物的活性最高。使用摩尔分数为5%的催化剂,将四氢吡咯在甲醇中回流能得到97%收率的N-甲基四氢吡咯的产物。其他的脂肪族胺和醇也可以反应得到相应的氮烷基化产物。Watanabe等[13]报道了使用摩尔分数为1%的RuCl2(PPh3)3为催化剂在180°C的条件下可以实现醇和胺的借氢反应(图3)。但该反应的选择性不是非常理想,如使用苯胺为底物和脂肪族醇反应时会得到单取代和双取代的混合物。
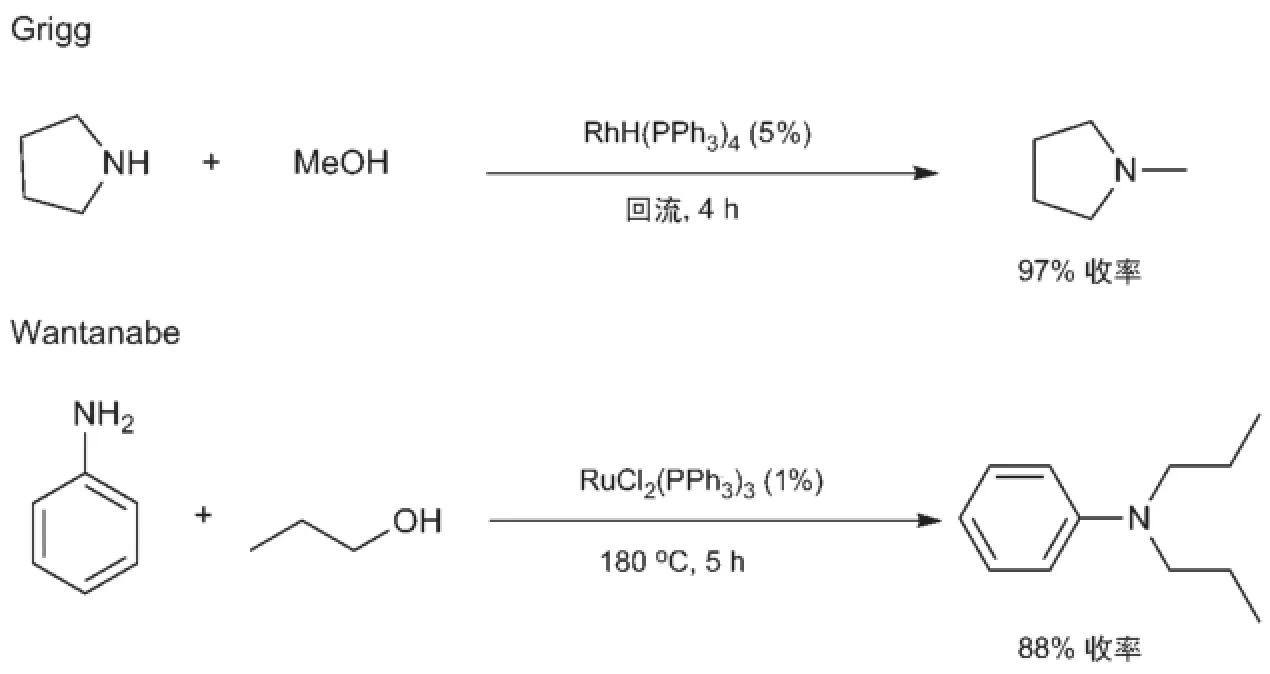
图3 首例均相催化的醇和胺的借氢反应
2.2重要研究进展
基于以上发现,化学家们一直在尝试发展底物适用范围更广、活性更高以及更廉价的催化剂和催化体系。在催化剂发展方面,[Cp*IrCl2]2[14]、Ru3(CO)3[15]等贵金属催化剂,以及结构确定的Pincer型Ru络合物[16]相继被报道。在已经报道的催化体系中,Williams等[17]于2009年报道的[Ru(p-cymene)Cl2]2和双膦配体原位形成的催化剂表现出了非常广泛的底物适用性(图4)。一系列的伯胺、仲胺以及磺酰胺均可发生反应。伯醇、仲醇以及二级醇等醇类都可以作为反应底物。此外以手性的胺做底物,其产物的ee值基本保持不变。

图4 钌-双膦催化的醇和胺借氢反应
以廉价而量大的氨气或者氨水为胺源和醇反应制备胺类物质具有重要实践价值。Gunanathan和Milstein[18]发现使用Ru-PNP的Pincer型催化剂1,能催化氨气和醇之间的借氢反应,选择性地得到伯胺产物。该反应还可以以水为溶剂,相对比较绿色(图5)。随后,Deutsch等[19]以及Hofmann等[20]相继报道了以氨气作为胺源和醇的借氢反应。Fujita等[21]报道使用一个水溶性的铱催化剂2,可以催化氨水和醇之间的借氢反应,得到三级胺的产物(图5)。
大部分借氢反应均在较高的温度下进行,化学家们一直尝试发展条件温和的反应体系。最近这方面也取得了一些进展。2009年,Kempe等[22]发展的带膦氮配体的铱催化剂可以在相对较低的温度(70°C)下实现醇和杂环胺之间的借氢反应(图6)。2013年,Li和Andersson[23]发现,使用带膦卡宾配体的铱催化剂3,醇和芳香胺的借氢反应可以在室温、无溶剂的条件下进行(图6)。

图5 以氨气或氨水为胺源的借氢反应示例
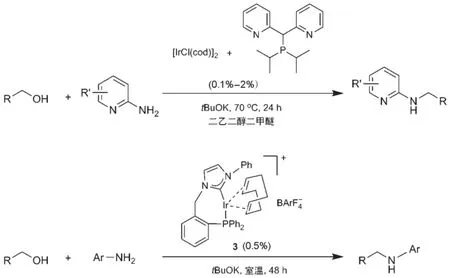
图6 温和条件下的借氢反应
除了醇和胺之间可以发生借氢反应之外,近年来化学家们发现胺和胺之间也可以发生借氢反应生成新的胺类化合物。2007年,Beller等[24]研究发现Shvo催化剂可以催化脂肪胺和芳香胺之间的借氢反应而得到烷基化的芳香胺(图7)。随后,Williams等[25]发现[Cp*IrI2]2可以催化胺和胺之间的选择性交叉借氢偶联(图7)。即使两个均可脱氢的脂肪族胺也能交叉偶联得到单一的产物。以上胺和胺的反应一般需要较高的温度(>150°C),Wang和Xiao等[26]发现使用一环金属化的铱催化剂,能在较低的温度(100°C)下实现胺和胺之间的借氢偶联(图7)。此外,该催化剂也能在相同的条件下催化醇和胺之间的借氢偶联,是目前唯一一例能催化两类反应的单一催化体系。
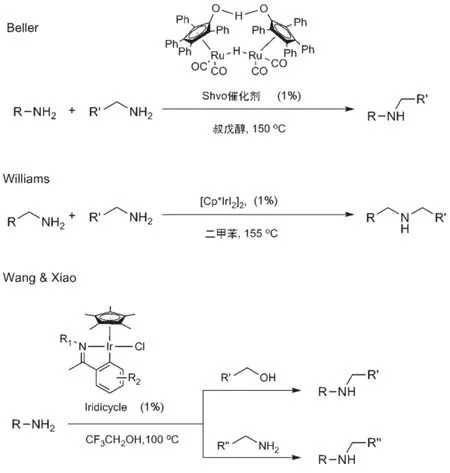
图7 胺和胺之间的借氢反应示例
钌、铑、铱等金属非常昂贵且有毒性,因此使用廉价金属催化剂来催化借氢反应,是该领域近年来的另一个重要发展方向。铁是自然界中丰度最大的金属元素,廉价而低毒,发展基于金属铁的催化剂是目前有机化学的重大挑战之一。2014年,Feringa等[27]发现使用一种双官能的铁催化剂4,能实现醇和胺之间的借氢反应(图8)。该催化体系具有很好的底物范围,苄醇、脂肪族醇及芳香胺、脂肪胺都能发生反应得到相应的借氢产物。2015年,Wills等[28]报道了一个结构类似的铁催化剂5在甲苯或者二甲苯中回流的情况下可以催化醇和胺间的借氢反应(图8)。除铁之外,最近基于金属钴的催化剂也被应用于借氢反应。2015年Kempe等[29]首次报道了Co-PNP络合物6催化的醇和芳香胺之间的借氢反应(图8)。2016年,Zhang等[30]发现在加入0.4 nm分子筛的条件下,Co-PNHP络合物7可以催化醇和胺之间的借氢反应(图8)。有趣的是,在没有加入0.4 nm分子筛的条件下,得到的产物是亚胺,而非借氢的胺。
在醇和胺的借氢反应中,如果使用二级醇作为反应底物,得到的产物中氮原子所连的碳则为手性碳原子。从醇和胺出发通过不对称的借氢反应制备出手性的胺类化合物是化学家梦寐以求的反应。但对于不对称借氢反应的研究目前仍处于起始阶段。二级醇由于位阻较大,参与借氢反应相对较难;其借氢反应所需的温度一般较高,要控制其立体选择性也比较困难。因此不对称的醇和胺之间的借氢反应例子不多。最初醇和胺的不对称借氢反应均通过底物的手性来控制所得产物的手性。Fujita等在其[Cp*IrCl2]2催化的醇和胺借氢反应基础上[14]发现,如果使用光学纯的α-苯乙胺作为底物和二醇反应能得到手性的杂环化合物,反应获得了76%收率、92%的非对映选择性(de)以及86%对映选择性(ee)的主要产物(图9)[31]。Trudell等[32]后来将此方法应用于天然产物Noranabasamine的合成之中。
2014年,Dong和Guan等[33]报道,使用手性亚磺酰胺作为底物和消旋的二级醇反应,在Ru-PNP络合物8的催化剂下,可以得到立体选择性较高的手性胺类化合物(图10)。虽然该反应的温度比较高,但得到产物的dr值仍然比较好。
通过手性催化剂来控制不对称借氢反应产物的立体选择性是更为理想的途径。2013年,Zhao等[34]首次实现了手性催化剂控制的醇和胺之间的不对称借氢反应。受Xiao等[35,36]使用手性铱催化剂9及手性磷酸10协同催化的酮和胺的还原胺化反应启发,Zhao等发现这一协同催化体系在较高的温度下能够实现消旋二级醇和芳香胺之间的不对称借氢反应(图11)。芳香族和脂肪族的醇都可以反应而得到不错的立体选择性。
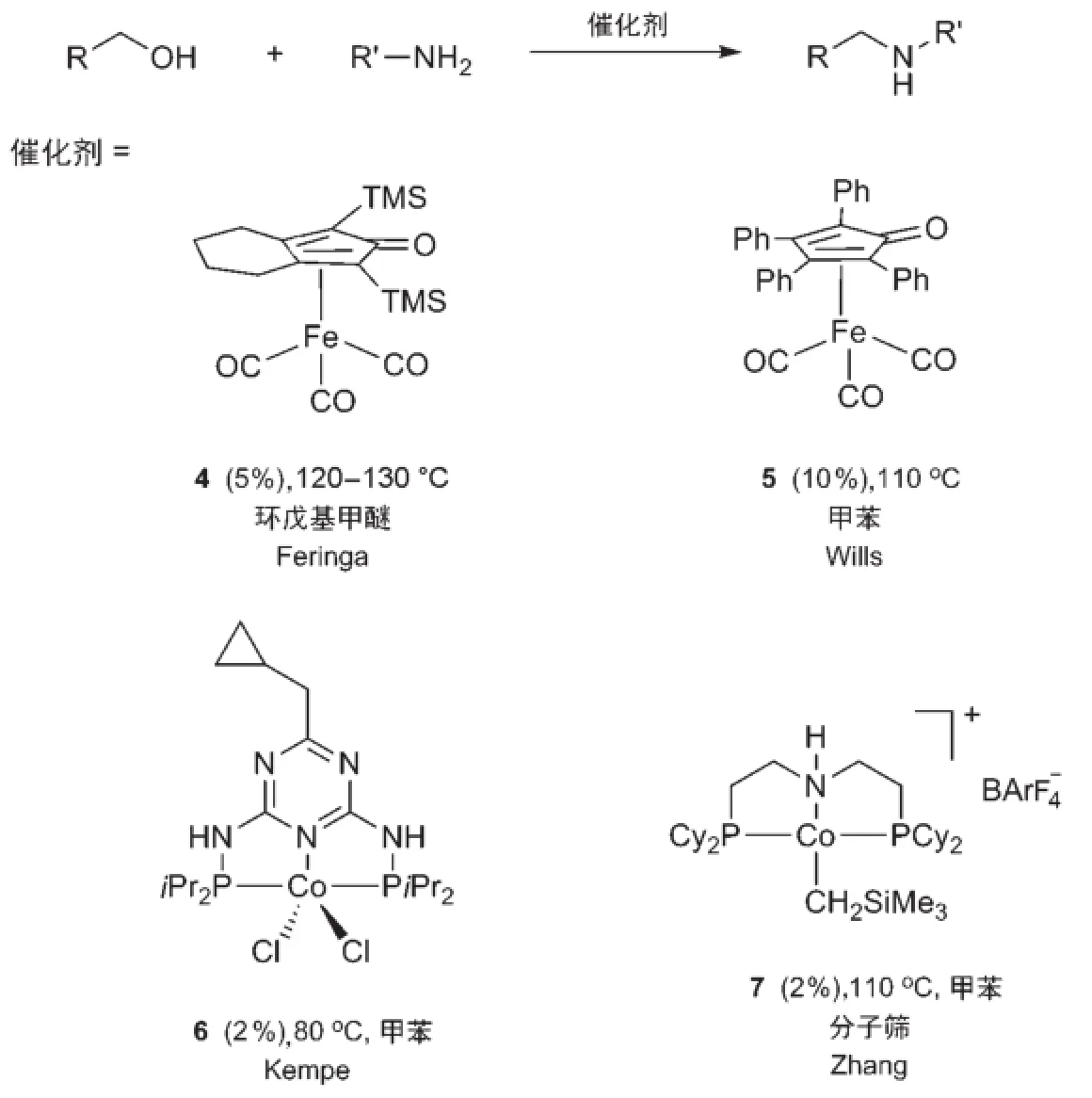
图8 廉价金属催化的借氢反应
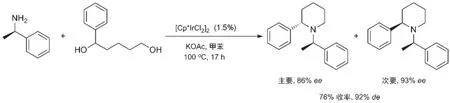
图9 首例底物控制的不对称借氢反应
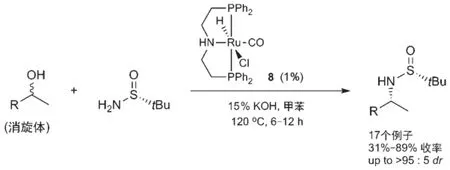
图10 手性亚磺酰胺控制的不对称借氢反应
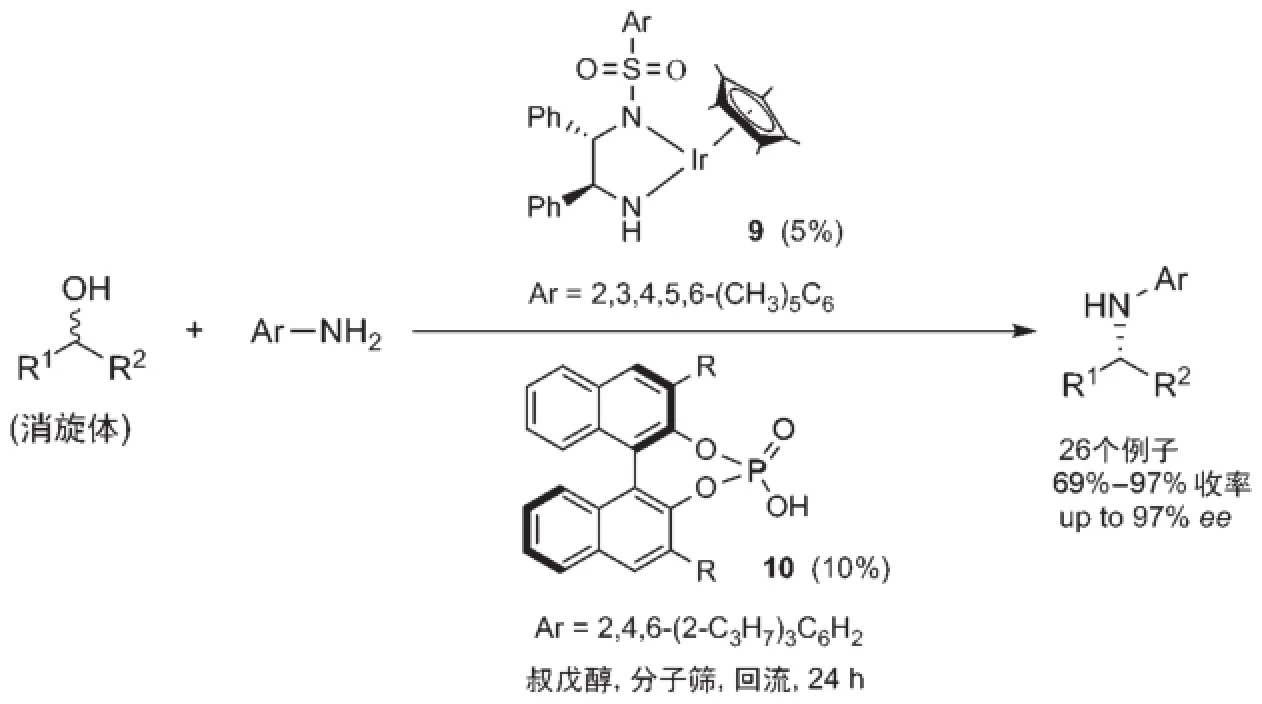
图11 催化不对称借氢反应

图12 基于动态动力学拆分的不对称借氢反应
最近,Zhao等[37]基于其前期不对称借氢反应的结果,通过动态动力学拆分的方法实现了从α-支链的消旋醇制备α-支链的手性胺的新方法。通过使用手性铱催化剂9和一螺环骨架的手性膦酸11协同催化,实现了高非对映选择性及高立体选择性的手性二胺合成(图12)。反应中,金属铱催化剂先对醇进行脱氢生成酮12和铱氢化合物,随后酮和胺缩合生成亚胺,亚胺被手性膦酸质子化生成含手性膦酸阴离子的亚胺盐,之后铱氢化合物将亚胺盐还原而得到手性的胺产物。带支链的二级醇存在四个光学异构体,羰基被氧化及缩合成亚胺后,还存在两个可能的光学异构体13和14;两个光学异构体之间可以通过亚胺和烯胺之间的异构而相互转化。由于膦酸阴离子及铱催化剂手性配体的控制,铱氢化合物还原亚胺盐时对其中一个异构体(13)还原速度快,因而可以高立体选择性地得到高光学纯的手性产物。虽然该反应的时间比较长(96 h),对某些底物收率不高,但该体系给出了非常高的非对映选择性及对映选择性。
3 总结与展望
均相催化的醇和胺之间的借氢反应从最开始的催化剂用量高、反应温度高、底物范围窄、选择性差发展到可以用低的催化剂用量、在温和的条件下实现不同醇和胺类物质之间的借氢反应。更为重要的是,通过催化剂设计,高选择性包括不对称选择性的借氢反应得以实现。廉价金属催化的醇和胺间的借氢反应也取得了成功。然而,廉价金属催化的醇和胺间的借氢反应在底物范围及催化活性方面仍有提升空间。催化剂控制的不对称借氢反应底物仅适用于芳香族胺类化合物,且催化剂活性较低,催化体系复杂。本人认为廉价金属催化以及不对称催化的高效、底物适用范围广的借氢反应是醇和胺借氢反应未来发展的重点领域。
[1]Hamid,M.H.S.A.;Slatford,P.A.;Williams,J.M.J.Adv.Synth.Catal.2007,349(10),1555.
[2]Nixon,T.D.;Whittlesey,M.K.;Williams,J.M.J.Dalton Trans.2009,No.5,753.
[3]Watson,A.J.A.;Williams,J.M.J.Science 2010,329(5992),635.
[4]Obora,Y.ACS Catal.2014,4(11),3972.
[5]Dobereiner,G.E.;Crabtree,R.H.Chem.Rev.2010,110(2),681.
[6]Gunanathan,C.;Milstein,D.Science 2013,341(6143),1229712.
[7]Guillena,G.;Ramón,J.D.;Yus,M.Chem.Rev.2010,110(3),1611.
[8]Bähn,S.;Imm,S.;Neubert,L.;Zhang,M.;Neumann,H.;Beller,M.ChemCatChem 2011,3(12),1853.
[9]Kobayashi,S.;Ishitani,H.Chem.Rev.1999,99(5),1069.
[10]Nugent,T.C.;El-Shazly,M.Adv.Synth.Catal.2010,352(5),753.
[11]Nef,J.U.Liebigs Ann.Chem.1901,318(2-3),137.
[12]Grigg,R.;Mitchell,T.R.B.;Sutthivaiyakit,S.;Tongpenyai,N.J.Chem.Soc.,Chem.Commun.1981,No.12,611.
[13]Watanabe,Y.;Tsuji,Y.;Ohsugi,Y.Tetrahedron Lett.1981,22(28),2667.
[14]Fujita,K.I.;Li,Z.;Ozeki,N.;Yamaguchi,R.Tetrahedron Lett.2003,44(13),2687.
[15]Zhang,M.;Imm,S.;Bähn,S.;Neumann,H.;Beller,M.Angew.Chem.Int.Edit.2011,50(47),11197.
[16]Abbenhuis,R.A.T.M.;Boersma,J.;van Koten,G.J.Org.Chem.1998,63(13),4282.
[17]Hamid,M.H.S.A.;Allen,C.L.;Lamb,G.W.;Maxwell,A.C.;Maytum,H.C.;Watson,A.J.A.;Williams,J.M.J.J.Am.Chem.Soc. 2009,131(5),1766.
[18]Gunanathan,C.;Milstein,D.Angew.Chem.Int.Edit.2008,47(45),8661.
[19]Baumann,W.;Spannenberg,A.;Pfeffer,J.;Haas,T.;Köckritz,A.;Martin,A.;Deutsch,J.Chem.Eur.J.2013,19(52),17702.
[20]Ye,X.;Plessow,P.N.;Brinks,M.K.;Schelwies,M.;Schaub,T.;Rominger,F.;Paciello,R.;Limbach,M.;Hofmann,P.J.Am.Chem. Soc.2014,136(16),5923.
[21]Kawahara,R.;Fujita,K.I.;Yamaguchi,R.J.Am.Chem.Soc.2010,132(43),15108.
[22]Blank,B.;Michlik,S.;Kempe,R.Chem.Eur.J.2009,15(15),3790.
[23]Li,J.Q.;Andersson,P.G.Chem.Commun.2013,49(55),6131.
[24]Hollmann,D.;Bähn,S.;Tillack,A.;Beller,M.Angew.Chem.Int.Edit.2007,46(43),8291.
[25]Saidi,O.;Blacker,A.J.;Farah,M.M.;Marsden,S.P.;Williams,J.M.J.Angew.Chem.Int.Edit.2009,48(40),7375.
[26]Zou,Q.;Wang,C.;Smith,J.;Xue,D.;Xiao,J.Chem.Eur.J.2015,21(27),9656.
[27]Yan,T.;Feringa,B.L.;Barta,K.Nat.Commun.2014,5,5602.
[28]Rawlings,A.J.;Diorazio,L.J.;Wills,M.Org.Lett.2015,17(5),1086.
[29]Rösler,S.;Ertl,M.;Irrgang,T.;Kempe,R.Angew.Chem.Int.Edit.2015,54(50),15046.
[30]Zhang,G.;Yin,Z.;Zheng,S.Org.Lett.2016,18(2),300.
[31]Fujita,K.I.;Fujii,T.;Yamaguchi,R.Org.Lett.2004,6(20),3525.
[32]Miao,L.;DiMaggio,S.C.;Shu,H.;Trudell,M.L.Org.Lett.2009,11(7),1579.
[33]Oldenhuis,N.J.;Dong,V.M.;Guan,Z.J.Am.Chem.Soc.2014,136(36),12548.
[34]Zhang,Y.;Lim,C.S.;Sim,D.S.B.;Pan,H.J.;Zhao,Y.Angew.Chem.Int.Edit.2014,53(5),1399.
[35]Li,C.;Wang,C.;Villa-Marcos,B.;Xiao,J.J.Am.Chem.Soc.2008,130(44),14450.
[36]Li,C.;Villa-Marcos,B.;Xiao,J.J.Am.Chem.Soc.2009,131(20),6967.
[37]Rong,Z.Q.;Zhang,Y.;Chua,R.H.B.;Pan,H.J.;Zhao,Y.J.Am.Chem.Soc.2015,137(15),4944.
Borrowing Hydrogen Reaction with Alcohols and Amines by Homogeneous Catalysis
WANG Chao*
(School of Chemistry and Chemical Engineering,Shaanxi Normal University,Xi'an 710062,P.R.China)
The"Borrowing Hydrogen"reaction between alcohols and amines is a green route for accessing new amines.The concept of"Borrowing Hydrogen"reaction,the origin,and important developments,as well as future directions for"Borrowing Hydrogen"reaction of alcohols and amines by homogeneous catalysis are described in the paper.
Alcohol;Amine;Dehydrogenation;Organometallics;Asymmetric catalysis
G64;O621.3
10.3866/PKU.DXHX201606001
,Email:c.wang@snnu.edu.cn
国家自然科学基金面上项目(21473109)

