不同辣椒炭疽病菌对唑菌酯的敏感性差异
满益龙, 谭新球, 司乃国, 陈 岳,张 卓, 刘 勇, 张德咏*
(1. 湖南农业大学植物保护学院, 长沙 410128; 2. 园艺作物病虫害治理湖南省重点实验室,湖南省农业科学院植物保护研究所, 长沙 410125; 3. 沈阳化工研究院, 沈阳 110021)
不同辣椒炭疽病菌对唑菌酯的敏感性差异
满益龙1,2, 谭新球2*, 司乃国3, 陈 岳2,张 卓2, 刘 勇1,2, 张德咏1,2*
(1. 湖南农业大学植物保护学院, 长沙 410128; 2. 园艺作物病虫害治理湖南省重点实验室,湖南省农业科学院植物保护研究所, 长沙 410125; 3. 沈阳化工研究院, 沈阳 110021)
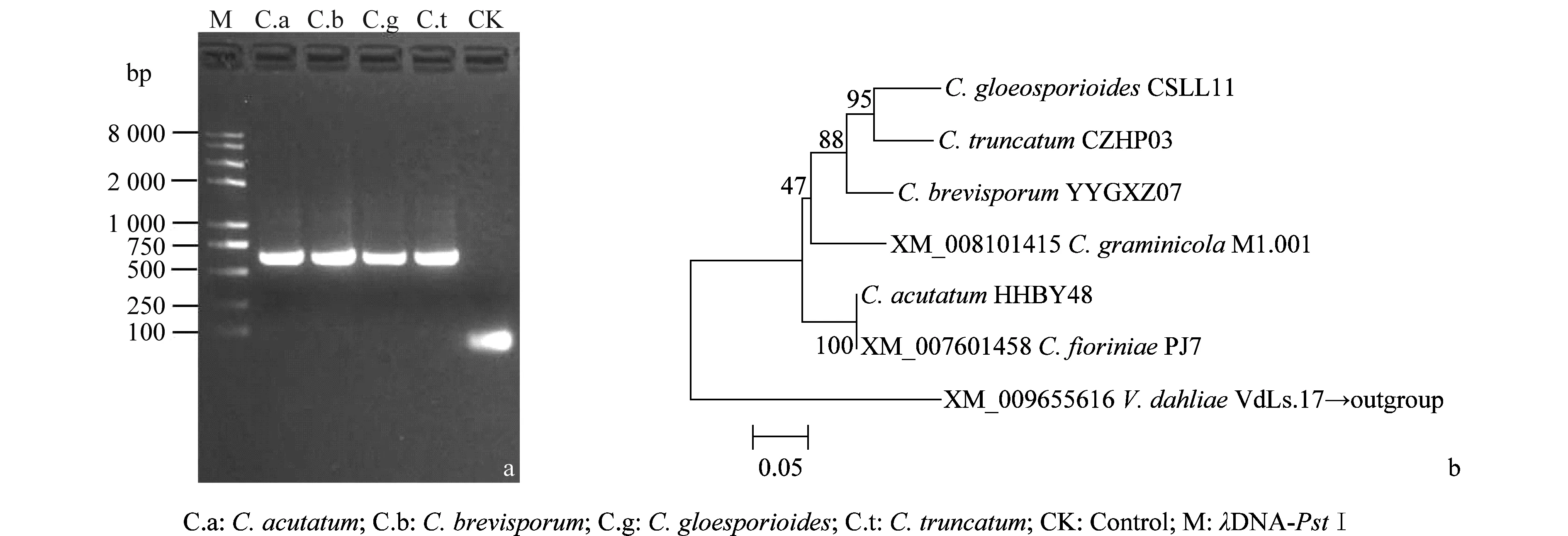
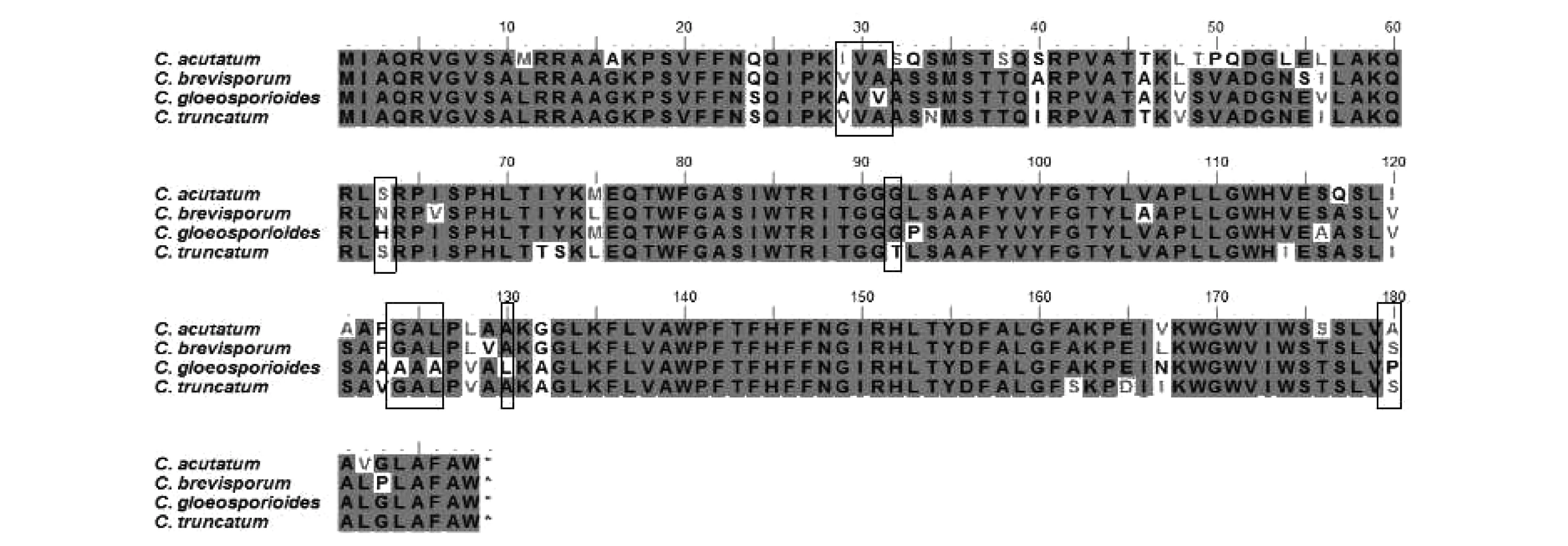
辣椒炭疽病是辣椒生产上的重要病害,严重制约辣椒生产,唑菌酯防治辣椒炭疽病的相关研究未见报道。为此,本研究利用菌丝生长速率法测定了4种不同炭疽病菌对唑菌酯的敏感性,并对其作用靶标基因细胞色素b基因(Cytb)进行比较分析。结果表明:唑菌酯对ColletotrichumbrevisporumYYGXZ07,C.truncatumCZHP03,C.acutatumHHBY48和C.gloeosporioidesCSLL11的EC50分别为0.098、3.363、10.156和31.982 μg/mL,而且供试菌株在含药培养基上的生长速率排序为C.truncatumCZHP03 辣椒炭疽病菌; 唑菌酯; 生物测定; 敏感性 唑菌酯是沈阳化工研究院自主创制的甲氧基丙烯酸酯类杀菌剂,具有杀菌活性高、抗病谱广、环境相容性好和作用机制独特等特点。其作用机理主要是抑制线粒体复合物Ⅲ中电子的传递。目前相关研究证明可有效防治黄瓜霜霉病、小麦白粉病,对水稻纹枯病菌、黄瓜炭疽病菌、油菜菌核病菌、葡萄白腐病菌、苹果轮纹病菌、苹果斑点落叶病菌等也具有良好的抑菌活性。 炭疽病是危害辣椒生产的主要真菌病害,其病原菌种类较为复杂[1-3],目前我国已经报道的辣椒炭疽病菌有C.gloeosporioides[1],C.acutatum[16],C.truncatum[3],C.coccodes[14],C.boninense[2], 加上最近分离的新种C.brevisporum(本研究室分离保存,数据正在投稿中)共6个种。不同地区炭疽病菌常常混合发生,其优势种群存在明显差异。炭疽病菌主要危害辣椒茎秆、叶片和果实,危害严重时病果率达40%~60%[10],影响辣椒生产和商品价值。目前炭疽病的防治主要依赖苯醚甲环唑·嘧菌酯悬浮剂、肟菌酯·戊唑醇水分散粒剂、吡唑醚菌酯乳油等化学药剂,但是未见利用唑菌酯防治辣椒炭疽病的报道。为此本研究采用生长速率法测定了不同辣椒炭疽病菌对唑菌酯的敏感性,在该杀菌剂应用早期建立灵敏的敏感性检测方法及敏感性基线,对于正确评价唑菌酯对辣椒炭疽病菌的生物学活性,开展抗药性早期监测, 及早提出药剂的科学使用方法和抗药性治理策略具有重要意义。 1.1 供试病原菌的培养 供试辣椒炭疽病菌包括:C.gloeosporioidesCSLL11,C.acutatumHHBY48,C.truncatumCZHP03和C.brevisporumYYGXZ07共4个种,其中设定C.gloeosporioidesCSLL11为敏感对照菌株,所有供试菌株由湖南省植物保护研究所真菌研究室提供,供试菌株保存于4℃冰箱。使用时先活化菌株, 采用PDA培养基25℃暗培养7 d,采用单孢纯化备用。 1.2 供试化学药剂 研究使用的唑菌酯原药由沈阳化工研究院司乃国老师提供,试验时先用丙酮将原药溶解,然后通过灭菌水稀释,配制成浓度为200 mg/L的母液,并利用细菌过滤器过滤,用灭菌水对滤液进行定容,现配现用。 1.3 试验设计与处理 根据黄瓜炭疽病菌研究的相关报道[17],供试药剂终浓度设置为0、2.5、5、10、20 、和40 mg/L 6个浓度,并分别以清水作对照,共设6个处理。每个处理重复4次。 1.4 含药培养基制备及生长速率测定 将配制好的PDA培养基高温灭菌,待培养基冷却至50℃时,将浓度为200 mg/L唑菌酯母液稀释后加到不同体积的培养基中至设定浓度,并轻轻摇匀。然后倒入直径9 cm的培养皿中,每皿15 mL。 待培养基表面水汽蒸发后,将直径为7 mm的病原菌菌饼置于培养基中央,于25℃恒温培养箱中培养,从接种后第2天开始,每天采用十字交叉法测量菌落直径,共培养8 d,直至清水对照菌丝长满培养基为止。测量数据利用SPSS 16.0进行统计分析。 1.5 辣椒炭疽菌菌株总RNA的提取 供试菌株的总RNA提取参照Tiangen RNA simple Total RNA Kit的方法进行,并稍作修改。抽提的总RNA用新的无RNase的离心管分装并保存在-80℃超低温冰箱备用。 1.6 唑菌酯作用靶标基因Cytb的克隆 cDNA的合成参照Vazyme HiScriptⅡ1st Strand cDNA Synthesis Kit进行,-20℃保存备用。通过已报道的植物炭疽病菌基因组(C.graminicolaM1.001 登录号:XM_008101415.1、C.fioriniaePJ7 登录号:XM_007601458.1)的Cytb基因序列分析比较,设计简并引物CYB-F1:5′-ATGATTGCGCAGCGGGTGG-3′和CYB-R1:5′-CTACCACGCAAAGGCCARDCCRA-3′(其中R为A或G;D为G或A或T),目的片段大小约为567 bp。 以合成的cDNA为模板进行PCR扩增,PCR反应体系(25 μL)为:10×EasyTaq buffer 2.5 μL、High Pure dNTPs(2.5 mmol/L)2.5 μL、EasyTaq DNA Polymerase(5 U/μL)1.0 μL、引物CYB-F1/ CYB-R1(10 μmol/L)各1.0 μL、cDNA 2.0 μL、ddH2O 15 μL。PCR反应条件为: 94℃ 5 min;94℃ 30 s,58℃或60℃退火30 s(具体根据菌株确定),72℃45 s,共35个循环;72℃延伸10 min,4℃保存。 PCR产物经1%琼脂糖凝胶电泳检测后采用TaKaRa割胶回收试剂盒回收。将获得的目的回收产物与载体连接、转化,具体参考pEASY®-T1 Cloning Kit进行。以通用引物M13F、M13R进行菌落PCR筛选,将筛选到的阳性克隆加入含100 mg/L氨苄青霉素的LB液体培养基中,置于200 r/min 37℃摇床过夜培养。 1.7 序列分析及数据处理 序列测定由北京奥科生物公司完成。将测序结果经BLAST比对分析,以已报道的植物炭疽病菌基因组(C.graminicolaM1.001 登录号:XM_008101415.1、C.fioriniaePJ7 登录号:XM_007601458.1)的Cytb基因序列为参考,确定克隆序列为辣椒炭疽菌的Cytb基因序列后,利用DNAMAN version 8.0将基因核苷酸序列翻译成氨基酸序列,利用ClustalW (http:∥www.ch.embnet.org/software/ClustalW.html)和BioEdit比对分析不同辣椒炭疽菌的Cytb基因差异。 2.1 不同辣椒炭疽病菌在含唑菌酯培养基上的生长速率 所有供试菌株经单孢分离纯化后,采用通用引物ITS4和ITS5扩增ITS序列并测序验证,确认正确后进行试验。由于所有供试菌株在含药培养基上生长速度比较缓慢,数据分析均从接种后第3天开始。不同菌株在含药系列浓度培养基上生长速率存在一定差异。C.truncatumCZHP03对唑菌酯最为敏感,药剂处理后菌丝生长速率明显低于其他菌株,而且接种后第3天到第8天菌丝生长速率的波动较小;C.gloeosporioidesCSLL11的菌丝生长速率明显高于其他菌株,接种后第4天到第8天,生长速率逐渐下降;C.brevisporumYYGXZ07和C.acutatumHHBY48 菌丝生长相对比较稳定(图1a~d)。其生长速率顺序为C.truncatumCZHP03 图1 不同辣椒炭疽病菌在含唑菌酯培养基上的生长速率Fig.1 The mycelial growth rate of different Colletotrichum strains causing anthracnose of Capsicum annuum plants on the medium with different concentrations of pyraoxystrobin 2.2 不同辣椒炭疽病菌对唑菌酯的敏感性 根据菌丝生长速率法测定抑制率,利用SPSS 16.0进行线性回归分析,唑菌酯对C.brevisporumYYGXZ07的抑制作用最强,其EC50为0.098 μg/mL。而对C.gloeosporioidesCSLL11的EC50为31.982 μg/mL,是C.brevisporumYYGXZ07的327倍。供试菌株EC50的顺序为C.brevisporumYYGXZ07 表1 不同辣椒炭疽病菌菌株对唑菌酯的敏感性Table 1 Sensitivity of different Colletotrichum strains to pyraoxystrobin 2.3 辣椒炭疽病菌唑菌酯靶标基因Cytb的比较与分析 从表1可以看出,唑菌酯对不同菌株的EC50存在明显差异,而且相关研究表明炭疽病菌对甲氧基丙烯酸酯类杀菌剂(嘧菌酯)极易产生抗药性[13]。为进一步弄清不同菌株对唑菌酯的敏感性差异,对唑菌酯靶标基因Cytb进行了克隆(图2a),并进行了序列分析。结果表明:供试菌株C.acutatumHHBY48、C.truncatumCZHP03、C.brevisporumYYGXZ07和C.gloeosporioidesCSLL11与C.fioriniaePJ7 (GenBank 登录号:XM_007601458.1)的Cytb基因氨基酸序列的同源性分别为100%、83.51%、85.64%和82.98%,而与C.graminicolaM1.001 (GenBank 登录号:XM_008101415.1)的同源性分别为87.23%、83.51%、86.17%和82.45%。C.acutatumHHBY48、C.truncatumCZHP03和C.brevisporumYYGXZ07与C.gloeosporioidesCSLL11的Cytb氨基酸序列同源性分别为82.98%、88.30%和87.77%(图2b)。通过BioEidt比对分析,结合不同辣椒炭疽病菌对嘧菌酯的敏感性反应[11],发现氨基酸29~31位、63位、93位、124~126位、130位和180位C.gloeosporioidesCSLL11分别为AVV、H、P、AAA、L和P;其中氨基酸29~31位和180位C.acutatumHHBY48分别为IVA和A,而C.truncatumCZHP03和C.brevisporumYYGXZ07均分别为VVA和S,124~126位C.acutatumHHBY48、C.truncatumCZHP03和C.brevisporumYYGXZ07均为GAL。推测以上位点氨基酸可能与菌株对唑菌酯的敏感性差异存在一定关联(图3)。 图2 4种辣椒炭疽病菌Cytb基因的克隆(a)和系统进化分析(b)Fig.2 PCR products of Cytb genes from Colletotrichum truncatum CZHP03, C.gloeosporioides CSLL11, C.acutatum HHBY48 and C.brevisporum YYGXZ07 (a) and their phylogenetic tree based on Cytb amino acids sequence(b) by ClustalW methods 图3 4种辣椒炭疽病菌Cytb基因氨基酸序列比对分析Fig.3 Analysis of Cytb amino acids sequence from Colletotrichum acutatum HHBY48, C.brevisporum YYGXZ07, C.truncatum CZHP03 and C.gloeosporioides CSLL11 by BioEidt methods 在我国,辣椒年种植面积超过130万hm2,但是炭疽病菌等病虫害的胁迫[1,3]给辣椒生产带来巨大压力。除了报道的C.gloeosporioides,近年来国际学者根据C.truncatum和C.capsici的形态特征和分子生物学鉴定方法,将二者合并为C.truncatum,另外一些危害辣椒的炭疽病菌新种也相继发现,如四川德阳的C.boninense[2]和湖南岳阳的C.brevisporum(投稿中),表明我国辣椒炭疽病菌种群田间存在复杂多样性。另外, Diao Yongzhao等利用卫星DNA标记分析我国13个辣椒种植区C.truncatum的遗传多样性,发现C.truncatum存在有性重组和地域分布[3],我们针对湖南湘中、湘东、湘南和湘西等地区C.gloeosporioides进行分析也发现同样的结果(未发表)。表明辣椒炭疽病田间管理有必要制定分区管理策略。 辣椒炭疽病防治主要有抗病品种、生物防治和化学防治[5-9]。目前化学防治仍然是主要的防治方法,而且主要依靠以甲氧基丙烯酸酯类为主的化学农药[10],但是田间防治效果存在较大波动,除了环境因素不同外,很大程度上归结于田间炭疽病种类复杂,如湖南长沙主要以C.gloeosporioides为优势种群、而湖南岳阳主要以C.brevisporum为优势种群、湖南湘西地区则以C.acutatum为优势种群、湘南地区则以C.truncatum为优势种群(数据未发表),本研究证实了不同炭疽病菌对农药的敏感性存在显著差异,这与不同辣椒炭疽病菌对嘧菌酯的敏感性差异一致[11];而且通过唑菌酯对炭疽病菌的作用靶标基因Cytb进行克隆和分析,推测其中一些位点的变异与菌株对唑菌酯的敏感性存在一定的关联,相关位点的确认工作正在进行中。为此要合理高效使用化学农药,需要根据当地辣椒炭疽病菌种类和优势种群组成,建立分区指导用药防治对策,减少化学农药的投入,保障辣椒安全生产。 辣椒炭疽病菌对甲氧基丙烯酸酯类(嘧菌酯)敏感性研究表明,其具有独特的作用机制,与已有的所有杀菌剂无交互抗药性。但已有研究表明多种植物病原真菌对该类药剂产生抗药性自发突变频率较高,在高选择压下自然界易形成抗药性病原真菌群体[11-13]。甲氧基丙烯酸酯类杀菌剂因为作用位点单一,长期频繁使用极易产生抗药性,而且相关研究报道证明在包括苹果、黄瓜等许多作物上检测到甲氧基丙烯酸酯类杀菌剂的抗性病原菌,导致对甲氧基丙烯酸酯类杀菌剂产生抗药性的直接原因是病原菌细胞色素b上的氨基酸残基被取代,以致影响药剂与靶点的结合[13],主要是127~147 位和256~296 位氨基酸系列区内的氨基酸残基发生了单点取代突变,其中,在127~147位区域的取代大多表现较高的抗性水平,最强而且频次最高的突变发生在143 位点,该位点的氨基酸由甘氨酸变成了丙氨酸,形成G143A 突变体[4]。而我们的研究中4个供试菌株中C.gloeosporioides的靶标基因Cytb的124~126位为AAA,其他3菌株该位点为GAL,与上述报道结果一致。而且在我们的室内加压选择中,发现C.gloeosporioides和C.acutatum在加压选择6代后,菌株产生了明显的抗药性,EC50值是出发菌株的5~10倍(未发表)。唑菌酯是近年沈阳化工研究院自主创新开发的用于防治炭疽病及其他病害的新型杀菌剂,目前在辣椒炭疽病防治方面未见报道,为此在该杀菌剂应用早期建立灵敏的敏感性检测方法及敏感性基线,对于正确评价唑菌酯对辣椒炭疽病菌的生物学活性,开展抗药性早期监测,及早提出药剂的科学使用方法和抗药性治理策略具有重要意义。 [1] Than P P, Jeewon R, Hyde K D, et al. Characterization and pathogenicity ofColletotrichumspecies associated with anthracnose on chilli (Capsicumspp.) in Thailand [J]. Plant Pathology, 2008, 57: 562-572. [2] Diao Yongzhao, Fan J R, Wang Z W, et al. First report ofColletotrichumboninensecausing anthracnose on pepper in China [J]. Plant Disease, 2013, 97(1): 138. [3] Diao Yongzhao, Zhang Can, Xu Jianping, et al. Genetic differentiation and recombination among geographic populations of the fungal pathogenColletotrichumtruncatumfrom chili peppers in China [J]. Evolutionary Applications, 2015, 8(1): 108-118. [4] Gisi U, Sierotzki H, Cook A, et al. Mechanisms influencing the evolution of resistance to Qo inhibitor fungicides [J]. Pest Management Science, 2002, 58(9): 850-867. [5] 吕玲玲, 李威, 谷会, 等. 辣椒资源对炭疽病的抗性比较研究[J]. 种子, 2014, 33(2): 60-62. [6] 何红, 蔡学清, 关雄, 等. 辣椒内生枯草芽孢杆菌(Bacillussubtilis) BS-2和BS-1防治辣椒炭疽病研究[J]. 植物病理学报, 2003, 33(2): 170-173. [7] 蔡学清, 何红, 叶贻源, 等. 内生菌BS-1和BS-2对辣椒炭疽病及椒果活性氧代谢的效应[J]. 福建农林大学学报(自然科学版), 2004, 33(1): 21-25. [8] 何海清, 钟娟, 周金燕, 等. 角毛壳菌CH-1产生的抗真菌活性化合物的纯化和鉴定[J]. 中国生物防治学报, 2015, 31(4): 592-597. [9] 曾大兴, 张晓阳, 贾书娟, 等. 枯草芽孢杆菌C-D6 对辣椒炭疽菌附着胞形成的抑制作用研究[J]. 微生物学通报, 2015, 42(12): 2377-2385. [10]智亚楠, 陈利军, 王国君. 几种杀菌剂对辣椒炭疽病的防治效果[J]. 浙江农业科学, 2014(6): 889-890. [11]李红霞, 刘照云, 王建新, 等. 辣椒炭疽病菌对嘧菌酯的敏感性测定[J]. 植物病理学报, 2005, 35(1): 73-77. [12]金丽华, 陈长军, 王建新, 等. 旁路氧化作用对嘧菌酯抑制辣椒炭疽菌孢子萌发和菌丝生长的影响[J]. 植物病理学报, 2007, 37(3): 289-295. [13]贾俊超, 马琳, 范志金, 等. 病原菌对Strobilurin类杀菌剂抗药性机理研究进展[J]. 农药学学报, 2008, 10(1): 1-9. [14]申铉珠, 徐同, 章初龙, 等. 韩国与中国的辣椒炭疽病菌菌株比较研究(英文)[J]. 浙江大学学报(农业与生命科学版), 2000, 26(6): 629-634. [15]思彬彬, 杨卓. 甲氧基丙烯酸酯类杀菌剂作用机理研究进展[J]. 世界农药, 2000, 29(6):5-9. [16]夏花,朱宏建,周倩,等. 湖南芷江辣椒上一种新炭疽病的病原鉴定[J]. 植物病理学报,2012,42(2):120-125. [17]王丽颖, 刘君丽,孙芹,等. 唑菌酯与苯醚甲环唑混剂对瓜类炭疽病的防治[J]. 农药, 2015 (7):530-532. (责任编辑:杨明丽) Sensitivity differentiation of differentColletotrichumspp. strains causing anthracnose ofCapsicumannuumL.plants to pyraoxystrobin Man Yilong1,2, Tan Xinqiu2, Si Naiguo3, Chen Yue2, Zhang Zhuo2, Liu Yong1,2, Zhang Deyong1,2 (1. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Province Key Laboratory of Integrated Management of the Pests and Diseases on Horticultural Crops,Institute of Plant Protection, Hunan Academy of Agricultural Sciences, Changsha 410125, China;3. Shenyang Research Institute of Chemical Industry, Shenyang 110021, China) The anthracnose disease caused byColletotrichumspp. is an important limited factor in pepper production in the world. Many chemicals have been used to control this disease in the fields. However, so far, pyraoxystrobin, a new strobilurin fungicide, hasn’t been reported in the disease control. Therefore, sensitivities of four differentColletotrichumstrains to pyraoxystrobin were determined through bioassay of mycelial growth rate, and target gene of pyraoxystrobin, cytochrome b (Cytb) of differentColletotrichumspecies was cloned and analyzed in this study. The results showed that the EC50value of pyraoxystrobin toC.brevisporumYYGXZ07,C.truncatumCZHP03,C.acutatumHHBY48 andC.gloeosporioidesCSLL11 was 0.098,3.363,10.156 and 31.982 μg/mL,respectively. The mycelial growth rate was ranked asC.truncatumCZHP03 Colletotrichumspp.; pyraoxystrobin; bioassay; sensitivity 2016-03-06 2016-07-06 国家自然科学基金(31471831); “十二五”国家科技支撑计划(2014BAD05B04-4) S 436.418 A 10.3969/j.issn.0529-1542.2016.05.030 * 通信作者 E-mail:tanxinqiu2008@163.com;dyzhang78@163.com1 材料与方法
2 结果与分析


3 讨论

