HPLC法同时测定大黄炮制品中10种化学成分的含量Δ
颜永刚,尹立敏,王红艳,郭玲玲,邓 翀(陕西中医药大学药学院,陕西咸阳 712046)
HPLC法同时测定大黄炮制品中10种化学成分的含量Δ
颜永刚*,尹立敏,王红艳,郭玲玲,邓翀(陕西中医药大学药学院,陕西咸阳712046)
目的:建立同时测定生大黄、酒大黄、熟大黄、大黄炭、醋大黄中没食子酸、儿茶素、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷含量的方法,并分析其差异。方法:采用高相液相色谱法。色谱柱为Hypersil C18,流动相为甲醇-0.2%乙酸(梯度洗脱),流速为1.0 ml/min,检测波长为260 nm,柱温为25℃,进样量为10 μl。结果:没食子酸、儿茶素、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷检测进样量线性范围分别为0.252 5~4.040 0 μg(r=0.999 6)、0.600 0~9.600 0 μg(r=0.999 6)、0.297 4~4.758 4(r=0.999 9)、0.001 8~0.028 8 μg(r=0.999 9)、0.005 0~0.080 0 μg(r=0.999 9)、0.019 0~0.304 0 μg(r=0.999 8)、0.380 2~6.083 2 μg(r= 0.999 7)、0.008 2~0.131 2 μg(r=0.999 8)、0.126 0~2.016 0 μg(r=0.999 6)、0.111 3~1.780 8 μg(r=0.999 8);精密度、稳定性、重复性试验的RSD<3.0%;加样回收率分别为96.17%~97.21%(RSD=1.67%,n=6)、97.60%~100.54%(RSD=2.55%,n=6)、99.45%~101.32%(RSD=1.63%,n=6)、95.31%~98.19%(RSD=2.42%,n=6)、98.99%~100.35%(RSD=1.86%,n=6)、98.95%~101.21%(RSD=2.17%,n=6)、99.81%~100.62%(RSD=1.66%,n=6)、96.78%~98.52%(RSD=1.99%,n=6)、97.80%~100.14%(RSD=3.32%,n=6)、97.40%~101.24%(RSD=2.89%,n=6)。与生大黄比较,酒大黄、醋大黄、大黄炭中的没食子酸、儿茶素、番泻苷B和蒽醌类成分含量减少,熟大黄中儿茶素、番泻苷B和蒽醌类成分含量减少,在大黄炭中未检测到儿茶素、番泻苷B、大黄素-1-O-葡萄糖苷、芦荟大黄素、大黄酸。结论:该方法操作简便,精密度、稳定性、重复性良好,可用于大黄炮制品中10种化学成分的同时测定;大黄不同炮制品中10种化学成分含量均有明显差异。
大黄;高效液相色谱法;没食子酸;儿茶素;番泻苷B;蒽醌类
大黄为蓼科掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum Maxim.ex Balf.或药用大黄Rheum officinale Baill.的干燥根及根茎,其味苦、性寒,归脾、胃、大肠、肝、心包经,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄的功效[1]。临床常用饮片为生大黄、酒大黄、熟大黄、醋大黄和大黄炭。酒大黄苦寒泻下作用稍缓,并借酒升提之性,引药上行,善清上焦血分热毒;熟大黄泻下作用缓和,而活血化瘀和泻火解毒功效增强;醋大黄泻下作用减弱,以消积化瘀为主;大黄炭泻下作用极微,而凉血化瘀止血作用明显[2]。大黄不同的炮制品,因炮制温度、时间、辅料不同,其本身化学成分、药性发生变化,从而改变其临床作用的不同[3]。现代药理研究表明,鞣质中的没食子酸及儿茶素是大黄发挥止血作用的有效成分;大黄泻下、解热作用与蒽醌含量是密切相关的,同时泻下解热作用与鞣质含量也呈正相关[4-6]。蒽醌苷元是大黄活血化瘀主要物质基础[7]。大黄酸和大黄素有明显的利尿作用,大黄酸、大黄素和芦荟大黄素有明显的抗炎作用[8]。大黄中的多糖成分具有抗衰老、补益、调血脂、保护肝脑的作用[9-10]等。鉴于此,本课题组重点分析大黄不同炮制品中蒽醌类和鞣酯类化学成分的变化,旨在为其质量标准制订和临床合理用药提供科学依据。
1 材料
1.1仪器
U-3000型高效液相色谱仪,包括四元超高压溶剂系统、自动进样恒温样品管理器、UV2489 PDA检测器、Chromeleon色谱工作站(美国Dionex公司);FW-200型高速万能粉碎机(北京中兴伟业仪器有限司);KQ-200KED型超声波清洗机(江苏昆山市超声仪器有限公司);GB204型电子分析天平(北京赛多利斯科学仪器有限公司)。
1.2试剂
没食子酸对照品(批号:122811,纯度>99%)、儿茶素对照品(批号:11c15,纯度>98%)、番泻苷B对照品(批号:11z15,纯度>98%)均购自天津西玛科技有限公司;芦荟大黄素对照品(批号:03071201,纯度>99%)、大黄素对照品(批号:110795-200505,纯度>98%)、大黄酚对照品(批号:110796-200615,纯度>99%)、大黄酸对照品(批号:0757-200206,纯度>99%)、大黄素甲醚对照品(批号:110758-200610,纯度>98%)、大黄酚-1-O-葡萄糖苷对照品(批号:110796-200615,纯度>98%)、大黄素-8-O-葡萄糖苷对照品(批号:10756-200110,纯度>98%)均购自中国食品药品检定研究院;甲醇为色谱纯,其余试剂均为分析纯,水为纯化水。
1.3药材
大黄药材于2015年11月12日购自甘肃省兰州市黄河中药材市场,经陕西中医药大学胡本祥教授鉴定为真品。大黄5种炮制品(生大黄、酒大黄、熟大黄、醋大黄和大黄炭)分别按照《中药炮制学》中大黄项下炮制方法制备[2]。
2 方法与结果
2.1色谱条件与系统适用性试验
色谱柱:Hypersil C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.2%乙酸(B),梯度洗脱(洗脱程序见表1);流速:1.0 ml/min;检测波长:260 nm;柱温:25℃;进样量:10 μl。在上述色谱条件下,理论板数以各待测成分峰计均≥5 000;各成分基线分离良好,分离度>1.5,色谱峰对称因子均在0.95~1.05。色谱见图1。
2.2溶液的制备
2.2.1混合对照品溶液分别取10种待测成分对照品适量,精密称定,置于同一2 ml量瓶中,用甲醇溶解并定容,摇匀,制成没食子酸、儿茶素、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷质量浓度分别为2.525、6.002、2.974、1.260、1.113、0.018、0.050、0.190、3.802、0.082 mg/ml的混合对照品溶液。
2.2.2供试品溶液分别取生大黄、酒大黄、熟大黄、大黄炭、醋大黄样品各20 g,粉碎(过60目筛),混匀,分别取10 g,精密称定,加6倍量水,水沸腾后煎煮30 min,煎煮2次,2次滤液合并,浓缩,各取1/5浓缩物,分别置于50 ml具塞锥形瓶中,用甲醇定容,称定质量,超声(功率:500 W,频率:40 kHz)处理30 min,放至室温,加甲醇补足质量,摇匀,滤过,取续滤液,以0.45 μm微孔滤膜滤过,作为供试品溶液。
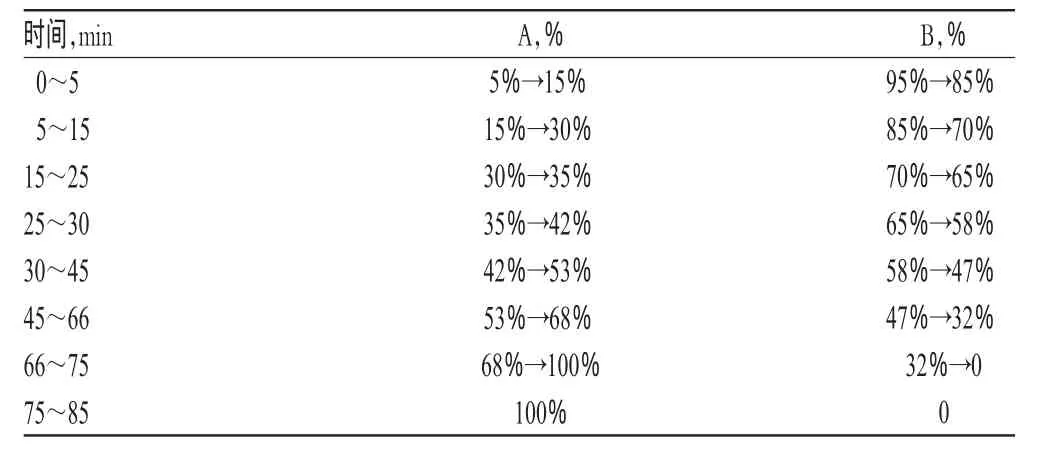
表1 梯度洗脱程序Tab 1 Gradient elution program

图1 高效液相色谱图A.混合对照品;B.生大黄供试品;1.没食子酸;2.儿茶素;3.番泻苷B;4.大黄酚-1-O-葡萄糖苷;5.大黄素-8-O-葡萄糖苷;6.芦荟大黄素;7.大黄酸;8.大黄素;9.大黄酚;10.大黄素甲醚Fig 1 HPLC chromatogramsA.mixed reference substance;B.Rhei Radix et Rhizoma test sample;1. gallic acid;2.catechin;3.sennosides B;4.chrysophanol-1-O-glucoside;5. emodin-8-O-glucoside;6.aloe-emodin;7.rhein;8.emodin;9.chrysophanol;10.physcion
2.3线性关系考察
精密量取混合对照品溶液0.01、0.02、0.04、0.08、0.16 ml、分别置于2 ml量瓶中,加甲醇定容,摇匀,得系列混合对照品溶液。按照“2.1”项下的色谱条件分别进样10 μl,记录色谱。分别以待测成分进样量(x,μg)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程与线性范围,详见表2。

表2 回归方程与线性范围Tab 2 Regression equations and linear ranges
2.4精密度试验
取“2.2.2”项下生大黄供试品溶液适量,按“2.1”项下色谱条件连续进样6次,记录峰面积。结果,没食子酸、儿茶素、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、大黄酚-1-O-葡萄糖苷和大黄素-8-O-葡萄糖苷峰面积的RSD分别为1.81%、2.03%、1.60%、1.31%、1.77%、1.52%、1.33%、1.28%、0.61%、1.49%,表明仪器精密度良好。
2.5稳定性试验
精密量取“2.2.2”项下生大黄供试品溶液适量,分别于室温下放置0、2、4、8、16、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,没食子酸、儿茶素、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、大黄酚-1-O-葡萄糖苷和大黄素-8-O-葡萄糖苷峰面积的RSD分别为2.13%、1.69%、1.55%、1.71%、1.58%、1.70%、1.63%、0.66%、1.53%和1.78%(n=6),表明供试品溶液在24 h内稳定性良好。
2.6重复性试验
取同一批生大黄样品粉末适量,精密称定,按“2.2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积。结果,没食子酸、儿茶素、番泻苷B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、大黄酚-1-O-葡萄糖苷和大黄素-8-O-葡萄糖苷平均含量的RSD分别为2.77%、2.21%、1.67%、1.64%、1.84%、1.33%、1.16%、1.41%、2.27%和2.12%,表明本方法重复性较好。
2.7加样回收率试验
取生大黄样品粉末6份,每份约0.2 g,精密称定,分别加入一定含量待测成分对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表3。
2.8样品含量测定
取大黄各炮制品适量,粉碎,过60目筛。按不同比例配比,每个样品平行称3份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,计算样品含量,结果见表4。
3 讨论
3.1分析成分的筛选
现代研究发现,大黄中主要含有蒽醌类、酚类、鞣质类、氨基酸、多糖类等多种化学成分,其生物活性最显著的是蒽醌和鞣质类[3-4]。本试验确定通过同时测定大黄不同炮制品中的游离型蒽醌:芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚;结合型蒽醌:大黄酚-1-O-葡萄糖苷、大黄素-8-O-葡萄糖苷;以及没食子酸、儿茶素、番泻苷B共10种成分[11-12],进而分析不同炮制方法对大黄中化学成分含量的影响。

表3 加样回收率试验结果(n=6)Tab 3 Results of recovery tests(n=6)

表4 样品含量测定结果(n=3,mg/g)Tab 4 Results of contents determination in samples(n=3,mg/g)
3.2色谱条件的选择
检测波长采用PDA检测器在200~500 nm之间进行了考察;结果表明,检测波长在260 nm时,色谱图所包含的信息量较大,杂质干扰较少,线性关系和重复性良好,各色谱峰分离较好,结合相关参考文献[13-15],最终本试验选择检测波长为260 nm。流动相分别考察了乙腈-0.05%乙酸、乙腈-0.1%乙酸、乙腈-0.2%乙酸、甲醇-0.05%乙酸、甲醇-0.1%乙酸、甲醇-0.2%乙酸等。结果,采用甲醇-0.2%乙酸梯度洗脱时,色谱峰分离度良好,故最终选择甲醇-0.2%乙酸梯度洗脱作为流动相。
3.3含量测定结果分析
与生大黄比较,醋大黄、酒大黄、熟大黄、大黄炭中的没食子酸、儿茶素、番泻苷B和蒽醌类成分含量减少(熟大黄中的没食子酸增加除外),并且在大黄炭中儿茶素、番泻苷B、大黄素-1-O-葡萄糖苷、芦荟大黄素、大黄酸5种化学成分未检测到。各成分含量高低排列顺序分别为游离型蒽醌:生大黄>酒大黄>醋大黄>熟大黄>大黄炭;结合型蒽醌:生大黄>醋大黄>酒大黄>熟大黄>大黄炭;没食子酸:熟大黄>生大黄>醋大黄>大黄炭>酒大黄;儿茶素:生大黄>醋大黄>酒大黄>熟大黄>大黄炭;番泻苷B:生大黄>醋大黄>酒大黄>熟大黄>大黄炭。大黄经炮制后不但苷类水解及所含成分减少,而且发生了复杂的化学变化,其中成分比例重新组合[16],表明生大黄、醋大黄、酒大黄、熟大黄、大黄炭5种炮制品在临床上功效的不同,不仅有中药大黄传统的苦寒药性变化,而且有明显的化学成分差异表现。
进一步分析发现,生大黄、醋大黄、酒大黄、熟大黄、大黄炭5种炮制品在游离型蒽醌、结合型蒽醌、没食子酸、儿茶素、番泻苷B多种化学成分方面发生变化的主要影响因素有炮制过程中的净制、炮制温度、时间、辅料等。例如,5种炮制品中蒽醌类成分含量减少,炮制温度可能是蒽醌类成分降低的原因之一。这与已经报道大黄中蒽醌类成分有一定的毒副作用一致[17];熟大黄中没食子酸的提取量增加,可能与大黄中鞣质的水解有关;醋大黄中番泻苷B的提取量增加,可能是pH环境改变所致;大黄炭中5种化学成分的消失,主要是炒炭过程中高温对其结构的破坏。本试验证实了大黄不同炮制品中的化学成分变化与大黄传统药性理论的苦寒药性变化基本一致[18]。大黄不同炮制品因炮制温度、加热时间、所用辅料等条件不同,都在物质成分的变化中体现,而变化程度同炮制条件的强烈程度相关。此外,炮制过程中的一些经验因素也会对结果造成影响。这就要求必须建立大黄蒽醌类、鞣质类、多糖类等成分的多指标评价体系,规范大黄的炮制工艺,制订其质量标准,以指导实际生产工作,进而为中药大黄的临床应用和深入研究提供科学依据。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:23.
[2]龚千锋.中药炮制学[M].北京:中国中医药出版社,2012:8.
[3]曹宏伟.大黄的炮制作用与应用[J].中国医药科学,2013,3(8):91.
[4]胡永淑.大黄炮制前后物质基础变化研究[J].中国药房,2014,25(11):1 016.
[5]隋峰,闫美娟,林娜,等.大黄不同炮制品解热作用及机制研究[J].中国实验方剂杂志,2012,18(15):167.
[6]李春凤,孙瑶,简洁.表没食子儿茶素没食子酸酯调控自噬抗心肌缺血再灌注损伤[J].中国新药与临床杂志,2015,34(6):471.
[7]隋峰,闫美娟,李燕,等.不同炮制法对大黄活血化瘀作用影响的比对研究[J].中药药理与临床,2012,28(6):90.
[8]杨伟鹏,王怡薇,王彦礼,等.不同炮制方法对大黄泻下、解热、抗炎作用的影响[J].中国实验方剂学杂志,2011,17(13):117.
[9]袁常青,邢亮.大黄的炮制及其药理分析[J].中国现代药物应用,2010,4(9):122.
[10]杨武德,李聪.大黄生品及炮制品中总糖及多糖的含量测定[J].中国药房,2010,21(19):1 759.
[11]葛亚宁,魏宝林,董明芝,等.不同炮制方法对大黄有效成分的影响研究[J].陕西中医,2013,34(8):1 069.
[12]付绍智,王婷婷,高文远,等.基于主成分分析的不同初加工方法大黄的蒽醌及酚酸类成分比较研究[J].中国中药杂志,2014,39(5):833.
[13]卫昊,冯改利,郑洁,等.清蒸和酒蒸对大黄中9种化学成分的影响分析[J].中成药,2013,35(3):777.
[14]高晓燕,卢建秋.HPLC-DAD法同时测定大黄中7个蒽醌类化合物的含有量[J].药物分析杂志,2010,30(9):1 636.
[15]毛春芳,施忠,罗琳,等.HPLC法同时测定大黄中芦荟大黄素等11种成分的量[J].中草药,2014,45(16):2 400.
[16]李会芳,孙琴,王伽伯.大黄炮制后化学组分转移规律研究[J].山西中医学院学报,2011,12(6):14.
[17]代春美.基于大黄蒽醌、鞣质类物质作用于HK-2细胞的毒效相关性研究[D].成都:成都中医药大学,2013.
[18]李丽,肖永庆.大黄饮片炮制前后物质基础变化规律研究[J].中华中医药杂志,2012,27(4):803.
(编辑:张静)
Simultaneous Determination of 10 Kinds of Chemical Components in Processed Products of Rhei Radix et Rhizoma
YAN Yonggang,YIN Limin,WANG Hongyan,GUO Lingling,DENG Chong(School of Pharmacy,Shaanxi University of Chinese Medicine,Shaanxi Xianyang 712046,China)
OBJECTIVE:To establish a method for the contents of gallic acid,catechin,sennosides B,aloe-emodin,rhein,emodin,chrysophanol,physcion,chrysophanol-1-O-glucoside and emodin-8-O-glucoside in Rhei Radix et Rhizoma,Jiu Rhei Radix et Rhizoma,Shu Rhei Radix et Rhizoma,Rhei Radix et Rhizoma tan,Cu Rhei Radix et Rhizoma,and analyze the differences.METHODS:HPLC was performed on the column was Hypersil C18with mobile phase of methanol-0.2%acetic acid(gradient elution)at a flow rate of 1.0 ml/min,the detection wavelength was 260 nm,column temperature was 25℃,injection volume was 10 μl.RESULTS:The linear range was 0.252 5-4.040 0 μg for gallic acid(r=0.999 6),0.600 0-9.600 0 μg for catechin(r= 0.999 6),0.297 4-4.758 4 μg for sennosides B(r=0.999 9),0.001 8-0.028 8 μg for aloe-emodin(r=0.999 9),0.005 0-0.080 0 μg for rhein(r=0.999 9),0.019 0-0.304 0 μg for emodin(r=0.999 8),0.380 2-6.083 2 μg for chrysophanol(r=0.999 7),0.008 2-0.131 2 μg for physcion(r=0.999 8),0.126 0-2.016 0 μg for chrysophanol-1-O-glucoside(r=0.999 6)and 0.111 3-1.780 8 μg for emodin-8-O-glucoside(r=0.999 8);RSDs of precision,stability and reproducibility tests were lower than 3.0%;recoveries were 96.17%-97.21%(RSD=1.67%,n=6),97.60%-100.54%(RSD=2.55%,n=6),99.45%-101.32%(RSD=1.63%,n=6),95.31%-98.19%(RSD=2.42%,n=6),98.99%-100.35%(RSD=1.86%,n=6),98.95%-101.21%(RSD=2.17%,n=6),99.81%-100.62%(RSD=1.66%,n=6),96.78%-98.52%(RSD=1.99%,n=6),97.80%-100.14%(RSD=3.32%,n=6)and 97.40%-101.24%(RSD=2.89%,n=6).Compared with Sheng Rhei Radix et Rhizoma,the contents of gallic acid,catechin,sennosides B and anthraquinones in Cu Rhei Radix et Rhizoma,Jiu Rhei Radix et Rhizoma and Rhei Radix et Rhizoma tan decreased. The contents of catechin,sennosides B and anthraquinones in Shu Rhei Radix et Rhizoma.Catechin,sennosides B,chrysophanol-1-O-glucoside,aloe-emodin and rhein were not detected in Dahuang tan.CONCLUSIONS:The method is simple with good precision,stability and reroducibility,and can be used for the simultaneous determination of 10 chemical components in processed products of Rhei Radix et Rhizoma;there were significant differences in contents of 10 chemical components in processed products of Rhei Radix et Rhizoma.
Rhei Radix et Rhizoma;HPLC;Gallic acid;Catechin;Sennoside B;Anthraquinones
R927
A
1001-0408(2016)27-3839-04
10.6039/j.issn.1001-0408.2016.27.31
陕西省教育厅重点实验室科研计划项目(No.13JS030);陕西省教育厅专项科研计划项目(No.14JK1204)
*副教授,硕士生导师,博士。研究方向:中药品种、品种与资源开发、中药物质基础和质量标准。电话:029-38185165。E-mail:yunfeng828@163.com
(2016-02-13
2016-04-27)

