溶液组成对焙烧-水化制备氢氧化镁纳米片的影响
陈泆君,马祥伟,易美桂(四川大学化工学院,四川成都610065)
溶液组成对焙烧-水化制备氢氧化镁纳米片的影响
陈泆君,马祥伟,易美桂
(四川大学化工学院,四川成都610065)
以团聚态工业氢氧化镁为原料,采用焙烧-水化法制备高分散氢氧化镁纳米片,探讨了水化过程中溶液组成对产物形貌和分散性的影响。研究结果表明:采用1 mol/L MgCl2溶液为水化介质,可促进氢氧化镁的溶解-重结晶过程,利于形成形貌规则、分散性较好的氢氧化镁纳米片;同时,在水化介质中添加十二烷基硫酸钠可降低氢氧化镁表面电位,抑制纳米片团聚,可制备直径为0.5~0.8 μm、团聚粒径为3.3 μm的高分散氢氧化镁纳米片。
氢氧化镁;焙烧;水化介质;表面活性剂;分散性
氢氧化镁是一种生态环保材料,用于无机阻燃剂具有无毒、热稳定性高的优点。但由于氢氧化镁表面极性强,常规方法合成的产物一般团聚严重,难以均匀分散在基体中,从而影响了复合材料的阻燃性能和机械加工性能[1]。科研工作者此前多采用水热法对常温合成的纳米氢氧化镁进行改性,以获得高分散氢氧化镁纳米片[2-4]。笔者所在课题组提出以团聚态工业氢氧化镁为原料,通过焙烧-水化得到活性氢氧化镁,再经水热处理制备高分散氢氧化镁的思路[5],但水化步骤仍存在温度较高的问题。在前期工作基础上,笔者以焙烧-低温水化法(<100℃)制备形貌规则、高分散氢氧化镁纳米片,考察了水化介质(H2O、MgCl2和NaOH)及添加表面活性剂对产物形貌和分散性的影响,结合溶液组成和产物表面性质初步探讨了低温水化过程中高分散氢氧化镁纳米片形成的规律。
1 实验方法
1.1 实验方法
氢氧化镁原料来自中国某化工企业。其余所用试剂均为分析纯。将氢氧化镁与20%(质量分数)MgCl2及少量水配成浆料,在500℃下恒温4 h。称取适量焙烧产物和表面活性剂(聚乙二醇、十二烷基硫酸钠或六偏磷酸钠),分别加入H2O、1 mol/L MgCl2、1 mol/L NaOH溶液,在80℃和750 r/min条件下水化12h。再经过滤、洗涤、在105℃下烘干12h。
1.2 分析检测
采用JSM7401F型扫描电镜和JEM-2010型高分辨率透射电镜观察样品形貌;采用D8 Advance型X射线衍射仪分析样品晶体结构;采用Mastersizer 3000型粒度分析仪测定样品的表观团聚粒径和粒度分布;采用560型傅立叶变换红外光谱仪测定分散剂的官能团在氢氧化镁表面吸附;采用Zeta PLAS型电位分析仪测定氢氧化镁悬浮液的表面电位。
2 结果和讨论
2.1 水化介质的影响
图1为工业团聚态氢氧化镁原料的SEM形貌照片、XRD谱图及粒径分布。由图1a~1b可见,原料由不规则片状物团聚而成的微球(直径为 5.0~15.0 μm)组成。由图1c~1d可见,原料为结晶良好的氢氧化镁相,表观团聚粒径呈双峰分布,平均粒径为12.5 μm。因此确定,工业氢氧化镁具有形貌不规则、团聚严重的特点。
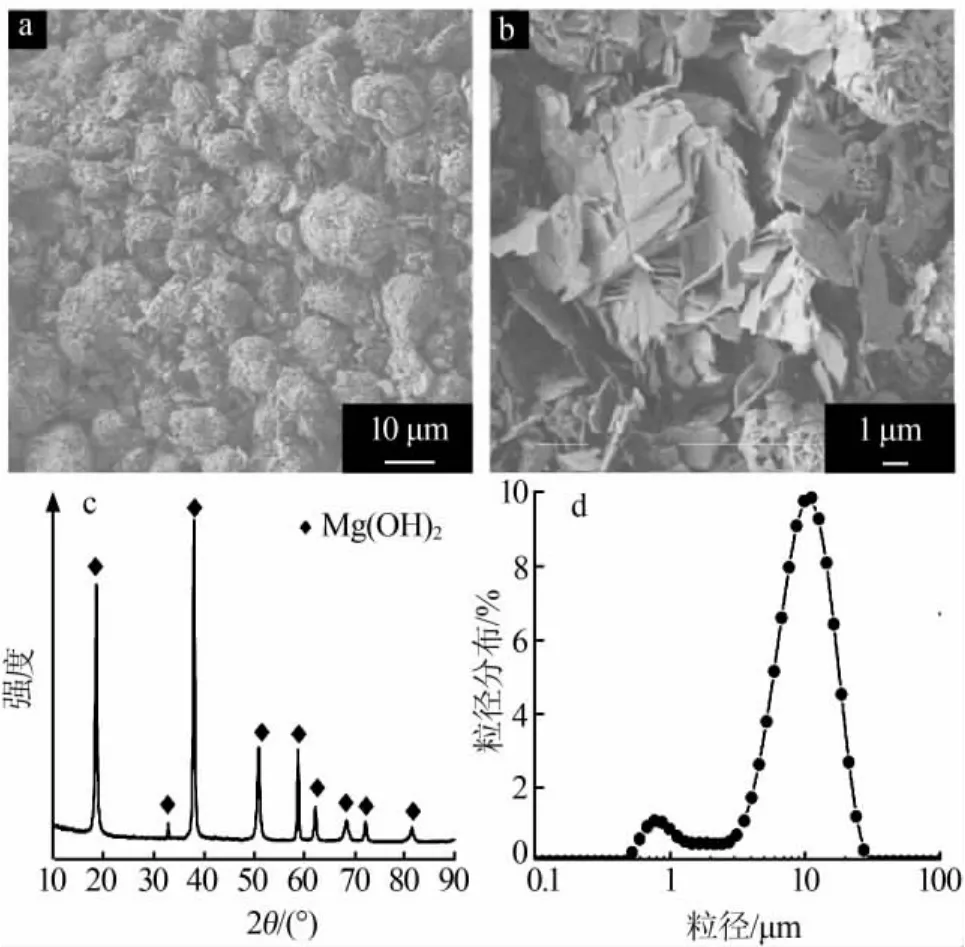
图1 工业团聚氢氧化镁
图2为3种水化介质 (去离子水、1 mol/L MgCl2和1 mol/L NaOH)对产物形貌及团聚粒径分布的影响。由图2可见,去离子水中水化产物呈不规则片状团聚物(直径为 0.6~1.0 μm,团聚粒径为8.7 μm);氯化镁溶液中水化产物呈规则近圆形片状(直径为0.5~0.8 μm,厚度为20~30 nm),团聚粒径下降至5.2 μm,且纳米片形貌较均一;NaOH溶液中水化产物虽然团聚粒径降至3.1 μm,但呈不均匀颗粒状(直径为0.1~0.8 μm),无法形成纳米片。以上结果表明,1 mol/L MgCl2溶液水化有助于获得形貌规则的氢氧化镁纳米片,并可提高纳米片的分散性。

图2 水化介质对氢氧化镁形貌(a~c)及团聚粒径分布(d)的影响
图3为不同水化介质下氢氧化镁的XRD谱图。由图3可见,去离子水、MgCl2和NaOH溶液中的水化产物,特征衍射峰(001)和(101)相对强度I(001)/I(101)分别为 0.56、0.63和 0.91。水化介质为 MgCl2和NaOH时,I(001)/I(101)增大表明了极性较弱的(001)面暴露增加,而极性较强的(101)面相应受到抑制。前人研究表明,氢氧化镁粉体(101)面上的极性和微观内应都比较大,而这正是引起颗粒团聚的主要原因[6-7]。因此,MgCl2和NaOH中形成的氢氧化镁的表面极性和微观内应力降低,结构更稳定,因而团聚趋势减弱。

图3 不同水化介质下氢氧化镁的XRD谱图
图4a~4c为MgCl2溶液中不同水化时间所形成产物的TEM图像。由图4a~4c可见,水化20 min的产物中,仍存有大量团聚态氢氧化镁,但已有部分氢氧化镁纳米片从团聚体中剥落;水化至40 min时,剥落的分散纳米片进一步增加;水化1 h时,产物大部分为分散纳米片,团聚体已基本解体。图4d为纯水中水化1 h的产物。由图4d可见,纳米片团聚体基本保持原有形貌,这表明MgCl2溶液可能促进了氢氧化镁纳米片的溶解-重结晶过程,导致团聚体的破碎、解体,从而形成较分散、形貌规则的氢氧化镁纳米片。
水化介质对氢氧化镁的形貌及分散性的影响可能与溶液中各组分含量相关。利用热力学计算了实验条件下MgO-Mg(OH)2-H2O体系在不同水化介质中各组分含量变化。

图4 不同介质中水化产物形貌随时间变化
表1 为MgO-Mg(OH)2-H2O在不同水化介质的平衡体系的可能反应及相应平衡常数(80℃),平衡常数采用水溶液热力学软件HSC计算获得。表2为根据表1中平衡反应计算在H2O、MgCl2、NaOH溶液中80℃水化反应过程各组分的平衡浓度(计算过程中用浓度代替活度)。由表1~2可见,MgCl2溶液中Mg2+和MgOH+组分浓度远高于H2O和NaOH溶液;NaOH溶液中的OH-浓度最大,MgCl2溶液最小。根据前人研究可知[5],高浓度的Mg2+和MgOH+可能对氢氧化镁纳米片的溶解-重结晶过程有一定的促进作用,并有利于水化生成形貌规则、片状氢氧化镁;而OH-浓度较高时易导致氢氧化镁颗粒形成。

表1 平衡反应和平衡常数

表2 不同溶液的组分平衡浓度 mol/L
2.2 表面活性剂的影响
为进一步提高水化产物的分散性,在水化过程中加入表面活性剂。图5为不同表面活性剂对氢氧化镁形貌和分散性的影响。由图5可见,添加聚乙二醇(PEG)、十二烷基硫酸钠(SDS)及六偏磷酸钠(SHMP)的水化产物团聚粒径分别为5.4、3.3、3.0 μm。PEG对水化产物形貌和分散性均影响不大;添加SDS的水化产物片之间团聚明显减弱,大部分可呈单分散片状;添加SHMP的水化产物虽然团聚粒径最小,但形貌转变为锥状,无法形成纳米片。

图5 分散剂对水化产物的影响
图6a为不同表面活性剂下水化产物的红外光谱图。由图6a可见,3 699 cm-1处是氢氧化镁的特征吸收峰,2 918 cm-1和2 858 cm-1处是SDS—CH2—对称和非对称伸缩振动吸收峰,1 298 cm-1处是SHMP中P=O键伸缩振动峰,未发现PEG的基团吸收峰位置。该结果表明,PEG难以吸附在氢氧化镁表面,而SDS和SHMP可吸附在氢氧化镁表面。图6b为不同添加剂条件下水化产物的表面电位。由图6b可见,氢氧化镁在MgCl2溶液中表面电位为-3.02 mV,氢氧化镁片之间的静电斥力较小,易发生团聚。聚乙二醇是长链、中性表面活性剂,加入悬浮液中对氢氧化镁表面电位影响不大,对其团聚状态没有影响。SDS使氢氧化镁表面电位降至-34.6 mV,提高氢氧化镁片间的静电斥力,有利于片之间分散;SHMP虽显著降低了氢氧化镁的表面电位(-37.67 mV),但在水化反应时改变了氢氧化镁的生长方向。上述结果表明,在水化时添加SDS,可有效提高氢氧化镁纳米片的分散性。
Influence of solution composition on synthesis of dispersive Mg(OH)2nanoplates via sintering-hydration route
Chen Yijun,Ma Xiangwei,Yi Meigui
(College of Chemical Engineering,Sichuan University,Chengdu 610065,China)
Highly dispersive Mg(OH)2nanoplates were synthesized from industrial Mg(OH)2agglomerates via sinteringhydration method.The influence of solution composition in the hydration step on the morphology and dispersion of Mg(OH)2nanoplates was studied.Experimental results indicated that taking MgCl2solution with 1 mol/L as the hydration medium could promote the dissolution and recrystallization of Mg(OH)2,and it was also in favor of the formation of uniform and well-dispersed Mg(OH)2nanoplates.Meanwhile,the addition of sodium dodecyl sulfate led to the decrease of the zeta potential of Mg(OH)2,which inhibited the aggregation,leading to formation of high-dispersive Mg(OH)2nanoplates with diameter at 0.5~0.8 μm and agglomerate size in 3.3 μm.
magnesium hydroxide;sintering;hydration media;surfactants;dispersion
TQ132.2
A
1006-4990(2016)11-0035-03

