T3N0M0期肾细胞癌患者预后相关因素分析:单中心182例患者回顾性研究
彭 鼎,李学松,张崔建,杨恺惟,唐 琦,张 雷,余霄腾,何志嵩,周利群
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿、男性生殖系肿瘤诊治中心,北京 100034)
·论著·
T3N0M0期肾细胞癌患者预后相关因素分析:单中心182例患者回顾性研究
彭 鼎*,李学松*,张崔建△,杨恺惟,唐 琦,张 雷,余霄腾,何志嵩,周利群△
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿、男性生殖系肿瘤诊治中心,北京 100034)
目的:研究影响T3N0M0期肾细胞癌患者肿瘤学预后的临床及实验室检查因素。方法:回顾性分析2007年至2012年于北京大学第一医院行手术治疗的T3N0M0肾细胞癌患者的临床资料、实验室检查结果及随访数据。应用Kaplan-Meier法计算生存率,Log-rank方法进行单因素分析,对单因素分析中显著相关的变量采用Cox模型进行多因素生存分析。结果:共182例T3N0M0肾细胞癌患者纳入研究,其中男性患者126例(69.23%),女性患者56例(30.77%)。患者平均年龄为(56.75±12.45)岁,中位随访时间48个月(3~99个月),末次随访时共有50例(27.47%)患者死亡,59例患者(32.42%)复发。患者的5年肿瘤特异性生存率为68.30% (95%CI: 60.16%~75.84%),5年无复发生存率为60.70%(95%CI: 53.16%~68.84%)。多因素分析发现,糖尿病(HR=2.434, 95%CI:1.243~4.769,P=0.010)、术前低白蛋白血症(HR=2.188, 95%CI:1.074~1.074,P=0.031)及贫血(HR=3.320, 95%CI:1.839~5.991,P<0.001)是T3N0M0肾细胞癌患者术后肿瘤特异生存的独立危险因素,更高的Fuhrman分级(HR=2.552, 95%CI:1.433~4.545,P=0.001)、术前贫血(HR=2.535, 95%CI:1.497~4.293,P=0.001)是T3N0M0肾细胞癌患者术后复发的独立危险因素。结论:糖尿病、术前低白蛋白血症、贫血是T3N0M0肾细胞癌患者术后生存的独立危险因素;高Fuhrman分级、贫血是T3N0M0肾细胞癌患者术后复发的独立危险因素。
肾肿瘤;癌,肾细胞;治疗结果;肾切除术
肾细胞癌(renal cell carcinoma,RCC)占所有恶性肿瘤的3.9%,其中85%为透明细胞癌(clear cell renal cell carcinoma,ccRCC)[1-2]。根据《2015年中国癌症统计》,中国每年新增肾癌66 800例,死亡23 400例[3]。在2002年至2011年的10年中,RCC发病率年增长1.6%[4],因此,研究RCC的预后及术后风险因素对于预测患者复发、转移、肿瘤死亡及制定随访策略具有重要意义。
目前,RCC最常用的预后因素仍是TNM分期和Fuhrman分级,两者分别反映了肿瘤的解剖特征和分化特征与生存的关系。不同临床特征的患者能够表现出显著不同的预后特点,而针对T3N0M0这一特定分期RCC患者的研究较少。本研究对T3N0M0的RCC患者临床资料与实验室检查结果进行了回顾性研究,探讨其与预后的相关性。
1 资料与方法
1.1 病例选择与评估
2007年至2012年共有2 651例RCC患者于北京大学第一医院行手术治疗,根据2010年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)的TNM分期[5],其中共有189例T3N0M0患者,因其中7例无随访数据,予以排除,所以共182例患者纳入本研究。所有患者术前均有完整的辅助检查资料(胸部X线片、腹部超声、泌尿系CT以及实验室检查项目;如有临床相关症状的患者进一步检查头颅CT、骨扫描、胸部CT等),术前均无转移,术后组织病理检查无淋巴结转移,组织病理类型均为RCC。
本研究所统计的患者临床及病理特征包括性别、年龄、体重指数(body mass index,BMI)、糖尿病病史、血尿病史、组织病理亚型、肿瘤侵犯范围、Fuhrman分级、肿瘤部位、肿瘤最大径、肾盂侵犯、肾窦脂肪侵犯、手术类型(开放手术及腹腔镜手术)、手术方式[肾部分切除术(partial nephrectomy, PN)及根治性肾切除术(radical nephrectomy,RN)]。实验室指标包括术前白蛋白、胆固醇、血红蛋白、中性粒细胞百分比。组织病理学亚型根据2004年世界卫生组织(World Health Organization,WHO)标准分类,Fuhrman分级根据1997年WHO推荐标准评估[6],分期根据2010年AJCC TNM分期标准进行[5]。
患者随访策略为术后2年内每3个月随访一次,第2~4年为每半年随访一次,第5年及以后每年随访一次。随访资料包括影像学(胸部X线片、CT、B超)和实验室检查(血常规、生化全项、尿常规等)。患者随访结果包括肿瘤特异性生存(cancer-specific survival,CSS)及无复发生存(recurrence-free survival,RFS), 复发包括局部复发及远处转移。随访时间为手术日期到肿瘤复发、肿瘤特异死亡、末次随访的时间,单位为月。
1.2 统计学分析
数据分析使用SPSS软件(19.0,Chicago, Illinois),呈正态分布的数值型变量,使用均数±标准差表示,不符合正态分布的变量,采用中位数及极值的形式。用Kaplan-Meier法绘制曲线及生存率的估计,Log-rank检验进行单因素分析,P<0.05为差异有统计学意义。单因素分析中有显著差异的变量,进行Cox回归模型多因素分析,以逐步向前法得到CSS及RFS的独立危险因素。
2 结果
按照纳入标准,共182例患者纳入研究,其中失访病例12例,失访率6.59%。182例入组患者中男性126例(69.23%),女性56例(30.77%);患者平均年龄(56.75±12.45)岁,其他一般临床特征如表1所示。患者中位随访时间48个月(3~99个月),末次随访时共有50例患者(27.47%)死亡,59例患者(32.42%)复发。患者的5年肿瘤特异性生存率为68.30%(95%CI:60.16%~75.84%), 5年无复发生存率为60.70%(95%CI:53.16%~68.84%,图1)。
采用Log-rank检验对可能影响T3N0M0RCC预后的因素(性别、年龄、BMI、糖尿病病史、血尿、组织病理亚型、Fuhrman分级、肾盂浸润、肾窦脂肪浸润、肿瘤侵犯范围、左右侧、肿瘤最大径、手术方式、手术类型、术前白蛋白、胆固醇、血红蛋白、中性粒细胞百分比)进行单因素分析,结果如表1所示。

表1 患者一般临床特征及肿瘤特异性生存、无复发生存的单因素分析结果Table 1 Clinicopathologic characteristics of the patients and univariate analysis of prognostic factors for cancer-specific survival and recurrence-free survival
CSS,cancer-specific survival; RFS, recurrence-free survival; BMI, body mass index; DM, diabetes mellitus; IVC, inferior vena cava; ccRCC, clear cell renal cell carcinoma; PN, partial nephrectomy; RN, radical nephrectomy.
图1 Kaplan-Meier法计算患者的肿瘤特异生存曲线(A)及无复发生存曲线(B)
Figure 1 Kaplan-Meier method estimated cancer-specific survival (A) and recurrence-free survival (B)
对单因素分析中P<0.05的变量进行Cox多因素回归分析。在比例风险模型分析中,多因素分析发现糖尿病(HR=2.434, 95%CI:1.243~4.769,P=0.010)、术前低白蛋白血症(HR=2.188, 95%CI:1.074~1.074,P=0.031)及贫血(HR=3.320, 95%CI:1.839~5.991,P<0.001)是T3N0M0RCC患者术后肿瘤特异生存的独立危险因素(表2);更高的Fuhrman分级(HR=2.552, 95%CI:1.433~4.545,P=0.001)、术前贫血(HR=2.535, 95%CI:1.497~4.293,P=0.001)是T3N0M0RCC患者术后无复发生存的独立危险因素(表3)。
3 讨论
目前对RCC预后及危险因素的研究多为转移性肾细胞癌(metastatic RCC)及局限性肾细胞癌(localized RCC),而对于T3N0M0RCC患者的预后及预后因子的研究较少。Nayak等[7]的一项多中心研究中,176例T3N0M0RCC患者的中位随访时间为22.6个月,3年无进展生存(progression-free survival,PFS)为67%。本研究发现T3N0M0RCC患者的3年RFS为71%,结果相仿。Stewart等[8]研究了94例T3及T4RCC患者,中位随访时间为17.4个月,无术前转移患者的5年CSS为62.6%,无术前转移患者的5年PFS为44.6%。本研究中T3N0M0RCC患者的5年CSS和RFS分别为68.30%、60.70%,结果均优于上述研究,这应该与Stewart等[8]的研究中包括了一部分T4期患者有关。Chen等[9]最近研究了218例pT3期RCC患者,中位随访时间30.6个月,108例患者(49.5%)发生了肿瘤进展,80例患者(36.7%)发生了肿瘤死亡。本研究182例T3N0M0患者中共有50例(27.47%)患者肿瘤特异性死亡,59例患者(32.42%)发生了复发,均低于上述报道,可能与Chen等[9]的研究中包括了淋巴结阳性、术前有转移的患者导致总体生存率降低有关。
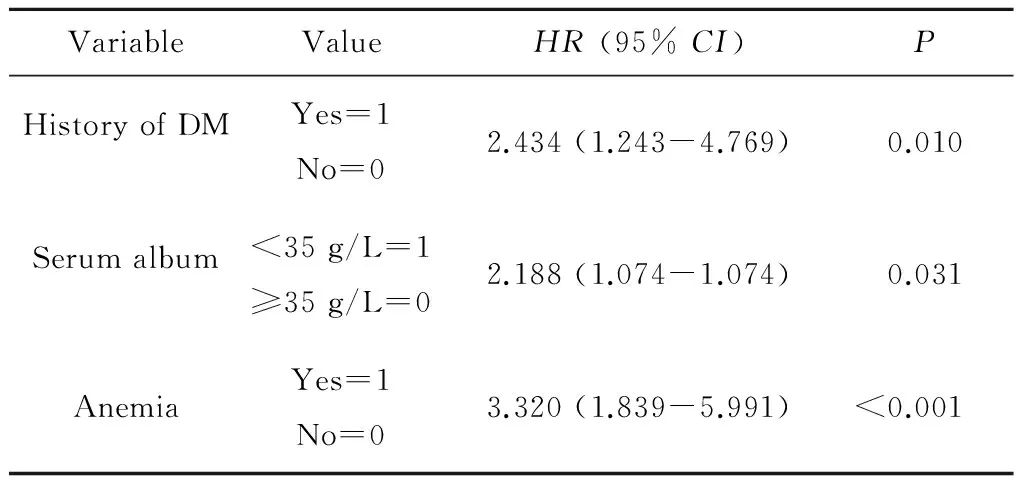
表2 肿瘤特异性生存的Cox多变量回归分析Table 2 Multivariate analyses of risk factors for cancer-specific survival
DM, diabetes mellitus.

表3 无复发生存的Cox多变量回归分析Table 3 Multivariate analyses of risk factors for recurrence-free survival
RCC的预后因子可以分为4类:解剖学因素、病理学因素、临床因素、分子标记物等,其中TNM分期和Fuhrman分级是目前应用最广的指标[1]。Chen等[9]通过单因素及多因素分析发现,集合系统侵犯、组织病理亚型、肿瘤最大径、术前转移是pT3期RCC患者CSS的独立危险因素;而在本研究中,组织病理亚型、肿瘤最大径并非T3N0M0RCC患者CSS的危险因素。本研究队列中非透明细胞癌的例数比较有限,这可能导致组织病理亚型对肿瘤学预后的影响并未体现出来,肿瘤最大径并非预后显著影响因素提示与肿瘤分期相比,肿瘤最大径可能只是患者预后的次要影响因素。
对于局限性RCC,已有许多文献报道经腹腔镜手术与开放手术对于患者肿瘤学预后的影响没有明显差异[10-12]。对于T3分期的RCC患者,Laird等[13]通过病例配对研究(开腹25例、腹腔镜25例)发现,腹腔镜及开腹患者术后的总生存率(overall survival,OS)、CSS和PFS均无显著差异。Bensalah等[14]对179例T3期RCC患者的配对研究(开腹135例、腹腔镜44例)显示,患者的术后OS无显著差异,在肾周脂肪浸润及肾静脉侵犯的亚组中,术后OS也无显著差异。本研究182例T3N0M0RCC患者中行开腹手术的患者133例、腹腔镜手术的患者49例,两组的CSS(P=0.392)及RFS(P=0.204)差异均无统计学意义,与以往的研究结果相符,说明对于T3N0M0RCC患者,腹腔镜手术在肿瘤学预后上与开放手术一样安全。
本研究中,糖尿病、术前低白蛋白、术前贫血是T3N0M0RCC患者CSS的独立危险因素;更高的Fuhrman分级、术前贫血是T3N0M0RCC患者RFS的独立危险因素。关于糖尿病与肾癌预后的关系,有一些单中心的回顾性研究[15-17]。Psutka等[18]的研究发现,RCC患者中糖尿病患者的5年OS显著低于非糖尿病患者(65%vs. 74%,P<0.001),多因素分析发现糖尿病是RCC患者CSS和OS的独立危险因素。本研究发现,T3N0M0RCC患者合并糖尿病的5年CSS显著低于无糖尿病患者(51%vs. 72%),多因素分析发现糖尿病史是T3N0M0RCC患者CSS的独立危险因素。Psutka等[18]认为,RCC患者中糖尿病患者的预后更差可能与其高胰岛素血症及高血糖血症有关。血浆中高胰岛素浓度会导致肝合成胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)增加,促进肿瘤细胞增殖,抑制了细胞凋亡,除此之外,高血糖还会导致肿瘤细胞中的无氧酵解即Warburg效应增加,促进肿瘤的生长[19-20],这些可能是合并糖尿病的T3N0M0RCC患者预后更差的原因。
术前低白蛋白血症及贫血都是反映患者营养缺乏的重要指标。许多研究发现在转移性RCC中术前低白蛋白血症、贫血是患者CSS或OS的独立危险因素[21-24]。Morgan等[25]将术前低白蛋白作为非转移RCC患者营养缺乏的标志,发现非转移肾癌患者中5%存在低白蛋白血症,25%存在贫血,多因素分析发现低白蛋白血症是RCC术后OS的独立危险因素(HR=2.41, 95%CI:1.40~4.18,P=0.002)。本研究中,T3aN0M0RCC患者中10.4%存在低白蛋白血症,26.4%存在贫血,均高于此前文献报道。由于本研究入选的均为T3期患者,而Morgan等[25]的报道中以T1~T2期患者为主,肿瘤分期的增高可能导致低白蛋白血症发生增加,这可能与肿瘤消耗增加导致的营养缺乏相关。术前低白蛋白血症的RCC患者预后更差的原因也可能与免疫因素相关,因白蛋白是免疫反应的重要影响因素,与C反应蛋白、红细胞沉降率一样是患者免疫应激状态的标志[25]。
贫血是恶性肿瘤患者中经常发生的并发症,目前认为,肿瘤患者贫血的产生原因可能有:(1)肿瘤释放的细胞因子(如IL-6等)能够通过影响铁调素的生成导致缺铁性贫血;(2)肿瘤细胞产生的活性氧能抑制红细胞生成;(3)肿瘤患者常伴有慢性出血,导致缺铁性贫血[26]。因此,肿瘤患者低白蛋白血症与贫血都可能反映其营养及免疫功能的紊乱,这可能是低白蛋白血症与贫血患者预后更差的原因。在一些指南中已经建议,即使推迟手术,也应在术前改善患者的营养状况[27]。对于T3N0M0RCC患者,术前监测白蛋白、血红蛋白,并对低白蛋白及贫血患者进行纠正,可能有助于改善其预后。
本研究的局限性是单中心、回顾性研究,样本量相对较小。T3N0M0RCC患者预后及危险因素的研究及术前监测白蛋白、血红蛋白,并对低白蛋白及贫血患者进行营养支持是否能改善其预后还需进一步的前瞻性、大样本量的多中心临床对照研究。
综上所述,糖尿病史、术前低白蛋白血症、术前贫血是T3N0M0RCC患者术后肿瘤特异生存的独立危险因素;更高的Fuhrman分级、术前贫血是T3N0M0RCC患者术后复发的独立危险因素。
[1]Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update [J]. Eur Urol, 2015, 67(5): 913-924.
[2]Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[3]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[4]Motzer RJ, Jonasch E, Agarwal N, et al. Kidney cancer, version 3.2015 [J]. J Natl Compr Canc Netw, 2015, 13(2): 151-159.
[5]Egner JR. AJCC cancer staging manual [J]. JAMA, 2010, 304(15): 1726-1727.
[6]Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma [J]. Am J Surg Pathol, 1982, 6(7): 655-663.
[7]Nayak JG, Patel P, Bjazevic J, et al. Clinical outcomes following laparoscopic management of pT3 renal masses: A large, multi-institutional cohort [J]. Can Urol Assoc J, 2015, 9(11-12): 397-402.
[8]Stewart GD, Ang WJ, Laird A, et al. The operative safety and oncological outcomes of laparoscopic nephrectomy for T3 renal cell cancer [J]. BJU Int, 2012, 110(6): 884-890.
[9]Chen L, Ma X, Li H, et al. Invasion of the urinary collecting system is an independent prognostic factor in pT3 renal cell carcinoma [J]. Urol Oncol, 2016, 34(7): 293. e11-16.
[10]Marszalek M, Meixl H, Polajnar M, et al. Laparoscopic and open partial nephrectomy: a matched-pair comparison of 200 patients [J]. Eur Urol, 2009, 55(5): 1171-1178.
[11]Simone G, Papalia R, Guaglianone S, et al. Laparoscopic versus open nephroureterectomy: perioperative and oncologic outcomes from a randomised prospective study [J]. Eur Urol, 2009, 56(3): 520-526.
[12]Porpiglia F, Volpe A, Billia M, et al. Laparoscopic versus open partial nephrectomy: analysis of the current literature [J]. Eur Urol, 2008, 53(4): 732-742; discussion 42-43.
[13]Laird A, Choy KC, Delaney H, et al. Matched pair analysis of laparoscopic versus open radical nephrectomy for the treatment of T3 renal cell carcinoma [J]. World J Urol, 2015, 33(1): 25-32.
[14]Bensalah K, Salomon L, Lang H, et al. Survival of patients with nonmetastatic pT3 renal tumours: a matched comparison of laparoscopicvs. open radical nephrectomy [J]. BJU Int, 2009, 104(11): 1714-1717.
[15]Fukushima H, Masuda H, Yokoyama M, et al. Diabetes mellitus with obesity is a predictor of recurrence in patients with non-metastatic renal cell carcinoma [J]. Jpn J Clin Oncol, 2013, 43(7): 740-746.
[16]Hofner T, Zeier M, Hatiboglu G, et al. The impact of type 2 diabetes on the outcome of localized renal cell carcinoma [J]. World J Urol, 2014, 32(6): 1537-1542.
[17]Lee S, Hong SK, Kwak C, et al. Prognostic significance of diabetes mellitus in localized renal cell carcinoma [J]. Jpn J Clin Oncol, 2012, 42(4): 318-324.
[18]Psutka SP, Stewart SB, Boorjian SA, et al. Diabetes mellitus is independently associated with an increased risk of mortality in patients with clear cell renal cell carcinoma [J]. J Urol, 2014, 192(6): 1620-1627.
[19]Godinot C, De Laplanche E, Hervouet E, et al. Actuality of Warburg’s views in our understanding of renal cancer metabolism [J]. J Bioenerg Biomembr, 2007, 39(3): 235-241.
[20]Ricketts CJ, Shuch B, Vocke CD, et al. Succinate dehydrogenase kidney cancer: an aggressive example of the Warburg effect in cancer [J]. J Urol, 2012, 188(6): 2063-2071.
[21]Corcoran AT, Kaffenberger SD, Clark PE, et al. Hypoalbuminaemia is associated with mortality in patients undergoing cytoreductive nephrectomy [J]. BJU Int, 2015, 116(3): 351-357.
[22]Donskov F, von der Maase H. Impact of immune parameters on long-term survival in metastatic renal cell carcinoma [J]. J Clin Oncol, 2006, 24(13): 1997-2005.
[23]Heng DY, Xie W, Regan MM, et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study [J]. J Clin Oncol, 2009, 27(34): 5794-5799.
[24]Motzer RJ, Bukowski RM, Figlin RA, et al. Prognostic nomogram for sunitinib in patients with metastatic renal cell carcinoma [J]. Cancer, 2008, 113(7): 1552-1558.
[25]Morgan TM, Tang D, Stratton KL, et al. Preoperative nutritional status is an important predictor of survival in patients undergoing surgery for renal cell carcinoma [J]. Eur Urol, 2011, 59(6): 923-928.
[26]Maccio A, Madeddu C, Gramignano G, et al. The role of inflammation, iron, and nutritional status in cancer-related anemia: results of a large, prospective, observational study [J]. Haematologica, 2015, 100(1): 124-132.
[27]Weimann A, Braga M, Harsanyi L, et al. ESPEN Guidelines on Enteral Nutrition: Surgery including organ transplantation [J]. Clin Nutr, 2006, 25(2): 224-244.
(2016-04-06收稿)
(本文编辑:任英慧)
Prognostic factors of patients with T3N0M0renal cell carcinoma: a single-center retrospective study of 182 patients
PENG Ding*, LI Xue-song*, ZHANG Cui-jian△, YANG Kai-wei, TANG Qi, ZHANG Lei, YU Xiao-teng, HE Zhi-song, ZHOU Li-qun△
(Department of Urology, Peking University First Hospital; Institute of Urology, Peking University; National Urological Cancer Center; Beijing 100034, China)
Objective: To evaluate the impacts of clinical, pathological, and laboratory factors on oncological outcomes of patients with T3N0M0renal cell carcinoma. Methods: The clinical data, laboratory exam results, and follow-up outcomes of 182 patients with T3N0M0renal cell carcinoma who underwent nephrectomy from 2007 to 2012 in Peking University First Hospital were retrospectively collected. The 5-year cancer-specific survival and 5-year recurrence-free survival of all the patients were calculated using Kaplan-Meier method, and the statistical significance between the survival curves were compared using the Log-rank test. Variables with significant differences in the univariate analysis were subjected to the multivariate analysis by Cox regression model. All the comparisons were conducted using two-tailed test andP<0.05 was considered statistically significant. Results: A total of 182 patients were included in this study. Of all the 182 patients, 126 were male (69.23%) and 56 were female (30.77%). The mean age was (56.75±12.45) years. The median follow-up time was 48 months (3-99 months). At the end of the follow-up, 50 patients (27.47%) died due to the disease after a median of 29.74 months and 59 patients (32.42%) had tumor recurrence after a median of 22.12 months. The 5-year cancer-specific survival of all patients was 68.30% (95%CI: 60.16%-75.84%); the 5-year recurrence-free survival was 60.70% (95%CI: 53.16%-68.84%). In the univariate analysis, diabetes mellitus, tumor invasion status, Fuhrman grade, serum album, serum cholestenone, anemia, and neutrophils percentage were associated with the cancer-specific survival and Fuhrman grade, serum album and anemia were associated with the recurrence-free survival. Variables with significant differences on univariate analysis were included in Cox multivariate regression analysis. Multivariate Logistic regression analysis showed that diabetes mellitus (HR=2.434, 95%CI: 1.243-4.769,P=0.010), hypoalbuminemia (HR=2.188, 95%CI: 1.074-1.074,P=0.031), and anemia (HR=3.320, 95%CI: 1.839-5.991,P<0.001) were independent risk factors significantly associated with cancer-specific survival; and higher Fuhrman grade (HR=2.552, 95%CI: 1.433-4.545,P=0.001), anemia (HR=2.535, 95%CI: 1.497-4.293,P=0.001) were independent factors significantly associated with recurrence-free survival. Conclusion: Diabetes mellitus, hypoalbuminemia, and anemia were independent risk factors significantly associated with cancer-specific survival of T3N0M0renal cell carcinoma patients; higher Fuhrman grade and anemia were independent risk factors significantly associated with tumor recurrence of T3N0M0renal cell carcinoma patients.
Kidney neoplasms; Carcinoma, renal cell; Treatment outcome;Nephrectomy
时间:2016-9-5 9:24:10
http://www.cnki.net/kcms/detail/11.4691.R.20160905.0924.006.html
R737.11
A
1671-167X(2016)05-0806-06
10.3969/j.issn.1671-167X.2016.05.010
△ Corresponding author’s e-mail, surgeon_zhang@126.com, zhouliqunmail@sina.com
* These authors contributed equally to this work

